STAT3在大鼠心肌缺血再灌注损伤中的作用
2016-07-24许先成柯昌斌吴艳琼孙艳玲王贤裕
许先成,柯昌斌,吴艳琼,孙艳玲,王贤裕
(湖北医药学院附属太和医院麻醉科,湖北十堰 442000)
论著·基础研究
STAT3在大鼠心肌缺血再灌注损伤中的作用
许先成,柯昌斌△,吴艳琼,孙艳玲,王贤裕
(湖北医药学院附属太和医院麻醉科,湖北十堰 442000)
目的 探讨转录活化因子3 (STAT3)在大鼠心肌缺血再灌注损伤中的作用。方法 将健康成年雄性SD大鼠18只分为3组(n=6):假手术组(S组),只分离左冠状动脉,不结扎;缺血/再灌注组(I/R组),结扎左冠状动脉前降支30 min,再灌注120 min;缺血/再灌注+STAT3抑制剂Stattic组(ST组),于再灌注前10 min经尾静脉注射STAT3特异性抑制剂Stattic 500 μg/kg。再灌注结束时,取缺血区心肌标本,采用红四唑(TTC)染色检测心肌梗死面积;采用原位末端缺口标记法(TUNEL法)检测细胞凋亡指数;采用Western-blot检测磷酸化STAT3(p-STAT3)、Fas蛋白表达;采用RT-PCR检测p-STAT3、Fas的mRNA表达;采用免疫组织化学法检测半胱氨酸天冬氨酸蛋白酶3(Caspase-3)表达。结果 与S组相比,I/R组心肌梗死面积、心肌细胞凋亡指数、p-STAT3和Fas的蛋白及其mRNA表达、Caspase-3表达水平均增高(P<0.05);与I/R组比较,ST组心肌梗死面积、心肌细胞凋亡指数升高(P<0.05),p-STAT3蛋白及mRNA表达水平下调,Fas蛋白及mRNA表达、Caspase-3表达水平增加(P<0.05)。结论 STAT3可能通过调控Fas系统,从而有效的抑制Caspase-3凋亡系统对心肌细胞及其其他组织的损伤。
心肌缺血;再灌注损伤;转录活化因子3; Fas;半胱氨酸天冬氨酸蛋白酶3
心肌缺血再灌注损伤(myocardial ischemic reperfusion injury,MIRI)是心脏外科手术及心血管介入治疗中较棘手的问题,如何及时有效的减少MIRI已成为当代医学亟需解决的难点之一。凋亡被认为是MIRI导致心肌细胞死亡和细胞功能发生不可逆性丧失的主要机制之一[1],常受到细胞内外多种信号因子及传导系统的调控。研究证实,转录活化因子3(signal transducer and activator of transcription3,STAT3)过表达后可减少缺血再灌注损伤后心肌细胞凋亡,显著增强心肌细胞抗凋亡能力[2-4],但其确切机制有待探讨。本研究拟评价STAT3在MIRI中的作用,从而为临床治疗心肌缺血性疾病提供新的理论依据。
1 材料与方法
1.1 材料 选择健康成年雄性SD大鼠18只,体质量200~250 g,由湖北医药学院动物研究中心提供。
1.2 方法
1.2.1 动物分组 采用随机数字表法,将18只SD大鼠随机分为3组(n=6) :假手术组(S组),只分离左冠状动脉,不结扎;缺血/再灌注组(I/R组),结扎左冠状动脉前降支30 min,再灌注120 min;缺血/再灌注+STAT3抑制剂Stattic组(ST组),于再灌注前10 min经尾静脉注射STAT3特异性抑制剂Stattic。
1.2.2 大鼠MIRI模型的建立 参照文献[5]建立大鼠MIRI模型,各组大鼠均于麻醉后,切开气管行气管插管连接小动物呼吸机及小动物心电图监护仪。心前区备皮消毒,左侧第四肋间开胸,剪开心包膜,充分暴露心脏,于左心耳与肺动脉圆锥之间找到与左冠状动脉伴行的冠状静脉,在左心耳下方2 mm处,结扎左冠状动脉前降支,心电图Ⅱ导联出现ST段弓背抬高为结扎成功,30 min后剪断缝线,ST段回落为再通。实验过程加用保温毯保暖,保持大鼠直肠温度在36.5~37.5 ℃。
1.2.3 梗死面积检测 于再灌注结束后重新阻断血管,静脉注射2%伊文思兰1 mL,迅速取出心脏,置于-20 ℃冰箱冰冻30 min后,将冰冻心脏从心尖至心底横向切成约2.0 mm的切片,将所有切片置于1%红四唑(TTC)磷酸缓冲液(pH7.4)中37 ℃水浴15 min,蓝染区域为非缺血区,非蓝染区域为缺血危险区;梗死心肌呈灰白色,非梗死心肌呈砖红色。以梗死面积占缺血危险区面积的百分比反映心肌梗死程度。运用IPP2.5全自动图像分析软件进行面积计算处理。
1.2.4 细胞凋亡指数检测 再灌注120 min后,取左室心尖部全层心肌标本,将标本置入4%中性多聚甲醛溶液中固定后常规石蜡包埋切片,用末端脱氧核苷酸转移酶(TdT 酶)介导的带荧光的dUTP缺口末端标记法(TUNEL)测定心肌细胞凋亡指数。每张切片随机取6个高倍镜视野,检测每个高倍镜视野下调亡细胞数和总细胞数,凋亡指数=凋亡细胞数/总观察细胞数×100%,凋亡细胞胞核呈棕黄色或棕褐色颗粒,正常细胞核为蓝色。
1.2.5 Western-blot检测p-STAT3、Fas蛋白表达 取保存在液氮中的心肌组织匀浆,RIPA蛋白裂解液提取蛋白,用紫外分光光度计检测提取蛋白水平。采用10%SDS-PAGE进行电泳,转至PVDF膜上。加入兔抗大鼠p-STAT3和Fas抗体(稀释度1∶1 000,Santa Cruz公司,美国),加入HRP标记的山羊抗兔二抗(稀释度1∶3 000,Santa Cruz公司,美国)。ECL试剂显色,暗室X光胶片曝光,扫描底片,Gelpro条带分析软件进行曝光条带光密度值分析,以目的蛋白条带与内参β-actin条带光密度值的比值反映目的蛋白p-STAT3和Fas的表达。
1.2.6 RT-PCR检测p-STAT3、Fas mRNA表达 取左室心肌组织,保存于液氮中备用。用Trizol一步法提取总RNA,紫外分光光度计检测总RNA及纯度后水平,配制20 μL逆转录体系合成cDNA,逆转录产物作为下一步PCR模板,采用Primer Premier5软件设计引物。STAT3上游引物:5′-CGC CAC TCT GGT GTl TrC ATA-3′,下游引物:5′-TTC GCA GGT TGT GCT GAT AG-3′;Fas上游引物:5′-TCT AGT TGG AAA GAA CCG AAG G-3′,下游引物 5′-CCA CAA ACG AGA TGC AAT CAC-3′;β-actin上游引物:5′-CCC ATC TAT GAG GGT TAC GC-3′,下游引物:5′-TTT AAT GTC ACG CAC GAT TTC-3′。采用25 μL体系行PCR,反应条件:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,30个循环,并在每个循环延伸末端收集信号,绘制扩增曲线,采用2-△△CT法计算目的基因表达。
1.2.7 免疫组化检测半胱氨酸天冬氨酸蛋白酶3(Caspase-3)表达 石蜡包埋标本制成5 μm厚的连续组织切片,脱蜡水化,高压抗原修复,过氧化物酶封闭,室温冷却后,滴加一抗Caspase-3兔抗多克隆抗体(北京博奥森生物技术有限公司)孵育,滴加二抗二步法免疫组化试剂P6001(北京中杉金桥生物公司),DAB显色,苏木素复染,脱水透明,封片。光镜下进行观察Caspase-3,以细胞核染成棕黄色或黄褐色为阳性细胞。每张切片随机取5个高倍视野,采用Image-Pro Plus 6.0图像分析系统(Media Cybernetics公司,美国)计算光密度值,取其平均值反映Caspase-3的表达。

2 结 果
2.1 3组大鼠心肌梗死面积及心肌细胞凋亡指数比较 与S组比较,I/R组心肌梗死面积、心肌细胞凋亡指数增加(P<0.05);与I/R组比较,ST组心肌梗死面积、心肌细胞凋亡指数亦显著增加(P<0.05),见表1、图1。

表1 3组大鼠心肌梗死面积及心肌细胞凋亡指数 比较
a:P<0.05,与S组比较;b:P<0.05,与I/R组比较。

A:S组,未见明显凋亡细胞核;B:I/R组,可见明显棕黄色凋亡细胞核;C:ST组,可见大量棕黄色凋亡细胞核。

图1 TUNEL法检测3组大鼠心肌细胞凋亡结果(×100)表2 各组大鼠心肌细胞p-STAT3、Fas蛋白和mRNA表达比较
a:P<0.05,与S组比较;b:P<0.05,与I/R组比较。
2.2 3组大鼠p-STAT3、Fas蛋白和mRNA、Caspase-3表达水平比较 与S组比较,I/R组p-STAT3、Fas蛋白和mRNA、Caspase-3表达水平均增高(P<0.05);与I/R组比较,ST组p-STAT3蛋白及mRNA表达水平显著下调,Fas蛋白及mRNA表达、Caspase-3表达水平增加(P<0.05)。各组大鼠心肌细胞p-STAT3、Fas蛋白和mRNA表达比较,见表2、图2。S、I/R、ST组大鼠Caspase-3表达分别为0.18±0.05、0.68±0.21、1.02±0.30;与S组比较,I/R组、ST组Caspase-3表达增高(P<0.05),见图3。

图2 各组大鼠心肌组织p-STAT3蛋白表达比较
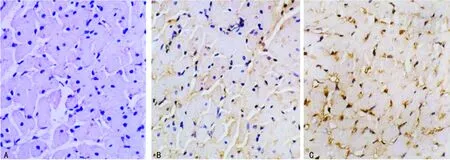
A:S组,未见阳性表达细胞;B:I/R组,可见明显棕黄色细胞;C:ST组,可见大量棕黄色。
图3 免疫组化检测Caspase-3蛋白表达(×200)
3 讨 论
STAT3是Stats家族的重要成员,广泛参与细胞的增殖分化、细胞凋亡、以及免疫调节等多种病理生理过程[6]。Liu等[7]在研究小鼠脑缺血再灌注损伤保护机制发现,STAT3信号传导通路的激活能够降低 Bax/Bcl-2 的比值,减少脑梗死后凋亡细胞数量,减小脑梗死体积,发挥脑保护作用[8]。有研究表明,特异性激活心肌STAT3基因的转基因小鼠能够耐受阿霉素引起的心肌细胞损伤[9],说明STAT3介导并触发了心肌内源性细胞保护作用,但确切机制尚不清楚。Sattic是一种卟啉类非肽小分子,能抑制STAT3的核转运,是STAT3的特异性抑制剂[10]。在本研究中,ST组于心肌再灌注早期给予STAT3抑制剂干预,p-STAT3蛋白及mRNA表达明显下调,心肌梗死面积和心肌细胞凋亡指数显著增加,明确了STAT3能够在MIRI中发挥保护作用。
Caspase-3被认为是Caspase家族中重要的凋亡执行者之一,它在各种生理和病理因素刺激下被激活,通过裂解核酸酶、蛋白激酶等作用底物,引起细胞特征性的凋亡形态学上的改变[11], 如细胞核浓缩、脱氧核糖核酸链断裂等,从而发挥促凋亡作用,加重组织或器官的功能损害。本研究表明,与S组比较,I/R组出现Caspase-3高表达,证实了Caspase-3参与了大鼠MIRI。
Caspase-3是Fas介导的凋亡信号途径下游的关键性效应蛋白酶,Fas在细胞表面的高表达只能说明细胞对凋亡的敏感性增强,而决定细胞是否产生凋亡,关键在于细胞质中被活化的Caspase-3水平[12]。当 FasL与Fas以三聚体的形式结合,激活凋亡基因产物Caspase-3蛋白[13],可以诱导表达Fas的细胞凋亡,Caspase-3被认为是介导凋亡最终步骤的实施者[14]。有研究报道,STAT3实际上是作为一种抗凋亡转录因子来抑制Caspase-3表达[15-16],因此,为进一步阐明STAT3信号通路与心肌细胞凋亡之间的相互关系,于心肌再灌注早期给予STAT3抑制剂处理可以显著抑制p-STAT3蛋白及mRNA的表达,同时呈现Fas蛋白及mRNA、Caspase-3的表达增高,说明STAT3心肌保护机制之一是通过调控Fas死亡信号及Caspase-3凋亡通路实现的。
综上所述,本实验通过建立大鼠MIRI模型,证实了STAT3在MIRI中的作用,其可能机制是通过作用于Fas系统,从而有效的抑制Caspase-3凋亡系统对心肌细胞及其他组织的损伤。
[1]Ling H,Lou Y.Total flavones from elsholtzia blanda reduce infarct size during acute myocardial isehemia by inhibiting myocardial apoptosis in rat[J].J Ethnopharmacol,2005,101(1/2/3):169-175.
[2]Obana M,Maede M,Takeda K,et al.Therapeutic activation of signal transducer and activator of transcription on 3 by interleukin-11 ameliorates cardiac fibrosis after myocardial infarction[J].Circulation,2010,121(5):684-691.
[3]Haghikia A,Stapel B,Hoch M,et al.STAT3 and cardiac remodeling[J].Heart Fail Rev,2011,16(1):35-47.
[4]Das A,Salloum FN,Durrant D,et al.Rapamycin protects against myocardial ischemia-reperfusion injury through JAK2-STAT3 signaling pathway[J].J Mol Cell Cardiol,2012,53(6):858-869.
[5]Betker HE,Kharbanda R,Sehmidt MR,et al.Remote ischaemic conditioning before hospital admission,as a complement to angioplasty,and effect on myocardial salvage in patients with acute myocardial infarction:a randomised trial[J].Lancet,2010,375(9716):727-734.
[6]Hua Y,Richard J.The STATs of cancernew molecular targets come of age[J].Nature (Review/Cancer),2004,4(2):97-105.
[7]Liu X,Zhang X,Kang N,et al.Diosmin protects against cerebral ischemia/reperfusion injury through activating JAK2/STAT3 signal pathway in mice[J].Neuroscience,2014,268(21):318-327.
[8]Yamashita T,Sawamoto K,Suzuki S,et al.Blockade of interleukin-6 signaling aggravates ischemiccerebraldamage in mice:possible involvement of STAT 3 activation in theprotection of neurons[J].Neurochemistry,2005,94(2):459-468.
[9]Smith RM,Suleman N,Lacerda L,et al.Genetic depletion of cardiac myocyte STAT3 abolishes classical preconditioning[J].Cardiovasc Res,2004,63:611-616.
[10]Uehara Y,Mochizuki M,Matsuno K,et al.Novel high-throughput screening system for identifying STAT3-SH2 antagonists[J].Biochem Biophys Res Commun,2009,380(3):627-631.
[11]Whelan RS,Kaplinskiy V,Kitsia RN.Cell death in the pathogenesis of heart disease:mechanisms and significance[J].Annu Rev Physiol,2010,72(1):19-44.
[12]陈月桥,王丽,武建华.细胞凋亡信号传导途径研究进展[J].中国实用医药,2007,33(2):186-187.
[13]Liang Y,Nylander KD,Yan C,et al.Role of caspase 3-dependent Bcl-2 cleavage in potentiation of apoptosis by Bcl-2[J].Mol Pharmacol,2002,61(1):142-149.
[14]李静岩.Caspase-3与肿瘤关系的研究[J].医学综述,2005,11(5):430-432.
[15]聂丽霞,田首元,孟玉洁,等.JAK2-STAT3通路在舒芬太尼后处理减轻犬心肌缺血再灌注损伤中的作用[J].中华麻醉学杂志,2012,32(3):368-370.
[16]Yang Y,Duan W,Jin Z,et al.JAK2/STAT3 activation by melatonin attenuates the mitochondrial oxidative damage induced by myocardial ischemia/reperfusion injury[J].J Pineal Res,2013,55(3):275-286.
Role of signal transducer and activator of transcription 3 in rat myocardial ischemia-reperfusion injury
XuXiancheng,KeChangbin△,WuYanqiong,SunYanling,WangXianyu
(DepartmentofAnesthesiology,AffiliatedTaiheHospital,HubeiUniversityofMedicine,Shiyan,Hubei442000,China)
Objective To investigate the role of signal transducer and activator of transcription 3 (STAT 3) in rat myocardial ischemia-reperfusion(I/R) injury.Methods 18 healthy adult male SD rats were randomly divided into three groups (n=6).The sham operation group(group S) was only performed the left coronary artery separation without ligation; the I/R group was performed the left anterior descending coronary artery ligation for 30 min,then the 120 min reperfusion; the I/R+ STAT3 inhibitor Stattic group(group ST),on the basis of the group I/R,Stattic 500 μg/kg was injected at 10 min by the tail vein before reperfusion.The myocardial specimens at the ischemic area were taken at the end of reperfusion,the TTC staining was adopted to determine the myocardial infarct size,and the myocardial cell apoptosis index(AI) was detected by TUNEL.The expression of phosphorylated-STAT3 (p-STAT3) and Fas protein were detected by Western-blot.RT-PCR was used to determine mRNA level of p-STAT3 and Fas protein,and the immunohistochemical method to detect the Caspase-3 expression.Results Compared with the group S,the myocardial infarct size,AI and the expressions of p-STAT3,Fas and Caspase-3 in the group I/R were significantly increased (P<0.05);compared with the group I/R,the myocardial infarct size,AI,the expression of p-STAT3 protein and mRNA in the group ST were significantly down-regulated,while Fas protein and mRNA expression,Caspase-3 expression level were increased (P<0.05).Conclusion STAT3 effectively suppresses the injury of Caspase-3 apoptosis system to myocardial cells and other tissues through exerting the action on Fas system.
myocardial ischemia;reperfusion injury;signal transducer and activator of transcription3;Fas;Caspase-3
许先成(1963-),主任医师,大学本科,主要从事围术期器官保护的临床研究。△
,Tel:(0719)8801437;E-mail:kcbzzzz@163.com。
10.3969/j.issn.1671-8348.2016.05.009
R542.2
A
1671-8348(2016)05-0606-04
2015-09-01
2015-10-28)
