子宫腺肌病中同源框基因10和整合素β3的表达与不孕的关系
2016-07-24萨日娜宋静慧
萨日娜 宋静慧 高 燕
子宫腺肌病中同源框基因10和整合素β3的表达与不孕的关系
萨日娜 宋静慧*高 燕
内蒙古医科大学附属医院妇产科(呼和浩特,010050)
目的:观察同源框基因10(HOXA10)及整合素β3(Intβ3)在子宫腺肌病(AM)患者在位内膜、子宫内膜-肌层交界面以及异位病灶中的表达情况,探讨子宫腺肌病不孕原因。方法:以2014年2~8月在本院住院因子宫腺肌病行子宫全切术者31例为观察组,其中增殖期内膜15例,分泌期内膜16例;因宫颈上皮内瘤变Ⅲ级(CINⅢ级)或宫颈肌瘤行子宫全切术者33例为对照组,其中增殖期内膜15例,分泌期内膜18例。通过免疫组化链霉菌抗生物素蛋白-过氧化物酶连接(SP)法,测定并分析子宫腺肌病患者在位内膜、内膜-肌层交界面以及异位病灶中HOXA10与Intβ3的表达情况,并用双盲法评分进行分析比较。结果:①无论在增殖期还是分泌期,观察组结合带HOXA10和Intβ3的表达均低于对照组(P<0.05)。②增殖期HOXA10观察组异位内膜表达弱于对照组正常内膜,而与在位内膜未发现有差异(P>0.05);Intβ3表达强度由高到低依次为对照组正常内膜、观察组异位内膜、观察组在位内膜(P<0.05)。③观察组在位内膜和对照组正常内膜增殖期HOXA10及Intβ3的表达均低于各自分泌期(P<0.05)。④观察组在位内膜增殖期和分泌期HOXA10及Intβ3的表达分别低于同期对照组正常内膜(P<0.05)。结论:子宫腺肌病患者在位子宫内膜、结合带Intβ3及HOXA10的表达下降,异位病灶处Intβ3表达增强,分泌期该两种因子均低表达,可能是导致不孕的重要原因之一。
HOXA10Intβ3子宫腺肌病不孕子宫内膜免疫组织化学
子宫腺肌病(AM)为育龄妇女常见病,发病率为10.0%~18.2%[1],主要临床表现之一是不孕,且有逐渐增多趋势[2]。目前尚无充分的流行病学数据证明子宫腺肌病与不孕之间的确切关系,但随着影像学水平及治疗水平的提高,间接证明了子宫腺肌病与不良妊娠结局和生殖能力低下有关[3]。有研究提示[4]:胚胎着床因素导致的不良妊娠有2/3是由子宫内膜容受性功能低下引起的。在调节内膜容受窗的功能蛋白中,整合素β3(Intβ3)、转录调节基因同源框基因10(HOXA10)与子宫内膜容受密切相关[5],推测这些蛋白分子的异常表达可能是子宫腺肌病不孕的重要源头问题之一。目前有关子宫腺肌病病因及机制仍无定论,并且对该病引起的不孕症症状的治疗效果也多不满意。本研究拟对子宫腺肌病患者在位内膜、结合带以及异位病灶中HOXA10和Intβ3的表达情况进行研究,探讨其与不孕的关系。
1 材料与方法
1.1 研究对象
1.1.1 资料来源 选取2014年2~8月在内蒙古医科大学附属医院住院因子宫腺肌病行子宫全切术31例为观察组,收集其在位子宫内膜(带部分肌层)、异位病灶,其中增殖期内膜15例,分泌期内膜16例。取同期因宫颈上皮内瘤变III级(CINⅢ级)或单纯宫颈肌瘤行子宫全切术的患者33例为对照组,收集其正常子宫内膜(带部分肌层),其中增殖期内膜15例,分泌期内膜18例。所有对象年龄42.3 ±6.5岁,月经均规律。术前半年内均未服用激素类药物,术后均经病理学诊断确诊,且不合并全身疾病,以及其他内分泌疾病、乳腺疾病、免疫和代谢性疾病,未放置宫内节育器、无子宫内膜息肉。
1.1.2 子宫内膜形态学分期 子宫内膜分期标准参照Noyes分期[6]:对照组33例,其中增殖期15例,分泌期18例。观察组31例,在位内膜中增殖期15例,分泌期16例;异位病灶内膜均为增殖期。
1.2 方法
1.2.1 实验步骤 采用免疫组化链霉菌抗生物素蛋白-过氧化物酶连接(SP)法检测(即用型链霉素抗生物素蛋白-过氧化酶超敏试剂盒,迈新生物工程有限公司)。组织切片修复抗原,依次滴加鼠抗人interginβ3单克隆抗体(美国Santa Cruz公司)、兔抗人HOXA10多克隆抗体(武汉博士德公司),辣根过氧化物酶结合的抗兔IGg,二氨基联苯胺(DAB)显色。以棕黄色染色为阳性染色,根据计算机自动统计测定细胞棕黄色颗粒的平均吸光度值(AOD),以定量表示组织兔抗人HOXA10多克隆抗体蛋白的表达情况。同时行常规HE染色。
1.2.2 质量控制及阳性结果判断 按照染色阳性细胞所占百分比分为0~4分。染色强度分为0~3分:不着色计为0分,淡黄色计为1分,黄色计为2分,棕褐色计为3分。将二者评分之积作为最终评判标准。所有评分结果均由2名妇产科方面的病理科专家采用双盲法(独立检测)进行检测,若两人结果不同则重新判定。
1.3 统计分析
应用SPSS13.0软件对所有数据进行统计学处理,两组间比较采用t检验,多组间比较采用方差分析,检验水准α=0.05。
2 结果
2.1 Intβ3、HOXA10在两组内膜-肌层交界面表达的比较
增殖期内膜-肌层交界Intβ3和HOXA10的表达,观察组低于对照组(t=7.944,P<0.05;t=8.452,P<0.05);分泌期内膜-肌层交界Intβ3和HOXA10的表达,观察组也均低于对照组(t3=8.359,P<0.05;t4=8.339,P<0.05)。见表1及图1、2、3、4。

表1 Intβ3及HOXA10在两组子宫内膜-肌层交界面的表达比较(珚x±s)

图1 观察组子宫内膜-肌层交界面Intβ3的表达(400×)

图2 对照组子宫内膜-肌层交界面Intβ3的表达(400×)
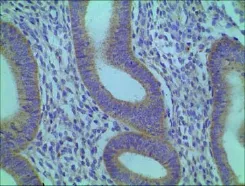
图3 观察组在位内膜Intβ3的表达(400×)

图4 对照组内膜Intβ3的表达(400×)
2.2 Intβ3、HOXA10在增殖期两组内膜表达的比较
因腺肌病肌层异位病灶的内膜病理诊断均为增殖期,故仅与其他各组增殖期内膜进行比较。Intβ3表达强度由高到低依次为对照组正常内膜、观察组异位内膜、观察组在位内膜,差异均有统计学意义(F=14.623,P<0.05),见表2、图5、6、7;HOXA10在观察组异位内膜的表达弱于对照组正常内膜,差异均有统计学意义(F=21.300,P<0.05),而与在位内膜无统计学差异(F=21.300,P>0.05),见表2、图8、9、10。
2.3 Intβ3、HOXA10在增殖期和分泌期两组内膜表达的比较
观察组增殖期在位内膜Intβ3及HOXA10的表达均低于分泌期(t=-2.897,P<0.05;t=-2.918,P<0.05),对照组增殖期内膜的Intβ3及 HOXA10的表达也均低于分泌期(t=-2.406,P<0.05;t=-2.321,P<0.05)。观察组增殖期在位内膜Intβ3及HOXA10的表达低于同期对照组增值期内膜(t=5.005,P<0.05;t=5.978,P<0.05),观察组分泌期在位内膜Intβ3及HOXA10的表达也低于对照组分泌期内膜(t=7.944,P<0.05;t=8.452,P<0.05),见表2及图5、6、7、8。
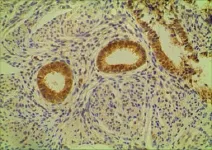
图5 腺肌病异病灶位内膜Intβ3的表达(400X)

表2 Intβ3及HOXA10在两组不同期子宫内膜表达的比较(珚x±s)
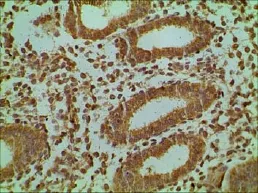
图7 对照组子宫内膜-肌层交界面HOXA10的表达(400×)

图8 观察组在位内膜HOXA10的表达(400×)
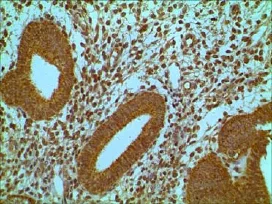
图9 对照组内膜HOXA10的表达(400×)

图10 观察组异病灶位内膜HOXA10的表达(400×)
3 讨论
3.1 Intβ3及HOXA10的生物学特性及研究概况
Intβ3是广泛分布于细胞表面的跨膜黏附受体,与多种配体结合,在细胞的增殖、分化、黏附、迁移、血管生成以及胚胎着床、创伤修复等许多生理病理过程中起重要作用[7]。已有大量研究证明,Intβ3与胚胎-子宫内膜黏附过程直接有关,并且对胚胎和子宫内膜具有双向调节的作用。其作用之一是参与早期胚胎与子宫内膜的黏附反应,调节胚胎的生长发育,使其具有黏附能力或黏附能力增加,从而获得“侵入”子宫内膜的能力;其作用之二表现为上调胚胎着床窗口期子宫内膜对胚胎的接受能力,也就是子宫内膜容受性。动物实验显示,鼠和兔的Intβ3功能阻断显著降低胚胎着床率[10]。在正常育龄妇女中,Intβ3在子宫内膜的表达于黄体生成素(LH)峰值出现后即分泌期显著增加,而在妊娠失败的患者中,如多囊卵巢综合征、黄体功能不全、输卵管积水以及不明原因性不孕,其表达明显降低[11]。因此,Intβ3是区分子宫内膜容受性的关键性指标。
HOXA10对雌性生殖系统发育发挥调节子宫内膜増殖与分化,维持内膜蜕膜化和胚胎发育,以及建立子宫内膜容受性的重要作用。有研究表明,HOXA10-小鼠可以存活,并能正常排卵并受精,但其胚泡不能成功着床或植入[12]。而将HOXA10-小鼠产生的正常数量的胚胎移植到假孕小鼠子宫内,则可以正常妊娠。反过来,将野生型小鼠胚胎移到HOXA10-小鼠子宫中则不能正常植入并存活,这表明HOXA10-小鼠子宫内膜容受性以及内膜蜕膜化异常,导致子宫内膜无法达到胚胎继续生长的环境水平,最终影响胚胎发育和着床[13]。在人类,Taylor等[14]研究发现,HOXA10在正常育龄妇女子宫内膜的增殖期呈现低表达,而在分泌期特别是分泌中晚期子宫内膜的表达水平呈现明显上升趋势。而在不明原因不孕妇女分泌期子宫内膜HOXA10mRNA的表达水平显著低于正常育龄妇女同期水平。这表明:母体HOXA10在分泌期表达增强这一条件对胚胎成功植入是必不可少的,这种在增殖期、分泌期呈现不同表达的特征性时相,提示HOXA10基因的恰当表达对子宫内膜良好容受性的形成具有重要作用,并且可以作为评价内膜容受功能的标志性分子。
3.2 Intβ3及HOXA10与子宫腺肌病致不孕的关系
子宫腺肌病的主要临床表现之一是不孕,Devlieger等[15]的研究发现,约19.5%的育龄妇女受子宫腺肌病的影响而致不孕。尽管子宫腺肌病患者可以通过体外受精助孕,但是种植后妊娠率仍有限,而且流产率较高。许多文献研究表明,正常子宫内膜存在诸如芳香化酶细胞色素P450、雌酮硫酸酯酶等与雌、孕激素代谢相关的酶类,以及一定比例的雌孕激素受体;受雌、孕激激素周期性调控的内膜容受性蛋白分子随着子宫内膜增殖期、分泌期的周期性变化而变化;这些调节内膜容受性蛋白分子是内膜微调控网络中的重要组成部分,对维持子宫内膜功能具有极其重要的作用[16]。子宫腺肌病患者子宫内膜功能缺陷,或许无法给生长的胚胎提供一个适宜的着床环境[17],以至于受精卵着床困难,这可能是子宫腺肌病生育能力低下和不良生殖结果的原因。
在本研究中,笔者观察了两组增殖期和分泌期子宫内膜Intβ3及HOXA10的表达情况,结果表明:虽然子宫腺肌病患者在位内膜分泌期较增殖期Intβ3及HOXA10的表达均有所增加,但仍显著低于对照组正常内膜分泌期的表达,推测子宫腺肌病患者不孕可能与在位内膜组织在分泌期未出现Intβ3及HOXA10的高表达有关。其原因可能是Intβ3及HOXA10的低表达影响了子宫内膜容受性的建立以及对受精卵的黏附能力,从而导致受精卵不能着床,这与肖豫等[18]研究一致。虽然Intβ3及HOXA10在子宫内膜的低表达引起子宫腺肌病不孕的具体调节机制还有待进一步研究,但是本研究结果为子宫腺肌病不孕的治疗提供了新的思路,对子宫腺肌病不孕患者,如能通过干预使子宫内膜Intβ3及HOXA10的表达,出现特征性的增殖期和分泌期的时相变化,并达到相应时期的正常水平,可能会对其不孕起到治疗作用。
由于未完成生育的子宫腺肌患者切除子宫者极少,本研究中标本取材存在一定局限性。本资料中有2例原发不孕,因严重腺肌症切除子宫,但因例数太少,无法进一步分析其与完成生育的腺肌症患者是否存在统计学差异,有待累积样本量进行深入研究原发不孕腺肌病者的各种因子表达。
综上所述,子宫腺肌病患者在位内膜、子宫内膜-肌层交界面Intβ3及HOXA10的表达下降,异位病灶处内膜Intβ3的表达增强,以及分泌期子宫内膜Intβ3及HOXA10的低表达可能是导致不孕的重要原因之一。
[1] Bergholt T,Eriksen L,Berendt N,et al.Prevalence and risk factors of adenomyosis at hysterectomy[J].Hum Repmd,2001,16:2418-2421.
[2] Matallotakis IM,Katsikis IK,Panidis DK.Adenomyosis:What is theimpact on fertility?[J].Curr Opin in Obstet Gynecol,2005,17:261-264.
[3] Tremellen K,Thalluri V.Impact of adenomyosis on pregnancy rates in IVF treatment[J].Reprod Biomed Online,2013,26(3):299-300.
[4] Benagiano G,Brosens I,Habiba M.Structural and molecular features of the endomyometrium in endometriosis and adenomyosis[J].Hum Reprod Update,2014,20(3):386-402.
[5] Konopka B,Skasko E,Kluska A,et al.Changes in the concentrations of receptor of insulin-like groth factor-I,epithelial growth factor,oestrogens and progestagcns in adenomyosis foci,endometrium and myometrium of woman during menstrual cycle[J].Eur J C-ynaccol,1998,19(1):93.97.
[6] Noyes RW,Hcrtig AT,Rock J.Dating the endometrial biopsy[J].Fertit Steril,1950,1:3-25.
[7] Casals G,Ordi J,Creus M,et al.Osteopontin and alphavbeta3 inte grin expression in the endometrium of infertile and fertile women[J].Reprod Biomed Online,2008,16:808-816.
[8] Ren L,Liu YQ,Zhou WH,et al.Trophoblast-derived chemokine CXCL12promotes CXCR4expression and invasion of human first-trimester decidual stromal cells[J].Hum Reprod,2012,27(2):366-374.
[9] Fischer CP,Kayisili U,Taylor HS.HOXA10expression is decreased in endometrium of women with adenomyosis[J].Fertil Steril,2011,95(3):1133-1136.
[10] Gardner DK,Wale PL,Collins R,et al.Glucose consumption of single post-compaction human embryos is predictive of embryo sex and live birth.Outcome[J].Hum Reprod,2011,26(8):1981-1986.
[11] Tan YQ,Tan K,Zhang SP,et al.Single-nucleotide polymorphism microarray-based preimplantation genetic diagnosis is likely to improve the clinical outcome for translocation carriers[J].Hum Reprod,2013,28(9):2581-2592.
[12] Fischer CP,Kayisili U,Taylor HS.HOXA10expression is decreased in endometrium of women with adenomyosis[J].Fertil Steril,2011,95(3):1133-1136.
[13] Fischer CP,Kayisili U,Taylor HS.HOXA10expression is decreased in endometrium of women with adenomyosis[J].Fertil Steril,2011,95(3):1133-1136.
[14] Fischer CP,Kayisili U,Taylor HS.HOXA10expression is decreased in endometrium of women with adenomyosis[J].Fertil Steril,2011,95(3):1133-1136.
[15] Devlieger R,D'Hooghe T,Timmerman D.Uterine adenomyosis in the infertility clinic[J].Hum Reprod Update,2003,9(2):139-147.
[16] Wei Q,St Clair JB,Fu T,et al.Reduced expression of biomarkers associated with the implantation window in women with endometriosis[J].Fertil Steril,2009,91(5):1686-1691.
[17] Wei Q,St Clair JB,Fu T,et al.Reduced expression of biomarkers associated with the implantation window in women with endometriosis[J].Fertil Steril,2009,91(5):1686-1691.
[18] Xiao Y,Li T,Xia E,et al.Expression of integrinβ3and osteopontin in the eutopic endometrium of adenomyosis during the implantation window[J].Eur J Obstet Gynecol Reprod Biol,2013,170(2):419-422.
[责任编辑:张 璐]
The relationship of expression of HOXA10 and interginβ3 in infertile women with adenomyosis
SA Rina,SONG Jinghui*,GAO Yan
DepartmentofObstetricsandGynecology,AffiliatedHospital,InnerMongoliaMedicalUniversity,InnerMongolia,010050
*Correspondingauthor:songjinghui2002@aliyun.com
Objective:To investigate the expression of homeobox gene 10(HOXA10)and integrinβ3(Intβ3)in eutopic endometrium,endometrium near myometrium,or endometrial ectopic lesions of infertile women with adenomyosis,and to explore the reason of infertility.Method:From Feb.2014to July 2014,31infertile women with adenomyosis who came to Affiliated Hospital of Inner Mongolia Medical University for hysterectomy were in experimental group,which included 15women with proliferative endometrium,16women with secretory endometrium.And another 33 women who had experienced hysterectomy because of cervical intraepithelial neoplasia III(CIN III)or cervical fibroids were in control group,which included 15women with proliferative endometrium,18women with secretory endometrium.The expression of HOXA10and Intβ3in tissue of eutopic endometrium,endometrium near myometrium,or endometrial ectopic lesions of the uterine specimens of all the women were checked by immunohistochemistry streptavidin biotin peroxidase.Result:1.The expression of HOXA10and Intβ3in endometrium near myometrium both in proliferative and secretory endometrium of women in experimental group had significant higher than those of women in control group(P<0.05).2.The expression of HOXA10of endometrial ectopic lesions in proliferative endometrium of women in experimental group had significant lower than that of women in control group,but in eutopic endometrium,there was no significant difference between the two groups(P>0.05).As for expression intensity of Intβ3,it was moststrong in eutopic endometrium of women in controll group,more strong in endometrial ectopic lesions of women in experimental group,and strong in eutopic endometrium of women in experimental group,which difference had statistical significance(P<0.05).3.The expression of HOXA10and Intβ3in eutopic proliferative endometrium both in the two groups had significant higher than those in secretory endometrium(P<0.05).4.The expression of HOXA10and Intβ3 in eutopic proliferative and secretory endometrium of women in experimental group had significant lower than those of women in control group(P<0.05).Conclusion:The expressions of HOXA10and Intβ3decrease in eutopic endometrium and endometrium near myometrium,the expression of Intβ3endometrialis increases in endometrial ectopic lesions,and the expressions of HOXA10and Intβ3decrease for secretory endometrium may be one of the important reason for infertility of women.
HOXA10;Intβ3;Adenomyosis;Endometrium;infertility;Immunohistochemistry
10.3969/j.issn.1004-8189.2016.12
内蒙古教育厅课题:NJZY13424
2016-01-07
2016-10-14
*通讯作者:songjinghui2002@aliyun.com
