甘丙肽对幼年大鼠蓝斑神经元兴奋性的影响及作用机制
2016-07-24马海涛白云飞刘丽娜王迪徐志卿
马海涛,白云飞,刘丽娜,王迪Δ,徐志卿Δ
(1.锦州医科大学 基础医学院,辽宁 锦州 121000;2.首都医科大学 基础医学院,北京 100069)
甘丙肽对幼年大鼠蓝斑神经元兴奋性的影响及作用机制
马海涛1,白云飞2,刘丽娜2,王迪1Δ,徐志卿2Δ
(1.锦州医科大学 基础医学院,辽宁 锦州 121000;2.首都医科大学 基础医学院,北京 100069)
目的 探讨甘丙肽(galanin,GAL)对幼年大鼠蓝斑神经元兴奋性的影响,研究甘丙肽与其受体(GalR)和钾离子通道的作用机制。方法 制备幼年大鼠脑片,采用全细胞记录法记录灌流给予甘丙肽后,蓝斑神经元静息膜电位水平和自发动作电位的发放频率;灌流给予不同浓度甘丙肽2型受体(GalR2)激动剂AR-M1896和不同类型钾离子通道阻断剂后,研究甘丙肽对幼年大鼠蓝斑神经元兴奋性的影响。结果 甘丙肽能够诱导蓝斑神经元膜电位发生超级化并抑制其动作电位的发放,但GalR2激动剂AR-M1896只有在高浓度(1 μM)时才能够诱导蓝斑神经元膜电位发生轻微的超级化并减少动作电位的发放;电压依赖性钾通道阻断剂四乙胺(Tetraethylammonium,TEA)能够部分阻断甘丙肽的抑制作用,内向整流钾通道阻断剂BaCl2能够显著阻断甘丙肽的抑制作用,而其他钾通道阻断剂,如ATP敏感性钾通道阻断剂格列本脲(Glybenclamide)、大电导钙依赖的钾通道(BK通道)阻断剂北非蝎毒素(Charybdotoxin)、小电导钙依赖的钾通道(SK通道)阻断剂蜂毒明肽(Apamin)均未能阻断甘丙肽的抑制作用。结论 甘丙肽能够抑制幼年大鼠蓝斑神经元的兴奋性,其抑制作用可能主要是通过甘丙肽1型受体(GalR1)产生的,并且这种抑制作用可能与TEA敏感的钾通道和内向整流钾通道相关,而ATP敏感的钾通道和钙依赖的钾通道不参与其中。
蓝斑;神经元;甘丙肽;甘丙肽受体;钾通道;阻断剂
位于脑干的蓝斑,主要由去甲肾上腺素能神经元组成。由于蓝斑去甲肾上腺素能神经元有广泛的上行纤维投射到皮层和海马,因此蓝斑参与唤醒和警戒、学习和记忆等重要生理功能,而蓝斑的功能异常与抑郁症和焦虑等密切相关。已有研究表明,80%的蓝斑去甲肾上腺素能神经元同时表达甘丙肽[1],一个含有29个氨基酸残基的多肽。甘丙肽最早是由Mutt和Tatemoto[2]于1983年从猪小肠中提取,目前已经克隆了3种甘丙肽受体,分别是甘丙肽1型受体(GalR1)、甘丙肽2型受体(GalR2)和甘丙肽3型受体(GalR3),它们都属于G蛋白偶联受体[3]。以往的电生理实验结果表明甘丙肽对成年大鼠蓝斑去甲肾上腺素能神经元有直接的抑制作用,而且是通过GalR1介导的[4]。尽管原位杂交工作发现GalR1和GalR2在蓝斑神经元中均有表达[5]。已有研究报道蓝斑神经元对去甲肾上腺素(noradrenaline,NA)的反应具有年龄依赖性,即幼年鼠蓝斑神经元局部给予NA后能够观察到超级化-去极化双相反应,而成年鼠的蓝斑神经元则只能够观察到单相的超级化反应[6-7]。成年大鼠对NA的单相反应主要是成年大鼠蓝斑神经元α1受体表达丢失,仅通过α2受体介导引起的;而α1受体和α2受体共同存在可能是幼年大鼠双相反应的主要原因[8-9]。由于蓝斑神经元中GalR1和GalR2均有表达[10],且一般来说,GalR1介导的是抑制作用而GalR2多介导兴奋作用[11]。因此本研究旨在探讨甘丙肽对幼年大鼠蓝斑神经元兴奋性的影响,并进一步探讨其作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级SD大鼠,雌雄不限,P8~16,购自北京维通利华有限公司,实验动物合格证号:SCXK(京)2012-001。
1.1.2 试剂:甘丙肽(Galanin)、AR-M1896购自英国Tocris公司;四乙胺(Tetraethylammonium,TEA)、氯化钡(BaCl2)、格列本脲(Glybenclamide)、北非蝎毒素(Charybdotoxin)、蜂毒明肽(Apamin)购自美国Sigma公司。
1.1.3 仪器:振动切片机(Leica VT1000s,德国);EPC-10膜片钳放大器(HEKA,德国);正置显微镜(NIKON FN-S2N,日本)。
1.2 方法
1.2.1 溶液配制:人工脑脊液(mM):125 NaCl,25 NaHCO3,2.5 KCl,1.3 MgCl2,1.25 NaH2PO4,2.5 CaCl2和10 glucose,pH 7.4。电极内液(mM):143 KCl,8 NaCl,1 MgCl2,10 HEPES,0.4 Na2GTP,2 Na2ATP。
1.2.2 脑片制备:取SPF级SD大鼠,雌雄不限,P8~16(首都医科大学实验动物中心),快速断头,置于预先充好45 min二元气(95%O2+5%CO2)的0 ℃冰冻人工脑脊液(artificial cerebrospinal fluid,ACSF)中,分离出大脑,进行修块,随后在振动切片机上进行切片,厚度为300 μm。将含有蓝斑的脑片移至34.5 ℃浴槽中孵育,45 min后移至室温,孵育30 min后将脑片移至记录浴槽进行全细胞记录,整个实验过程始终通二元气。
1.2.3 电生理记录:采用膜片钳全细胞记录法,记录细胞的膜电位水平和动作电位的发放频率。记录信号经EPC-10膜片钳放大器及PatchMaster(HEKA,德国)采集、储存。将脑片置于正置显微镜工作平台上的灌流池(容积为2.0 mL)中,固定脑片,用ACSF灌流,流速为2 mL/min。记录电极(武汉微探科学仪器有限公司)经垂直微电极拉制仪PC-10(Narishige,日本)两步拉制而成,灌注电极内液后,电极阻抗为3~5 MΩ。选用轮廓清晰膜饱满表面光滑的细胞进行实验。形成吉欧封接后,进行电极电容补偿。负压或高电压脉冲破膜,进行膜电容、串联电阻及漏电流补偿,平衡5 min待电极内液与细胞内液交换充分,膜电位和放电频率稳定后,向灌流池中灌流试剂,记录给药后的膜电位和动作电位。数据分析时采用的细胞满足静息膜电位<-50 mV,动作电位超射>5 mV,膜输入电阻>70 MΩ。
1.2.4 指标检测:采用电流钳模式,记成年和幼年大鼠蓝斑神经元放电特性。灌注不同浓度甘丙肽(10、100、250、500、1000 nM),膜片钳检测其对成年和幼年大鼠蓝斑神经元电兴奋性的影响。灌流给予不同浓度GalR2受体的选择性激动剂AR-M1896(100 nM,1 μM;2 min),检测GalR2受体是否参与甘丙肽对蓝斑神经元的作用。在固定甘丙肽浓度(500 nM)情况下,灌流给予不同类型钾离子通道阻断剂,如TEA(10 mM,10 min),内向整流钾通道阻断剂BaCl2(1 mM,10 min),ATP敏感钾通道阻断剂Glybenclamide(100 μM,5 min)、大电导钙依赖的钾通道(BK通道)阻断剂Charybdotoxin(500 nM,5 min)、小电导钙依赖的钾通道(SK通道)阻断剂Apamin(200 nM,5 min),观察这些阻断剂对甘丙肽抑制幼年大鼠蓝斑神经元动作电位的发放和诱导膜电位超极化作用的影响。

2 结果
2.1 幼年与成年大鼠蓝斑神经元的电生理特性比较 与成年大鼠蓝斑神经元相比,幼年大鼠蓝斑神经元的膜特性与其在很多方面都基本类似,2者最显著的差别在于:幼年大鼠蓝斑神经元能够记录到一种缓慢的有节律的3~15 mV的去极化电位(见图1B),而这种去极化电位在成年大鼠蓝斑神经元则很少出现(见图1A)。此外,本实验发现大部分的幼年蓝斑神经元都出现自发的簇状放电(见图1C),而成年大鼠蓝斑神经元则几乎不存在这种自发的放电模式(见图1A)。

图1 幼年与成年大鼠蓝斑神经元电生理特性比较A:典型的成年大鼠蓝斑神经元放电特性;B:幼年大鼠蓝斑神经元的放电特性,箭头表示3~15 mV的去极化电位;C:幼年大鼠蓝斑神经元的簇状放电Fig.1 Comparison of electrophysiology properties of LC neurons between adult and neonatal ratA: Presentive firing properties of LC neurons from adult rat;B:Presentive firing properties of LC neurons from neonatal rat(arrow shows 3~15 mV depolarization potential);C:Burst firing of LC neurons from neonatal rat
2.2 甘丙肽对幼年大鼠蓝斑神经元电兴奋性的影响 对蓝斑神经元进行全细胞记录时,钳制电压维持在-60 mV,待膜电位水平和动作电位发放频率稳定后,灌流给予500 nM的甘丙肽2 min,可以看到所有蓝斑神经元的膜电位发生超极化,动作电位发放完全被抑制,灌流给予ACSF冲洗5~10 min后膜电位水平和动作电位发放频率逐渐恢复到给药前水平(见图2A和2C)。与甘丙肽灌流前膜电位的水平相比,甘丙肽灌流后膜电位水平明显降低(见图2B)。当给予不同浓度甘丙肽(10~1000 nM)时,随着甘丙肽浓度的增加膜电位发生超极化的程度也不断增加,呈现明显的浓度依赖性(见图2D)。

图2 甘丙肽对幼年大鼠蓝斑神经元兴奋性的影响A:甘丙肽抑制幼年大鼠蓝斑神经元动作电位的发放并诱导膜电位产生超极化;B:灌流给予甘丙肽前后蓝斑神经元膜电位水平变化;C:灌流给予甘丙肽后蓝斑神经元放电频率随时程变化;D:甘丙肽诱导蓝斑神经元膜电位产生超极化的浓度依赖曲线(EC50=173 nM,Hill系数=0.89)Fig.2 GAL affects the excitability of LC neurons from neonatal ratA:GAL inhibits the firing frequency and hyperpolarizes the membrane potential of LC neurons from neonatal rat;B:The comparison of membrane potential of LC neurons before(control) and after(GAL 500 nM) bath application of GAL;C:Time course of firing frequency of LC neurons after bath application of GAL;D:Dose-curve after bath application of different concentration of GAL(EC50=173 nM, Hill coefficient=0.89)
2.3 甘丙肽抑制蓝斑神经元电兴奋性的机制 为证实GalR2受体是否参与甘丙肽对蓝斑神经元电兴奋性的影响,给予GalR2受体的选择性激动剂AR-M1896灌流2 min。结果表明:低浓度(100 nM)的AR-M1896几乎对蓝斑神经元动作电位的发放和膜电位超极化无影响,只有高浓度(1 μM)的AR-M1896才能减少蓝斑神经元动作电位的发放和诱导蓝斑神经元膜电位发生轻微的超极化(见图3,n=7)。说明甘丙肽对蓝斑神经元动作电位和膜电位的影响可能主要是通过GalR1受体介导。

图3 GalR2受体激动剂AR-M1896对幼年大鼠蓝斑神经元放电频率的影响A,B:低浓度AR-M1896(100 nM)对幼年大鼠蓝斑神经元放电频率的影响;C,D:高浓度AR-M1896(1 μM)对幼年大鼠蓝斑神经元放电频率的影响Fig.3 Effect of AR-M1896(an angonist of GalR2) on the firing frequency of LC neurons in neonatal ratA,B:low concentration of AR-M1896(100 nM) fails to reduce the fring frequency of LC neurons;C,D:high concentration of AR-M1896(1 μM) reduces the firing frequency of LC neurons
2.4 TEA对甘丙肽诱导幼年大鼠蓝斑神经元膜电位超极化的影响 当预先灌流给予钾离子通道阻断剂TEA(10 mM,10 min)后,发现TEA能够增加幼年大鼠蓝斑神经元动作电位的幅度及延长动作电位的复极化时程(见图4B),降低动作电位的发放频率,但并不会显著改变蓝斑神经元的静息电位水平。再给予甘丙肽2 min后,发现甘丙肽能够完全抑制蓝斑神经元动作电位的发放,但是膜电位的超极化程度显著降低[GAL:(8.9638±3.682)mV;GAL+TEA:(4.8281±1.8842)mV,P<0.01,见图4C]。说明钾离子通道可能参与了甘丙肽对幼年大鼠蓝斑神经元的抑制作用。
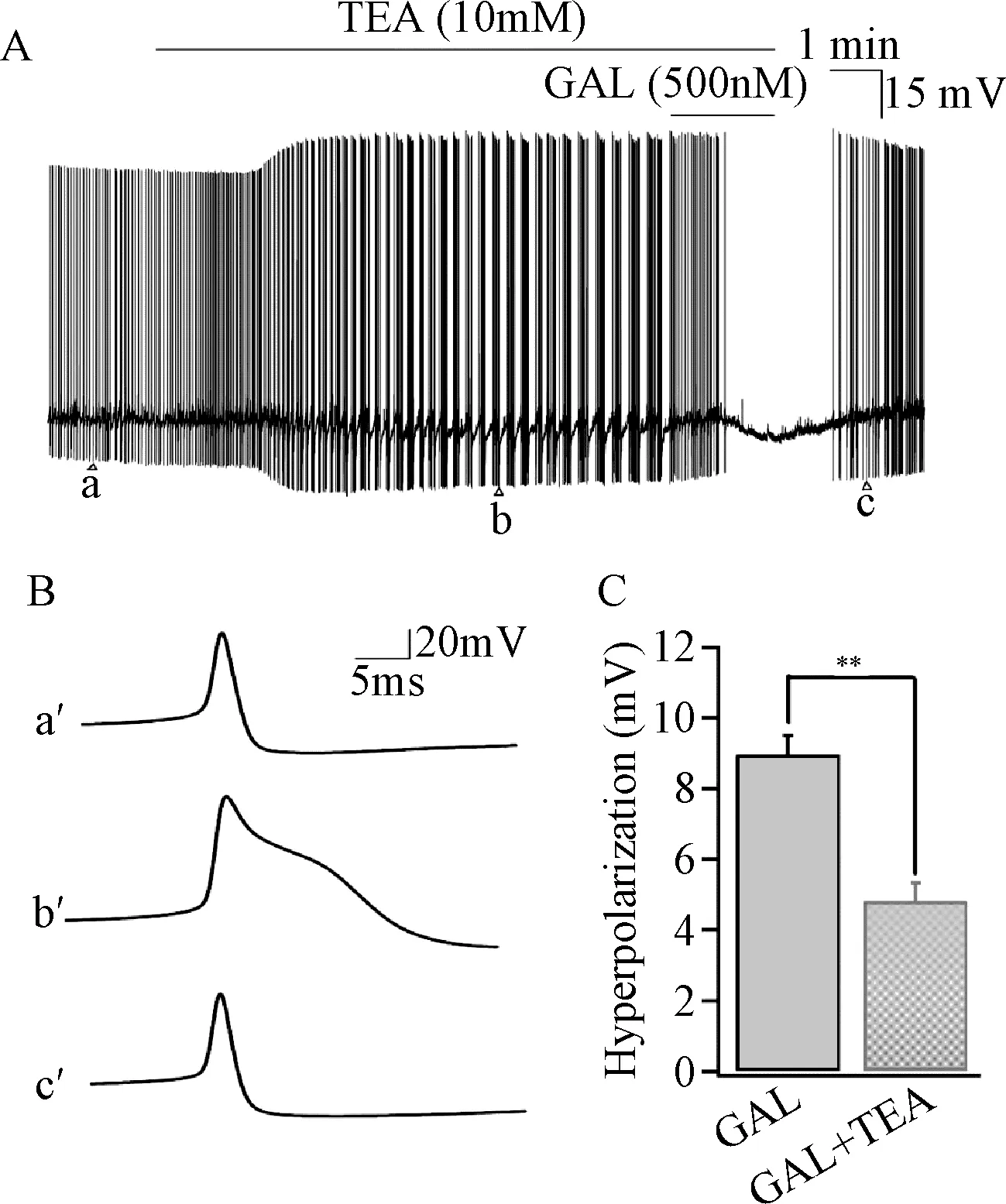
图4 TEA对甘丙肽诱导的幼年大鼠蓝斑神经元膜电位超级化的影响A:TEA减少甘丙肽诱导的膜电位超级化程度;B:TEA延长了蓝斑神经元动作电位复极化时程(a’、b’、c’分别对应图A中a、b、c);C:正常ACSF和给予阻断剂TEA后甘丙肽诱导的膜电位超极化程度**P<0.01Fig.4 GAL induced hyperpolarization can be partially blocked by TEAA:GAL induced weaker hyperpolarization in the presence of TEA;B:TEA broaden the time course of repolarization(a’,b’,c’ represent a,b,c in figure A, respectively);C:GAL induced hyperpolarization level in the presence of normal ACSF**P<0.01
2.5 BaCl2对甘丙肽抑制幼年大鼠蓝斑神经元作用的影响 当灌流给予一种广谱的内向整流钾通道阻断剂BaCl21 mM后,蓝斑神经元的放电频率显著增加,而静息膜电位水平并没有发生明显的变化(见图5A)。灌流给予BaCl210 min后,再给予500 nM甘丙肽2 min,甘丙肽的抑制作用几乎被完全阻断[GAL:(8.9638±3.682)mV;GAL+BaCl2:(0.951±0.6227)mV,P<0.001,见图5B]。说明甘丙肽的抑制作用很可能与内向整流钾通道密切相关。

图5 BaCl2对甘丙肽抑制蓝斑神经元作用的影响A: BaCl2能够显著阻断甘丙肽的抑制作用;B:正常ACSF和给予阻断剂BaCl2后甘丙肽GAL诱导幼年大鼠蓝斑神经元超极化程度比较***P<0.001Fig.5 Effect of BaCl2 on GAL induced hyperpolarizationA:GAL induced hyperpolarization can be blocked significantly by BaCl2;B:GAL induced hyperpolarization level in the presence of normal ACSF***P<0.001
2.6 ATP-敏感 K+/BK/SK通道阻断剂对甘丙肽诱导的超极化作用的影响 分别选用ATP敏感钾通道、大电导钙依赖的钾通道(BK通道)、小电导钙依赖的钾通道(SK通道)的阻断剂Glybenclamide (100 μM)、Charybdotoxin(500 nM)、Apamin(200 nM),预先灌流给予3种通道的阻断剂5 min后,500 nM甘丙肽的抑制作用与给药前相比差异并无统计学意义[GAL:(8.9638±3.682)mV,GAL+Glybenclamide:(9.0684±4.3313)mV,GAL+Charybdotoxin:(9.3008±3.3969)mV,GAL+Apamin:(9.2730±5.4779)mV,P>0.05,见图6)。说明ATP-敏感K+/BK/SK通道可能并未参与甘丙肽诱导的超极化作用。

图6 3种阻断剂对甘丙肽诱导的幼年大鼠蓝斑神经元膜电位超极化的影响A:灌流给予Glybenclamide(100 μM);B:灌流给予Charybdotoxin(500 nM);C:灌流给予Apamin(200 nM);D:正常脑脊液和分别给予Glybenclamide(100 μM)、Charybdotoxin(500 nM)和Apamin(200 nM)后甘丙肽诱导的膜电位超极化程度的变化Fig.6 Effect of three antagonist on GAL induced hyperpolarizationA:in the presence of Glybenclamide(100 μM);B:in the presence of Charybdotoxin(500 nM);C:in the presence of Apamin(200 nM);D:GAL induced hyperpolarization level in the presence of normal ACS
3 讨论
本研究首次对甘丙肽在幼年大鼠蓝斑神经元上的作用进行了观察,发现甘丙肽能够抑制幼年大鼠蓝斑神经元动作电位的发放频率和诱导其膜电位产生超极化,当给予选择性GalR2激动剂AR-M1896后,蓝斑神经元动作电位的发放频率并没有显著减少,即使给予高浓度的AR-M1896也没有发生明显的超极化,表明甘丙肽的抑制作用很可能是通过GalR1介导的。这一结果与本实验室既往在成年大鼠蓝斑神经元的观察结果一致[4]。因此,蓝斑神经元对甘丙肽的反应可能没有年龄依赖性,即蓝斑神经元上同时存在GalR1和GalR2,无论是成年还是幼年大鼠甘丙肽的作用主要是通过GalR1介导。
在成年大鼠,甘丙肽抑制蓝斑神经元动作电位的发放并诱导其膜电位产生超级化主要是通过激活钾通道增加钾电导产生。TEA是一种电压依赖性钾通道的阻断剂,在成年大鼠, TEA能够显著或完全阻断甘丙肽在蓝斑神经诱导的超极化作用[12],而在幼年大鼠蓝斑神经元,甘丙肽诱导的超级化作用只能被TEA部分阻断。内向整流钾通道阻断剂BaCl2能够明显阻断甘丙肽的抑制作用,说明在钾离子通道机制上成年和幼年大鼠存在差异。此外,无论在成年或幼年大鼠蓝斑神经元,ATP敏感通道阻断剂Glybenclamide都不能显著影响蓝斑神经元的静息膜电位,也未能阻断甘丙肽诱导的超级化作用。Charybdotoxin是一种BK通道阻断剂,本实验室前期实验表明:激活GalR2能够激活BK通道,增加钾电流[13],本实验中Charybdotoxin也未能阻断甘丙肽的抑制作用,这也间接表明甘丙肽诱导的超级化作用很可能主要是通过激活GalR1产生的;SK通道阻断剂Apamin既不能显著影响蓝斑神经元的静息膜电位,也不能显著阻断甘丙肽诱导的超级化作用,说明与成年大鼠相同,SK通道可能没有参与甘丙肽对幼年大鼠蓝斑神经元的作用。综上所述,甘丙肽对幼年大鼠蓝斑神经元的抑制作用很可能是通过激活GalR1进而增加内向整流钾通道电导产生的。
[1] Melander T, Hokfelt T, Rokaeus A,et al.Coexistence of galanin-like immunoreactivity with catecholamines,5-hydroxytryptamine,GABA and neuropeptides in the rat CNS[J].J Neurosci,1986,6(12):3640-3654.
[2] Tatemoto K,Rokaeus A,Jornvall H,et al.Galanin—a novel biologically active peptide from porcine intestine[J].FEBS Lett,1983,164(1):124-128.
[3] Branchek TA,Smith KE,Gerald C,et al.Galanin receptor subtypes[J].Trends Pharmacol Sci,2000,21(3):109-117.
[4] Ma X,Tong YG,Schmidt R,et al.Effects of galanin receptor agonists on locus coeruleus neurons[J].Brain Res,2001,919(1):169-174.
[5] O’donnell D,Ahmad S,Wahlestedt C,et al.Expression of the novel galanin receptor subtype GALR2 in the adult rat CNS:distinct distribution from GALR1[J].J Comp Neurol,1999,409(3):469-481.
[6] Finlayson PG,Marshall KC.Locus coeruleus neurons in culture have a developmentally transient alpha 1 adrenergic response[J].Brain Res,1986,390(2):292-295.
[7] Finlayson PG,Marshall KC.Hyperpolarizing and age-dependent depolarizing responses of cultured locus coeruleus neurons to noradrenaline[J].Brain Res,1984,317(2):167-175.
[8] Williams JT,Marshall KC.Membrane properties and adrenergic responses in locus coeruleus neurons of young rats[J].J Neurosci,1987,7(11):3687-3694.
[9] Williams JT,North RA,Shefner SA,et al.Membrane properties of rat locus coeruleus neurones[J].Neuroscience,1984,13(1):137-156.
[10] Wang S,Hashemi T,Fried S,et al.Differential intracellular signaling of the GalR1 and GalR2 galanin receptor subtypes[J].Biochemistry,1998,37(19):6711-6717.
[11] Lang R,Gundlach AL,Holmes FE,et al.Physiology,signaling,and pharmacology of galanin peptides and receptors:three decades of emerging diversity[J].Pharmacol Rev,2015,67(1):118-175.
[12] Pieribone VA,Xu ZQ,Zhang X,et al.Galanin induces a hyperpolarization of norepinephrine-containing locus coeruleus neurons in the brainstem slice[J].Neuroscience,1995,64(4):861-874.
[13] Pan NC,Bai YF,Yang Y,et al.Activation of galanin receptor 2 stimulates large conductance Ca(2+)-dependent K(+) (BK) channels through the IP3 pathway in human embryonic kidney (HEK293) cells[J].Biochem Biophys Res Commun,2014,446(4):316-321.
(编校:吴茜)
Effect and function mechanism of Galanin on neonatal rat locus coeruleus neurons
MA Hai-tao1, BAI Yun-fei2, LIU Li-na2, WANG Di1Δ, XU Zhi-qing2Δ
(1.School of Basic Medical Sciences, Jinzhou Medical University, Jinzhou 121000, China;2.School of Basic Medical Sciences, Capital Medical University, Beijing 100069, China)
ObjectiveTo explore the effect of galanin (GAL) on locus coeruleus (LC) neurons from neonatal rat and mechanism with its receptor GalR and potassium channel. MethodsBrain slices from neonatal rats were prepared and the resting membrane potential and spontaneous action potential of LC neurons were recorded with whole cell patch-clamp configuration. GAL, AR-M1896 and potassium channel blockers were bath applied with different concentration. ResultsBath application GAL induced hyperpolarization and inhibited firing rate of LC neurons. However, AR-M1896 (a selective GalR2 agonist) did not induce significant effect on LC neurons, only at very high concentration(1 μM) it induced slight hyperpolarization and reduced firing rate. The inhibitory effect of GAL was partially blocked by TEA (an antagonist of voltage-dependent potassium channel) and significantly blocked by BaCl2(an antagonist of inward-rectifying potassium channels), while other potassium channels blockers such as Glybenclamide(ATP-sensitive potassium channel blocker),Charybdotoxin(large-conductance Ca2+-activated K+channels blocker),Apamin(small-conductance Ca2+-activated K+channels blocker)failed to block it. ConclusionGAL inhibits LC neurons from neonatal rats, mainly through GalR1. TEA-sensitive potassium channels and inward-rectifying potassium channels, but not ATP-sensitive potassium channel and calcium-activated potassium channel, are involved in this inhibition.
Locus coeruleus; neurons; galanin; galanin receptors; potassium channels; antagonist
留学回国人员科研启动基金
马海涛,男,硕士在读,E-mail:mahaitao1988@126.com;王迪,通信作者,女,博士,教授,研究方向:运动行为的神经细胞分子机制及神经递质的调节;脑卒中基础与应用基础研究,E-mail:tulip_wang@yahoo.com;徐志卿,共同通信作者,男,博士,教授,研究方向:脑重大疾病(抑郁症、癫痫等)中神经肽及受体的作用及其分子机制研究,E-mail:zhiqingxu@ccmu.edu.cn。
R338.8
A
10.3969/j.issn.1005-1678.2016.04.10
