NOD小鼠调节性T细胞的功能表型分析
2016-07-23吴玲
吴 玲
(宣城市中心医院 内三科,安徽 宣城 242000)
·基础医学·
NOD小鼠调节性T细胞的功能表型分析
吴玲
(宣城市中心医院内三科,安徽宣城242000)
【摘要】目的:比较和探讨NOD(Non-Obese Diabetic)小鼠与正常BALB/C小鼠脾脏中CD4+CD25+调节性T细胞(regulatory T cell,Treg)的功能表型分子、抑制性细胞因子的表达差异及意义。方法:采用流式细胞检测技术,测定NOD小鼠(实验组)和正常BALB/C小鼠(对照组)脾脏中 Treg细胞(CD4+CD25+Foxp3+)的比例、功能表型分子(CTLA-4、GITR)和抑制性细胞因子(IL-10、TGF-β)的表达比例和平均荧光强度(mean fluorescence intensity,MFI)。结果:NOD小鼠脾脏中 CD4+CD25+Foxp3+Treg细胞比例与对照组相比无显著差异,但Foxp3+的MFI显著降低;NOD小鼠Treg细胞表达CTLA-4、GITR、IL-10、TGF-β均发生不同程度降低。结论:NOD小鼠Treg细胞功能表型分子表达下降,提示其免疫抑制功能降低,这可能与Ⅰ型糖尿病(type Ⅰ diabetes mellitus,T1DM)的发病有一定关系。
【关键词】1型糖尿病;NOD小鼠;调节性T细胞
【DOI】10.3969/j.issn.1002-0217.2016.03.004
Ⅰ型糖尿病(type Ⅰ diabetes mellitus,T1DM)是一种自身免疫性疾病,其免疫学致病机制主要是由于自身反应性T细胞的活化导致胰岛β细胞的破坏,造成胰岛素的绝对缺乏最终引起血糖升高。全球Ⅰ型糖尿病发病率逐年增加,主要好发于儿童及青少年[1-2],我国2010年成年人群患病率高达11.6%,是发病率增长最快的国家之一[3]。T1DM严重危害患者的健康,可引起机体多器官功能障碍,甚至器官衰竭;此外,患者须进行持续性治疗,也是其终生沉重的经济负担。因此,Ⅰ型糖尿病的研究十分重要。
CD4+CD25+调节性T细胞(Treg细胞)是1995年发现的一类重要的T细胞亚群,其对于机体维持耐受,保持免疫平衡至关重要。Treg细胞大致可分为2群:胸腺来源的天然Treg细胞(natural Treg,nTreg)和外周诱导的Treg细胞(induced Treg,iTreg)。Foxp3+(transcription factor forkhead box p3)是Treg细胞极其重要的标志性核心转录因子,对于诱导Treg细胞形成调节性表型,启动其各类抑制性细胞因子的表达和分泌,从而发挥免疫学抑制作用至关重要[4-6]。
一系列研究结果表明,在一些自身免疫性疾病中,Treg细胞数量或免疫抑制功能显著下降,从而导致免疫效应细胞过度活化,促进了自身免疫性疾病的进展。亦有研究表明,T1DM的发病与Treg细胞功能受到抑制相关。因此本文以NOD小鼠为T1DM模型,主要采用流式细胞术检测小鼠脾脏Treg细胞的表型和功能相关分子,进一步阐明Treg细胞在T1DM发病过程中的确切作用,希望将来能够为T1DM的免疫治疗提供可能的靶点。
1材料与方法
1.1实验动物和主要试剂SPF级雌性BALB/C小鼠、NOD小鼠均购自上海斯莱克实验动物有限公司。以下用于流式细胞术的抗小鼠的荧光标记抗体均购自eBioscience公司:PerCP-cy5.5-anti-CD3、FITC-anti-CD4、APC-anti-CD25、PE-anti-Foxp3+、PE-anti-CTLA-4、PE-anti-GITR、PE-anti-IL-10、PE-anti- TGF-β、同型对照抗体;RPMI 1640及胎牛血清(FBS)购自GIBCO公司;离子霉素(ionomycin)和佛波酯(PMA)购自Sigma公司;破膜固定试剂盒购自BD公司。
1.2制备脾的单细胞悬液15周龄的NOD小鼠及BALB/C小鼠麻醉后,无菌分离小鼠脾脏,研磨后用200目尼龙滤膜过滤。用红细胞裂解液(KHCO3,10.0 mmol/L;NH4Cl,155 mmol/L;EDTA,0.1 mmol/L;pH 7.2~7.4)去除红细胞,再用PBS重悬后计数。
1.3细胞染色及检测分析每只小鼠取脾细胞(2×106个)于15 mL离心管中,离心(4℃、1500 r/min、5 min),去上清;用100 μL Staining Buffer重悬细胞沉淀,加入1 μg PerCP-cy5.5-anti-CD3、0.25 μg FITC-anti-CD4、0.125 μg APC-anti-CD25,4℃,避光孵育30 min。以下操作视检测指标而定:①检测细胞核内转录因子Foxp3+:加入破膜固定试剂,4℃,避光孵育1 h;再加入1 μg Fc阻断剂,4℃,避光孵育15 min;最后加入1 μg PE-anti-Foxp3+,4℃,避光孵育30 min。②检测功能表型分子CTLA-4和GITR:分别加入0.25 μg PE-anti-CTLA-4或0.04 μg PE-anti-GITR,4℃,避光孵育30 min。③检测细胞因子IL-10和TGF-β:在所有荧光抗体染色前,须先加入离子霉素(1 μg/mL)、佛波酯(50 ng/mL)、Golgistop(1 μL/mL)刺激脾细胞6 h;然后再按如上方法标记表面分子CD3、CD4、CD25;再按如下方法进行破膜固定;最后分别加入0.125 μg PE-anti-IL-10或0.5 μg PE-anti-TGF-β。所有染色步骤的最后用500 μL Staining Buffer重悬细胞沉淀,上流式细胞仪(FACSCalibur,BD公司)进行检测,并用Flowjo 7.6.5软件分析。分析时,先通过FSC/SSC设门于淋巴细胞,然后再设门于CD3+CD4+CD25+T细胞,最后在此设定门内分别分析Foxp3+、CTLA-4、GITR、IL-10、TGF-β。
1.4统计学分析数据表达以均数±标准差表示。采用SPSS 11.5统计软件分析,两组间比较采用t检验,P<0.05为差异具有统计学意义。
2结果
2.1CD3+CD4+CD25+Treg细胞设门方法先通过散射光组合设门法(前向/侧向散射光)圈定淋巴细胞群(主要含T、B淋巴细胞),再分别通过细胞分子标记进一步圈定CD3+T细胞、CD3+CD4+CD25+Treg细胞(图1)。

图1CD3+CD4+CD25+Treg细胞设门方法
2.2NOD小鼠CD4+CD25+Foxp3+Treg细胞比例及Foxp3+的MFINOD小鼠脾脏中CD4+CD25+Foxp3+Treg细胞比例与正常BALB/C小鼠相比并无显著性差异(图2A、2B;t=0.888,P=0.409);但是NOD鼠CD4+CD25+Foxp3+Treg细胞的Foxp3+的MFI显著低于正常BALB/C小鼠(图2A、2C;t=6.172,P=0.001)。
2.3NOD小鼠CD4+CD25+CTLA-4+Treg细胞、CD4+CD25+GITR+Treg细胞比例及CTLA-4、GITR的MFICTLA-4和GITR是与Treg细胞免疫抑制功能密切相关的重要分子标记。NOD小鼠脾脏中CD4+CD25+CTLA-4+Treg及CD4+CD25+GITR+Treg细胞比例均显著低于正常BALB/C小鼠(图3A、3B、3D、3E;t=6.167、P=0.001vst=4.902、P=0.003);而且,这两群细胞CTLA-4及GITR的MFI同样显著低于正常BALB/C小鼠(图3C、3F;t=4.922、P=0.003vst=9.204、P=0.000)。

A. CD4+CD25+Foxp3+Treg的代表性流式结果图;B.比例统计图;C.MFI 统计图。
图2NOD小鼠CD4+CD25+Foxp3+Treg细胞比例及Foxp3+的MFI
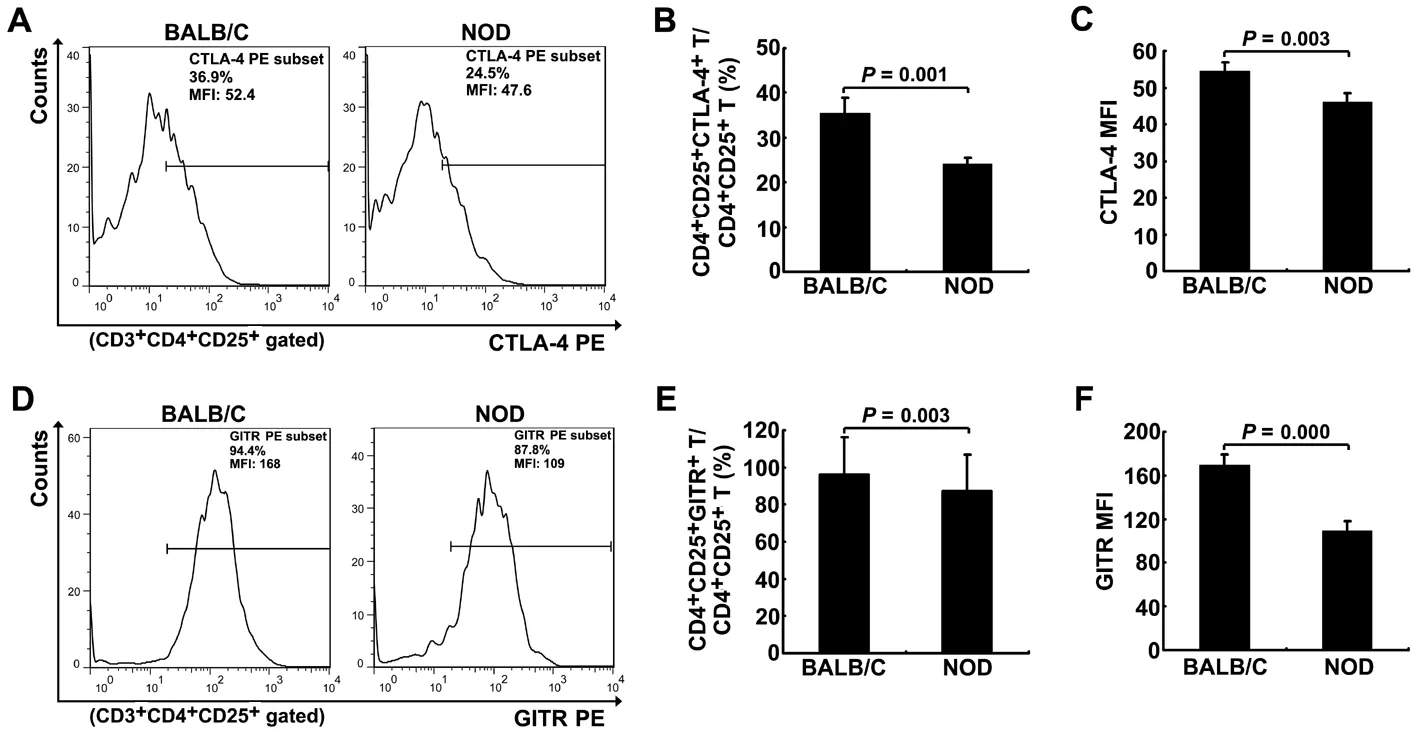
A.CD4+CD25+CTLA-4+Treg的代表性流式结果图;B.比例统计图;C.MFI 统计图;D.CD4+CD25+GITR+Treg的代表性流式结果图;E.比例统计图;F.MFI 统计图。
图3NOD小鼠CD4+CD25+CTLA-4+Treg、CD4+CD25+GITR+Treg细胞比例及CTLA-4、GITR的MFI
2.4NOD小鼠CD4+CD25+IL-10+Treg细胞、CD4+CD25+TGF-β+Treg细胞比例及IL-10、TGF-β的MFIIL-10、TGF-β是Treg细胞发挥免疫抑制功能的主要效应细胞因子。NOD小鼠脾脏中CD4+CD25+IL-10+Treg及CD4+CD25+TGF-β+Treg细胞比例均显著低于正常BALB/C小鼠(图4A、4B、4D、4E;t=4.824、P=0.003vst=5.483、P=0.002);而且,这两群细胞IL-10和TGF-β的MFI也同样显著低于正常BALB/C小鼠(图4C、4F;t=5.074、P=0.002vst=4.057、P=0.007)。

A.CD4+CD25+IL-10+Treg的代表性流式结果图;B.比例统计图;C.MFI 统计图;D.CD4+CD25+TGF-β+Treg的代表性流式结果图;E.比例统计图;F.MFI 统计图。
图4NOD小鼠CD4+CD25+IL-10+Treg细胞、CD4+CD25+TGF-β+Treg细胞比例及IL-10、TGF-β的MFI
3讨论
T1DM主要是由于T细胞进行性损伤胰岛β细胞导致的自身免疫性疾病。不同于其他自身免疫性疾病模型,NOD小鼠与人类T1DM发病极其类似,其T1DM的发生、发展均为自发性,80%的雌性NOD小鼠在出生12周后发生自发性糖尿病,因此是一种非常好的研究人类T1DM的动物模型[7]。
Treg细胞是免疫系统中一群具有广泛免疫抑制力的细胞,可对多种免疫细胞发挥抑制作用,属于免疫系统中非常关键的负调节机制之一[8-9]。Treg细胞功能若受到损害,会导致机体丧失免疫平衡,从而促进多种自身免疫病或炎症性疾病的发生,如T1DM、类风湿性关节炎、系统性红斑狼疮等[9-12]。先前已有研究发现,与正常人相比,T1DM病人外周血中Treg细胞的抑制能力是减弱的[10]。本研究通过NOD小鼠模型,进一步从核心功能转录因子Foxp3+、功能表型分子、抑制性细胞因子多个层面证明了NOD小鼠脾脏中Treg的抑制功能的不足。
Foxp3+是Treg细胞最重要的特征性标记,也是最为关键的核转录因子,对于Treg细胞的发育、分化、功能维持都很重要。Foxp3+可诱导Treg细胞表达一系列免疫抑制功能相关分子,如CD25、CTLA-4(cytotoxic T lymphocyte antigen-4)、GITR(glucocorticoid-induced TNF-receptor-related protein),提示Treg具有免疫抑制活性[13-14]。具有免疫抑制活性Treg细胞既能以细胞接触的方式通过CTLA-4发挥抑制效应,又可通过分泌抑制性细胞因子IL-10、TGF-β、IL-35发挥抑制效应[15]。本研究与别的学者研究结果一致[10],NOD小鼠脾脏中CD4+CD25+Treg细胞中Foxp3+的细胞比例,与正常对照组小鼠相比并无显著差异,但是Foxp3+的MFI却显著低于对照组小鼠。此结果提示,虽然NOD小鼠脾脏中Treg细胞比例(或数量)未发生变化,但是Treg细胞的免疫抑制功能是降低的。进一步实验证明,与Treg细胞功能有关的两个主要的表面分子CTLA-4和GITR,两者在Treg细胞中的比例和表达水平均显著降低。最后,本研究还检测了Treg细胞的IL-10和TGF-β表达水平,结果均与前面一致,NOD小鼠的Treg细胞表达此两种抑制性细胞因子的水平均显著降低。
总之,本研究从分子水平上进一步证实了NOD小鼠体内Treg细胞的免疫抑制功能有所降低,这无疑有利于自身反应性T细胞的激活和扩增,促进细胞免疫所介导T1DM的发生和进展,有效弥补Treg细胞的抑制功能不足,对T1DM的预防和治疗起重要作用。
【参考文献】
[1]EHEHALT S,DIETZ K,WILLASCH AM,etal.Epidemiological perspectives on type 1 diabetes in childhood and adolescence in germany:20 years of the Baden-wurttemberg Diabetes Incidence Registry (DIARY)[J].Diabetes Care,2010,33:338-340.
[2]GILLESPIE KM,BAIN SC,BARNETT AH,etal.The rising incidence of childhood type 1 diabetes and reduced contribution of high-risk HLA haplotypes[J].Lancet,2004,364:1699-1700.
[3]XU Y,WANG L,HE J,etal.Prevalence and control of diabetes in Chinese adults[J].JAMA,2013,310:948-959.
[4]LI Z,LI D,TSUN A,etal.FOXP3+regulatory T cells and their functional regulation[J].Cell Mol Immunol,2015,12:558-565.
[5]KAUFMAN GN,MASSOUD AH,DEMBELE M,etal.Induction of Regulatory T Cells by Intravenous Immunoglobulin:A Bridge between Adaptive and Innate Immunity[J].Front Immunol,2015,6:469.
[6]DHAEZE T,STINISSEN P,LISTON A,etal.Humoral autoimmunity:a failure of regulatory T cells[J]?Autoimmun Rev,2015,14:735-741.
[7]ANDERSON MS,BLUESTONE JA.The NOD mouse:a model of immune dysregulation[J].Annu Rev Immunol,2005,23:447-485.
[8]SAKAGUCHI S,YAMAGUCHI T,NOMURA T,etal.Regulatory T cells and immune tolerance[J].Cell,2008,133:775-787.
[9]SAKAGUCHI S,ONO M,SETOGUCHI R,etal.Foxp3+CD25+CD4+natural regulatory T cells in dominant self-tolerance and autoimmune disease[J].Immunol Rev,2006,212:8-27.
[10] LINDLEY S,DAYAN CM,BISHOP A,etal.Defective suppressor function in CD4(+)CD25(+) T-cells from patients with type 1 diabetes[J].Diabetes,2005,54:92-99.
[11] HORWITZ DA.Regulatory T cells in systemic lupus erythematosus:past,present and future[J].Arthritis Res Ther,2008,10:227.
[12] EHRENSTEIN MR,EVANS JG,SINGH A,etal.Compromised function of regulatory T cells in rheumatoid arthritis and reversal by anti-TNFalpha therapy[J].J Exp Med,2004,200:277-285.
[13] HORI S,NOMURA T,SAKAGUCHI S.Control of regulatory T cell development by the transcription factor Foxp3[J].Science,2003,299:1057-1061.
[14] FONTENOT JD,GAVIN MA,RUDENSKY AY.Foxp3 programs the development and function of CD4+CD25+regulatory T cells[J].Nat Immunol,2003,4:330-336.
[15] SAKAGUCHI S,POWRIE F.Emerging challenges in regulatory T cell function and biology[J].Science,2007,317:627-629.
Analysis on the function and phenotype of regulatory T cells in non-obese diabetic mice
WU Ling
Department of 3rd Internal Medicine,Xuancheng Central Hospital,Xuancheng 242000,China
【Abstract】Objective:To compare the expression of surface functional molecules and immunosuppressive cytokines(CD4+CD25+) of regulatory T cells(Tregs) in non-obese diabetic(NOD) mice and BALB/C mice.Methods:The percentage and expression intensity of key transcription factor Foxp3+,surface molecules (CTLA-4,GITR) and cytokines (IL-10 and TGF-β) of CD4+CD25+ Tregs in spleen of mice were determined with fluorescent antibody staining and analyzed by flow cytometry.Results:There was no significant difference in the percentage of CD4+CD25+Foxp3+ Tregs between NOD and control mice.However,CD4+CD25+ Tregs in NOD mice had led to significantly reduced expression levels of Foxp3+,surface molecules (CTLA-4,GITR) and cytokines (IL-10 and TGF-β),when expressed as the mean fluorescence intensity (MFI) respectively.Conclusion:Our findings confirmed impaired function of CD4+CD25+ Tregs in NOD mice that may facilitate the pathogenesis of T1DM.
【Key words】type 1 diabetes mellitus; non-obese diabetic mice; regulatory T cell
文章编号:1002-0217(2016)03-0219-04
收稿日期:2015-11-25
作者简介:吴玲(1983-),女,住院医师,(电话)18956308288,(电子信箱)xcwuling@163.com.
【文献标识码】【中图号】R 392;R 587.1A
