芝麻素对自发性高血压大鼠脑皮层氧化应激损伤的保护作用
2016-07-23卢毅宁沈媛媛杨解人
卢毅宁,沈媛媛,杨解人
(皖南医学院 药理学教研室,安徽 芜湖 241002)
·基础医学·
芝麻素对自发性高血压大鼠脑皮层氧化应激损伤的保护作用
卢毅宁,沈媛媛,杨解人
(皖南医学院药理学教研室,安徽芜湖241002)
【摘要】目的:探讨芝麻素(sesamin,Ses)对自发性高血压大鼠(SHR)脑皮层神经元型一氧化氮合酶(nNOS)及烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶亚单位p22phox、p47phox蛋白表达的影响。方法:16周龄雄性SHR 35只,随机分为SHR[(0.5%羧甲基纤维素钠5 mL/(kg·d)]模型组,Ses高、低[160 mg/(kg·d)、80 mg/(kg·d)]剂量组,卡托普利30 mg/(kg·d)阳性组,每组7只。另设Wistar-Kyoto(WKY)0.5%羧甲基纤维素钠5 mL/(kg·d)正常对照组7只,每日给药1次,连续灌胃12周。于末次给药后断头取脑,尼氏染色观察脑皮层神经元细胞病理变化并计数;比色法测定脑皮层组织MDA、H2O2、SOD及T-AOC的含量;硝酸还原酶法测定脑皮层组织NO含量;Western Blot法检测脑皮层nNOS、p22phox及p47phox蛋白表达。结果:SHR模型组脑皮层存在组织损伤,神经元细胞排列疏松不均,形态不规则且细胞数量减少(P<0.05);脑皮层组织MDA、H2O2和NO增高,SOD、T-AOC明显降低(P<0.05或P<0.01);脑皮层nNOS、p22phox和p47phox蛋白表达上升(P<0.05或P<0.01)。芝麻素给药12周后,芝麻素高、低剂量组对SHR脑皮层病理性损伤均有不同程度改善,细胞数目增多(P<0.05或P<0.01),脑皮层组织MDA、H2O2和NO减少,SOD、T-AOC明显升高(P<0.05或P<0.01);脑皮层nNOS、p22phox和p47phox蛋白表达明显下调(P<0.05或P<0.01)。结论:Ses具有改善SHR脑皮层损伤的氧化应激作用,其机制与下调nNOS及p22phox、p47phox蛋白表达有关。
【关键词】芝麻素;脑皮层;神经元型一氧化氮合酶;NADPH氧化酶;氧化应激
【DOI】10.3969/j.issn.1002-0217.2016.03.003
高血压是常见的威胁人类生命健康的疾病,主要损害人体重要靶器官心、脑、肾及血管。文献表明[1],脑部在高血压状态下,会发生不同程度的脑缺血或出血性病变等高血压并发症,进而引起神经细胞损伤和脑血管病变,最终对大脑皮层造成损伤。同时有文献报道高血压大鼠脑部存在氧化应激状态并造成脑损伤[2],提示氧化应激在高血压脑损伤的发生发展中起重要作用,因此寻找具有抗氧化作用的脑保护药物具有重要意义。芝麻素(sesamin,Ses)是从芝麻中提取的木脂素类化合物,具有降血压、抗氧化、降血脂等[3-4]作用。前期研究中我们发现,Ses可以降低肾性高血压、肾性高血压伴高脂高糖饮食大鼠血压并缓解心脏、肾脏等靶器官的损伤[5],其作用机制与其在靶器官发挥的抗氧化作用相关。但关于Ses对SHR脑皮层损伤的保护作用是否与抗氧化应激有关未见相关报道。故本研究采用SHR模型,观察Ses对SHR脑皮层的保护作用,并且通过研究nNOS及NADPH氧化酶亚单位p22phox、p47phox等与氧化应激相关蛋白的表达来探讨其可能机制。
1材料与方法
1.1实验动物16周龄雄性SHR 35只和WKY 7只,体质量(340±20)g,许可证号:SCXK(沪)2007-0005,购于上海斯莱克实验动物有限责任公司。单笼饲养,保持温度22~25 ℃,相对湿度60%~70%,自然光照,定时进食和饮水,饲料购于南京市江宁区青龙山动物繁殖场。
1.2药品和试剂芝麻素(纯度93.7%),分子式为C20H15O6,分子量354.34,批号P0315(北京兴百祥科贸有限公司)。卡托普利(captopril,Cap),25 mg/片,批号:09102411(常州制药有限公司);超氧化物歧化酶(SOD,编号:S0107)、总抗氧化能力(T-AOC,编号:S0116)、丙二醛(MDA,编号:S0131)、过氧化氢(H2O2,编号:S0038)、一氧化氮(NO,编号:S0021)及BCA蛋白检测试剂盒(江苏碧云天生物技术研究所)。nNOS抗体,编号:BA0360(武汉博士德生物科技有限公司)、p22抗体,编号:sc-20781、p47抗体,编号:sc-86190(Sant Cruz公司)。辣根过氧化物酶标记山羊抗兔IgG,编号:A0208,辣根过氧化物酶标记山羊抗小鼠IgG,编号:A0216,Tubulin抗体,编号:AT819(江苏碧云天生物技术研究所)。氟化聚偏乙烯(polyvinylidene fluoride,PVDF)微孔转移膜(美国Millipore公司)。
1.3实验分组及给药雄性16周龄SHR 35只,WKY 7只,适应性喂养2周。SHR随机分组:SHR[0.5%羧甲基纤维素钠5 mL/(kg·d),n=7]模型组、Ses高剂量[160 mg/(kg·d),n=7]组、Ses低剂量[80 mg/(kg·d),n=7]组、Cap[30 mg/(kg·d),n=7]阳性对照组。另设WKY[0.5%羧甲基纤维素钠5 mL/(kg·d),n=7]正常对照组。每日下午5时灌胃给药1次,连续12周。
1.4标本采集与组织处理于末次给药后,大鼠禁食12 h,麻醉,断头取脑。取每组大鼠左脑,以冠状面切分为4段,分别置于4%多聚甲醛溶液中固定,用于石蜡包埋;另取每组大鼠右脑皮层置于1.5 mL EP管中,用于制备10%组织匀浆;并将剩余脑皮层-80 ℃保存,用于Western blot实验。
1.5尼氏(Nissl)染色常规石蜡切片(5 μm),放入60 ℃烘箱烤干2 h后,常规脱蜡至水。加入尼氏染色液5 min后,用蒸馏水冲洗两次后常规脱水、透明、中性树胶封片,显微镜下观察大鼠脑皮层神经元细胞的变化,随后选取每组脑皮层各区切片,随机选取5个视野,在400倍光镜下进行细胞计数,取其均数进行分析。
1.6生化指标测定BCA法测定组织蛋白浓度。按试剂盒说明书分别以黄嘌呤氧化酶法、硫代巴比妥酸比色法、二甲酚橙比色法和ABTS法测定脑组织匀浆SOD、MDA、H2O2和T-AOC的含量,硝酸还原酶法测定脑皮层组织匀浆中NO含量。
1.7Western Blot法检测脑皮层nNOS、p22phox和p47phox蛋白低温提取组织蛋白,BCA法测定蛋白浓度。每孔上样60 μg蛋白,10%SDS-PAGE分离样品,转膜,封闭,再分别滴加Tubulin(1∶1000)、nNOS(1∶200)及p22phox(1∶500)、p47phox(1∶200)一抗4 ℃过夜。洗膜,二抗(1∶2000)室温孵育2 h。洗膜后将高灵敏的ECL化学发光剂加到膜的正面,暗室压片曝光、显影。胶片扫描后用Image J 1.43软件统计各组集成光密度值,并统计分析比较各组蛋白表达差异。
2结果
2.1Ses对SHR脑皮层的病理组织学影响尼氏染色结果显示,WKY组脑皮层神经元细胞染色清晰,排列紧密、规则,形态完整;与WKY组相比,SHR模型组脑皮层神经元细胞排列疏松不均,形态不规则,且细胞数量减少(P<0.05),细胞空染或淡染;与SHR组相比,Ses高、低剂量组及Cap组脑皮层神经元细胞排列较紧密,形态较规则,细胞空染或淡染均有不同程度的减少,其中Ses高剂量组细胞数量显著上升(P<0.05)。提示Ses具有改善SHR皮层损伤的作用(见图1,表1)。

A.WKY; B.SHR; C.Ses 80 mg/kg; D.Ses 160 mg/kg; E.Cap 30 mg/kg。
图1Ses对SHR皮层的影响(尼氏染色,×400)


GroupDose/(mg/kg)神经元细胞数WKY-144.00±19.78SHR-73.63±12.38*+Ses8078.29±2.81+Ses160116.00±6.51#+Cap3082.51±2.77F值10.632P值<0.01
*P<0.05,**P<0.01vsWKY;#P<0.05,##P<0.01vsSHR。
2.2芝麻素对SHR脑皮层组织匀浆T-AOC、SOD、MDA和H2O2的影响与WKY组相比,SHR模型组脑皮层组织匀浆MDA和H2O2含量明显升高(P<0.05),SOD和T-AOC含量明显降低(P<0.05);与SHR模型组相比,Ses高、低剂量组及Cap组脑皮层MDA及H2O2含量明显降低(P<0.05或P<0.01),SOD和T-AOC含量明显升高(P<0.05或P<0.01)。提示Ses具有抗SHR脑皮层氧化应激的作用(见表2)。


Group/(mg/kg)T-AOC/(U/mgprot)SOD/(mmol/gprot)MDA/(μmol/gprot)pO2/(μmol/gprot)WKY4.97±0.23138.70±15.0211.40±1.33132.10±5.36SHR3.71±0.20**72.60±6.82**35.29±6.79**257.50±37.90*+Ses(80)4.41±0.13#105.90±9.49#17.21±2.51#208.90±31.22+Ses(160)4.85±0.25##130.60±12.50##11.55±1.96##138.60±5.84#+Cap(30)4.83±0.12##128.80±12.76##10.99±1.84##111.40±8.44##F值14.94711.20918.34915.337P值<0.01<0.01<0.01<0.01
*P<0.05,**P<0.01vsWKY;#P<0.05,##P<0.01vsSHR。
2.3芝麻素对SHR脑皮层组织匀浆NO的影响与WKY组相比,SHR组脑皮层组织中NO含量明显上升(P<0.05)。与SHR组相比,Ses[160 mg/(kg·d)]组和Cap 组均有不同程度下降(P<0.05),提示Ses可以降低SHR脑皮层中NO含量(见图2)。
2.4Ses对SHR脑皮层nNOS蛋白表达的影响与WKY组相比,SHR组脑皮层组织nNOS蛋白表达明显上调(P<0.01);与SHR组相比,Ses 高、低剂量组和Cap 组nNOS蛋白表达均显著下调(P<0.01)。提示Ses可以下调SHR脑皮层nNOS蛋白的表达(见图3)。

*P<0.05,**P<0.01vsWKY; #P<0.05,##P<0.01vsSHR。
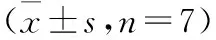
*P<0.05,**P<0.01vsWKY; #P<0.05,##P<0.01vsSHR。
2.5Ses对SHR脑皮层p22phox和p47phox蛋白表达的影响与WKY组相比,SHR组脑皮层p22phox和p47phox蛋白表达明显上调(P<0.01);与SHR组相比,Ses 高、低剂量组和Cap组脑皮层p22phox和p47phox蛋白的表达不同程度地下调(P<0.05或P<0.01)。提示Ses具有下调SHR脑皮层p22phox和p47phox蛋白的作用(见图4)。
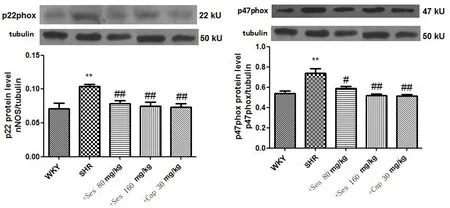
*P<0.05,**P<0.01vsWKY; #P<0.05,##P<0.01vsSHR。
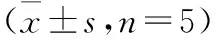
3讨论
研究表明长期的高血压可导致SHR脑血管、脑皮层等部位发生结构形态、组织代谢的损伤[6],国外研究发现高血压对SHR脑皮层功能造成严重危害并引起紊乱[7]。通过对饲养28周后的SHR脑皮层组织进行尼氏染色观察其形态改变发现其脑皮层中神经元细胞形态不规则,排列疏松不均,且细胞数量减少,证实了高血压可引起SHR脑皮层发生损伤。当SHR每天进行1次Ses灌胃给药,给药12周后,不同Ses剂量组大鼠脑皮层组织损伤得到不同程度改善,且细胞数得到不同程度恢复,提示Ses具有改善SHR脑皮层损伤的作用。
当体内自由基的产生远高于氧化防御体系的保护能力时,体内自由基与抗氧化物质的平衡被打破,就会导致机体氧化应激并引起损伤[8]。文献结果显示,SHR大鼠脑组织自由基生成过多,抗氧化防御能力和自由基清除能力下降[9-10],最终导致SHR大鼠脑部发生氧化应激。国外研究发现,高血压大鼠脑皮层存在氧化应激[11]。因此本课题组制备脑皮层组织匀浆,发现SHR脑皮层组织自由基指标MDA和H2O2含量明显高于WKY组,证明SHR脑皮层存在大量自由基;同时发现SHR组大鼠脑皮层抗氧化能力指标SOD活性和T-AOC能力明显低于WKY组,提示SHR脑皮层清除自由基和总抗氧化能力明显减弱,说明脑皮层存在氧化应激状态。经Ses治疗12周后,SHR脑皮层组织MDA和H2O2含量明显降低,SOD活性和T-AOC能力明显提高,提示Ses可改善SHR脑皮层的氧化应激状态。但Ses具体是通过何种途径改善SHR脑皮层的氧化应激,有待于进一步研究。故本课题组采用硝酸还原酶法测定脑皮层NO含量,同时用免疫印迹方法检测nNOS及NADPH氧化酶亚基蛋白表达,从nNOS-NO通路及NADPH氧化酶亚基p22phox和p47phox途径,探索Ses保护SHR脑皮层氧化应激损伤的可能机制。
文献报道,在对SHR脑损伤的研究中发现持续的高血压状态可最终导致nNOS过量表达,并催化精氨酸产生过量NO[12]。过量的NO可与超氧阴离子(O2-)反应生成过氧亚硝基阴离子(ONOO-)等自由基进而引起氧化应激损伤。本实验结果表明,SHR脑皮层组织中NO含量显著增高,且nNOS蛋白表达明显上调,表明SHR脑皮层nNOS蛋白过表达并生成过量NO,造成脑皮层氧化应激损伤。经Ses给药治疗后,SHR脑皮层组织内NO含量下降,nNOS蛋白表达明显下调,说明Ses可下调nNOS蛋白表达并抑制NO产生,调节nNOS-NO通路,改善SHR脑皮层氧化应激。
NADPH 氧化酶是体内氧化应激的另一重要来源,包括p22phox和gp91phox以及p47phox、p67phox等各种亚单位。在病理状态或大量有害物质聚集等条件作用下,NADPH 氧化酶被激活从而造成高血压大鼠脑部自由基进一步蓄积[13]。本实验结果发现SHR脑皮层p22phox、p47phox蛋白表达均显著上升,经Ses治疗后,SHR脑皮层p22phox、p47phox蛋白表达均不同程度下降,提示Ses可下调脑皮层p22phox、p47phox蛋白表达,调节NADPH氧化酶亚基p22phox和p47phox途径引起的氧化应激。
综上所述,芝麻素可能通过抑制脑皮层nNOS-NO和NADPH氧化酶亚基p22phox、p47phox所介导通路,降低脑皮层自由基含量,提高其抗氧化能力,进而对自发性高血压大鼠脑皮层氧化应激损伤起到改善作用,但其确切机制有待进一步研究。
【参考文献】
[1]HE DH,ZHANG LM,NING RB,etal.Differential effects of anti hypertensive treatments on apoptosis,oxidative stress,and expression of angiotensin receptors in the cerebral cortex from the onset of prehypertension and hypertension in stroke-prone spontaneous hypertensive rats[J].Neuroreport,2013,24(16):911-917.
[2]王琰,余毅,周丽娜.坎地沙坦抑制盐负荷高血压大鼠大脑尼克酰胺腺嘌呤二核苷酸磷酸氧化酶基因的表达[J].中华高血压杂志,2009,17(3):222-225.
[3]SU SUWEN,LI QIAN,LIU YI,etal.Sesamin ameliorates doxorubicin-induced cardiotoxicity:involvement of Sirt1 and Mn-SOD pathway[J].Toxicology Letters,2014,224(2):257-263.
[4]ZHANG JUNXIU,YANG JIEREN,CHEN GUOXIANG,etal.Sesamin ameliorates arterial dysfunction in spontaneously hypertensive rats via downregulation of NADPH oxidase subunits and upregulation of eNOS expression[J].Acta Pharmacologica Sinica,2013,34(7):912-920.
[5]LI WENXING,KONG XIANG,ZHANG JUNXIU,etal.Long-term intake of sesamin improves left ventricular remodelling in spontaneously hypertensive rats[J].Food & function,2013,4(3):453-460.
[6]王超,张志国,贾晓旭.自发性高血压大鼠脑损伤研究概况[J].中国药理学通报,2009,25(10):1272-1274.
[7]BREZHNEVA ES.Electroencephalographic data on functional changes of the cerebral cortex in hypertension[J].Klinicheskaia Meditsina,1954,32(9):52-57.
[8]MONTEZANO AC,DULAK-LIS M,TSIROPOULOU S,etal.Oxidative stress and human hypertension:Vascular mechanisms,biomarkers and novel therapies[J].Canadian Journal of Cardiology,2015,31(5):631-641.
[9]黄峰,朱鹏立,林帆,等.替米沙坦及吡哆胺对自发性高血压大鼠脑组织氧化应激的影响[J].中国应用生理学杂志,2012,28(4):342-345.
[10] 李湘民,龚姣娥,杨期东.缬沙坦对自发性高血压模型鼠脑氧化应激的影响[J].中风与神经疾病杂志,2010(5):420-422.
[11] KISHI T,HIROOKA Y,SUNAGAWA K.Telmisartan protects against cognitive decline via up-regulation of brain-derived neurotrophic factor/tropomyosin-related kinase B in cerebral cortex of hypertensive rats[J].Journal of Cardiology,2012,60(6):489-494.
[12] 乔松,冯加纯,杨晶.高血压大鼠脑内小血管改变及其继发损伤的研究[J].中风与神经疾病杂志,2006,23:290-293.
[13] HUANG F,ZHU P L,LIN F,etal.Effect of telmisartan and pyridoxamine on oxidative stress in brain tissue of spontaneously hypertensive rats[J].Chinese journal of applied physiology,2012,28(4):342-345.
Antioxidative effect of sesamin on the cerebral cortex protection in spontaneous hypertensive rats
LU Yining,SHEN Yuanyuan,YANG Jieren
Department of Pharmacology,Wannan Medical College,Wuhu 241002,China
【Abstract】Objective:To investigate the effect of sesamin on nNOS,NADPH oxidase subunits p22phox and p47phox expression at the cerebral cortex in spontaneous hypertensive rats(SHR).Methods:Forty male SHRs,aged 16 weeks,were randomized into groups of SHR model,n=7,treated with 0.5% sodium carboxymethyl cellulose in dose of 5 mL/(kg·d),sesamin treatment group by diverse dosage 80 mg/(kg·d) and 160 mg/(kg·d),n=7 for each dosage,and captopril intervention group,30 mg/(kg·d),n=7.Another 7 Wistar-Kyoto(WKY) rats were included as negative controls treated with 0.5% sodium carboxymethyl cellulose in dose of 5 mL/(kg·d).All rats were intragastrically administrated with the drugs once a day for consecutive 12 weeks,and the brain tissues were obtained after final treatment.Nissl′s staining was used to detect changes of the cortex neurons in rats in each group.MDA,H2O2,SOD,T-AOC levels and NO content in the cortex homogenate and the expression of nNOS,p22phox and p47phox protein were determined respectively by,colorimetry,nitrate reductase method and Western blot.Results:Damaged cerebral cortex was seen in SHR models.The neurons were in loose arrangement and irregular in shape,with reduced cells.However,sesamin treatment had significantly relieved the neuron damage at cerebral cortex and promoted the number of neuron in different cortex regions(P<0.05 or P<0.01),and markedly reduced the levels of MDA,H2O2,SOD and NO amount in cortex homogenate(P<0.05 or P<0.01).The expression of nNOS,p22 phox and p47phox protein was greatly reduced and the SOD and T-AOC levels were notably improved in cortex homogenate in SHR rats(P<0.05 or P<0.01).Conclusion:Sesamin may produce antioxidative effect on the damage of cerebral cortex in SHRs.The mechanism may be associated with decreased expression of nNOS,p22phox and p47phox protein.
【Key words】sesamin;cerebral cortex;nNOS;NADPH oxidase;oxidative stress
文章编号:1002-0217(2016)03-0214-05
基金项目:安徽省自然科学基金项目(1308085QH145)
收稿日期:2015-12-14
作者简介:卢毅宁(1990-),男,2013级硕士研究生,(电话)15212244260,(电子信箱)815471692@qq.com;
【文献标识码】【中图号】R 285;R 544.1A
杨解人,女,教授,硕士生导师,(电子信箱)jryang1955@sina.com,通讯作者.
