刺芹侧耳原生质体的再生及多糖含量差异
2016-07-23李艳丽金周雨李玉
李艳丽++金周雨++李玉

摘要:采用溶壁酶进行刺芹侧耳菌丝原生质体的制备,研究培养基、渗透压稳定剂和稀释剂PPRL对原生质体再生率的影响,以从中筛选原生质体再生的最佳培养条件。对再生菌丝进行发酵培养,提取原生质体再生菌株菌丝体胞内多糖(IPS)、发酵液胞外多糖(EPS),并进行含量测定。结果表明:最佳再生培养基为PPR,渗透压稳定剂、稀释剂均为0.6 mol/L甘露醇;此时原生质体经过14 d左右的培养可再生出白色菌落,再生率为0.76%;原生质体再生菌丝IPS、EPS含量差异明显,多株高于亲本菌株。研究结果为刺芹侧耳高产多糖菌株的选育奠定了前期基础。
关键词:刺芹侧耳;多糖含量;原生质体;再生率
中图分类号: S646.1+41.03文献标志码: A文章编号:1002-1302(2016)05-0255-03
eryngii)别称杏鲍菇,是一种珍稀美味食用菌[1],它不但营养丰富[2],而且具有保健功能[3-5]。近年的研究表明,刺芹侧耳富含有药理活性的多糖,展现了较强的抗氧化作用[6]、抗肿瘤活性[7-8]以及降脂活性[9]。因此可知,刺芹侧耳及其多糖已经逐渐成为人们研究的热点。
原生质体是一种具有生物全能性的细胞,在食用菌的遗传育种领域具有重要应用[10-12]。本研究探索再生条件对刺芹侧耳原生质体再生率的影响,旨在筛选出再生率最高的培养条件;同时对原生质体再生菌株菌丝体胞内多糖(IPS)、发酵液胞外多糖(EPS)进行提取,并测定其含量,以期为刺芹侧耳高产多糖菌株的选育奠定前期基础。
1材料与方法
1.1材料
供试菌株为刺芹侧耳菌株HB3,购自吉林省高新技术园区。溶壁酶购自广东省微生物研究所。
培养基及其配方如下。PDR:200 g马铃薯、2 g葡萄糖、20 g琼脂粉、0.6 mol/L甘露醇,用蒸馏水补足至1 000 mL。
POR:在PDR中添加3 g KH2PO4、1.5 g MgSO4、10 mg维生素B1。PPR:在POR中添加2 g蛋白胨、2 g酵母膏。CMR:20 g葡萄糖、2 g蛋白胨、2 g酵母膏、0.46 g KH2PO4、1.0 g K2HPO4、0.5 g MgSO4、20 g琼脂粉、0.6 mol/L甘露醇,用蒸馏水补足至1 000 mL。PMR:10 g麦芽糖、4 g葡萄糖、4 g酵母膏、1.0 g KH2PO4、1.0 g MgSO4、10 g可溶性淀粉、20 g琼脂粉、0.6 mol/L甘露醇,用蒸馏水补足至1 000 mL。YPR:30 g玉米粉、20 g葡萄糖、1.0 g蛋白胨、1.0 g KH2PO4、0.5 g MgSO4、20 g琼脂粉、0.6 mol/L甘露醇,用蒸馏水补足至 1 000 mL。
以上培养基于121 ℃高压灭菌20 min,备用。
1.2试验方法
1.2.1原生质体的制备采用相应文献的方法[13]。
1.2.2原生质体的再生将原生质体悬液用0.6 mol/L甘露醇适当稀释,取100 μL涂布于再生培养基中,置于25 ℃恒温培养箱中避光培养,同时用蒸馏水稀释原生质体悬液作为空白对照。再生率计算公式:
再生率=再生培养基中菌落数/涂布的原生质体数×100%。
1.2.3培养基种类对再生率的影响用“1.1”节中培养基进行原生质体再生,考察其对再生率的影响。
1.2.4渗透压稳定剂对再生率的影响以甘露醇、蔗糖、MgSO4、NaCl作为渗透压稳定剂,分别考察其在浓度为0.4、0.6、0.8 mol/L时对再生率的影响。
1.2.5PPRL对再生率的影响PPRL为PPR的液体培养基,考察其对原生质体再生率的影响。
1.2.6再生菌株多糖的发酵培养、提取及含量的测定随机筛选原生质体再生菌株10株(编号为SH1至SH10),先经PPA(无0.6 mol/L甘露醇的PPR)活化培养,然后用直径 1 cm 打孔器取出2块菌丝,接种在CMA(无0.6 mol/L甘露醇的CMR液体培养基)中,于25 ℃、160 r/min培养5~6 d,转接至CMA加富培养基(CMA中添加20 g玉米浸汁)中,于25 ℃、160 r/min培养9 d,真空抽滤菌丝,冷冻干燥。采用相应文献方法提取IPS、EPS[14],采用苯酚硫酸法测定含量[15]。
2结果与分析
2.1原生质体的制备及再生
由图1可见:镜检下原生质体呈现球状,无残余菌丝片段,说明采用本试验方法可获得纯净的刺芹侧耳原生质体,且产量较高,达到6.34×107个/mL。经过12~14 d的培养,原生质体可以萌发出幼眼可见的白色菌落,空白对照则无再生菌落生长,进一步说明原生质体纯化较好。经过一段时间的培养,可见菌落形态各异,或浓密,或稀疏,且大小不等。有的菌落形态较特殊,中心、外周突起,形成1个环状凹陷(图1-Ⅱ中箭头指示);有的菌落间会产生拮抗(图1-Ⅲ中箭头指示)。这些现象表明,再生菌落之间遗传性状差异明显。
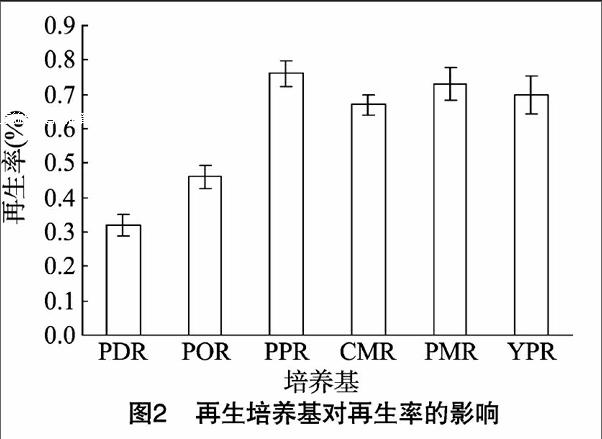
2.2培养基种类对再生率的影响
培养基种类对再生率的影响如图2所示:PPR培养基再生率最高,为0.76%;其次是PMR、YPR、CMR,再生率与PPR相差不明显;再次是POR、PDR,它们的再生率明显偏低,PDR的再生率仅为0.32%。
此外,原生质体在不同培养基中再生成菌落时间并不一致。在YPR中约12 d,而在其他培养基中约14 d,可见再生培养基成分对原生质体再生率有较大影响。综上可知,PPR、PMR、YPR、CMR均有利于原生质体的再生,可作为再生培养基使用,本试验选取PPR作为最终再生培养基。
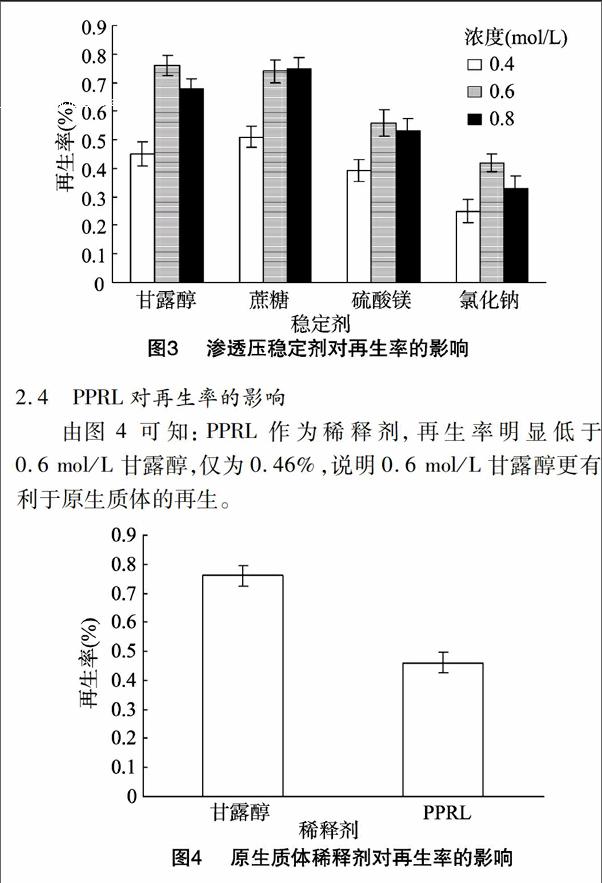
2.3渗透压稳定剂对再生率的影响
由图3可知:甘露醇、蔗糖作为渗透压稳定剂的再生率明显高于无机渗透压稳定剂MgSO4、NaCl,且再生率与渗透压稳定剂的浓度明显相关,当浓度为0.6 mol/L时(除0.8 mol/L蔗糖),原生质体的再生率最高,其次是0.8 mol/L,浓度为0.4 mol/L 时再生率最低。0.6 mol/L的甘露醇再生率达到0.76%,0.4 mol/L NaCl 再生率仅为0.25%。综上可知,0.6 mol/L 甘露醇、0.6~0.8 mol/L蔗糖均有助于刺芹侧耳原生质体的再生,可作为渗透压稳定剂使用,因此本试验选取0.6 mol/L甘露醇作为最终的渗透压稳定剂。
2.4PPRL对再生率的影响
由图4可知:PPRL作为稀释剂,再生率明显低于0.6 mol/L 甘露醇,仅为0.46%,说明0.6 mol/L甘露醇更有利于原生质体的再生。
2.5多糖含量的测定结果
由表1可知:原生质体再生菌株与亲本菌株的IPS、EPS含量差异均较大,有4株再生菌株IPS含量高于亲本菌株HB3,分别为SH3、SH4、SH5、SH7,其中SH7最高,为(127.8±3.2)mg/g,比亲本菌株高34.8%;有6株再生菌株EPS含量高于亲本菌株,分别为SH1、SH2、SH4、SH6、SH8、SH9,其中SH9的EPS含量最高,为(324.4±8.3)mg/L,比亲本菌株高42.1%。其他几株菌株的IPS、EPS含量或接近或低于亲本菌株。
3讨论与结论
原生质体酶解后需要过滤纯化除去残余的菌丝片段,以减少对原生质体后续操作的影响。本研究通过溶壁酶制备系统较好地实现了原生质体的纯化。原生质体再生受到多种因素的影响[16-18],但有关刺芹侧耳原生质体最佳再生条件的研究鲜有报道。
本研究设计了不同的培养基、渗透压稳定剂及稀释剂,以期筛选最佳再生条件。结果显示:PPR培养基为最佳再生培养基,再生率是PDR的2.37倍。笔者认为,与PDR相比,PPR含有蛋白胨、酵母膏等营养物质,它们更有利于原生质体再生为菌丝。0.6 mol/L甘露醇作为最佳渗透压稳定剂,再生率比0.4 mol/L NaCl高2.04倍。一般认为,有机渗透压稳定剂比无机渗透压稳定剂更有利于食用菌原生质体的再生[16-17],本试验结果与其一致。有报道称,真菌细胞壁成分主要为葡萄糖、几丁质[19];笔者认为,甘露醇、蔗糖等糖醇类有机渗透压稳定剂更有利于转化为真菌的细胞壁物质,这是再生率高的主要原因。
再生菌株、亲本菌株IPS、EPS含量测定结果表明,经原生质体再生的菌丝多糖含量与亲株相比差异明显,有几株多糖含量分别高于亲株,暗示其遗传物质可能发生了变异,这点通过再生菌丝的形态和菌丝间拮抗也可以得到初步证实。通过原生质体再生筛选刺芹侧耳高产多糖菌株鲜有报道,因此这些菌株的获得具有一定的理论和实际参考价值。
参考文献:
[1]郭美英. 珍稀食用菌杏鲍菇生物学特性的研究[J]. 福建农业学报,1998,13(3):45-50.
[2]Reis F S,Barros L,Martins A,et al. Chemical composition and nutritional value of the most widely appreciated cultivated mushrooms:an inter-species comparative study[J]. Food and Chemical Toxicology,2012,50(2):191-197.
[3]Mori K,Kobayashi C,Tomita T,et al. Antiatherosclerotic effect of the edible mushrooms Pleurotus eryngii (Eringi),Grifola frondosa (Maitake),and Hypsizygus marmoreus (Bunashimeji) in apolipoprotein E-deficient mice[J]. Nutrition Research,2008,28(5):335-342.
[4]Cha W S,Park S S,Kim S J,et al. Biochemical and enzymatic properties of a fibrinolytic enzyme from Pleurotus eryngii cultivated under solid-state conditions using corn cob[J]. Bioresource Technology,2010,101(16):6475-6481.
[5]Han E H,Hwang Y P,Kim H G,et al. Inhibitory effect of Pleurotus eryngii extracts on the activities of allergic mediators in antigen-stimulated mast cells[J]. Food and Chemical Toxicology,2011,49(6):1416-1425.
[6]Liu X,Zhou B,Lin R,et al. Extraction and antioxidant activities of intracellular polysaccharide from Pleurotus sp. mycelium[J]. International Journal of Biological Macromolecules,2010,47(2):116-119.
[7]Shenbhagaraman R,Jagadish L K,Premalatha K,et al. Optimization of extracellular glucan production from Pleurotus eryngii and its impact on angiogenesis[J]. International Journal of Biological Macromolecules,2012,50(4):957-964.
[8]Jing X Y,Mao D B,Geng L J,et al. Medium optimization,molecular characterization,and bioactivity of exopolysaccharides from Pleurotus eryngii[J]. Archives of Microbiology,2013,195(10/11):749-757.
[9]Chen J J,Yong Y Y,Xia X,et al. The excreted polysaccharide of Pleurotus eryngii inhibits the foam-cell formation via down-regulation of CD36[J]. Carbohydrate Polymers,2014,112(21):16-23.
[10]Kuo C Y,Huang C T. A reliable transformation method and heterologous expression of beta-glucuronidase in Lentinula edodes[J]. Journal of Microbiological Methods,2008,72(2):111-115.
[11]Zhang J J,Shi L,Chen H,et al. An efficient Agrobacterium-mediated transformation method for the edible mushroom Hypsizygus marmoreus[J]. Microbiological Research,2014,169(9/10):741-748.
[12]Sun S J,Li X J,Ruan L Y,et al. A novel breeding strategy for new strains of Hypsizygus marmoreus and Grifola frondosa based on ligninolytic enzymes[J]. World Journal of Microbiology & Biotechnology,2014,30(7):2005-2013.
[13]李艳丽,金周雨,李玉. 刺芹侧耳原生质体酶解条件的优化[J]. 食品科学,2010,31(10):155-158.
[14]Shih I L,Pan K,Hsieh C Y. Influence of nutritional components and oxygen supply on the mycelial growth and bioactive metabolites production in submerged culture of Antrodia cinnamomea[J]. Process Biochemistry,2006,41(5):1129-1135.
[15]Dubois M,Gilles K A,Hamilton J K,et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry,1956,28(3):350-356.
[16]Yan P S,Jiang J H,Cui W S. Characterization of protoplasts prepared from the edible fugus,Stropharia rugoso-annulata[J]. World Journal of Microbiology & Biotechnology,2004,20(2):173-177.
[17]韩华丽,郭成金. 黄伞原生质体制备与再生条件研究[J]. 天津师范大学学报:自然科学版,2008,28(4):9-12.
[18]陈鹏,郭成金. 金针菇原生质体制备和再生探究[J]. 江苏农业科学,2014,42(9):200-204.
[19]邱景芸,廖汉泉,吴月嫦. 一种溶高等担子菌细胞壁酶的制备[J]. 遗传,1982,4(4):13-14,24.韩霜. 钙和硼对菊花品种金陵丰收花粉萌发及花粉管生长的影响[J]. 江苏农业科学,2016,44(5):258-261.
