谷子EPSPS基因的分离、修饰及表达载体的构建
2016-07-23段明
段明

摘要:5-烯醇式丙酮酸莽草酸-3-磷酸合酶(EPSPS)是植物莽草酸合成途径中的一个重要酶,与芳香族氨基酸及其次生代谢物的合成有关。利用RT-PCR方法,从谷子中分离到5-烯醇式丙酮酸莽草酸-3-磷酸合酶基因SiEPSPS,全长1 573 bp,开放阅读框1 536 bp,编码511个氨基酸。同源序列比较发现,SiEPSPS氨基酸序列与小麦、短柄草、高粱的EPSPS序列高度同源。结构同源性分析表明,SiEPSPS与其他植物一样,均具有2个序列保守的结构域。对其启动子序列分析显示,该片段富含ABRE、TC-rich repeats、TCA-element等响应胁迫的顺式作用元件。针对草甘膦结合位点,对SiEPSPS基因进行定点修饰。为研究其功能,构建植物表达载体pWM101-EPSPS,并导入农杆菌进行检测。测序结果比对表明,突变型EPSPS基因在173位的脯氨酸变为丝氨酸,为后续EPSPS的真核表达奠定了基础。
关键词:谷子;草甘膦;EPSPS基因;表达载体
中图分类号: Q78文献标志码: A文章编号:1002-1302(2016)05-0051-05
谷子(Setaria italic)属禾本科狗尾草属,在我国有数千年的栽培历史,全国各地均有种植,是我国北方的主要粮食作物之一。谷子具有营养丰富、耐旱耐瘠、粮草兼用等特点,深受人们的喜爱。然而,杂草已成为谷子生产中主要的障碍因素之一,影响农作物对阳光和养分的吸收。目前,化学除草已成为主要的除草手段,被广泛应用于农业生产中。草甘膦(Glyphosate)的学名为N-(膦羧甲基)甘氨酸,是全球使用最广泛的一种除草剂[1]。起初,草甘膦因其非选择性的特点而被用作非农田区域的除草剂;20世纪90年代,抗草甘膦作物开始大面积种植,至2012年种植面积已达1.2亿hm2。抗草甘膦生物工程不仅对全球农业生产具有重大贡献,并在一定程度上减轻了机械除草对环境的负面影响[2-4]。
5-烯醇式丙酮莽草酸-3-磷酸合成酶(EPSPS,EC2.5.1.19)是莽草酸途径中的第6个酶,在芳香族氨基酸和次生代谢物的合成中发挥着重要作用[5]。草甘膦与EPSPS的底物磷酸烯醇式丙酮酸(PEP)结构相似,在莽草酸途径中能与PEP发生竞争作用,特异性地结合到EPSPS的活性位点,而不与莽草酸-3-磷酸(S3P)发生竞争,生成EPSPS-S3P-草甘膦三元复合物,从而抑制EPSPS的活性[6]。目前,全世界80%的抗草甘膦作物品种均与EPSPS有关,EPSPS基因已被广泛应用于抗草甘膦农业生物工程的研究,包括在野生型植株中过量表达EPSPS基因,以及对EPSPS基因进行突变使其对草甘膦具有抗性[7-9]。
基于EPSPS在抗除草剂方面的重要性,学者针对EPSPS的酶学特性及草甘膦抑制机理进行了大量研究,目前已从细菌、藻类、植物中分离到了EPSPS基因并应用于生产[10-13]。对农杆菌、大肠杆菌、分枝杆菌、肺炎链球菌中EPSPS的晶体结构分析表明,它们均包括2个相似的结构域,每个结构域由3个亚单位组成,3个亚单位由4个β折叠、2个α螺旋组成。在没有结合底物或配体时,EPSPS的2个结构域是分开的;当有配体存在时,2个结构域会结合在一起形成活性中心,可能是因为配体的结合促使EPSPS构象发生改变[14]。
自然界中的EPSPS主要分为2类,即Class Ⅰ和Class Ⅱ。Class Ⅰ存在于所有植物以及大肠杆菌、鼠伤寒沙门氏菌等部分细菌中,对草甘膦敏感。在高等植物中,EPSPS主要定位在叶绿体,它含有叶绿体转运肽(chloroplast transit peptide,CTP),可将外源蛋白定位到叶绿体中;因此,EPSPS只有在叶绿体中与其他莽草酸途径的成员共同作用才能合成芳香族氨基酸。Class Ⅱ存在于假单胞菌PG2982、农杆菌CP4等对草甘膦具有抗性的细菌中。序列比对发现,2类EPSPS的氨基酸同源性低于50%[15]。目前针对抗草甘膦基因的研究主要集中于杂草和细菌,关于农田作物的研究较少,且原核生物与真核生物在基因表达调控方面存在显著差异,真核生物的调控机制更为复杂。发掘和改良植物特别是农作物中的抗草甘膦基因显得尤为重要。
目前,使植物对草甘膦产生抗性的机制主要有以下3种。(1)在植物体内引入过量表达载体,使植物体内产生较多 EPSPS。Chen等研究发现,在高选择压下,牛筋草R3株系中的EPSPS表达量提高了13.8倍,表现出对草甘膦的抗性[16]。(2)引入能够降解草甘膦的酶,在除草剂产生作用前将其降解或解毒。如代谢基因GAT编码草甘膦N-乙酰转移酶(NAT),通过乙酰化使草甘膦失活[17]。(3)修饰EPSPS使其对草甘膦不敏感,该方法已成为商业化应用的主要方法。已有研究表明,牛筋草EPSPS氨基酸序列中的脯氨酸位点发生突变时,会在一定程度上表现出对草甘膦的抗性[18]。由突变而引起对草甘膦产生抗性的机制,在黑麦草、芒稗等植物中也被陆续发现[19]。
本研究利用RT-PCR方法分离谷子EPSPS基因,通过定点突变获得了突变基因SiEPSPS,并将2个基因的编码序列连入表达载体中,为真核表达及谷子抗草甘膦的研究奠定基础。
1材料与方法
1.1材料与试剂
选用“豫谷1号”为试验材料,种植于人工气候室中。pLB零背景快速克隆试剂盒、胶回收试剂盒、质粒提取试剂盒、大肠杆菌DH5α均购自天根生化科技(北京)有限公司,植物表达载体pWM101、农杆菌菌种均由笔者所在实验室保存。高保真PCR酶-KOD-Plus购自东洋纺(上海)生物科技有限公司,限制性内切酶Kpn Ⅰ、Xba Ⅰ以及T4DNA连接酶均购自NEB(北京)有限公司。PCR引物均由上海生工生物有限公司合成。
1.2方法
1.2.1SiEPSPS基因的克隆根据数据库已公布的谷子EPSPS基因序列设计扩增引物,引物序列如下:SiEPSPS-F:5′-GGTACCATGGCGGCCATGGCGTCC-3′;SiEPSPS-R:5′-TCTAGAATCACTTCAACATGGCCTGGT-3′。
PCR总体系为25 μL,包括10×PCR buffer 2.5 μL、dNTP 2.5 μL、cDNA模板2 μL、MgCL2 1 μL、引物F及引物R各 1.5 μL、Taq酶2 μL、ddH2O 12 μL。反应程序为:94 ℃预变性2 min;94 ℃变性15 s,68 ℃延伸1.5 min,68 ℃后延伸 10 min,35个循环。
1.2.2基因的定点突变以质粒pLB-EPSPS为模板,采用重叠延伸PCR法突变SiEPSPS基因的第517位,由C突变为T,其蛋白序列第173位由Pro突变为Ser。重叠延伸PCR法所用引物如下:Siepsps-F:5′-TGGAACAGCGATGCGGTCGTTGACAGCAGCCGT-3′;Siepsps-R:5′-ACGGCTGCTGTCAACGACCGCATCGCTGTTCCA-3′。
1.2.3植物表达载体的构建提取测序正确的pLB-EPSPS载体质粒,用Kpn Ⅰ、Xba Ⅰ双酶切质粒pLB-EPSPS,回收EPSPS片段;同样用Kpn Ⅰ、Xba Ⅰ双酶切质粒pWM-EPSPS,回收载体片段。采用T4DNA连接酶将目的基因与载体以体积比约2 ∶1进行接连,并用热激法转入大肠杆菌DH5α。在含有50 μg/mL Kan 的LB培养基平板上筛选转化菌落,提取质粒采用Kpn Ⅰ、Xba Ⅰ双酶切鉴定。
2结果与分析
2.1谷子EPSPS基因的分离及氨基酸序列分析
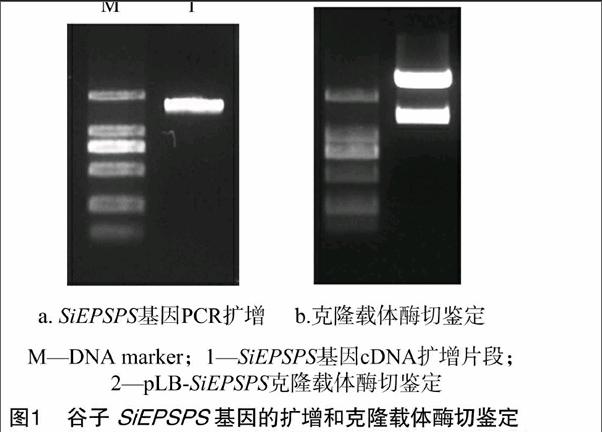
采用RNA提取试剂盒从谷子叶片中提取总RNA,反转录为cDNA。根据数据库中已公布的序列设计特异性引物SiEPSPS-F和SiEPSPS-R,以反转录产物为模板进行RT-PCR反应,电泳检测扩增出1条长度约为1 573 bp的条带(图1-a)。
将扩增得到的目的基因与克隆载体连接,转化至大肠杆菌DH5α感受态细胞中,过夜培养,提取质粒并进行酶切鉴定,得到与PCR产物大小相同的目的条带(图1-b)。送样测序并对序列进行Blast分析,证明分离得到的片段是SiEPSPS基因全长(GenBank注册号:XM_004964389.1)。
由SiEPSPS的序列分析可知,基因全长为1 573 bp,开放
阅读框1 536 bp,3′端非编码区37 bp,编码1个含511个氨基酸的蛋白。将该基因编码的氨基酸序列与GenBank中所有氨基酸序列进行比对,结果显示,谷子的5-烯醇式丙酮酸莽草酸-3-磷酸合酶与黑麦草、小麦、短柄草、高粱等植物的EPSPS高度同源(图2),表明成功克隆到了谷子5-烯醇式丙酮酸莽草酸-3-磷酸合酶基因的序列。
系统发育树由MEGA 5分析软件完成,5-烯醇式丙酮酸莽草酸-3-磷酸合酶的来源如下。谷子:SiEPSPS(XM_004964389.1),Setaria italica;多花黑麦草:LmEPSPS(AAZ79230.2),Lolium multiflorum;短柄草:BdEPSPS(XP_003557242.1),Brachypodium distachyon;野生稻:ObEPSPS(XP_006656606.1),Oryza brachyantha;小麦:TaEPSPS(ACH72672.1),Triticum aestivum;高粱:SbEPSPS(XP_002436424.1),Sorghum bicolor;牛筋草:EiEPSPS(CAD01096.1),Eleusine indica;玉米:ZmEPSPS(CAA44974.1),Zea mays;石茅:ShEPSPS(AEP26124.1),Sorghum halepense;芭蕉:MaEPSPS(CAA44974.1),Musa acuminata AAA Group;芭蕉:ZmEPSPS(XP_009418331.1),Musa acuminata AAA Group。
与其他植物中EPSPS所编码的氨基酸序列进行同源性比较,发现SiEPSPS基因所编码的氨基酸与其他已知EPSPS所编码的氨基酸序列同源性较高,且有2个序列保守区域(conserved site Ⅰ、conserved site Ⅱ)。其中,conserved site Ⅰ是该酶的激活位点,同时是该酶与除草剂草甘膦的结合位点(图3)。
2.2谷子EPSPS基因的定点突变
将扩增得到的基因片段连接到pLB载体,测序正确后将质粒命名为pLB-SiEPSPS(图1-b)。根据序列比对找到谷子中EPSPS的保守位点。谷子EPSPS(SiEPSPS)第162~174位之间的氨基酸序列是草甘膦的结合位点,根据相关研究推测第173位脯氨酸(Pro)是重要位点之一,设计引物将此位点的氨基酸进行突变。以质粒pLB-SiEPSPS为模板,采用重叠延伸PCR定点突变技术,以前2次的PCR产物为模板进行第3次PCR,获得突变后的目的DNA片段。送样测序,获得重组突变质粒pLB-Siepsps(图4)。突变后的Siepsps基因编码的蛋白有1个氨基酸发生变化,即173位脯氨酸(Pro)变为丝氨酸(Ser)(图5)。
2.3谷子EPSPS基因启动子的生物信息学分析
由表1可知,SiEPSPS启动子中含有多个参与响应激素和逆境胁迫的应答元件,如参与干旱胁迫的MYB转录因子结合位点(MYB binding site,MBS)、ABA响应元件(ABA-responsive element,ABRE)、赤霉素响应元件(gibberellin-responsive element,P-box)、生长素响应元件(auxin-responsive element,TGA)、生理节奏控制元件(involved in circadian control,circadian)等。
2.4植物表达载体pWM-EPSPS的构建
为转化植物构建真核表达载体。将EPSPS、epsps与克隆载体相连,连接产物转化大肠杆菌,提取质粒。分别采用限制性内切酶将克隆载体和表达载体双酶切,回收后将含有EPSPS、epsps基因编码区插入表达载体pWM,构成过表达、定点突变表达载体,分别命名为pWM-EPSPS、pWM-epsps(图3)。酶切鉴定表明,2种表达载体已构建成功(图6)。
2.5重组表达载体导入农杆菌
将植物表达载体pWM-EPSPS、pWM-epsps转化农杆菌LBA4404感受态细胞,在含有卡那霉素的培养基上进行筛选,挑选克隆并进行菌液PCR扩增。结果显示,获得1.5 kb的预期片段(图7),表明表达载体已成功导入农杆菌中。
3结论与讨论
草甘膦是一种环境友好、无污染、高效的除草剂,对杂草具有极强的清除能力,自问世以来已在中国使用了30余年[20-21]。然而,长期施用草甘膦必将导致一些抗性杂草的产生。EPSPS 保守区中脯氨酸(Pro)位点的突变是杂草获得抗性的一个重要机制。迄今为止,抗草甘膦杂草中EPSPS基因的突变主要涉及到106位脯氨酸突变为丙氨酸、亮氨酸,以及亲水性氨基酸丝氨酸、苏氨酸。此外,有学者通过定向诱变技术改造EPSPS,产生双位点突变的EPSPS,使玉米和油菜获得抗性[22-24]。Yu等研究发现,在具有草甘膦抗性的牛筋草中,其体内EPSPS的苏氨酸突变为异亮氨酸,脯氨酸突变为丝氨酸[25]。与单一位点突变相比,EPSPS双位点突变能够赋予植物对草甘膦更强的抗性。Pro单个位点的突变仅轻微影响了EPSPS对草甘膦/烯醇式丙酮酸的结合能力,赋予植物草甘膦抗性的同时又不影响EPSPS正常的生物学功能。与此相比,双位点突变在获得较高抗性的同时,导致EPSPS对草甘膦/烯醇式丙酮酸的结合能力较大程度降低,使莽草酸途径受阻,最终抑制植物体内芳香族氨基酸的合成,对植物的生长发育等代谢过程产生影响。综合考虑,单一位点突变在抗草甘膦的研究与应用中更具优势。
本研究采用RT-PCR和定点突变技术分别获得全长1 573 bp 的EPSPS和epsps基因,该序列开放阅读框1 536 bp,编码511个EPSPS前体多肽。经ChloroP 1.1 Server软件在线预测,前体多肽中含有叶绿体转运肽,可将EPSPS蛋白定位到叶绿体中行使功能。启动子元件分析表明,EPSPS含有多个与光响应的元件,这与EPSPS的定位相符合。而对草甘膦具有抗性的EPSPS基因大多来源于不具有叶绿体转运肽的细菌,在植物中应用须整合外源叶绿体转运肽。经ProtParam tool软件预测,该基因编码的蛋白质分子量为 51.3 ku,等电点(pI)为8.05。在谷子基因组序列中,SiEPSPS具有8个外显子、7个内含子,位于第4号染色体上。进化树分析表明,SiEPSPS与黑麦草、小麦、短柄草、高粱等植物的5-烯醇式丙酮酸莽草酸-3-磷酸合酶高度同源。SiEPSPS基因具有与其他植物中5-烯醇式丙酮酸莽草酸-3-磷酸合酶基因相同的2个序列保守区域,即conserved site Ⅰ、conserved site Ⅱ,分别位于162~174、423~442 bp。conserved site Ⅰ是EPSPS的活性位点,也是草甘膦的作用位点,保守序列为LFLGNAGTAMRPL,该区域某些位点发生突变将导致对草甘膦具有抗性;conserved site Ⅱ保守序列为RVKETERMVAIRTELTKLGA,位于EPSPS的C端,含有保守的赖氨酸,对EPSPS的活性具有重要作用。
本研究利用基因重组技术成功构建了由CaMV35S启动子调控的植物表达载体pWM-EPSPS、pWM-epsps,并将其导入根癌农杆菌LBA4404,为该基因功能的研究、进一步转化谷子、培育抗除草剂谷子新品种提供依据。
参考文献:
[1]Duke S O,Powles S B. Glyphosate:a once-in-a-century herbicide[J]. Pest Management Science,2008,64(4):319-325.
[2]Brookes G,Barfoot P. The global income and production effects of genetically modified(GM) crops:1996—2011[J]. GM Crops & Food,2013,4(1):74-83.
[3]Gardner J G,Nelson G C. Herbicides,glyphosate resistance and acute mammalian toxicity:simulating an environmental effect of glyphosate-resistant weeds in the USA[J]. Pest Management Science,2008,64(4):470-478.
[4]Bonny S. Herbicide-tolerant transgenic soybean over 15 years of cultivation:pesticide use,weed resistance,and some economic issues[M]. Sustainability,2011,3(9):1302-1322.
[5]Steinrücken H C,Amrhein N. The herbicide glyphosate is a potent inhibitor of 5-enolpyruvyl-shikimic acid-3-phosphate synthase[J]. Biochemical and Biophysical Research Communications,1980,94(4):1207-1212.
[6]Alibhai M F,Stallings W C. Closing down on glyphosate inhibition:with a new structure for drug discovery[J]. Proceedings of the National Academy of Sciences of the United States of America,2001,98(6):2944-2946.
[7]Howe A R,Gasser C S,Brown S M,et al. Glyphosate as a selective agent for the production of fertile transgenic maize(Zea mays L.) plants[J]. Molecular Breeding,2002,10(3):153-164.
[8]Wang H Y,Li Y F,Xie L X,et al. Expression of a bacterial aroA mutant,aroA-M1,encoding 5-enolpyruvylshikimate-3-phosphate synthase for the production of glyphosate-resistant tobacco plants[J]. Journal of Plant Research,2003,116(6):455-460.
[9]Ye G N,Hajdukiewicz P T,Broyles D,et al. Plastid-expressed 5-enol-pyruvylshikimate-3-phosphate synthase genes provide high level glyphosate tolerance in tobacco[J]. Plant Journal,2001,25(3):261-270.
[10]Garbe T,Jones C,Charles I,et al. Cloning and characterization of the aroA gene from Mycobacterium tuberculosis[J]. Journal of Bacteriology,1990,172(12):6774-6782.
[11]Ream J E,Steinrücken H C,Porter C A,et al. Purification and properties of 5-enolpyruvylshikimate-3-phosphate synthase from dark-grown seedlings of Sorghum bicolor[J]. Plant Physiology,1988,87(1):232-238.
[12]Xu J W,Feng D J,Li X G,et al. Cloning of genomic DNA of rice 5-enolpyruvylshikimate 3-phosphate synthase gene and chromosomal localization of the gene[J]. Science in China:Series C,Life Sciences,2002,45(3):251-259.
[13]Gong Y,Liao Z,Chen M,et al. Characterization of 5-enolpyruvylshikimate 3-phosphate synthase gene from Camptotheca acuminate[J]. Biologia Plantarum,2006,50(4):542-550.
[14]Funke T,Han H,Healy F M L,et al. Molecular basis for the herbicide resistance of Roundup Ready crops[J]. Proceedings of the National Academy of Sciences of the United States of America,2006,103(35):13010-13015.
[15]Sun Y C,Chen Y C,Tian Z X,et al. Novel AroA with high tolerance to glyphosate,encoded by a gene of Pseudomonas putida 4G-1 isolated from an extremely polluted environment in China[J]. Applied and Environmental Microbiology,2005,71(8):4771-4776.
[16]Chen J C,Huang H J,Zhang C X,et al. Mutations and amplification of EPSPS gene confer resistance to glyphosate in goosegrass (Eleusine indica)[J]. Planta,2015,242(4):859-868.
[17]Castle L A,Siehl D L,Gorton R,et al. Discovery and directed evolution of a glyphosate tolerance gene[J]. Science,2004,304(5674):1151-1154.
[18]Baerson S R,Rodriguez D J,Tran M,et al. Glyphosate-resistant goosegrass.Identification of a mutation in the target enzyme 5-enolpyruvylshikimate-3-phosphate synthase[J]. Plant Physiology,2002,129(3):1265-1275.
[19]González T F,Gil-Humanes J,Barro F,et al. Target site mutation and reduced translocation are present in a glyphosate-resistant Lolium multiflorum Lam.biotype from Spain[J]. Plant Physiology and Biochemistry,2012,58(3):16-22.
[20]陈建华,卢敏,蔡志斌. 维生素C拮抗草甘膦对蚯蚓急性毒性的作用[J]. 江苏农业科学,2015,43(7):411-413,425.
[21]王莹,袁英. 抗除草剂转基因玉米的快速鉴定方法[J]. 江苏农业科学,2014,42(4):54-56.
[22]Alarcon R R,Garcia A,Urzua J A. Resistance to glyphosate in junglerice(Echinochloa colona) from California[J]. Weed Science,2013,61(1):48-54.
[23]Howe A R,Gasser C S,Brown S M,et al. Glyphosate as a selective agent for the production of fertile transgenic maize(Zea mays L.) plants[J]. Molecular Breeding,2002,10(3):153-164.
[24]Kahrizi D,Salmanian A H,Afshari A,et al. Simultaneous substitution of Gly96 to Ala and Ala183 to Thr in 5-enolpyruvylshikimate-3-phosphate synthase gene of E. coli (k12) and transformation of rapeseed (Brassica napus L.) in order to make tolerance to glyphosate[J]. Plant Cell Reports,2007,26(1):95-104.
[25]Yu Q,Jalaludin A,Han H,et al. Evolution of a double amino acid substitution in the 5-enolpyruvylshikimate-3-phosphate synthase in Eleusine indica conferring high-level glyphosate resistance[J]. Plant Physiology,2015,167(4):1440-1447.王晓君,滕琳. 一种基于宏基因组模拟数据的生物标志物筛选方法[J]. 江苏农业科学,2016,44(5):56-59.
