三生烟叶片与烟花的原生质体制备研究
2016-07-22齐耀程许大凤高正良
齐耀程,邹 禹,许大凤,高正良
(1.安徽省农业科学院烟草研究所,安徽合肥 230031;2.安徽省农业科学院水稻研究所,安徽合肥 230031;3.安徽省农业科学院科技产业处,安徽合肥 230031)
三生烟叶片与烟花的原生质体制备研究
齐耀程1,邹 禹2,许大凤1,高正良3*
(1.安徽省农业科学院烟草研究所,安徽合肥 230031;2.安徽省农业科学院水稻研究所,安徽合肥 230031;3.安徽省农业科学院科技产业处,安徽合肥 230031)
摘要[目的]探讨三生烟叶片及烟花的高质量原生质体制备方法。[方法]通过优化纤维素酶和离析酶浓度配比、酶解时间、渗透调节剂甘露醇浓度等参数,研究三生烟叶片与烟花原生质体的最优制备方法。[结果]三生烟烟叶材料最佳制备条件为1%纤维素酶和0.5%离析酶、甘露醇浓度0.6 mol/L、酶解时间4 h,完整率达88.22%。烟花材料最佳制备条件为0.8%纤维素酶和0.4%离析酶、甘露醇浓度0.7 mol/L、酶解时间2 h,完整率达83.59%。 [结论]三生烟叶片与烟花原生质体由于材料来源不同,酶解条件存在差异,制备时需要针对不同组织材料予以优化。
关键词烟叶;烟花;原生质体;分离纯化;完整率
植物原生质体是由脱去细胞壁,仅由质膜包围的,具有生活力的裸露细胞。植物原生质体应用领域广泛,涉及基因表达调控与定位、与宿主蛋白质相互作用、细胞融合[1-5],以及克服有性杂交不亲和性、花期不育[6-8]等领域的研究。原生质体可在细胞水平上进行基因重组,特别是细胞器,内含基因控制的农艺性状改良,如线粒体所控制的细胞质雄性不育等性状。目标蛋白质的亚细胞定位是通过目标基因载体和荧光表达载体共转化,在特定种类的原生质体中得以表达[9]。在信号通路研究中,原生质体表面膜系统的信号受体蛋白是信号受体研究材料[10],可有效避免细胞性状差异导致的研究障碍。原生质体由于纯度高、细胞状态相近,在蛋白质组学研究中可极大程度地解决细胞蛋白质响应差异问题,提高低丰度蛋白质的提取纯化效率等问题。
烟草研究中通常以烟叶为材料,极少涉及其他组织。以烟叶为材料制备原生质体对烟草生长期要求严格,取材后严重影响烟草幼苗的生长,而烟花具备花期长、生物产量相对较高、生育进程容易控制、生理状态差异小等优点。同时,三生烟也是研究烟草花叶病毒病的重要材料[11],可以在细胞水平研究其抗性机理,因此,高质量的原生质体是多领域深入研究的基础。鉴于此,笔者研究了三生烟叶片及烟花的高质量原生质体制备方法,旨在为烟草病理研究提供技术手段。
1材料与方法
1.1材料
1.1.1供试品种。烟草品种三生烟(NicotianatabacumL., cv.Samsun NN)种子由中国农业科学院烟草研究所提供。原生质体的提取是以三生烟的四叶期叶片和盛花期烟花为试验材料。
1.1.2试剂。纤维素酶(Cellulase R-10)、离析酶(Macerozyme R-10)均为日本Yakult原装进口,甘露醇、MES( 2-N-吗啉乙烷磺酸)、台盼蓝。
1.2方法
1.2.1材料的培养。将三生烟种子在75%乙醇中浸泡30 s,在 10%双氧水中消毒 10 min,用无菌水冲洗2~3次。搓揉去除种子的表面蜡质成分,培养皿中25 ℃催芽2~3 d,移植至9孔板培养容器的培养基质中,每个小孔放置2~3颗已发芽种子,十字期移栽进入花盆。培养箱中昼夜温度分别为28和20 ℃,培养至四叶期,取用幼嫩叶片制备原生质体,进入花期后以烟花为材料制备原生质体。
1.2.2原生质体的分离。烟叶取材四叶期叶片,烟花为盛开期[12](开花3 d,花冠开裂成平面)烟花。在超净工作台上将取植物材料剪碎为1 mm×1 mm碎片,置于10 mL 酶解液中,酶解液为CPW盐溶液 (KH2PO427.200 mg/L、KNO3101.000 mg/L、CaCl2·2H2O 1 480.000 mg/L、MgSO4·7H2O 246.000 mg/L、KI 0.160 mg/L、CuSO4·5H2O 0.025 mg/L),包含Cellulase R-10、Macerozyme R-10、渗透调节剂甘露醇0.6 mol/L、质膜稳定剂MES 浓度为5 mmol/L[13],pH 5.8。材料碎片与酶解液充分接触混匀,真空泵抽气30 min,封口后置于26 ℃气浴恒温振荡器内40 r/min回旋振荡,避光酶解。
1.2.3酶浓度及酶解时间的优化。前期研究显示纤维素酶和离析酶的最适质量比为2∶1[14],由于幼嫩叶片和烟花的纤维素含量较低,所以设置叶片的酶浓度梯度为1.50%/0.75%、1.00%/0.50%、0.50%/0.25%,烟花的酶浓度梯度分别为1.60%/0.80%、1.20%/0.60%、0.80%/0.40%,酶解体系均为10 mL。电子显微镜下观察原生质体酶解情况。酶解烟叶每2 h观察一次酶解效果,设置时间2、4、6和8 h;酶解烟花每1 h观察一次酶解效果,设置时间1、2、3和4 h。
1.2.4渗透压稳定剂甘露醇的浓度优化。2种材料在最佳酶浓度及酶解基础上,设置甘露醇浓度梯度为0.5、0.6、0.7和0.8 mol/L。原生质体洗涤液中使用含有同浓度的甘露醇洗涤溶液,纯化后观察记录原生质体的产率和完整率。
1.2.5原生质体的纯化。2种原生质体均用 300 目不锈钢细胞筛过滤,滤液经 700 r/min离心 5 min,去掉上清液,加 CPW洗涤液5 mL,700 r/min离心 5 min,洗去酶液,弃上清液,预留2 mL 原生质体悬液缓慢覆盖在 5 mL 20%蔗糖溶液上表面,500 r/min离心 5 min,吸取中间层原生质体转入干净离心管,用洗涤缓冲液轻轻洗涤2次,用刻度离心管稀释到1 mL。
用血球计数板统计纯化后细胞膜完整的原生质体数量,计算同一计数板上、下2个计数室所测定的原生质体平均值。利用台盼蓝染色可将死细胞染成蓝色,而活细胞拒染的性质,用0.4%台盼蓝对原生质体进行活体染色。原生质体完整率=未染成蓝色的完整原生质体数/原生质体总数 ×100%。3 次重复取平均值,每次重复统计5个视野。
2结果与分析
2.1原生质体分离及完整性鉴定三生烟叶片原生质体产量和完整性指标在3个酶解液组合中表现趋势基本相同。随着酶解时间延长,完整原生质体数量逐渐增大后降低。由表1、图1~2可知,E1在酶解 4 h 时原生质体的产量达到最大值,叶片细胞碎片趋于完全脱离,原生质体完整率为80.59%,随后2个指标下降且趋势相同。E2在反应4 h时原生质体产量最高,为2.09×106c/g,完整率达88.22%,6 h则原生质体产量稍有下降,完整性下降但幅度变化较缓。E3酶解产量于6 h时最高,完整率下降明显,也不适合后续复杂研究要求。因此,3种组合以E2综合指标较好,酶解时间以 4 h为宜。
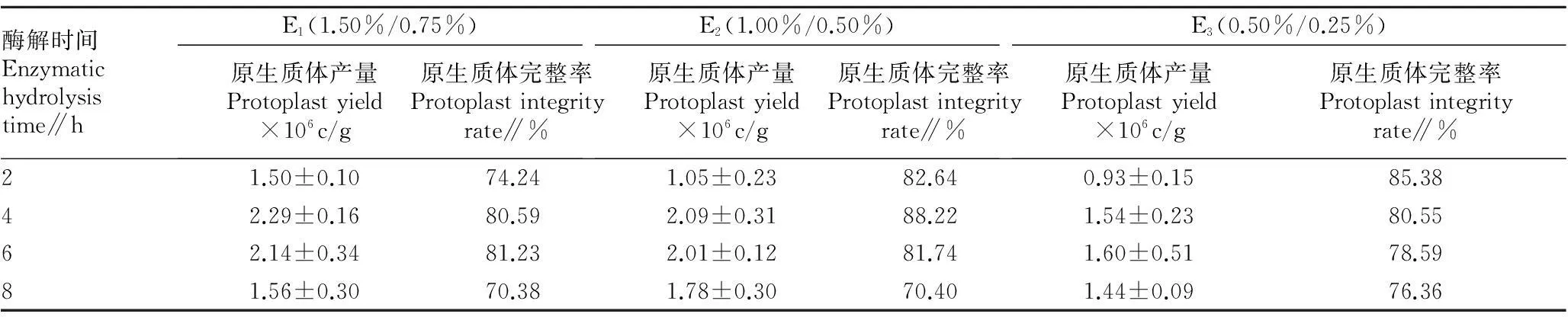
表1 三生烟叶片不同浓度酶解液组合的酶解效率比较
注: c/g表示细胞数/克鲜重。
Note:c/g indicated cell count/fresh weight per gram.
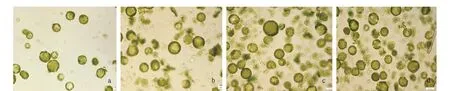
注:a~d分别为三生烟叶片酶解2、4、6和8 h的原生质体。Note:a-d were protoplasts of N.tabacum leaves after enzymolysis for 2, 4, 6 and 8 h, respectively.图1 三生烟叶片最适制备条件的原生质体形态Fig.1 Protoplast morphology of the optimum preparation conditions for N.tabacum leaf

注:a~d分别为三生烟叶片酶解2、4、6和8 h的台盼蓝染色原生质体。Note:a-d were protoplasts of N.tabacum leaves stained by trypan blue after enzymolysis for 2, 4, 6 and 8 h, respectively.图2 三生烟叶片原生质体完整性变化Fig.2 Integrity change of protoplasts of N.tabacum leaves
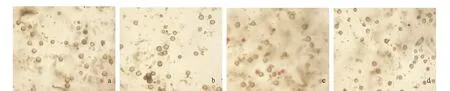
注:a~d分别为1、2、3和4 h的烟花原生质体。Note:a-d were protoplasts of N.tabacum petal after enzymolysis for 1, 2, 3 and 4 h, respectively.图3 三生烟烟花最适制备条件的原生质体形态Fig.3 Protoplast morphology of the optimum preparation conditions for N.tabacum petal
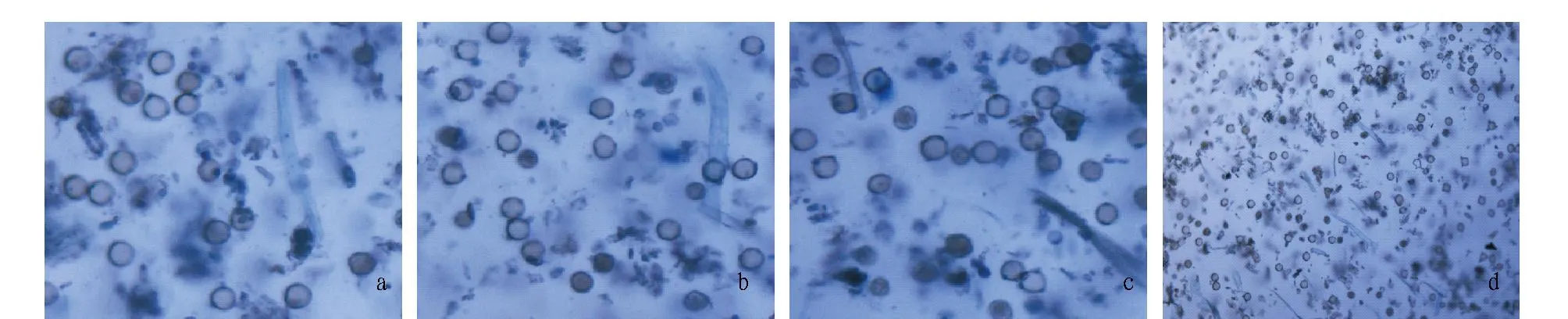
注:a~d分别为1、2、3和4 h台盼蓝染色原生质体。Note:a-d were protoplasts of N.tabacum petals stained by trypan blue after enzymolysis for 1, 2, 3 and 4 h, respectively.图4 三生烟烟花原生质体完整性变化Fig.4 Integrity change of protoplasts of N.tabacum petal
三生烟烟花的酶解组合显示(表2、图3~4),E1和E2酶液组合呈现相似的趋势,酶解反应2 h左右,原生质体产量和完整率指标增长到顶峰,随后下降,在4 h表现出较大的衰退幅度。高酶浓度的组合E1酶解效率一直较高,但原生质体完整率低。低浓度酶组合E3的酶解效率低,完整率指标前期较高,后期有降低趋势,但下降幅度较缓。E2酶组合在酶解2~3 h时烟花原生质体的产量最高(2.0×106c/g),烟花碎片解离基本完毕,除少数原生质体含红色素之外,其余细胞均为透明原生质球,2 h的完整率最高达83.59%,形态最完整,随着酶解时间继续延长,原生质体产量平缓下降,产生原生质体的质量稳定,所以指标表现最适宜。
2.2不同材料原生质体分离渗透压条件优化在已知最适酶解条件下筛选三生烟叶片最适渗透压参数。由表3可知,甘露醇在不同浓度下对原生质体的产量和完整率有一定影响,烟叶原生质体在0.5 mol/L甘露醇浓度下产量和完整率最低,可能是由于0.5 mol/L甘露醇渗透压过低导致原生质体产量较低,部分原生质体发生破裂,形成碎片或死细胞,使完整率仅为77.94%。甘露醇浓度在0.6~0.8 mol/L时原生质体产量和完整率较好。0.6 mol/L甘露醇的原生质体产量略低于0.7 mol/L甘露醇条件,但完整率高达87.04%。0.8 mol/L甘露醇浓度下原生质体产量和完整率都低于0.6~0.7 mol/L浓度下,而且原生质体存在一定比例的皱缩,表明已经超过了适宜的渗透浓度。因此,三生烟的原生质体的适宜渗透压水平对应的甘露醇浓度应为0.6~0.7 mol/L,过高与过低浓度均造成原生质体产率低下,综合考虑以0.6 mol/L最佳。
经渗透压浓度筛选显示,烟花材料的原生质体在0.5 mol/L甘露醇浓度时产生的原生质体量少且完整率低(仅为76.36%)。随甘露醇浓度提高,原生质体的产量得以提升,0.7 mol/L甘露醇的产量为2.26×106c/g,完整率为85.64%。甘露醇浓度为0.6 mol/L时原生质体的产量稍低,而甘露醇浓度为0.8 mol/L时原生质体的完整率稍低,总体差异不大。0.7 mol/L甘露醇处理的原生质体的产量和完整率均较高,优势明显。因此,烟花材料制备的原生质体适宜的甘露醇浓度为0.7 mol/L。
3结论与讨论
3.1烟草不同组织的原生质体纯化条件差异制备原生质体的基本要求是原生质体产量高、完整性好、活力水平高。使用酶解法制备原生质体需要保证适宜的酶解条件,满足2或2种以上酶的最适酶解条件,包括底物浓度、反应温度、酶解液pH等。由于植物材料的细胞壁主要成分是纤维素和果胶,所以一般选用纤维素酶、离析酶、果胶酶等。酶解条件为避光环境,酶解温度 26~28 ℃,恒温摇床转数为40 r/min左右,酶解时间不宜过长,根据材料特异性需要优化酶解时间和酶浓度组合。
注: c/g表示细胞数/克鲜重。
Note:c/g indicated cell count/fresh weight per gram.

表3 三生烟不同材料来源原生质体渗透压条件优化
注: c/g表示细胞数/克鲜重。
Note:c/g indicated cell count/fresh weight per gram.
该研究显示,以三生烟烟叶为材料,不同酶组合浓度处理烟叶原生质体产率差异显著。随酶解时间的延长,烟叶原生质体在3种酶浓度下趋势基本一致,酶解时间不能超过4 h,超过6 h原生质体的产量及完整率都明显下降,且趋势明显,幅度很大。高酶浓度组合虽然在2 h就获得较高的原生质体产率,但是其原生质体的完整率起点偏低,中浓度酶组合在4~6 h都能获得较高的原生质体产量。低浓度酶组合在酶解过程中起点低,获得原生质体少,原生质体间碰撞少、融合作用小,所以获得较好的完整性,但不适合大量制备。在酶解叶片过程中,可选择中浓度的酶液组合纤维素酶与离析酶为1.00%/0.50%,在4 h左右为酶解终点,可迅速进入纯化阶段,获得高质量的原生质体。
烟花单位质量的原生质体产量低于叶片,但烟花酶解速度较叶片快。原生质体产质量统计结果表明,在2 h时3种酶浓度组合的原生质体都基本达到各自产量最高峰。0.80%/0.40%酶液组合多指标显示其综合性能较好,酶解时间在2~3 h差异不显著,原生质体完整率下降较平缓。经过4 h的处理,低浓度酶组合在4 h原生质体完整率仅达71.4%,长时间酶液处理的酶解产物对原生质体确实有毒害作用,可能使其质膜损伤,造成原生质体的破裂。烟叶和烟花的适宜酶解条件差异也表明,由于材料的性质差异,不同组织间原生质体酶解条件最适指标也存在差异。烟花含纤维素较低,在酶液选择上纤维素酶的使用量较少,离析酶相应可作调整。酶解时间也显示出烟花的酶解效率比烟叶高,但单位质量的产量低于烟叶,所以在大规模纯化烟花原生质体时,还需要增加烟花材料的鲜重。
3.2烟花原生质体利用价值及意义原生质体的分离纯化是繁琐且细致的工作,不同的研究材料和研究目的都是优化纯化条件的前提。烟草是常见的模式生物,烟叶的应用研究以推广品种为主,如云烟87、K326、红花大金元以及香料烟品种等[15-17],而基础研究一般根据研究目的而选用特殊品种,如本氏烟(Nicotianabenthamiana)、心叶烟(Nicotianaglutinosa)、三生烟等。三生烟是研究烟草病理的优良材料,烟叶感染不同亚种病毒时,产生的病征也不相同[18],而在不同的生理病理条件下,不同的组织细胞的蛋白质表达应答反应差异明显。在深入研究烟草病害的应答机制,丰富烟草蛋白质逆境响应等基础理论时,不能仅仅局限于对烟叶的研究。烟花作为烟草生长后期重要的组织器官,对环境应答敏感,蛋白质表达谱的表现也不尽相同,可能蕴含对环境等因素的应答的特殊机制,所以也必须作为植物逆境响应研究的重要材料。
参考文献
[1] DAVEY M R,ANTHONY P,POWER J B,et al.Plant protoplasts:Status and biotechnological perspectives[J].Biotechnol Adv,2005,23(2):131-171.
[2] NG J C,TIAN T,FALK B W.Quantitative parameters determining whitefly (Bemisiatabaci) transmission ofLettuceinfectious yellows virus and an engineered defective RNA[J].J Gen Virol,2004,85(Pt 9):2697-2707.
[3] PORT M,TRIPP J,ZIELINSKI D,et al.Role of Hsp17.4-CII as coregulator and cytoplasmic retention factor of tomato heat stress transcription factor HsfA2[J].Plant Physiol,2004,135(3):1457-1470.
[4] MAJIRA A,DOMIN M,GRANDJEAN O,et al.Seedling lethality inNicotianaplumbaginifoliaconferred by Ds transposable element insertion into a plant-specific gene[J].Plant Mol Biol,2002,50(3):551-562.
[5] 聂琼,杨川龙,徐如宏,等.聚乙二醇法诱导烟草原生质体融合的条件优化[J].山地农业生物学报,2012(4):288-292.
[6] 胡宁.高通量细胞电融合芯片及实验研究[D].重庆:重庆大学,2010.
[7] 陈名红,陈学军,熊立.烟草原生质体再生植株的影响因子[J].种子,2007(5):4-7.
[8] 王小敏.玉米SKIP同源基因ZmSKIP的克隆及在非生物胁迫中的功能分析[D].重庆:重庆大学,2012.
[9] ROJAS H,FLOYD B,MORRISS S C,et al.NnSR1,a class III non-S-RNase specifically induced inNicotianaalataunder phosphate deficiency,is localized in endoplasmic reticulum compartments[J].Plant Sci,2015,236:250-259.
[10] KOBAYASHI Y,MURATA M,MINAMI H,et al.Abscisic acid-activated SNRK2 protein kinases function in the gene-regulation pathway of ABA signal transduction by phosphorylating ABA response element-binding factors[J].Plant J,2005,44(6):939-949.
[11] 刘开全,马学萍,陆伟东,等.心叶烟和三生烟对TMV的过敏性差异[J].中国烟草科学,2010(4):25-27.
[12] 刘国顺.烟草栽培学[M].北京:中国农业出版社,2003.
[13] 朱俊,聂琼,杨川龙,等.不同质膜稳定剂对烟草原生质体细胞壁再生的影响[J].山地农业生物学报,2012(3):222-227.
[14] QI Y,WANG H,ZOU Y,et al.Over-expression of mitochondrial heat shock protein 70 suppresses programmed cell death in rice[J].FEBS Lett,2011,585(1):231-239.
[15] 陈名红,陈学军,吴渝生,等.烟草K326叶肉原生质体培养再生植株及影响因素的研究[J].云南民族大学学报(自然科学版),2006(4):328-331.
[16] 陈名红,陈学军,陈毅坚,等.黄花烟草叶肉原生质体培养研究[J].种子,2008(4):24-27.
[17] 陈名红,李天飞,陈学军,等.4种基因型烟草叶肉原生质体培养的研究[J].江西农业大学学报,2006(2):175-179.
[18] 刘开全,马学萍,张丽.三生烟和心叶烟对TMV挑战接种的响应差异[J].曲靖师范学院学报,2012(3):29-31.
基金项目安徽省农业科学院院长青年基金项目(13B0941);安徽省烟草公司科研项目(20120551008);公益性行业(农业)科研专项(201203091)。
作者简介齐耀程(1983- ),男,安徽滁州人,助理研究员,博士,从事烟草栽培生理生化研究。*通讯作者,研究员,从事烟草和玉米病虫害研究。
收稿日期2016-04-08
中图分类号S 572
文献标识码A
文章编号0517-6611(2016)14-011-04
Preparation of Protoplast of Leaf and Petal ofNicotianatabacumL., cv.Samsun NN
QI Yao-cheng1, ZOU Yu2, XU Da-feng1, GAO Zheng-liang3*
(1.Tobacco Institute, Anhui Academy of Agricultural Sciences, Hefei, Anhui 230031; 2.Rice Institute, Anhui Academy of Agricultural Sciences, Hefei, Anhui 230031; 3.Department of Science and Technology Industry, Anhui Academy of Agricultural Sciences, Hefei, Anhui 230031)
Abstract[Objective] To discuss the preparation method of protoplast of leaf and petal of Nicotiana tabacum L., cv.Samsun NN.[Method] Several parameters were optimized, such as cellulase concentration, macerozyme concentration, enzymatic hydrolysis time and mannitol concentration.The optimal preparation method of N.tabacum leaf and petal was researched.[Result] The optimal preparation condition for N.tabacum leaf was 1% cellulose, 0.5% macerozyme, 0.6 mol/L mannitol concentration, and 4 h enzymatic hydrolysis time.Under this condition, the integrity rate was 88.22%.The optimal preparation condition for N.tabacum petal was 0.8% cellulose, 0.4% macerozyme, 0.7 mol/L mannitol concentration, and 2 h enzymatic hydrolysis time.Under this condition, the integrity rate was 83.59%.[Conclusion] Due to the different sources of N.tabacum leaf and petal, there are certain differences in enzymatic hydrolysis condition.Enzymatic hydrolysis condition should be optimized according to the tissue materials.
Key wordsTobacco leaf; N.tabacum petal; Protoplast; Isolation and purification; Integrity
