白芷饮片的薄层鉴别和指纹图谱研究
2016-07-22梁璐
梁璐
河南省洛阳市第一中医院药剂科 471000
白芷饮片的薄层鉴别和指纹图谱研究
梁璐
河南省洛阳市第一中医院药剂科471000
目的建立中药饮片白芷的薄层色谱(TLC)和高效液相色谱(HPLC)指纹图谱,进而对白芷饮片的真伪及质量优劣进行控制。方法利用薄层色谱方法,测定10批白芷样品,以欧前胡素为对照品,用硅胶G薄层板,展开剂为石油醚(30~60℃)-乙醚(3∶2),于254 nm处检视;同时利用高效液相色谱法,以YMC-Pack ODS-A(4.6 mm×250 mm,5 μm)为色谱柱,乙腈-0.1甲酸水为流动相梯度洗脱,采用国家药典委员会的中药指纹图谱相似度计算软件对数据进行分析,并对方法进行了评价。结果10批不同产地的白芷饮片TLC特征图谱有一个特征斑点,且斑点显色清晰;经HPLC指纹图谱分析,确立了10个共有峰,根据指纹图谱相似度评价结果得出10批样品虽存在一定的差异,但其相似度仍基本达到0.8以上,具有较好的相关性。结论本方法稳定、重现性好,所建立的指纹图谱为白芷饮片的产地鉴别和质量控制提供了科学依据。
白芷;薄层;鉴别;高效液相色谱
[Abstract]Objective To estab1ish a specific TLC method and HPLC fingerprint for Ange1icae Dahuricae,a Chinese Herba1 Medicine,in order to contro1 its authenticity and qua1ity.Methods Thin 1ayer chromatography(TLC)method was used to measure 10 batches of Ange1icae Dahuricae samp1es,using Imperatorin as reference,with petro1eum ether (30-60℃)-ether(3∶2)as deve1oping agent in si1ica ge1 G p1ate,and the detection wave1ength was at 254 nm;The HPLC chromatographic separation was performed on a C18co1umn(YMC-Pack ODS-A,4.6 mm×250 mm,5μm),the mobi1e phase was a mixture of acetonitri1e-0.1%formic acid in gradient e1ution.The simi1arity software of Chinese medicine fingerprint of the State Pharmacopoeia Commission was adopted for the data ana1ysis and the method eva1uation.Results The TLC resu1ts of 10 batches of different origin of Ange1icae Dahuricae had one c1ear and accurate characteristic spot;10 common peaks were estab1ished by HPLC fingerprint ana1ysis,and according to the simi1arity eva1uation resu1ts,a1though there were some differences between the 10 batches of samp1es,the simi1arity was sti11 more than 0.8,which showed a good corre1ation.Conclusion This method is stab1e and good in reproducibi1ity.The fingerprint estab1ished can be used to identify the origin and qua1ity contro1 of Ange1icae Dahuricae.
[Key words]Ange1icae Dahuricae;TLC;Identification;HPLC
白芷为伞形科植物白芷Angelica dahurica(Fisch. ex Hoffm.)Benth.et Hook.f.或杭白芷Angelica dahurica (Fisch.exHoffm.)Benth.etHook.f.var.formosana(Boiss.)Shan et Yuan的干燥根[1]。其性味温、辛,主要功效是祛风燥湿、消肿止痛[2]。白芷用于止痛已久,为我国40种大宗常用中药材品种之一,占世界白芷产量的90%以上[3],在中药材商品中使用频率很高。白芷的主要药效成分为香豆素类成分[4-5]。现代药理证明,白芷具有平喘镇痛抗炎等作用[6-8],故《中国药典》将作为白芷定量的控制标准。目前对白芷的质量评价主要采用高效液相色谱法[9-10]。但白芷主产河北、河南、四川[11],其受加工采收时间、炮制方法、储存条件的影响,仅单一成分不能反映其饮片的质量[12-15]。本文收集了10批白芷样品,分别采用薄层色谱法和高效液相色谱法,对白芷的特征图谱进行研究,通过图谱的分析对白芷饮片的质量评价及真伪鉴别提供了科学依据。
1 仪器与试药
1.1仪器
Shimadzu LC-20AB高液相色谱系统,包括在线脱气机,自动进样器Prominence SIL-20A,二极管阵列检测器SPD-M20A和柱温箱CTO-20A;色谱柱为YMC-Pack ODS-A(4.6 mm×250 mm,5 μm);CAMAG公司薄层色谱系统,包括半自动点样仪1inomat5-15074及自动成像系统Visua1izer-151204;硅胶预制薄层板G(青岛海洋化工厂)。
1.2药品与试剂
甲酸、乙腈(色谱级,美国天地);水(去离子水,自制)。欧前胡素(南京泽朗医药科技有限公司,批号ZL1203036,纯度99%);白芷饮片共10批,产地(批号)依次为浙江(110821)、安徽(110516)、安徽(120216)、安徽(01201116)、四川(101001)、四川(111012)、四川(100409)、浙江(101212)、安徽(090806)、安徽(120106),经南京中医药大学吴德康教授鉴定为合格的白芷饮片,并将饮片密封保存于阴凉干燥处。
2 方法与结果
2.1TLC特征图谱研究
2.1.1对照品溶液的制备
精密称取欧前胡素对照品,加乙酸乙酯,制成0.1 mg/mL,作为对照品溶液。
2.1.2供试品溶液的制备
精密称取白芷粉末0.5 g,置于10 mL容量瓶中,加超声提取乙醚10 mL,30 min时时振摇,滤过,滤液挥干,残渣加乙酸乙酯1 mL使溶解,作为供试品溶液。
2.1.3TLC特征图谱的建立
配制石油醚(30~60℃)-乙醚(3∶2)作为薄层展开剂,吸取“2.1.1”和“2.1.2”项下制备的溶液各4 μL,点于同一硅胶G薄层板上,展开,取出,晾干,放置30 min,置紫外光灯(254 nm)下检视,得到白芷饮片TLC特征图谱,其中6号样点为对照品欧前胡素,1~5、7~11号样点分别对应10批白芷饮片样品。见图1。
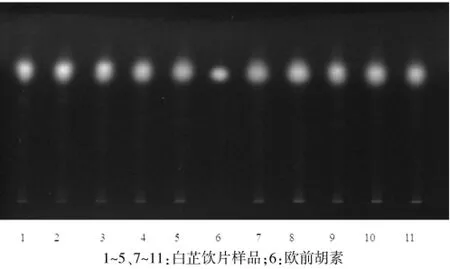
图1 白芷饮片TLC特征图谱(254 nm)
2.2 HPLC指纹图谱研究
2.2.1色谱条件
色谱柱:YMC-Pack ODS-A(4.6 mm×250 mm,5 μm)色谱柱;流动相:乙腈(A)-0.1甲酸水溶液(B);色谱柱柱温:40℃;体积流量:1 μL/min;进样体积:10 μL;检测波长:254 nm。
梯度洗脱程序:0~40 min,5%~10%B;40~80 min,10%~50%B;80~90 min,50%~65%B;90~100 min,65%~75%B;100~115 min,75%~95%B,115~120 min,95%~5%B。
2.2.2供试品溶液的制备
精密称取白芷粉末1 g,置于50 mL具塞锥形瓶中,加80%甲醇30 mL,超声提取30 min,滤过,再超声30 min,合并滤液并用旋转蒸发仪旋干,再加80%甲醇定容到10 mL容量瓶。
2.2.3共有峰的标定
白芷的指纹图谱中含有10个色谱峰,选择保留时间适中且分离度较好的8号峰(保留时间为89.40 min)作为参照峰。采用国家药典委员会颁布的《中药色谱指纹图谱相似度评价系统A版》软件导入10批次白芷的HPLC图谱数据,以平均数法生成对照指纹图谱的共有模式[16],见图2。建立对照指纹图谱,见图3。

图2 白芷饮片高效液相共有模式色谱图

图3 10批白芷饮片HPLC指纹图谱
经色谱分析,确立了10个共有峰(图2)。根据指纹图谱相似度评价结果得出各样品的相似度,10批样品来自四川、安徽、浙江等地,因此存在一定的差异,但其相似度仍达到0.8以上,具有很好的相关性,相似度计算数据见表1。

表1 样品相似度
2.2.4方法学试验
2.2.4.1精密度试验分别精密称取同一供试品溶液,连续进样6针,进样体积10 μL,测定各图谱共有峰相对保留时间的RSD<2.52%,相对峰面积值的RSD <3.08%,符合指纹图谱的要求。
2.2.4.2重复性试验 精密称取同一批号白芷样品6份,按上述方法制备供试品溶液,照上述色谱条件,分别进样,进样体积10 μL,采集其色谱图,测定各图谱共有峰相对保留时间的RSD<2.56%,相对峰面积值的RSD<2.81%,各主要色谱峰的相对保留时间和相对峰面积均无明显变化,表明该分析方法重现性良好。
2.2.4.3稳定性试验精密吸取同一供试品溶液,分别在0、2、4、6、8、24 h进样,进样体积10 μL,采集其色谱图,测定各图谱共有峰相对保留时间的RSD<3.04%,相对峰面积值的RSD<3.11%,各主要色谱峰的相对保留时间和相对峰面积均无明显变化,表明供试品溶液在24 h内稳定性良好。
2.2.4.4加样回收试验 精密称取同一批号的白芷样品5份,每份0.15 g,分别置于50 mL量瓶中,加入对照品2.5 mL,按上述方法制备供试品溶液,进样10 μL[17-18]。结果显示RSD值为0.67%。见表2。

表2 白芷欧前胡素的加样回收试验结果(n=5)
2.2.5共有峰的相对保留时间及相对峰面积值
各样品的指纹图谱共有峰相对保留时间及相对峰面积值数据见表3~4。所建立的白芷指纹图谱的10个共有峰非常吻合,各批样品之间相对保留时间RSD值较小,保留时间稳定,无明显差异。见表3。不同批次白芷样品10个共有峰相对峰面积RSD值差异较大,由此可知各批次各成分的含量之间存在明显差异。见表4。
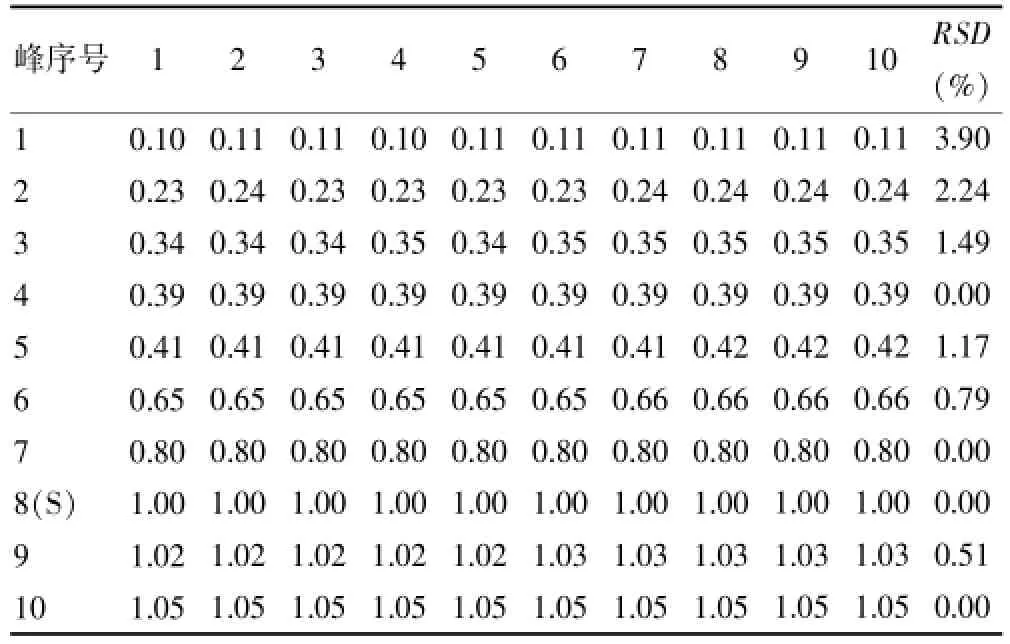
表3 共有峰相对保留时间

表4 共有峰相对峰面积值
3 讨论
3.1TLC鉴别
本文比较了甲醇、乙醇、乙酸乙酯、乙醚的超声提取液的薄层色谱。结果发现乙醚提取的供试品溶液斑点最多,且斑点颜色较深。试验先后比较了石油醚(30~60℃)-乙醚-乙酸乙酯、石油醚(30~60℃)-乙醚[19],经反复实验,选择了石油醚(30~60℃)-乙醚(3∶2)为展开剂可获得满意的、重现性好的薄层色谱效果,欧前胡素Rf值为0.65。考察了不同温湿度对色谱的影响,结果发现温度在28℃以下,展开后的色谱斑点集中,边缘效应小,欧前胡素Rf值在0.47~0.62间。
3.2HPLC指纹图谱
流动性的考察,经过前期比较甲醇-水、乙腈-水、乙腈-0.1%醋酸水溶液、乙腈-0.1%甲酸水溶液后的色谱图,最终确定选择分离度较好,响应值高的乙腈-0.1%甲酸水作为流动相[20-27]。
提取条件的优化,经过前期比较甲醇、乙醇、80%甲醇、60%甲醇、60%乙醇、纯水作为提取溶剂,发现其最终的样品色谱图显示,80%甲醇作为提取溶剂时,其色谱峰、分离度、基线最适宜。
白芷饮片含有多种有效成分,单一的测定一个或多个成分不足以评价其质量,因此本研究通过建立全面又系统地反映化学成分的薄层色谱和指纹图谱,全面地反映白芷的饮品质量。
本实验从白芷饮片整体色谱图入手,选取了10个特征峰构成了白芷的指纹图谱,以共有模式作为白芷饮片的鉴别标准,能提供更全面的质量控制信息,可为白芷饮片及其制剂质量标准的拟定提供依据。
[1]国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2015:105-106.
[2]江苏新医学院.中药大辞典[M].上海:上海科学技术出版社,2001:675-679.
[3]权延春,郑光浩.白芷萃取成分抗惊厥作用的实验研究[J].时珍国医国药,2011,22(10):2560.
[4]郑辉,王德才.白芷的药理作用与临床应用研究进展[J].医药导报,2009,1(18):83-86.
[5]彭梁,马爽,柳杰,等.中药白芷活性成分的研究进展[J].安徽农业科学,2015,43(22):57-58.
[6]朱艺欣,李宝莉,马宏胜,等.白芷的有效成分提取、药理作用及临床应用研究进展[J].中国医药导报,2014,11(31):159-162.
[7]吴媛媛,蒋桂华,马逾英,等.白芷的药理作用研究进展[J].时珍国医国药,2009,20(3):625-627.
[8]崔秋兵,张艺,兰莎.白芷镇痛作用物质基础研究[J].中国实验方剂学杂志,2010,16(12):102-104.
[9]王云龙,杨立志,姜雪敏,等.HPLC测定白芷药材中欧前胡素与异欧前胡素的含量[J].药品鉴定,2011,8(18):74-75.
[10]王连国,王欣,孟宪杰,等.高效液相色谱法测定白芷中欧前胡素和异欧前胡素含量[J].现代中西医结合杂志,2011,20(22):2816-2817.
[11]周冰,刘培,陈京,等.不同产地白芷药材中香豆素类及多糖类化学成分的分析评价[J].南京中医药大学学报,2015,31(1):68-73.
[12]雷云,王威,史洋,等.基于化学指纹图谱和多指标成分含量测定的白芷质量评价[J].中国实验方剂学杂志,2015,21(2):36-39.
[13]郭丁丁,马逾英,吕强,等.不同产地白芷中欧前胡素含量及HPLC指纹图谱的对比研究[J].中药材,2010,33 (1):22-25.
[14]张萍,杨燕,鄢丹,等.多指标成分含量测定与指纹图谱分析在中药制备工艺与质量控制中的应用[J].中华中医药杂志,2010,25(1):120-123.
[15]韩晔华,霍飞凤,杨悠悠,等.中药指纹图谱研究的某些进展与展望[J].色谱,2008,26(2):142-152.
[16]宋桂萍,陈国宝,郑礼娟,等.不同产地茯苓饮片的HPLC指纹图谱研究[J].世界中西医结合杂志,2013,8(1):36-38.
[17]孙玉刚,张玲,李晋,等.指纹图谱法评价规范化种植青蒿药材的质量[J].中国医院药学杂志,2013,33(1):29-31.
[18]向梅先,杜小青,徐宗,等.血三七活性部位特征图谱[J].中国医院药学杂志,2010,30(5):366-369.
[19]席琳图雅,张润祥,贡斯琴.对通便清火丸中白芷薄层色谱鉴别的研究[J].北方药学,2011,8(2):10.
[20]卢晓琳,蒋云斌,曹赟,等.熏硫与未熏硫白芷的体内外HPLC图谱分析[J].中药与临床,2015,6(5):7-9.
[21]赵友谊,孙浩,王鸣,等.HPLC法同时测定江苏引种白芷中5个香豆素的含量[J].中国野生植物资源,2013,32 (1):56-58.
[22]许本善,雷宁,马萍,等.复方痔疮栓的定性鉴别与定量分析方法研究[J].中国医药导报,2015,12(33):8-12.
[23]廖欣,岩林苹,白玲玲,等.热敷腾包质量标准建立的方法研究[J].中国医药导报,2015,12(33):13-16.
[24]陈群力,李洁,杨骏,等.宣肺清热合剂质量标准的建立[J].中国医药导报,2015,12(30):21-24.
[25]申丽,秦云,李明,等.裙带菜内生菌Baci11us sp.QD-4发酵液化学成分研究[J].中国医药导报,2015,12(31):53-56.
[26]林锦锋,杨志业,李曼莎,等.巴戟天薄层色谱鉴别用对照提取物的研制与应用[J].中国医药导报,2015,12(27):22-25.
[27]王银娟,陆崟,汪玥,等.紫元胶囊的质量标准研究[J].中国医药导报,2015,12(18):89-91.
TLC identification and HPLC fingerprint of Angelicae Dahuricae
LIANG Lu
Department of Pharmacy,the First Traditiona1 Chinese Medicine Hospita1 of Luoyang,He'nan Province,Luoyang 471000,China
R927
A
1673-7210(2016)04(c)-0139-04
国家火炬计划项目(2010GH020663);江苏省科技支撑计划工业项目(BE2011012)。
2016-01-04本文编辑:赵鲁枫)
