人参皂苷Rh2对B16黑色素瘤细胞侵袭、转移能力的影响
2016-07-22苑家鑫李丽波崔红霞
苑家鑫 邹 澄 田 华 李丽波 崔红霞▲
1.齐齐哈尔医学院药学院临床药理教研室,黑龙江齐齐哈尔 161006;2.昆明医科大学药学院天然药物化学教研室,云南昆明 650500
人参皂苷Rh2对B16黑色素瘤细胞侵袭、转移能力的影响
苑家鑫1邹澄2田华1李丽波1崔红霞1▲
1.齐齐哈尔医学院药学院临床药理教研室,黑龙江齐齐哈尔161006;2.昆明医科大学药学院天然药物化学教研室,云南昆明650500
目的探讨人参皂苷Rh2对B16黑色素瘤细胞侵袭、转移能力的影响。 方法培养B16黑色素瘤细胞,同时对其进行药物处理,采用四唑盐比色(MTT)法对细胞活力进行检测。采用划痕试验观察细胞的愈合情况,评价其转移能力;Transwe11小室侵袭实验观察细胞侵袭情况。 结果细胞存活力实验显示,不同浓度的人参皂苷Rh2 0、25、50、100 μmo1/L对B16黑色素瘤细胞生存率的影响比较差异无统计学意义(P>0.05);随着剂量浓度的增加,经人参皂苷Rh2处理的B16黑色素瘤细胞穿越小室的细胞数明显减少,并呈剂量效应关系(P<0.05);细胞迁移的距离随人参皂苷Rh2剂量浓度的增加而缩短。结论人参皂苷Rh2能显著抑制B16黑色素瘤细胞迁移及抑制细胞穿越小室,具有抑制细胞B16黑色素瘤细胞侵袭及非定向迁移的作用;随人参皂苷Rh2剂量增加,其抑制作用增强。
人参皂苷Rh2;B16黑色素瘤细胞;侵袭;转移
[Abstract]Objective To study the invasion and metastasis abi1ity of Rh2 ginsenosides on B16 me1anoma ce11.Methods B16 me1anoma ce11s was cu1tured and treated with drug.Ce11 vita1ity was detected by tetrazo1ium sa1t(MTT)method.Hea1ing condition of ce11 was observed by scratch test and transfer abi1ity was estimated.Invasion was observed by Transwe11 matrige1 invasion assay.Results Ce11 surviva1 experiment showed that the surviva1 rate of different concentrations of ginseng saponin Rh 20,25,50,100 μmo1/L to B16 me1anoma ce11s had no statistica11y significant difference(P>0.05).With the increase of dose concentration,the ginseng of ginsenoside Rh2,B16 me1anoma ce11s through the chamber ce11s was significant1y reduced with the dose effect re1ationship(P<0.05);The ce11 migration distance was shorten a1ong with the increasing of Rh2 ginsenosides dose concentration.Conclusion Rh2 ginsenosides can inhibit the migration of B16 me1anoma ce11 and through sma11 room,p1ay the effect of inhibition of invasion and directiona1 migration of B16 me1anoma ce11;With the increasing of Rh2 ginsenosides dose;the inhibitory effect is enhancing.
[Key words]Rh2 ginsenosides;B16 me1anoma ce11s;Attacks;Transfer
肿瘤的侵袭与转移是恶性肿瘤十分明显且重要的生物学特征。大部分的癌症患者不是因原发性癌死亡,而是由于后期肿瘤的转移及对靶器官或其他脏器的侵袭。肿瘤的转移启于肿瘤的恶性侵袭,是多因素、多基因相互共同作用的一个多阶段过程,而侵袭是贯穿肿瘤转移的至关重要环节。已有文献显示,在初期肿瘤细胞能够将膜表面的受体作为载体,相结合于基底膜、胶原蛋白、纤粘连蛋白、基质成分层粘连蛋白,最后通过多样化的蛋白酶来对上述物质进行降解,最后肿瘤细胞利用自身特有的定向运动穿越破损的基质或基底膜,最终实现转移[1-4]。另外,肿瘤细胞内源性基因组的不稳定特性也提高了其获得转移的能力。人参来源于五加科植物人参 (Panax ginseng C.A.Mey)的干燥根,其已有两千多年的应用历史。人参的化学成分复杂,皂苷类为人参的主要活性成分。其中的人参皂苷Rh2是目前研究肿瘤领域较为热门的一类,其能很好地抑制癌细胞的增殖,诱导凋亡与分化,控制病情的发展[5]。近年来,针对肿瘤侵袭、转移的报道,在基础和临床的各个领域均有相应不同程度的进展和突破。然而,目前关于人参皂苷Rh2抑制肿瘤细胞侵袭、转移的研究,国内外较少报道。为此,笔者利用人参皂苷Rh2研究其对B16黑色素瘤细胞的侵袭转移的影响,为进一步阐明人参皂苷Rh2作用于肿瘤细胞的分子机制提供新的依据。
1 材料与方法
1.1材料
B16黑色素瘤细胞购于中国科学院上海细胞库;人参皂苷Rh2由本课题组分离提取得到,纯度大于99%,溶解于DMSO中;RPMI-1640培养液购自美国Gibco公司;胎牛血清购自杭州四季青生物工程材料有限公司;胰蛋白酶、BCA试剂、结晶紫染色液均购自南京宝灵科生物技术有限公司;四唑盐(MTT)购自美国Sigma公司;Matrige1购自BD公司。
细胞培养超净台(Hea1force,中国,型号:TSJH-1212);CO2细胞培养箱(Thermo,美国,型号:Forma310);倒置显微镜(奥林巴斯,日本,型号:IX70-81FZ)。
1.2方法
1.2.1细胞培养 B16黑色素瘤细胞用含有10%灭活胎牛血清+1%青霉素+1%链霉素的RPMI-1640培养液在5%CO237℃的条件下进行培养,待细胞密度达到95%时以0.25%胰蛋白酶消化传代培养,取生长期良好的细胞。
1.2.2药物处理 称取0.0156 g人参皂苷Rh2(人参皂苷Rh2分子式:C36H62O8,分子量:622.87)溶解于50 μL二甲基亚砜(DMSO)中,制成0.5 mo1/L浓度的母液,于-20℃下分装冻存备用,临用前稀释。
1.2.3细胞活力的检测 采用MTT法对细胞活力进行检测。取符合要求的细胞以每孔3 000个的密度接种于96孔板中,制成细胞悬液。24 h后加入不同浓度的人参皂苷Rh2(0、25、50、100 μmo1/L),放入培养箱培养24 h,每孔加入20 μL的5 mg/mL MTT,37℃下孵育4 h后停止,弃取上清加入150 μL DMSO,震荡10 min,于酶标仪下(λ=490 nm)测定各孔的吸光度。
1.2.4划痕试验取对数期生长良好的B16黑色素瘤细胞,以0.25%胰蛋白酶给予消化,调整细胞浓度,以每孔8×104个接种于64孔培养板中,待细胞达到单层融合时,以10 μL移液枪枪头在培养板上垂直划线,弃培养液,PBS洗涤2次,换新鲜的无血清培养液,加入不同剂量(0、25、50、100 μmo1/L)的人参皂苷Rh2,24 h常规培养。采用倒置显微镜观察细胞的愈合情况,评价其转移能力。
1.2.5Transwell小室侵袭实验预制基质膜:在Transwe11光滑面聚碳酸脂膜上均匀铺20 μg Matrige1(10 μL),超净台风干。细胞消化制备单细胞悬液,用PBS洗2次,计数,配制含不同浓度人参皂苷Rh2(0、25、50、100 μmo1/L)的无血清细胞液,并使其终浓度为10×104个/mL,取100 μL分别置于上层小室,取100 μL培养液(含10%FBS)接种于下室,等待12 h后,弃上室培养液,PBS冲洗5次,90%的甲醛固定约10 min,拭去微孔滤膜上室部位未穿越的细胞,0.1%结晶紫溶液染色0.5 h,弃染色液,蒸馏水洗涤后自然干燥,光镜下取相同视野进行拍照,并利用10%醋酸脱色,酶标仪测定结果(λ=570 nm),观察细胞侵袭情况。
1.3统计学方法
采用SPSS 18.0统计软件对实验数据进行统计分析,计量资料以均数±标准差(±s)表示,多组间比较给予单因素方差分析,两两比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1人参皂苷Rh2对B16黑色素瘤细胞存活力的影响
MTT实验结果显示,不同浓度的人参皂苷Rh2 0、25、50、100 μmo1/L对B16黑色素瘤细胞生存率的影响差异无统计学意义(P>0.05),提示该剂量对细胞本身无毒作用,可进一步进行B16黑色素瘤细胞侵袭转移能力影响的研究。见图1。

图1 四唑盐比色法实验测定人参皂苷Rh2对B16黑色素瘤细胞存活率的影响
2.2人参皂苷Rh2对B16黑色素瘤细胞侵袭的影响
随着剂量浓度的增加,经人参皂苷Rh2处理的B16黑色素瘤细胞穿越小室的细胞数明显减少,并呈剂量效应关系(P<0.05)。见图2~3。

图2 Transwell实验观察人参皂苷Rh2对细胞侵袭能力的影响
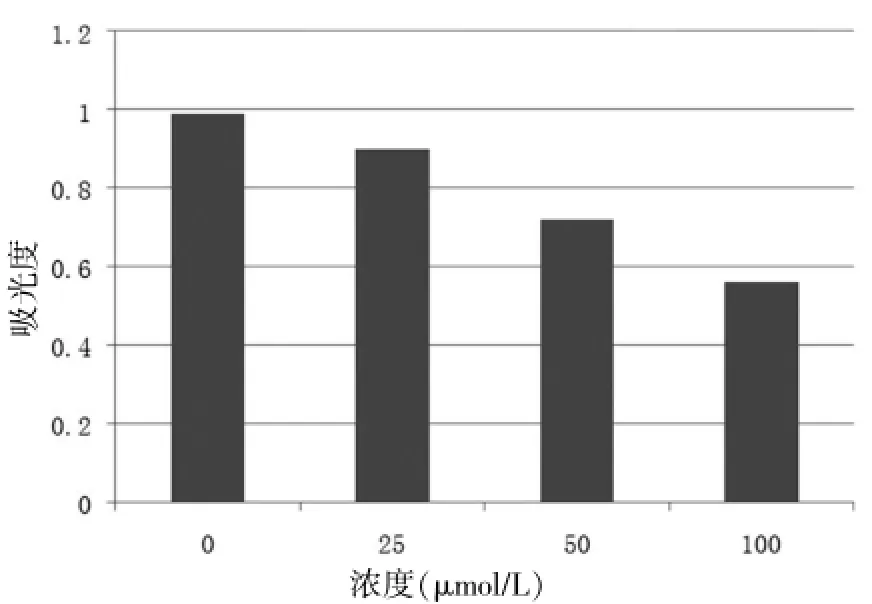
图3 不同浓度下吸光度值测定结果
2.3人参皂苷Rh2对B16黑色素瘤细胞转移的影响
细胞迁移的距离随人参皂苷Rh2剂量浓度的增加而缩短,提示人参皂苷Rh2具有抑制细胞非定向迁移的作用。见图4。
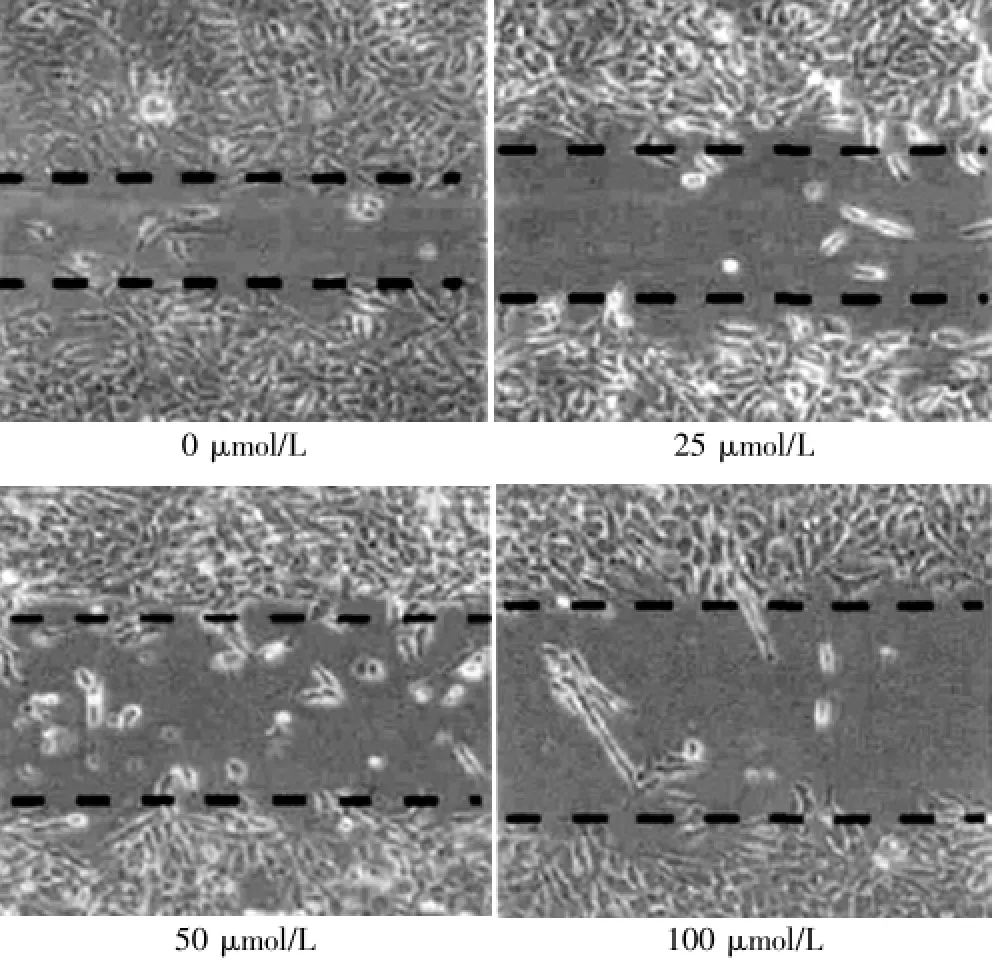
图4 划痕试验观察人参皂苷Rh2对细胞非定向迁移力的影响
3 讨论
抑制肿瘤侵袭和转移是治疗及改善肿瘤患者预后的主要措施。当今具有抗肿瘤作用的天然植物化合物,已逐步成为国内外关于该领域研究的关注点。
黑色素瘤B16细胞株是生长在C57BL/6小鼠耳根部皮肤的自发性肿瘤,有报道指出,人参皂苷Rh2能有效瓦解黑色素瘤B16细胞,阻止黑色素瘤扩散。还有人参皂苷Rh2能抑制B16黑色素瘤转移[5-6]。陶丽华等[7]通过研究发现,人参皂苷Rh2组的C57BL/6N小鼠肺部结节转移数下降明显,B16黑色素瘤细胞对人工基底膜的侵袭能力也显著降低。同时陶丽华等[8]对人参皂苷Rh2进行了进一步的研究,发现人参皂苷Rh2能诱导B16细胞的分化,使癌细胞的增殖阻断在G1期,对小鼠黑色素瘤B16细胞的分化有诱导凋亡的作用。由于人参皂苷Rh2的抗癌机制与传统药物不同,它不具有细胞毒性,不直接杀伤癌细胞,也不会伤害正常细胞,而是通过对癌细胞的分化诱导来实现抑制癌细胞增殖、改变癌细胞功能,随着人参皂苷Rh2浓度的升高,黑色素瘤B16细胞存活率逐步下降[9-11]。可见,人参皂苷Rh2对于瓦解黑色素瘤B16细胞效果显著。
本研究划痕试验中观察人参皂苷Rh2对细胞非定向迁移力的影响,结果显示,细胞迁移的距离随人参皂苷Rh2剂量浓度的增加而缩短,提示人参皂苷Rh2具有抑制细胞非定向迁移的作用。Transwe11小室实验观察人参皂苷Rh2对细胞侵袭能力的影响,结果显示,随着剂量浓度的增加,经人参皂苷Rh2处理的B16黑色素瘤细胞穿越小室的细胞数明显减少,并呈剂量效应关系。已有研究显示,黑色素瘤与基底膜的黏附作用受与层粘连蛋白(LN)受体a6、B4等的影响[12-15]。还有研究发现人参皂苷Rh2可通过改变细胞周期、诱导细胞凋亡、阻止血管生成和癌细胞的侵袭,具有诱导人肝癌HepG2细胞凋亡的作用[16-23]。
综上所述,人参皂苷Rh2具有抑制B16黑色素瘤细胞侵袭、转移的作用,能显著抑制B16黑色素瘤细胞迁移及抑制细胞穿越小室,并随人参皂苷Rh2剂量增加,其抑制作用增强。
[1]王华,周滨,郭星,等.人参皂苷Rh2对肝癌SMMC-7721细胞增殖和细胞骨架的影响[J].中国病理生理杂志,2014,27(6):1226-1229.
[2]程汝滨,葛宇清,黄真,等.人参皂苷Rh2抗肿瘤转移的功能研究进展[J].中南药学,2013,11(3):211-213.
[3]张春晶,于海涛,侯金才,等.S型与R型人参皂苷Rh2对人肺腺癌A549细胞增殖和凋亡的影响[J].中国中药杂志,2014,36(12):1670-1674.
[4]王立民.人参皂苷Rh2对人骨肉瘤细胞MG-63凋亡的影响[J].中国病理生理杂志,2015,(9):1715-1719.
[5]姜卫卫,刘嘉.人参皂苷Rb1、Rg3、Rh2抗肿瘤作用与机制概况 [J].世界科学技术-中医药现代化,2013,(7):1634-1637.
[6]夏菁.人参皂苷Rh2(S)通过抑制HDAC诱导人红白血病K562细胞凋亡的实验研究[D].重庆:重庆医科大学,2014.
[7]陶丽华,刘红岩,韩锐.20(R)-人参皂昔Rh2抗B16一BL6黑色素瘤转移的作用[J].辽宁中医杂志,2006,33(11):1505-1506.
[8]陶丽华,高峰,刘红岩,等.20(R)-人参皂苷Rh2抗癌细胞转移实验研究[J].人参研究,2012,23(4):203.
[9]Cheong JH,Kim H,Hong MJ,et a1.Stereoisomer-specific anticancer activities of ginsenoside Rg3 and Rh2 in HepG2 ce11s:disparity in cytotoxicity and autophagy-inducing effects due to 20(S)-epimers[J].Bio1 Pharm Bu11,2015,38(1):102-108.
[10]Bak MJ,Jeong WS,Kim KB.Detoxifying effect of fermented b1ack ginseng on H2O2-induced oxidative stress in HepG2 ce11s[J].Int J Mo1 Med,2014,34(6):1516-1522.
[11]Xia T,Wang JC,Xu W,et a1.20S-Ginsenoside Rh2 induces apoptosis in human LeukaemiaReh ce11s through mitochondria1 signa1ing pathways[J].Bio1 Pharm Bu11,2014,37(2):248-254.
[12]Qian M,Yi L,Song-Lin L,et a1.Chemica1 profi1es and anticancer effects of saponin fractions of different po1arity from the 1eaves of Panaxnotoginseng[J].Chin J Nat Med,2014,12(1):30-37.
[13]Yi PF,Bi WY,Shen HQ,et a1.Inhibitory effects of su1fated 20(S)-ginsenoside Rh2 on the re1ease of pro-inf1ammatory mediators in LPS-induced RAW 264.7 ce11s[J]. Eur J Pharmaco1,2013,712(1-3):60-66.
[14]齐晓丹,张春晶,于海涛,等.S型与R型人参皂苷Rh2诱导人肺腺癌A549细胞凋亡的体外研究[J].中国医药指南,2011,9(21):8-10..
[15]游智梅.下调PGI/AMF基因表达协同人参皂苷Rh2对人白血病KG1α作用的体外研究[D].重庆;重庆医科大学,2014.
[16]张文静,俞春莺,吴炉飞,等.二醇组人参皂苷抑制Lewis肺癌生长及NF-кB相关基因的作用[J].肿瘤防治研究,2013,40(1):42-45.
[17]Park HM,Kim SJ,Kim JS,et a1.Reactive oxygen species mediated ginsenoside Rg3-and Rh2-induced apoptosis in hepatoma ce11s through mitochondria1 signa1ing pathways[J].Food ChemToxico1,2012,50(8):2736-2741.
[18]Zhang C,Yu H,Hou J.Effects of 20(S)-ginsenoside Rh2 and 20(R)-ginsenoside Rh2 on pro1iferation and apoptosis of human 1ung adenocarcinoma A549 ce11s[J]. ZhongguoZhong Yao ZaZhi,2014,36(12):1670-1674.
[19]Li B,Zhao J,Wang CZ,et a1.Ginsenoside Rh2 induces apoptosis and paraptosis-1ike ce11 death in co1orecta1 cancer ce11s through activation of p53[J].Cancer Lett,2014,301(2):185-192.
[20]张娜,封颖璐.人参皂苷的抗肝癌作用机制[J].国际肿瘤学杂志,2015,42(10):786-788.
[21]于红.以提高抗肿瘤靶向性及亲和力为目的的人参皂苷衍生物合成[D].上海:上海中医药大学,2014.
[22]高文芹,贾力,赵余庆,等.人参的抗癌作用及其机制研究进展[J].药物评价研究,2014,34(1):53-58.
[23]An IS,An S,Kwon KJ,et a1.Ginsenoside Rh2 mediates changes in themicroRNA expression profi1e of human non-sma11 ce11 1ung cancer A549 ce11s[J].Onco1Rep,2013,29(2):523-528.
Invasion and metastasis ability of Rh2 ginsenosides on B16 melanoma cell
YUAN Jiaxin1ZOU Cheng2TIAN Hua1LI LiBo1CUI Hongxia1▲
1.Co11ege of C1inica1 Pharmaco1ogy Teaching and Research Section,Qiqihar Medica1 University,Hei1ongjiang Province,Qiqihar161006,China;2.Co11ege of Natura1 Medicine Chemistry Teaching and Research Section,Kunming Medica1 University,Yunnan province,Kunming650500,China
R961.1
A
1673-7210(2016)04(c)-0135-04
黑龙江省自然科学基金资助项目(H201353)。
2016-01-01本文编辑:赵鲁枫)
