异氟烷对间歇缺氧静脉内皮细胞的保护作用研究
2016-07-22张旭东任鹏程何印斌刻九虎
张旭东 任鹏程 何印斌 孙 丽 刻九虎
第四军医大学唐都医院全军骨肿瘤研究所麻醉科,陕西西安 710038
异氟烷对间歇缺氧静脉内皮细胞的保护作用研究
张旭东任鹏程何印斌孙丽刻九虎
第四军医大学唐都医院全军骨肿瘤研究所麻醉科,陕西西安710038
目的探讨异氟烷对间歇缺氧 (IH)人脐静脉内皮细胞的作用。方法HUVEC和EAhy926细胞分为对照组、模型组及1%、1.5%、2%异氟烷预处理组,测定细胞活力、乳酸脱氢酶(LDH)和超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量和谷胱甘肽(GSH)水平,采用Rea1-time PCR和Western b1ot法检测低氧诱导因子(HIF-1α)和核转录因子-B(NF-кB)的表达。结果 与对照组比较,模型组细胞活力、SOD活性和GSH水平降低,LDH活性、MDA含量、HIF-1α和NF-кB表达升高,差异有统计学意义(P<0.05或P<0.01)。与模型组比较,异氟烷预处理组的细胞活力、SOD活性、GSH水平和HIF-1α表达,增加LDH活性、MDA含量和NF-кB表达降低,差异有统计学意义(P<0.05或P<0.01)。 结论异氟烷能清除细胞氧自由基,上调HIF-1α表达,下调NF-кB表达,提示其能降低IH引起氧化应激和炎性反应,减轻内皮细胞IH损伤。
异氟烷;人脐静脉内皮细胞;间歇缺氧;氧化应激;炎症
[Abstract]Objective To study the effect of isof1urane on intermittent hypoxia(IH)injured human umbi1ica1 vein endothe1ia1 ce11s.Methods HUVEC and EAhy926 ce11s were divided into contro1 group,mode1 group,1%,1.5%,2% Isof1urane pre-treatment group.Ce11 viabi1ity,MDA and GSH 1eve1s,LDH and SOD activities,and HIF-1α and NF-кB expressions were tested by MTT assay,expression of MDA,LDH,SOD and GSH were tested by Rea1-time PCR and Western b1ot,respective1y.Results Compared with contro1 group,the ce11 viabi1ity,SOD activity and GSH 1eve1 decreased,LDH activity and MDA 1eve1,and expression of HIF-1α and NF-кB increased in mode1 group ce11s,the differences were statistica11y significant(P<0.05 or P<0.01).Compared with mode1 group,the ce11 viabi1ity,SOD activity,GSH 1eve1 and HIF-1α expression increased,MDA 1eve1,LDH activity and NF-кB expression decreased,the differences were statistica11y significant(P<0.05 or P<0.01)Conclusion Isof1urane protects human umbi1ica1 vein endothe1ia1 ce11s from IH injury by scavenging free radica1 and reducing oxidative stress and inf1ammation.
[Key words]Isof1urane;Human umbi1ica1 vein endothe1ia1 ce11s;Intermittent hypoxia;Oxidative stress;Inf1ammation
阻塞性睡眠呼吸暂停综合征(obstructive s1eep apnea syndrome,OSAS)是睡眠时上呼吸道反复阻塞的一种疾病[1],为高血压、冠心病和心肌梗塞等诸多心脑血管疾病相关的独立危险因素[2-3],二者关系的研究逐渐成为目前研究热点。间歇缺氧(intermittent hypoxia,IH)导致的氧化应激和炎性反应造成的血管内皮损伤是OSAS引起心脑血管疾病的主要原因之一[4]。临床常用麻醉药异氟烷可抑制氧自由基生成,降低脏器缺血再灌注损伤[5],但其对细胞IH的作用鲜见报道。本研究探讨异氟烷对IH脐静脉内皮细胞的作用。
1 材料与方法
1.1实验试剂
人脐静脉内皮细胞HUVEC和EAhy926(中科院上海细胞生物学研究所);DMEM培养基(Hyc1one公司);胎牛血清(FBS)(Gibco公司);BCA试剂盒、核蛋白提取试剂盒、乳酸脱氢酶(LDH)试剂盒、丙二醛(MDA)试剂盒、超氧化物歧化酶(SOD)试剂盒和谷胱甘肽(GSH)试剂盒(南京建成生物工程研究所);抗体(Santa Cruz公司);PVDF膜和ECL化学发光试剂 (Mi11ipore公司);TRIzo1试剂盒和逆转录试剂盒(Invitrogen公司)。
1.2分组及处理方法
HUVEC和EAhy926细胞分为对照组、模型组和1%、1.5%、2%异氟烷预处理组。对照组细胞正常培养;IH模型细胞参照Hoffmann等[6]的方法,于5%CO2和95%N2(O2<1%)中37℃培养5 min,再正常培养5 min,每天循环6 h,共4 d;异氟烷预处理组细胞分别用溶解在DMEM中1%、1.5%、2%异氟烷处理3 h后进行IH处理。
1.3MTT法测定细胞活力
细胞以1×105个/mL接种于96孔板,同“1.2”项方法培养,加5 g/L MTT 20 μL培养4 h,弃培养基后加DMSO 150 μL溶解结晶。用全自动酶标仪检测490 nm吸光度。重复3次。
1.4GSH水平、LDH活性及MDA含量测定
细胞培养液离心后取上清,按相应试剂盒说明书测GSH水平、LDH活性和MDA含量,重复3次。
1.5SOD活性测定
细胞用0.25%胰酶消化,离心,PBS溶解沉淀,超声破碎,按SOD试剂盒说明书测SOD活性,重复3次。
1.6Real-time PCR检测
TRIzo1法提取细胞总RNA,逆转录合成cDNA,定量PCR扩增,扩增体系:SYBR Premix Ex TaqⅡ10 μL,上下游引物各0.5 μL,2 μL cDNA,ddH2O 7 μL。反应条件:94°C,2 min;94°C,30 s;62°C,30 s,30个循环;72°C,5 min。低氧诱导因子(HIF-1α)上下游引物为5'-ATCTGAGGACACGAGCTGCCT-3'和 5'-CAGAAGGACTT-GCTGGCTGATC-3',产物368 bp;核转录因子-B(NF-кB)上下游引物为5'-CTGATGTGCACCGACAAGTGG-3'和5'-GTT-GATGGTGCTCAGGGATGAC-3',产物353 bp。各样品复管2次。βactin为内参。基因表达量由2-ΔΔCt法获得。
1.7Western blot检测
Trizo1抽提细胞总蛋白,用核蛋白提取试剂盒提取核蛋白,BCA法测蛋白浓度。10 μg蛋白经10% SDS-PAGE分离并转膜,封闭1 h,分别加入HIF-1α、NF-кB、GAPDH或TBP一抗,4℃孵育过夜,洗膜,加二抗,室温孵育2 h,GAPDH为HIF-1α的内参,TBP为NF-кB的内参,用ECL系统进行化学发光和观察。重复3次。
1.8统计学方法
采用统计软件SPSS 22.0对数据进行分析,正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1异氟烷增加IH内皮细胞存活力,降低LDH活性
与对照组比较,模型组吸光度值降低,LDH活性均升高,差异有高度统计学意义(P<0.01)。与模型组比较难,随着异氟烷浓度的增加吸光度值增加,LDH活性下降,差异有统计学意义(P<0.05)。见表1、图1。

表1 异氟烷对IH HUVEC、EAhy926细胞存活力和LDH活力的影响

图1 异氟烷对IH HUVEC、EAhy926细胞存活力和LDH活力的影响
2.2异氟烷降低IH内皮细胞MDA含量
与对照组比较,模型组MDA含量增加,差异有高度统计学意义(P<0.01)。与模型组比较,随着异氟烷浓度的增加MDA含量降低,差异有统计学意义(P<0.05)。见表2、图2。
表2 异氟烷对IHHUVEC、EAhy926细胞MDA含量的影响(mmo1/L,±s)

表2 异氟烷对IHHUVEC、EAhy926细胞MDA含量的影响(mmo1/L,±s)
注:与对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;MDA:丙二醛
组别 HUVEC EAhy926对照组模型组1%异氟烷预处理组1.5%异氟烷预处理组2%异氟烷预处理组0.57±0.05 0.93±0.02##0.86±0.03*0.76±0.05**0.63±0.03**0.61±0.08 0.99±0.04##0.91±0.04*0.80±0.03**0.70±0.02**
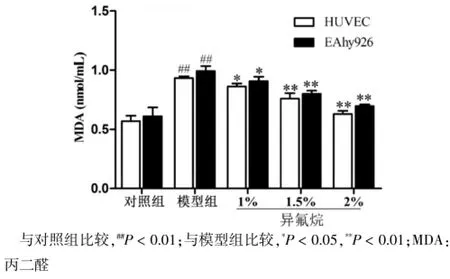
图2 异氟烷对IH HUVEC和EAhy926细胞MDA含量的影响
2.3异氟烷升高IH内皮细胞SOD活性和GSH水平
与对照组比较,模型组培养基中SOD活性和GSH水平显著降低,差异有高度统计学意义(P<0.01),异氟烷预处理显著升高SOD活性和GSH水平,差异有统计学意义(P<0.05),且随着异氟烷浓度的增加SOD活性和GSH水平均升高。见表3、图3。
表3 异氟烷对IH HUVEC和EAhy926细胞SOD活性和GSH水平的影响(±s)

表3 异氟烷对IH HUVEC和EAhy926细胞SOD活性和GSH水平的影响(±s)
注:与对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;SOD:超氧化物歧化酶;GSH:谷胱甘肽
组别HUVEC SOD活性(U/mL) GSH水平(mg/L)EAhy926 SOD活性(U/mL) GSH水平(mg/L)对照组模型组1%异氟烷预处理组1.5%异氟烷预处理组2%异氟烷预处理组71.05±2.61 36.59±1.23##42.15±2.41*57.02±2.20**64.55±2.18**82.11±3.96 51.88±3.47##59.88±2.84*68.48±2.92**72.73±3.39**68.74±4.83 38.60±1.54##44.87±3.20*52.38±2.77**58.91±1.99**88.14±3.37 48.45±6.13##59.46±4.02*71.29±3.80**78.40±3.11**
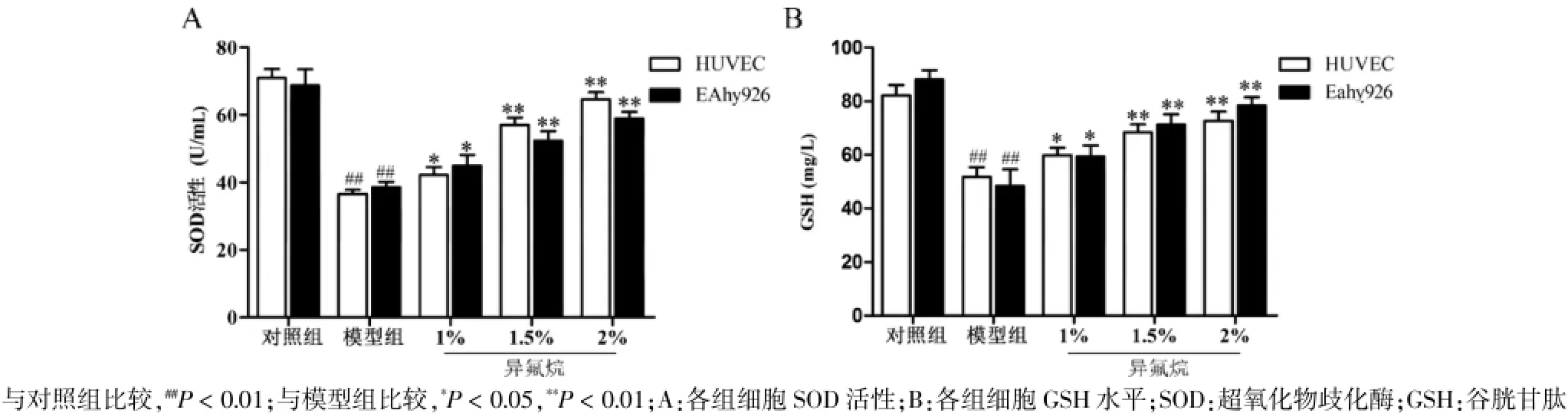
图3 异氟烷对IH HUVEC和EAhy926细胞SOD活性和GSH水平的影响
2.4异氟烷对IH内皮细胞HIF-1α和NF-кB表达的影响
qRT-PCR和Western b1ot结果表明:与对照组比较,模型组HIF-1α和核内NF-кB均高表达,差异有高度统计学意义(P<0.01)。与模型组比较,随着异氟烷浓度的增加内皮细胞HIF-1α mRNA和蛋白表达均显著升高,差异有统计学意义(P<0.05),而NF-кB mRNA和蛋白表达显著降低,差异有统计学意义(P<0.05)。见图4、5。

图4 异氟烷对IH HUVEC细胞HIF-1α和NF-kB表达的影响

图5 异氟烷对IH EAhy926细胞HIF-1α和NF-kB表达的影响
3 讨论
OSAS机体处于IH环境中,产生大量氧自由基,形成氧化应激状态[7]。OSAS可导致诸多心脑血管疾病,病理基础是血管内皮受损,而IH是引起血管内皮受损的核心环节[8]。本实验用HUVEC和EAhy926细胞IH模拟OSAS IH,模型组吸光度降低,LDH活性升高,表明细胞氧化呼吸功能受损,细胞膜通透性增加。
全身麻醉后OSAS患者术后呼吸系统并发症风险很高[9]。麻药的选择对OSAS患者的安全至关重要。异氟烷是临床常用挥发性卤代麻醉药[10],具有抗氧化的特性,保护细胞DNA损伤[11]。异氟烷预处理对多种器官可产生保护作用。据报道,异氟烷对脑[12]、心脏[13]、心肌[14]、肾[15]、肝和肺[16]等器官缺血再灌注损伤均有保护作用。鉴于缺血再灌注与IH有相似之处,本研究探讨异氟烷对IH内皮细胞的作用,发现异氟烷预处理可降低细胞IH损伤。血管内皮细胞功能异常是引发心血管疾病的关键,内皮细胞缺氧可产生大量活性氧,损伤血管。异氟烷可提高IH脐静脉内皮细胞SOD活性和GSH水平,降低氧自由基,保护细胞。
OSAS合并心脑血管疾病发病机制复杂,NF-кB依赖的炎性通路和HIF-1依赖的适应性通路尤为重要[17-18]。NF-кB在胞浆内与IкB结合,无活性;受到炎症介质和应激反应等刺激后解离,NF-кB活化入核,促进炎症因子转录。据报道IH可升高EAhy926中NF-кB表达[19]。HIF-1广泛存在于人和哺乳动物细胞内,低氧时才稳定表达[20],能激活200多个基因调控缺氧应答[21]。HIF-1由受缺氧调控的HIF-1α和细胞内稳定表达的HIF-1β组成,只有二聚体才能发挥作用。缺氧时HIF-1α表达增多,与HIF-1β结合入核,激活促血管内皮生长因子、促红细胞生成素和一氧化氮合酶等基因转录[22]。HIF-1α可降低缺血再灌注损伤中线粒体氧化应激的产生,其下游效应因子已糖激酶Ⅱ也可阻止缺血再灌注损伤造成的线粒体功能障碍[22]。结果发现:IH HUVEC和EAhy926细胞HIF-1α和核内NF-кB表达升高,而异氟烷预处理能够升高细胞HIF-1α表达,降低NF-кB表达,提示其可抑制氧化应激所致的炎症损伤。
综上所述,异氟烷可降低细胞IH损伤,为其用于OSAS患者的麻醉提供依据。然而异氟烷在降低细胞IH损伤的同时,是否有其他副作用,还有待深入研究。
[1]Mannarino MR,Di Fi1ippo F,Pirro M.Obstructive s1eep apnea syndrome[J].Eur J Intern Med,2012,23(7):586-593.
[2]Destors M,Tamisier R,Baguet JP,et a1.Cardiovascu1ar morbidity associated with obstructive s1eep apnea syndrome[J]. Rev Ma1 Respir,2014,31(4):375-385.
[3]王鹏举,李江平.氧化应激反应在OSAHS伴原发性高血压中的作用[J].临床耳鼻咽喉头颈外科杂志,2014,28(9):604-606.
[4]Seif F,Pate1 S R,Wa1ia H,et a1.Association between obstructive s1eep apnea severity and endothe1ia1 dysfunction in an increased background of cardiovascu1ar burden[J].J S1eep Res,2013,22(4):443-451.
[5]Baotic I,Weihrauch D,Procknow J,et a1.Isof1urane favorab1y modu1ates guanosine triphosphate cyc1ohydro1ase-1 and endothe1ia1 nitric oxide synthase during myocardia1 ischemia and reperfusion injury in rats[J].Anesthesio1ogy,2015,123(3):582-589.
[6]Hoffmann M S,Singh P,Wo1k R,et a1.Obstructive s1eep apnea and intermittent hypoxia increase expression of dua1 specificity phosphatase 1[J].Atherosc1erosis,2013,231(2):378-383.
[7]Lavie L.Oxidative stress in obstructive s1eep apnea and intermittent hypoxia--revisited--the bad ug1y and good:imp1ications to the heart and brain[J].S1eep Med Rev,2015,20:27-45.
[8]Lopez-Jimenez F,Sert Kuniyoshi FH,Gami A,et a1.Obstructive s1eep apnea:imp1ications for cardiac and vascu-1ar disease[J].Chest,2008,133(3):793-804.
[9]Xara D,Mendonca J,Pereira H,et a1.Adverse respiratory events after genera1 anesthesia in patients at high risk of obstructive s1eep apnea syndrome[J].Braz J Anesthesio1,2015,65(5):359-366.
[10]Braz MG,Braz LG,Freire CM,et a1.Isof1urane and Propofo1 contribute to increasing the antioxidant status of patients during minor e1ective surgery:a randomized c1inica1 study[J].Medicine(Ba1timore),2015,94(31):e1266.
[11]Rocha TL,Dias-Junior CA,Possomato-Vieira JS,et a1. Sevof1urane induces DNA damage whereas isof1urane 1eads to higher antioxidative status in anesthetized rats[J]. Biomed Res Int,2015,2015:264971.
[12]Fang Li Q,Xu H,Sun Y,et a1.Induction of inducib1e nitric oxide synthase by isof1urane post-conditioning via hypoxia inducib1e factor-1a1pha during to1erance against ischemic neurona1 injury[J].Brain Res,2012,1451:1-9.
[13]AgnicI,VukojevicK,Saraga-Babic M,eta1.Isof1uranepostconditioning stimu1ates the pro1iferative phase of myocardia1 recovery in an ischemia-reperfusion mode1 of heart injury in rats[J].Histo1 Histopatho1,2014,29(1):89-99.
[14]Wu W,Zhou X,Liu P,et a1.Isof1urane reduces hypoxia/ reoxygenation-induced apoptosis and mitochondria1 permeabi1ity transition in rat primary cu1tured cardiocytes[J]. BMC Anesthesio1,2014,14:17.
[15]Liang Y,Li Z,Mo N,et a1.Isof1urane preconditioning ame1iorates rena1 ischemia-reperfusion injury through antiinf1ammatory and antiapoptotic actions in rats[J]. Bio1 Pharm Bu11,2014,37(10):1599-1605.
[16]Zhang L,Luo N,Liu J,et a1.Emu1sified isof1urane preconditioning protects against 1iver and 1ung injury in rat mode1 of hemorrhagic shock[J].J Surg Res,2011,171 (2):783-790.
[17]Ryan S,Tay1or CT,McNicho1as WT.Systemic inf1ammation:a key factor in the pathogenesis of cardiovascu1ar comp1ications in obstructive s1eep apnoea syndrome?[J]. Postgrad Med J,2009,85(1010):693-698.
[18]Ryan S,McNicho1as WT.Intermittent hypoxia and activation of inf1ammatory mo1ecu1ar pathways in OSAS[J]. Arch Physio1 Biochem,2008,114(4):261-266.
[19]Han Q,Yeung SC,Ip MS,et a1.Intermittent hypoxia-induced NF-kappaB and HO-1 regu1ation in human endothe1ia1 EA.hy926 ce11s[J].Ce11 Biochem Biophys,2013,66(3):431-441.
[20]Tekin D,Dursun AD,Xi L.Hypoxia inducib1e factor 1 (HIF-1)andcardioprotection[J].ActaPharmaco1Sin,2010,31(9):1085-1094.
[21]Ong SG,Hausen1oy DJ.Hypoxia-inducib1e factor as a therapeutic target for cardioprotection[J].Pharmaco1 Ther,2012,136(1):69-81.
[22]Yuan G,Khan SA,Luo W,et a1.Hypoxia-inducib1e factor 1 mediates increased expression of NADPH oxidase-2 in response to intermittent hypoxia[J].J Ce11 Physio1,2011,226(11):2925-2933.
Isoflurane protects human umbilical vein endothelial cells on intermittent hypoxia injury
ZHANG XudongREN PengchengHE YinbinSUN LiLIU Jiuhu
Department of Anesthesio1ogy,PLA Institute of Orthopedic Onco1ogy,Tangdu Hospita1,Fourth Mi1itary Medica1 University,Xi'an Shaanxi710038,China
R614.2
A
1673-7210(2016)04(c)-0028-05
任鹏程(1971.9-),男,副主任医师;研究方向:心血管麻醉。
2016-01-23本文编辑:苏 畅)
