同源多倍体诱导与鉴定实验中的问题探讨
2016-07-21王竹林
孟 敏,王竹林,胡 甘
(西北农林科技大学 农学院,陕西 杨凌 712100)
同源多倍体诱导与鉴定实验中的问题探讨
孟敏,王竹林,胡甘
(西北农林科技大学农学院,陕西杨凌712100)
摘要针对同源多倍体诱导与细胞学鉴定实验中,存在实验材料霉烂,同源多倍体诱导率低,细胞学鉴定时染色体着色浅,制片时染色体不分散等问题,该文在豌豆实验中探索出一套染色体诱导、解离、染色、制片等最佳诱导浓度和诱导时间的完整组合,能有效提高豌豆同源多倍体实验的准备与教学工作效率。
关键词豌豆;同源多倍体;诱导;秋水仙素;实验教学
随着对多倍体生物的深入研究,越来越多的人认为,多倍化在生物的演化历史上扮演了重要的角色[1]。多倍体因其个体大、适应性强的特征[2],使多倍体动植物的深入研究在生物进化和遗传育种方面具有重要意义,多倍体的遗传研究也因此成为各大农林院校的热门话题[3-5]。
同源多倍体诱导与鉴定实验通过了解诱导植物同源多倍体遗传原理,初步了解人工诱导植物同源多倍体的方法及其细胞学鉴定技术。该实验既是培养学生科研意识和能力的基础性实验,又是指导学生学习遗传学理论和探索实践的重要实验。为了简化实验过程,本文选取简单易得的豌豆作为实验材料,以秋水仙素作为诱变剂。但是,实验中往往会出现诱导时豌豆发生霉烂,豌豆染色体不加倍,因诱导时间偏长导致染色体倍数不稳定,显微镜下看不清染色体数量等问题。通过多年的实验探索,我们总结摸索出一套能有效解决这些问题的实验方案,该方案操作简便、高效加倍、镜检重复性好,对同行有很好的借鉴意义。
1多倍体诱导
1.1选种与清洗
1.2萌芽培养
将清洗干净、覆盖好的豌豆种子置于人工气候箱内,将温度调控在25 ℃。大约24 h后,待绝大部分豌豆种子萌发至胚根长出约0.5 cm长时,连带白瓷盘一并取出备用。
1.3秋水仙素诱导
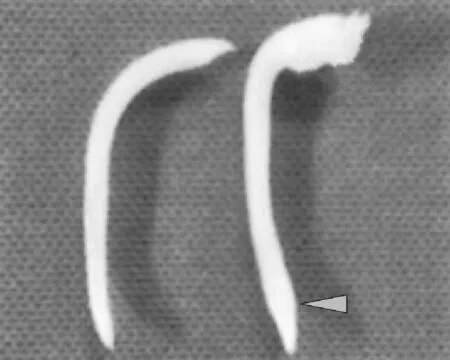
图1 诱导后,根尖膨大。左侧样品未经秋水仙素诱导处理,右侧样品经秋水仙素诱导处理,箭头示处明显膨大
2细胞学鉴定
我们在该实验中也使用常规制片,常规压片方法操作简单,无须特殊药品,是研究和鉴定染色体的首选方法[7],比较适合实验教学。
2.1课前解离
每次课前半小时,将固定好的豌豆根尖取出,置于50 mL的小烧杯中,用清水漂洗干净表面的乙醇。再用1 mol/L HCl溶液(82.5 mL浓HCl+917.5 mL ddH2O)洗涤一次,倒去HCl溶液,再倒入20 mL 1mol/L HCl,置于60℃水浴锅中解离8~10 min[8](期间用玻璃棒搅动数次,使烧杯内受热均匀)。待观察到根尖膨大处呈现乳白色半透明状时停止解离,用蒸馏水漂洗干净,置于盛有蒸馏水的培养皿内待用。
2.2制片鉴定
制片具体步骤如下:1)仔细切取乳白色的根尖分生组织,置于洁净干燥的载玻片上;2)在载玻片上,滴1滴改良苯酚品红染色液[9],用医用镊子捣碎组织(但不能捣成残渣状),除去纤维组织;3)用酒精灯外焰烤片8~10次(每次1~2 s,温度以不烫手背为宜),期间若染色液挥发变干,要及时滴加;4)盖上盖玻片,注意赶出气泡,吸水纸吸去多余染液后,大拇指垂直轻轻按压,并用解剖针手柄轻轻敲打压片;5)再次置于酒精灯外焰烤片5~6次(用微火,避免烤焦);6)Motic Digital Microsoope DMB SERIES DWB5-223-5型数码显微镜下镜检观察,视野下寻找分裂中期染色体加倍的细胞如图2所示,并照相。

图2 四倍体豌豆,细胞分裂中期,染色体加倍,视野下清晰可见28条染色体
3结束语
豌豆个体小,体细胞染色体数目少(2n=14)[10],是遗传学研究和教学中的经典实验材料。秋水仙素作为一种植物多倍体诱导的药剂,其独特的作用原理是阻止细胞分裂中期纺锤体的形成,致使分裂后期染色体不能移向两级,而组成一个双倍性的细胞核,从而使细胞染色体数目加倍,成为公认的多倍体诱导有效的药剂。适宜浓度的秋水仙素和诱导时间,是植物染色体加倍实验的关键。关于浓度和处理时间的最适宜组合问题,目前尚有不同看法。有些学者认为低浓度、长时间的组合较好,还有一些学者倾向于高浓度、短时间的组合[11]。我们在对比参考众多学者的研究基础上,找到了最佳诱导浓度和诱导时间的组合,实现了豌豆同源多倍体的高效诱导,为实验教学提供了高质量的实验材料。在制片环节,我们选择常规制片法,并注重染色、烤片、压片等操作细节,此法具有简便、高效、低污染、易学等优点,在同类实验教学中具有广泛的应用价值和参考意义。
参 考 文 献
[1]宋灿,刘少军,肖军等.多倍体生物研究进展[J].中国科学:生命科学,2012,42(3):173-184.
[2]王竹林,遗传学实验指导[M].杨凌:西北农林科技大学出版社,2011.26-27.
[3]郑永强,徐坤.秋水仙素在植物体细胞染色体加倍中的应用研究进[J].中国农学通报2003,19(5):89-91.
[4]闫秋洁,杨琼.秋水仙素对蚕豆胚根生长的影响及多倍体诱导效应分析[J].广西植物,2012,32(5):386-391.
[5]王晓雯,桑贤春.一种高效的蚕豆染色体加倍方法探讨[J].河南农业科学,2013,42(6):42-45.
[6]张雨婷,王贤,王永勤,等.次氯酸钠用于植物培养基灭菌方法初探[J].中国农学通报2012,28(4):263-268.
[7]杨起简,周禾,孙彦,等.豌豆染色体制片技术的比较研究[J].北京农学院学报,2003,18(3):172-174.
[8]刘莹,赵翠荣,王立峰,等.小麦根尖染色体制片及植株倍性鉴定[J].安徽农业科学,2012,40(25):12349-12350.
[9]周洲,程罗根.遗传学实验[M].北京:科学出版社,2013,267-277.
[10]王凤宝,付金锋,董立峰.秋水仙素与DMSO诱导豌豆同源四倍体[J].核农学报,2009,23(2):203-208.
[11]闵子扬,童龙,杨红波.组织培养结合秋水仙素诱导南瓜多倍体[J].中国瓜菜,2015,28(1):15-18.
Discussion on Some Problems of the Experiment on the Induction and Identification of Autopolyploid
MENG Min,WANG Zhulin,HU Gan
(College of Agronomy,Northwest A & F University,Yangling 712100,China)
AbstractIn order to solve the problems of the experiment on induction and identification on autopolyploid,such as material mildew,induced autopolyploid rate low,chromosome staining shallow in cytological identification,production chromosomes not scattered,and so on,we explored a set of best combinatorial methods in pea experiment on chromosomes induction,induced dissociation,dyeing,and production,which can effectively improve the peas autopolyploid experimental preparation and teaching efficiency.
Key wordspea;autopolyploid;induction;colchicine;experiment teaching
收稿日期:2015-06-29;修改日期: 2015-08-29
作者简介:孟敏(1978-),女,博士,实验师,主要从事本科遗传实验教学和科研工作。
中图分类号
文献标志码
doi:10.3969/j.issn.1672-4550.2016.02.011
