miR-15a下调BCL-2和BCL2L2 对下咽鳞癌FaDu细胞凋亡影响
2016-07-19路武豪冯龙娄卫华
路武豪冯龙娄卫华
miR-15a下调BCL-2和BCL2L2 对下咽鳞癌FaDu细胞凋亡影响
路武豪1冯龙2娄卫华1
【摘要】目的 miR-15a在许多癌症中均发现有表达异常,但其在下咽鳞状细胞癌的作用不清。本研究通过miR-15a抑制BCL-2和BCL2L2表达,探讨在将miR-15a对下咽鳞癌细胞凋亡的影响。方法 通过Lipofectamine2000将miR-15a mimics转染入下咽鳞癌FaDu细胞中。RT-PCR检测BCL-2和BCL2L2 mRNA的表达;Western Blotting检测BCL-2和BCL2L2蛋白的表达;流式细胞术检测检测miR-15a的对细胞凋亡的影响。结果 BCL-2和BCL2L2在FaDu细胞中表达较强;转染miR-15a mimics后的FaDu细胞中,BCL-2和BCL2L2蛋白和mRNA 的表达水平逐渐下调;同时转染miR-15a mimics后,FaDu细胞凋亡明显增加。结论 miR-15a可以下调BCL-2和BCL2L2的表达,促进下咽鳞癌细胞凋亡。
【关键词】miR-15a;下咽鳞癌;FaFu细胞;miRNA;凋亡;BCL-2;BCL2L2
下咽鳞状细胞癌是头颈部鳞状细胞癌(HNSCC)中常见的恶性肿瘤[1]。我国下咽鳞状细胞癌发病率唇部、口咽、喉咽和喉癌依次为0.04~0.14/10万,1~2/10万,0.15~0.8/10万和3~5/10万[2]。吸烟和嗜酒是头颈部鳞癌的主要的致癌因素。微小RNA (microRNA)是近年发现的一种内源性小分子非编码单链RNA,由22个核苷酸组成,由长约70~90 nt具有发夹结构的单链RNA前体加工而来,能够通过互补或部分互补的方式与靶mRNA的3'端非翻译区(3'-untranslated region,3'-UTR)结合,从而介导靶mRNA降解或抑制其翻译,负性调控下游靶基因的表达[3]。目前对下咽鳞癌miRNAs表达情况了解有限。因此,有必要对下咽鳞癌miRNAs表达情况进行深入研究。本研究通过miR-15a下调BCL-2和BCL2L2的表达,观察其对下咽鳞癌FaDu细胞凋亡的影响。探讨将miR-15a作为基因治疗靶点的价值,为以后的进入临床治疗提供有效的实验基础。
1 材料与方法
1.1 材料
1.1.1 标本来源 标本来自于2012年7月~2014年6月在郑州大学第一附属医院咽喉头颈外科接受喉咽鳞癌手术切除的患者,术前已经与患者签署知情同意书。
1.1.2 细胞株及细胞培养 人下咽鳞癌FaDu细胞株购自中国科学院上海细胞生物学研究所。细胞在含有10%的胎牛血清,100单位/ml青霉素,100 μg /ml链霉素的DMEM培养液(Gibco,美国)中生长,并置于37℃,5% CO2的条件下培养,实验细胞均处于对数生长期。
1.1.3 抗体和试剂 鼠抗人BCL2(sc-7382)单克隆抗体和鼠抗人BCL2L2(sc-293236)单克隆抗体购自Santa Cruz Biotechnology公司;细胞蛋白提取试剂盒购自Pierce公司;Annexin V凋亡检测试剂盒购自BD公司;miR-15a mimics上海吉玛制药技术有限公司。
1. 2 实验方法
1.2.1 miR-15a转染人下咽鳞癌FaDu细胞 实验分为以下3组:(1)miR-15a组,加入miR-15a mimics 150 nmol/L和脂质体;(2)miRNA无关序列对照组,加入 miRNA scramble 150 nmol/L和脂质体;(3)空白对照组,无任何转染。选用对数生长期FaDu细胞按照之前的实验分组参照脂质体转染试剂盒说明书分别进行脂质体转染。转染后继续培养6 h,换含10%胎牛血清的DMEM完全培养基,37℃,5% CO2,继续培养48 h,收集细胞进行检测。
1.2.2 细胞总PCR的提取和引物设计 FaDu细胞培养于25 mm的培养瓶中,当细胞汇合度至90%时,每瓶细胞中加1 ml Trizol试剂进行RNA提取。分别设计miR-15a、BCL-2和BCL2L2引物。见表1、图1所示。

表1 miR-15a、U6 nRNA、BCL-2、BCL2L2、GAPDH引物
1.2.3 miR-15a表达水平的检测 参照Trizol试剂盒说明书提取各组细胞的总RNA,运用miR-15a qPCR Quantitation Kit进行逆转录和扩增。逆转录反应体系为:4×dNTP 1 μl,miR-RT primer 1 μl,5×RT buffer 4 μl,M-MLV 0.5 μl,总RNA 1 μl,RNaseFree H2O补足至20 μl体积。逆转录反应程序:37℃ 60 min,95℃ 10 min。PCR扩增体系为:miR specific primer set 1 μl,2×Real-time PCR buffer 20 μl,Taq酶0.2 μl,miRNA逆转录产物1 μl,ddH2O补足至40 μl体积。定量PCR反应程序:95℃ 3 min预变性;95℃ 15 s,65℃ 45 s,循环40圈。所有反应均设置3个复孔,使用ABI 7500 Fast仪器进行扩增检测。以U6作为内参,记录Ct值,每个样本的Ct值取平均数,各组间miR-15a相对定量的倍数用2-△△CT值表示。
1.2.4 BCL-2和BCL2L2表达水平检测 反应总体积为30 μl,以上述逆转录产物为cDNA模板,每个反应设置3个复孔。Real-time PCR反应体系如下:94℃ 2 min,95℃ 1 min,两种引物分别在551 min,72℃ 1 min,34个循环, 72℃延伸5 min。
1.2.5 细胞蛋白的制备 参照细胞蛋白提取试剂盒说明书,提取细胞总蛋白,Bradford法检测总蛋白含量,并于-70℃保存。
1.2.6 BCL-2和BCL2L2蛋白表达水平检测 提取人下咽鳞癌FaDu细胞总蛋白25μg,与2×SDS 缓冲液按1:1混合,沸水煮浴10 min,经12%SDS-PAGE分离,湿转法转到硝酸纤维膜上。5%的脱脂奶粉TBST溶液封闭2 h,与单克隆鼠BCL-2和BCL2L2分别按1:2000 4℃孵育过夜,TBST溶液洗涤10 min,3次,硝酸纤维膜分别与辣根过氧化物酶标记的兔抗鼠(1:5000)室温孵育1 h,TBST 溶液洗涤10 min,3次,使用Molecular Dynamics densitometer对蛋白条带强度进行定量。实验重复3次,取其平均值。另外,转染miR-15a后,按照上述方法检测人下咽鳞癌FaDu细胞中BCL-2和BCL2L2蛋白的表达水平。
1.2.7 流式细胞仪检测细胞凋亡 收集各组细胞,细胞数调整为5×106个/ml细胞1 ml,PBS洗涤2次。用100 μl冰预冷的缓冲液重悬细胞,并向该细胞悬液中加入5 μl Annexin V-APC和2.5 μl 7-AAD染液,轻轻混匀,置于冰上。流式细胞仪检测。实验重复3次,取平均值。

表2 各组中miR-15a相对表达量
1. 3 统计学方法
采用SPSS 19.0对实验结果进行统计学处理。不同组间细胞凋亡比较采用单因素方差分析,两两比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.1 miR-15a在人下咽鳞癌FaDu细胞中表达显著升高
miR-15a mimics转染人下咽鳞癌FaDu细胞后,qRT-PCR检测到miR-15a组与miRNA无关序列对照组和空白对照组相比,miR-15a表达水平显著升高。如表2所示。
2.2 miR-15a下调BCL-2和BCL2L2的表达
为了评估的miR-15a和BCL2L2h和/或BCL-2之间的相关性,我们用miR-15a mimics转染后细胞中BCL2L2和/或BCL-2的表达进行了评价。miR-15a的高表达能够显著抑制BCL2L2和/或BCL-2 mRNA表达水平和蛋白质表达水平。见表3,图1所示。

表3 各组细胞中BCL-2和BCL2L2 mRNA相对表达量
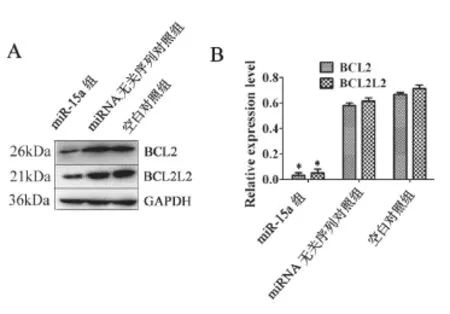
图1 Western Blotting法检测BCL-2 和BCL2L2在FaDu中蛋白的表达
2.3 流式细胞术(FCM)检测细胞凋亡结果
无关序列对照组与空白对照组相细胞凋亡率无显著性差异(P >0.05)。miR-15a组(7.246±0.815)与无关序列对照组与空白对照组相比细胞凋亡率降低,差异均有统计学意义(P<0.01),见表4,图2。

表4 各组细胞凋亡检测结果

图2 各组细胞凋亡率比较
3 讨论
头颈部鳞状细胞癌是一类常见的恶性肿瘤,大量吸烟和饮酒是其主要的致癌因素。miRNAs是一种内源性小分子RNA,可介导靶mRNA降解或抑制其翻译,能够对细胞的增殖、分化和凋亡进行调控,目前已明确其与包括肿瘤在内的诸多疾病密切相关[4]。研究发现,肿瘤中通常存在miRNAs表达水平的异常,miRNA基因在肿瘤发生过程中既可以起癌基因的作用,又可以充当抑癌基因角色[5]。
miR-15a是肿瘤中最易发生突变的基因区域之一[6]。有研究报道,miR-15a在肿瘤细胞中表达下调或缺失,推断miR-15a在肿瘤发生中可能是抑癌基因,由于等位基因缺失造成的miR-15a失活可能会导致肿瘤的发生[7-8]。我们的研究结果显示,人下咽鳞癌FaDu细胞中miR-15a表达水平较低,但转染miR-15a mimic后,人下咽鳞癌FaDu细胞中miR-15a表达水平高于转染之前,并且结果显示:miR-15a能够明显抑制下游目的基因BCL-2和BCL2L2 的mRNA和蛋白质水平的表达,细胞的凋亡显著增加。因此,以miR-15a这种抑癌基因,作为抗肿瘤治疗的靶点,如果能在下咽鳞癌组织中高表达,是否能够提高患者的生存率,以期为以后的临床治疗提供有益的参考。
参考文献
[1] 王莹,李文媛,岳文江,等. VEGF-D表达与下咽癌组织淋巴管生成及预后的相关性[J] . 中国组织化学与细胞化学杂志,2011,20(1):60-65.
[2] 邬振华,李群,崔翔,等. miR-196a在下咽鳞状细胞癌血浆中的表达及其临床意义[J]. 中国现代医生,2015,53(3):11-15,161.
[3] 鲁建光,肖玉丽,阚轩,等. 整合素αv亚基在喉和下咽鳞状细胞癌中的表达及其与肿瘤血管发生的相关性[J]. 中华耳鼻咽喉头颈外科杂志,2008,43(1):46-50.
[4] Veit JA,Scheckenbach K,Schuler PJ,et al. MicroRNA Expression in Differentially Metastasizing Tumors of the Head and Neck: Adenoid Cystic Versus Squamous Cell Carcinoma[J]. Anticancer Res.,2015,35 (3):1271-1277.
[5] 聂正超,翁文浩,李静,等. miR-126在食管癌组织中低表达并抑制食管癌EC109细胞的增殖和迁移[J]. 肿瘤,2015,35(1):55-64.
[6] Yang T,Thakur A,Chen T,et al. MicroRNA-15a induces cell apoptosis and inhibits metastasis by targeting BCL2L2 in non-small cell lung cancer[J]. Tumor Biol.,2015,36(6):4357-4365.
[7] Lin K,Farahani M,Yang Y,et al. Loss of MIR15A and MIR16-1 at 13q14 is associated with increased TP53 mRNA,de-repression of BCL2 and adverse outcome in chronic lymphocytic leukaemia[J]. British Journal of Haematology,2014,167(3):346-355.
[8] Dai L,Wang W,Zhang S,et al. Vector-based miR-15a/16-1 plasmid inhibits colon cancer growth in vivo[J]. Cell Biol Int.,2012,36 (8):765-770.
【中图分类号】R739.65
【文献标识码】A
【文章编号】1674-9308(2016)15-0202-03
doi:10.3969/j.issn.1674-9308.2016.15.135
基金项目:国家自然科学基金项目:81503677
作者单位:1 郑州大学第一附属医院咽喉头颈外科,河南 郑州450052;2 河南中医药大学基础医学院病原生物学与免疫学科,河南郑州 450008
通讯作者:娄卫华,E-mail:louweihuazzu@163.com
Effects of miR-15a Down Regulated BCL-2 and BCL2L2 on Apoptosis of FaDu Cells in the Lower Pharyngeal Squamous Cell Carcinoma
LU Wuhao1FENG Long2LOU Weihua1
1 Department of Otolaryngology-Head and Neck Surgery, First Affiliated Hospital of Zhengzhou University,Zhengzhou He’nan 450052, China, 2 Department of Pathogenic Organism Biology, He’nan University of Chinese Medicine, Zhengzhou He’nan 450008, China
[Abstract]Objective MiR-15a is found to have abnormal expression in many cancers, but its role in the squamous cell carcinoma of the lower pharynx is not clear. In this study, the expression of BCL-2 and BCL2L2 was inhibited by miR-15a, and the effect of miR-15a on the apoptosis of the cell apoptosis was studied. Methods Mimics FaDu was transfected into the miR-15a cells of the pharynx squamous cell carcinoma by Lipofectamine2000. RT-PCR detection of BCL-2 and mRNA BCL2L2 expression. Blotting Western to detect the expression of BCL-2 and BCL2L2 protein, flow cytometry to detect the effect of miR-15a on the apoptosis of the cell. Results Bcl-2 and BCL2L2 in FaDu cells expressed strong; transfection miR-15a mimics the FaDu cells, Bcl-2 and BCL2L2 protein and mRNA expression level decreased gradually; at the same time after transfection of miR-15a mimics, FaDu cells apoptosis significantly increased. Conclusion MiR-15a can down regulate the expression of BCL-2 and BCL2L2, and promote the apoptosis of cell apoptosis in the lower pharynx squamous cell carcinoma.
[Key words]miR-15a, Squamous cell carcinoma of the lower pharynx,FaFu cell, miRNA, Apoptosis, BCL-2, BCL2L2
