慢性乙型肝炎病毒感染者外周血辅助性T淋巴细胞17和调节性T淋巴细胞的变化及二者平衡的研究
2016-07-19刘怀鄂陈红英
娄 鸣,游 晶,刘怀鄂,陈红英,涂 琛,丁 洁,靳 智
·论著·
慢性乙型肝炎病毒感染者外周血辅助性T淋巴细胞17和调节性T淋巴细胞的变化及二者平衡的研究
娄 鸣,游 晶,刘怀鄂,陈红英,涂 琛,丁 洁,靳 智
650032云南省昆明市,昆明医科大学第一附属医院感染科
【摘要】目的分析慢性乙型肝炎病毒(HBV)感染者外周血辅助性T淋巴细胞17(Th17)和调节性T淋巴细胞(Treg)的变化及Th17/Treg平衡状态,并探讨Th17/Treg平衡在慢性HBV感染疾病发展过程中的作用。方法选取2013年11月—2015年12月昆明医科大学第一附属医院诊治的慢性HBV感染者142例为研究对象,其中慢性无症状HBV(ASC)携带者23例(ASC组)、慢性乙型肝炎(CHB)患者51例(CHB组)、乙型肝炎肝硬化(LC)患者37例(LC组)、乙型肝炎相关性肝细胞癌(HCC)患者31例(HCC组)。同期选取本院体检健康者26例为正常对照组。采用流式细胞术测定外周血Th17、Treg表达率,并计算Th17/Treg比值,采用反转录聚合酶链式反应(RT-PCR)法测定患者血清HBV-DNA载量,采用全自动生化分析仪检测丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBIL)水平。结果CHB组、LC组、HCC组外周血Th17、Treg表达率均高于正常对照组和ASC组(P<0.05);LC组外周血Th17表达率高于CHB组,HCC组外周血Th17表达率低于CHB组和LC组(P<0.05);HCC组外周血Treg表达率高于CHB组和LC组(P<0.05);HCC组外周血Th17/Treg比值低于正常对照组、CHB组、LC组(P<0.05)。CHB组、LC组、HCC组患者血清HBV-DNA载量均低于ASC组(P<0.05)。CHB组、LC组、HCC组患者ALT、AST、TBIL水平均高于正常对照组和ASC组(P<0.05);LC组ALT、TBIL水平高于CHB组(P<0.05);HCC组ALT水平低于CHB组和LC组,AST水平高于CHB组和LC组,TBIL水平低于LC组(P<0.05)。CHB组Th17表达率与ALT、AST和TBIL呈正相关,Th17/Treg比值与ALT、AST水平呈正相关(P<0.05);LC组Th17表达率与ALT水平呈正相关,Treg表达率与ALT、AST水平呈正相关(P<0.05);其余各指标间无直线相关关系(P>0.05)。结论Th17和Treg在慢性HBV感染相关肝脏疾病的发生、发展过程中发挥着重要的作用,Th17/Treg失衡可能与慢性乙型肝炎病程进展密切相关,为临床进一步研究奠定了基础。
【关键词】乙型肝炎病毒;乙型肝炎,慢性;T淋巴细胞,辅助;T淋巴细胞,调节性
娄鸣,游晶,刘怀鄂,等.慢性乙型肝炎病毒感染者外周血辅助性T淋巴细胞17和调节性T淋巴细胞的变化及二者平衡的研究[J].中国全科医学,2016,19(18):2115-2120.[www.chinagp.net]
Lou M,You J,Liu HE,et al.Changes of peripheral Th17 and Treg and Th17/Treg balance in patients with chronic hepatitis B virus infection[J].Chinese General Practice,2016,19(18):2115-2120.
全世界约有20亿人感染过乙型肝炎病毒(HBV),其中3.5~4.0亿人转变为慢性HBV携带者,每年有50~120万人死于HBV相关肝硬化(LC)和肝癌[1]。目前,HBV持续感染的机制尚不完全清楚,但有研究表明,其与宿主的病毒特异性细胞免疫缺陷有关,这可能是慢性HBV感染者不能得到有效治疗的一个重要原因[2]。HBV特异性的CD4+T淋巴细胞和CD8+T细胞在HBV感染中发挥了重要作用[3-4]。辅助性T淋巴细胞17(T helper cell 17,Th17)和调节性T淋巴细胞(T regulatory cell,Treg)是近年来新发现的两个CD4+T细胞亚群,正常情况下,机体内的Th17/Treg处于相对稳定的免疫平衡状态[5]。Th17/Treg失衡与HBV感染相关肝脏疾病的病情变化和临床转归有关[6]。本研究分析慢性HBV感染者外周血Th17和Treg的变化及Th17/Treg平衡状态,探讨Th17/Treg平衡在慢性HBV感染疾病发展过程中的可能作用,为进一步了解HBV感染相关肝脏疾病的免疫学发病机制及 HBV感染慢性化、疾病进展的机制提供理论依据。
1资料与方法
1.1一般资料选取2013年11月—2015年12月昆明医科大学第一附属医院诊治的慢性HBV感染者142例为研究对象,其中慢性无症状HBV(chronic asymptomatic HBV carrier,ASC)携带者23例(ASC组)、慢性乙型肝炎(chronic hepatitis B,CHB)患者51例(CHB组)、乙型肝炎LC患者37例(LC组)、乙型肝炎相关性肝细胞癌(HBV-related hepatocellular carcinoma,HCC)患者31例(HCC组)。同期选取本院体检健康者26例为正常对照组。纳入标准:(1)患者发病前均未行抗病毒治疗;(2)患者均符合中华医学会肝脏疾病学会分会与感染病学分会2010年联合修订的《慢性乙型肝炎防治指南》[1]和2009年制订的原发性肝癌诊断标准[7]。排除标准:(1)其他肝炎病毒感染患者;(2)酒精性肝炎、自身免疫性肝炎等非病毒性肝炎患者;(3)其他严重的全身性疾病患者。本研究已通过本院伦理委员会同意,研究对象均知情同意。5组研究对象性别比较,差异无统计学意义(P>0.05);而年龄比较,差异有统计学意义(P<0.05,见表1)。
1.2研究方法
1.2.1标本采集用含肝素钠的抗凝管采集研究对象外周静脉血约5 ml,混匀,待用。
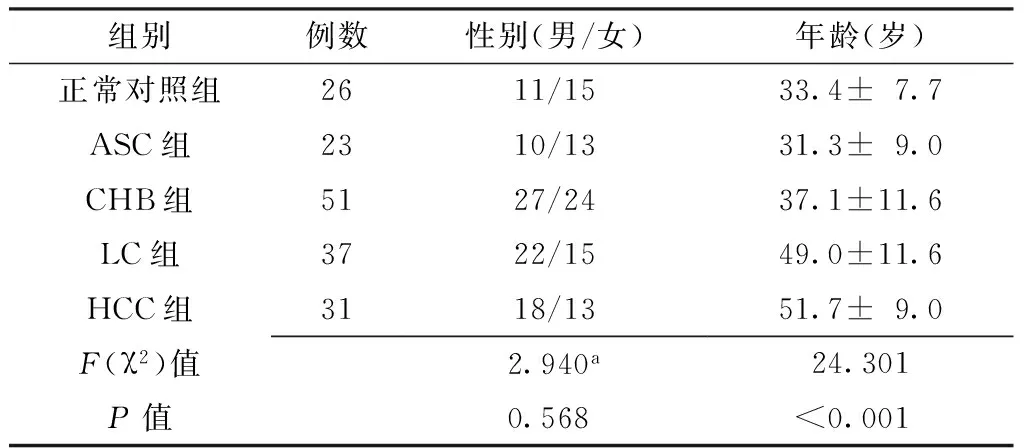
表1 5组一般资料比较
注:a为χ2值,ASC=慢性无症状乙型肝炎病毒,CHB=慢性乙型肝炎,LC=肝硬化,HCC=乙型肝炎相关性肝细胞癌
1.2.2外周血中Th17及Treg的培养及测定
1.2.2.1外周血细胞体外刺激培养将上述采集的含肝素钠抗凝管中的外周静脉血混匀,取300 μl加入容量为15 ml离心管中,取含10%胎牛血清的PRMI 1640培养基900 μl于上述离心管中,依次加入蛋白酶抑制剂(Protein Transport Inhibitor)0.8 μl、浓度为1 μg/ml的离子霉素(Ion)1.2 μl、浓度为50 ng/ml的佛波酯(PMA)1.2 μl,用巴氏吸管吹打混匀,将离心管中液体移入T25培养瓶中,将T25培养瓶移至温度为37 ℃、浓度为5% CO2恒温培养箱中培养10 h。试验过程应严格按照无菌操作。
1.2.2.2流式细胞术测定外周血Th17、Treg表达率将培养后的外周血细胞移至2 ml EP管内,以3 000 r/min离心7 min(离心半径10.5 cm);弃上清液,保留沉淀,加入Human Foxp3 Buffer A(按10×BufferA:dH2O=1∶9配备)(稀释1×)1 500 μl,充分混匀,避光保存20 min后以4 000 r/min离心7 min(离心半径10.5 cm);弃上清液,保留沉淀,加入(1×)磷酸盐缓冲液(PBS)1 000 μl,混匀后以4 000 r/min离心7 min(离心半径10.5 cm);弃上清液,保留沉淀,加入Human Foxp3 Buffer C (按Buffer B:1×Bufer A=1∶50配备)500 μl,充分混匀,避光保存30 min后以4 000 r/min离心7 min(离心半径10.5 cm);弃上清液,保留沉淀,加入(1×)PBS 1 000 μl,混匀后以4 000 r/min离心7 min(离心半径10.5 cm);弃上清液,保留沉淀,再次加入(1×)PBS 1 000 μl,混匀后以4 000 r/min离心7 min(离心半径10.5 cm);弃上清液,保留沉淀,加入(1×)PBS 50 μl和Human Th17/Treg Phenotyping Cocktail 4 μl,充分混匀,避光保存40 min后加入(1×)PBS 500 μl,以4 000 r/min离心7 min(离心半径10.5 cm);弃上清液,保留沉淀,加入(1×)PBS 350 μl,混匀后移入流式细胞管中上机测定外周血Th17、Treg表达率,计算Th17/Treg比值。
1.2.3血清HBV-DNA载量测定采用反转录聚合酶链式反应(RT-PCR)法测定患者血清HBV-DNA载量。RT-PCR检测系统(FQD-33A型)及试剂均由深圳市匹基生物工程股份有限公司提供,操作过程严格按照说明书进行。最终将血清HBV-DNA载量进行对数转换后进行比较。
1.2.4肝功能测定采用全自动生化分析仪测定丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBIL)水平,操作严格按照说明书进行。

2结果
2.15组外周血Th17、Treg表达率及Th17/Treg比值比较5组外周血Th17、Treg表达率及Th17/Treg比值比较,差异均有统计学意义(P<0.05)。CHB组、LC组、HCC组外周血Th17、Treg表达率均高于正常对照组和ASC组,差异有统计学意义(P<0.05);LC组外周血Th17表达率高于CHB组,HCC组外周血Th17表达率低于CHB组和LC组,差异有统计学意义(P<0.05);HCC组外周血Treg表达率高于CHB组和LC组,差异有统计学意义(P<0.05);HCC组外周血Th17/Treg比值低于正常对照组、CHB组、LC组,差异有统计学意义(P<0.05,见表2)。2.24组患者血清HBV-DNA载量比较4组患者血清HBV-DNA载量比较,差异有统计学意义(P<0.05)。CHB组、LC组、HCC组患者血清HBV-DNA载量均低于ASC组,差异有统计学意义(P<0.05,见表3)。2.35组ALT、AST、TBIL水平比较5组ALT、AST、TBIL水平比较,差异均有统计学意义(P<0.05)。CHB组、LC组、HCC组患者ALT、AST、TBIL水平均高于正常对照组和ASC组,差异有统计学意义(P<0.05);正常对照组与ASC组ALT、AST、TBIL水平比较,差异无统计学意义(P>0.05);LC组ALT、TBIL水平高于CHB组,差异有统计学意义(P<0.05);HCC组ALT水平低于CHB组和LC组,AST水平高于CHB组和LC组,TBIL水平低于LC组,差异有统计学意义(P<0.05,见表4)。
2.45组外周血Th17表达率、Treg表达率、Th17/Treg比值与ALT、AST、TBIL水平的相关性分析CHB组Th17表达率与ALT、AST和TBIL呈正相关,Th17/Treg比值与ALT、AST水平呈正相关(P<0.05);LC组Th17表达率与ALT水平呈正相关,Treg表达率与ALT、AST水平呈正相关(P<0.05)。其余各指标间无直线相关关系(P>0.05,见表5)。
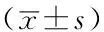
Table 2Comparison of the expression rates of Th17 and Treg and Th17/Treg among the 5 groups
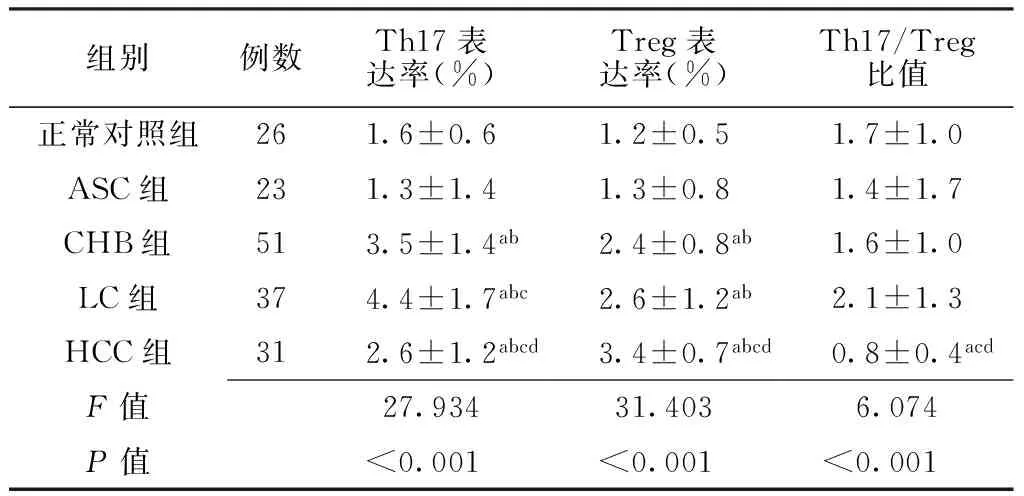
组别例数Th17表达率(%)Treg表达率(%)Th17/Treg比值正常对照组261.6±0.61.2±0.51.7±1.0ASC组231.3±1.41.3±0.81.4±1.7CHB组513.5±1.4ab2.4±0.8ab1.6±1.0LC组374.4±1.7abc2.6±1.2ab2.1±1.3HCC组312.6±1.2abcd3.4±0.7abcd0.8±0.4acdF值27.93431.4036.074P值<0.001<0.001<0.001
注:Th17=辅助性T淋巴细胞17,Treg=调节性T淋巴细胞;与正常对照组比较,aP<0.05;与ASC组比较,bP<0.05;与CHB组比较,cP<0.05;与LC组比较,dP<0.05
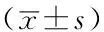
表3 4组患者血清HBV-DNA载量比较
注:HBV=乙型肝炎病毒;与ASC组比较,aP<0.05;b为经对数转换所得
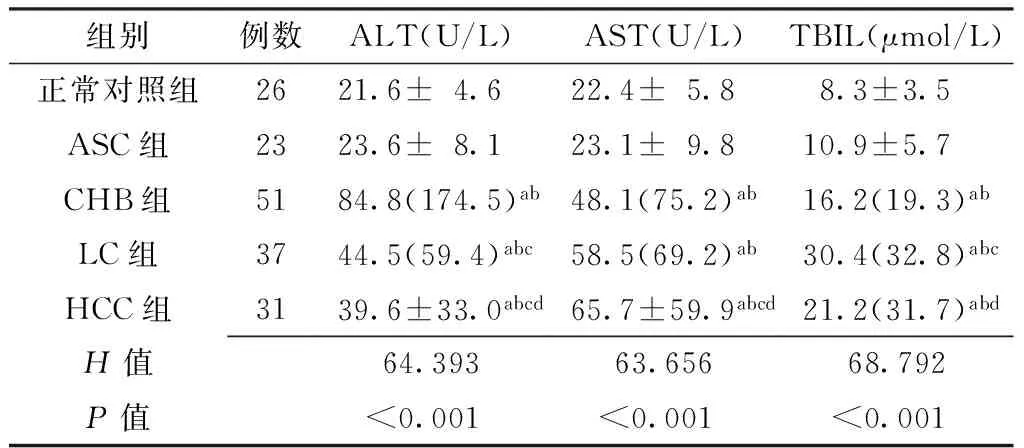
表4 5组ALT、AST、TBIL水平比较
注:ALT=丙氨酸氨基转移酶,AST=天冬氨酸氨基转移酶,TBIL=总胆红素;与正常对照组比较,aP<0.05;与ASC组比较,bP<0.05;与CHB组比较,cP<0.05;与LC组比较,dP<0.05
3讨论
目前,关于HBV感染相关肝脏疾病的致病机制尚未完全阐明,但大多数研究认为,其与机体的免疫功能紊乱密切相关[7-9]。人体感染HBV后,机体自身免疫状态是决定其转归的关键因素之一,大多数的慢性HBV感染患者是在自身的免疫缺陷、HBV基因突变逃避免疫清除等情况下形成的[10]。传统研究认为,HBV感染相关肝脏疾病的免疫紊乱主要与CD4+T淋巴细胞Th1、Th2有关[11]。近年来研究发现,除了Th1、Th2外,另一对CD4+T细胞——Th17和Treg在HBV感染中也发挥重要的作用[12]。在正常人体内,Th17、Treg表达率相对较低,其分化受体内代谢环境的影响,但Th17/Treg保持相对稳定[13]。由Th17产生的特异性白介素(IL)-17A与机体的自身免疫性疾病、肿瘤、宿主的抗病原微生物反应密切相关,IL-17F主要与宿主黏膜免疫有关[14-15]。Treg能分泌IL-4、IL-10、转化生长因子β(TGF-β)等多种细胞因子,主要介导免疫耐受,也与自身免疫性疾病、肿瘤、移植免疫等密切相关[16-17]。HBV感染后,在患者体内随着病情进展,Th17与Treg也可能存在动态演变过程。
表55组受试者外周血Th17表达率、Treg表达率、Th17/Treg比值与ALT、AST、TBIL的相关性分析(r值)
Table 5Correlation analysis between the expression rates of Th17 and Treg and Th17/Treg and ALT,AST and TBIL in the subjects of the 5 groups
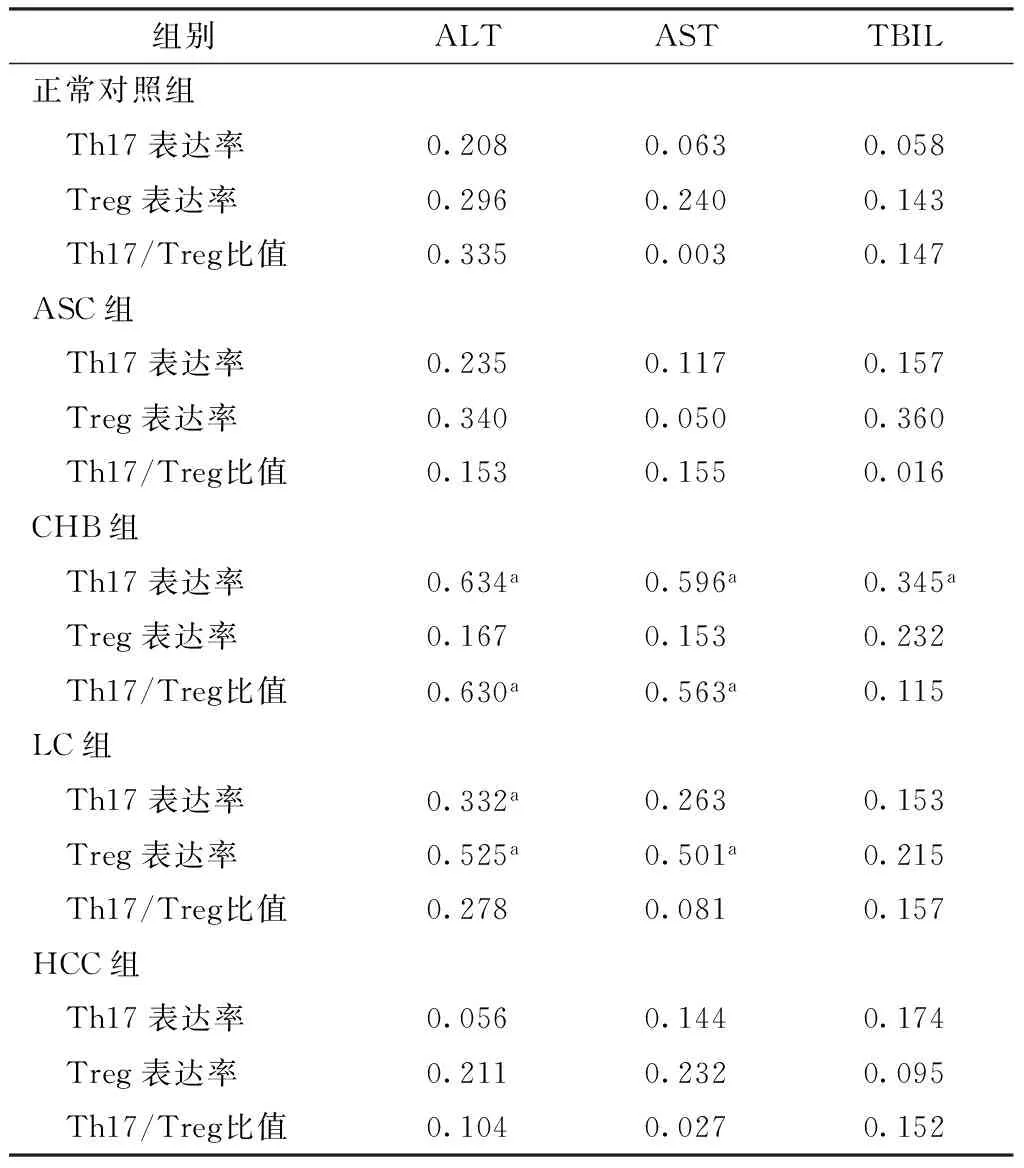
组别ALTASTTBIL正常对照组 Th17表达率0.2080.0630.058 Treg表达率0.2960.2400.143 Th17/Treg比值0.3350.0030.147ASC组 Th17表达率0.2350.1170.157 Treg表达率0.3400.0500.360 Th17/Treg比值0.1530.1550.016CHB组 Th17表达率0.634a0.596a0.345a Treg表达率0.1670.1530.232 Th17/Treg比值0.630a0.563a0.115LC组 Th17表达率0.332a0.2630.153 Treg表达率0.525a0.501a0.215 Th17/Treg比值0.2780.0810.157HCC组 Th17表达率0.0560.1440.174 Treg表达率0.2110.2320.095 Th17/Treg比值0.1040.0270.152
注:a表示P<0.05
本研究发现,CHB组、LC组、HCC组外周血Th17、Treg表达率均高于正常对照组和ASC组,LC组外周血Th17表达率高于CHB组,HCC组外周血Th17表达率低于CHB组和LC组,HCC组外周血Treg表达率高于CHB组和LC组,HCC组外周血Th17/Treg比值低于正常对照组、CHB组、LC组。以上结果说明感染HBV后,患者Th17和Treg可能均被激活,但激活程度不同,在病程进展过程中,Th17/Treg比值减小,提示可能是Treg的高度分化,抑制了机体对HBV的免疫清除,造成不可逆转的肝脏损害。
慢性HBV感染的自然病程一般分为免疫耐受期、免疫清除期、低复制期和再活跃期。肝细胞病变主要取决于机体的免疫应答。免疫应答既可以导致肝细胞损伤,又可清除病毒,甚至可诱导病毒的变异。当机体处于免疫耐受状态时,不发生免疫应答,多成为慢性无症状携带者。CHB的发生、发展与血清HBV-DNA载量、肝细胞功能及宿主的免疫状态相关,HBV并不能直接损伤肝细胞,肝细胞的损伤主要是由机体的免疫应答引起。当进入免疫清除期时,机体的免疫应答一方面可以清除HBV,另一方面可以造成肝细胞的损伤,表现为肝功能指标(ALT、AST、TBIL)的升高而血清HBV-DNA载量下降[18]。本研究发现,CHB组血清HBV-DNA载量较ASC组下降,ALT、AST、TBIL水平较正常对照组、ASC组升高,本研究结果与邹晓毅等[18]研究结果相似。
本研究还发现,CHB组Th17表达率与ALT、AST和TBIL呈正相关,Th17/Treg比值与ALT、AST水平呈正相关,LC组Th17表达率与ALT水平呈正相关,Treg表达率与ALT、AST水平呈正相关,提示Th17、Treg与肝功能相关。
LC的形成与肝星形细胞(hepatic stellatecell,HSC)密切相关,HSC在TGF-β的作用下能分泌多种细胞外基质(extracellular matrix,ECM),ECM在肝脏内过度沉积使肝脏结构发生改变,出现肝纤维化、LC。Treg可以通过分泌TGF-β作用于HSC,刺激HSC分泌ECM[19-20];同时Th17通过分泌IL-17作用于HSC表面的IL-17R,使HSC活化并分泌IL-6、IL-23等细胞因子促使TGF-β、肿瘤坏死因子α(TNF-α)表达增加,抑制自然杀伤细胞对HSC的杀伤作用而增强其纤维化作用[21]。HBV感染与HCC的发生关系密切,现在认为,HBV可与肝细胞内的人染色体整合,整合后的肝细胞受到刺激后容易发生各种转化。其中,HBV的X蛋白和截断的前S2/S多肽作为增强子可反式激活各种细胞因子,促进已整合的肝细胞转化,促进HCC的发生[22]。大部分HCC发生在HBV感染的晚期,尤以LC基础上发生多见,通常伴有炎症活动,但是也有少部分与HBV感染相关肝细胞癌患者并无LC的证据,甚至其肝功能可一直正常。
免疫反应引起的慢性炎症与肿瘤发生发展过程密切相关。Th17可以通过分泌IL-17促进Th1分化和诱导细胞毒性T淋巴细胞(CTL)活化,发挥抗肿瘤作用[23];另一方面,Th17可以促进一些血管因子如CXCL1、CXCL5、IL-8的生成,对肿瘤的生长和转移有促进作用[24]。目前,Th17在HCC中的作用尚不清楚,考虑到CHB组和LC组Th17表达率、Th17/Treg比值较HCC组高,推测患者由肝炎发展到LC,再由LC发展到HCC,可能是从一个由炎症主导的过程发展到一个由免疫抑制主导的过程。
综上所述,Th17和Treg在慢性HBV感染相关肝脏疾病的发生、发展过程中发挥着重要作用,Th17/Treg失衡可能与CHB病程进展密切相关,故Th17/Treg比值可作为检测CHB病情的一个指标,同时调节Th17和Treg的平衡关系可能成为治疗CHB、LC的一个新策略;Th17、Treg与CHB患者的HBV-DNA间并无相关性,说明Th17、Treg本身并不能影响HBV的复制。由于肿瘤发生发展的特殊性及复杂性,Th17、Treg与HCC间的相互关系目前尚不清楚,需更进一步的研究。
作者贡献:娄鸣负责试验实施和论文撰写;游晶负责试验设计和实施;陈红英、涂琛、丁洁、靳智负责试验实施、资料收集;刘怀鄂负责质量控制与论文结构完善及修改。
本文无利益冲突。
参考文献
[1]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].中华肝脏病杂志,2011,19(1):13-24.
[2]Webster GJ,Reignat S,Brown D,et al.Longitudinal analysis of CD8+T cells specific for structural and nonstrucral hepatitis B virus proteins with chronic hepatitis B:implications of immunotherapy[J].J Virol,2004,78(11):5707-5719.
[3]Boni C,Fisicaro P,Valdatta C,et al.Characterization of hepatitis B virus(HBV)-specific T cell dysfunction in chronic HBV infection[J].J Virol,2007,81(8):4215-4225.
[4]Sobao Y,Tomiyama H,Sugi K,et al.The role of hepatitis B virus specific memory CD8T cell in the control of viral replication[J].J Hepatal,2002,36(1):105-115.
[5]Chen Z,Laurence A,Kanno Y,et al.Selective regulatory function of Socs3 in the formation of IL-17-secreting T cells[J].Proc Natl Acad Sci U S A,2006,103(21):8137-8142.
[6]Li J,Qiu SJ,She WM,et al.Significance of the balance between regulatory T(Treg) and T helper 17(Th17) cells during hepatitis B virus related liver fibrosis[J].PLoS Qne,2012,7(6):e39307.
[7]中国抗癌协会肝癌专业委员会,中国抗癌协会临床肿瘤学协作专业委员会,中华医学会肝病学分会肝癌学组.原发性肝癌规范化诊治的专家共识[J].肿瘤,2009,29(4):295-304.
[8]陈国民.乙型肝炎免疫发病机制的再认识[C].第九届全国肝脏疾病临床学术大会论文汇编,成都,2014:146.
[9]Yu XJ,Wang GQ.Immunotherapy for chronic hepatitis B virus infections[J].World Chinese Journal of Digestology,2007,15(16):1835-1840.(in Chinese)
于贤杰,王贵强.慢性HBV感染的免疫治疗[J].世界华人消化杂志,2007,15(16):1835-1840.
[10]Busch K,Thimme R.Natural history of chronic hepatitis B virus infection[J].Med MicrobiolImmunol,2015,204(1):5-10.
[11]Yang PL,Althage A,Chung J,et al.Immune effectors required for hepatitis B virus clearance[J].Proc Natl Acad Sci U S A,2010,107(2):798-802.
[12] Niu Y,Liu H,Yin D,et al.The balance between intrahepatic IL-17(+) T cells and Foxp3(+) regulatory T cells plays an important role in HBV-related end-stage liver disease[J].BMC Immunol,2011,12(1):1-8.
[13]Barbi J,Pardoll D,Pan F.Metabolic control of the Treg/Th17 axis[J].Immunol Rev,2013,252(1):52-77.
[14]Iwakura Y,Ishigame H,Saijo S, et al.Functional specialization of interleukin-17 family members[J].Immunity,2011,34(2):149-162.
[15] Tang Y,Bian Z,Zhao L,et al.Interleukin-17 exacerbates hepatic steatosis and inflammation in non-alcoholic fatty liver disease[J].Clin Exp Immunol,2011,166(2):281-290.
[16]Tagliamonte M,Petrizzo A,Napolitano M,et al.Novel metronomic chemotherapy and cancer vaccine combinatorial strategy for hepatocellular carcinoma in a mouse model[J].Cancer ImmunolImmunother,2015,64(10):1305-1314.
[17]Taubert R,Hardtke-Wolenski M,Noyan F,et al.Intrahepatic regulatory T cells in autoimmune hepatitis are associated with treatment response and depleted with current therapies[J].J Hepatol,2014,61(5):1106-1114.
[18]邹晓毅,姚云清.机体清除乙型肝炎病毒免疫机制研究新进展[J].国外医学:病毒学分册,2005,12(2):42-45.
[19]B mmel FV,Berg T.Treatment of HBV related cirrhosis[J].Liver Int,2013,33(Supplement S1):176-181.
[20]Li J,Jia M,Liu Y, et al.Telbivudine therapy may shape CD4(+) T-cell response to prevent liver fibrosis in patients with chronic hepatitis B[J].Liver Int,2015,35(3):834-845.
[21]Wang GQ,Ding YP,Dong YH.Telbivudine treatment is associated with high hepatitis B e antigen seroconversion and immune modulatory effects in chronic hepatitis B patients[J].J Viral Hepat,2013,20(Suppl 1):9-17.
[22]Huang Y,Wang F,Wang Y,et al.Intrahepatic IL-17+T cells and FoxP3+Treg cooperate to promote development and affect the prognosis of hepatocellular carcinoma[J].J Gastroenterol Hepatol,2014,29(4):851-859.
[23]Huang Y,Wang FM,Wang T,et al.Tumor-infiltrating FoxP3+Tregs are associated with CD34expression and prognosis of hepatocellular carcinoma[J].Chinese Journal of Hepatology,2012,20(1):25-29.(in Chinese)
黄勇,王凤梅,王涛,等.癌组织浸润的FoxP3+调节性T淋巴细胞与CD34表达及肝癌患者的预后相关[J].中华肝脏病杂志,2012,20(1):25-29.
[24] Lin ZW,Wu LX,Xie Y,et al.The expression levels of transcription factors T-bet,GATA-3,RORγt and FOXP3 in peripheral blood lymphocyte(PBL) of patients with liver cancer and their significance[J].Int J Med Sci,2015,12(1):7-16.
(本文编辑:李婷婷)
Changes of Peripheral Th17 and Treg and Th17/Treg Balance in Patients With Chronic Hepatitis B Virus Infection
LOUMing,YOUJing,LIUHuai-e,etal.
DepartmentofInfectiousDisease,theFirstAffiliatedHospitalofKunmingMedicalUniversity,Kunming650032,China
【Abstract】ObjectiveTo investigate the changes of peripheral Th17 and Treg and Th17/Treg balance in patients with chronic hepatitis B virus(HBV)infection,and to explore the possible role in the development of chronic HBV infection.MethodsFrom November 2013 to December 2015,we enrolled 142 patients with chronic hepatitis B virus infection who received treatment in the First Affiliated Hospital of Kunming Medical University.Among them,there were 23 patients with chronic asymptomatic HBV carrier(ASC group),51 patients with chronic hepatitis B(CHB group),37 patients with HBV-related liver cirrhosis(LC group),and 31 patients with HBV-related hepatocellular carcinoma(HCC group).In the same period,26 healthy people were enrolled in the hospital as normal control group.Flow cytometry was used to determine the expression rates of peripheral Th17 and Treg and Th17/Treg.RT-PCR was employed to determine HBV-DNA load,and fully automatic biochemical analyser was employed to detect ALT,AST and TBIL.ResultsCHB group,LC group and HCC group were higher than normal control group and ASC group in the expression rates of peripheral Th17 and Treg(P<0.05);LC group was higher than CHB group in the expression rate of peripheral Th17,and HCC group was lower than CHB group and LC group in the expression rate of peripheral Th17(P<0.05);HCC group was higher than CHB group and LC group in the expression rate of Treg(P<0.05);HCC group was lower than normal control group,CHB group and LC group in peripheral Th17/Treg(P<0.05).CHB group,LC group and HCC group were lower than ASC group in serum HBV-DNA load(P<0.05).CHB group,LC group and HCC group were higher than normal control group and ASC group in the levels of ALT,AST and TBIL(P<0.05);LC group was higher than CHB group in the levels of ALT and TBIL(P<0.05);HCC group was lower in ALT level and higher in AST level than CHB group and LC group,and HCC group was lower than LC group in TBIL level(P<0.05).In CHB group,the expression rate of Th17 was positively correlated with the levels ALT,AST and TBIL,and Th17/Treg was positively correlated with the levels of ALT and AST(P<0.05);in LC group,the expression rate of Th17 was positively correlated with ALT level,and the expression rate of Treg was positively correlated with the levels of ALT and AST(P<0.05);there was no other linear correlation(P>0.05).ConclusionTh17 and Treg play an important role in the occurrence and development of chronic HBV infection related liver disease,and the imbalance of Th17/Treg may be closely correlated with the progress of chronic hepatitis B,which providesa basis for further clinical research.
【Key words】Hepatitis B virus;Hepatitis B,chronic;T-lymphocytes,helper;T-lymphocytes,regulatory
基金项目:云南省科技计划项目(2011WS0053;2011FZ121;2012WS0028);云南省教育厅基金项目(2013J053)
通信作者:游晶,650032 云南省昆明市,昆明医科大学第一附属医院感染科;E-mail:jingyoukm@126.com
【中图分类号】R 512.62
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.18.001
(收稿日期:2016-02-22;修回日期:2016-04-25)
·专题研究·
【编者按】乙型肝炎是由乙型肝炎病毒(HBV)感染肝脏引起的对生命有潜在危害的疾病,是重要的全球健康问题。中华人民共和国国家卫生和计划生育委员会发表声明称,我国已成为全球为乙型肝炎、肝硬化和肝癌付出最多社会成本的国家。全球3.5亿的HBV携带者中我国有近1亿,且在全球每年约70万人的病毒性肝炎相关死亡人群中,我国占近50%。因此,不论是从急性传染病角度还是从慢性肝脏疾病角度,HBV感染及其导致的慢性肝脏疾病及肝纤维化均是我国高度关注的问题。为此,本期特别邀请昆明医科大学第一附属医院感染科主任游晶教授组织了关于HBV感染的相关肝脏疾病及抗病毒治疗与T淋巴细胞免疫间关系的“专题研究”,以期为临床关于乙型肝炎的研究与防治提供参考。
