藏药绿绒蒿的质量标准研究
2016-07-18次仁旺姆
次仁旺姆
【摘 要】 目的:建立三种藏药绿绒蒿的质量标准。方法:考察药材基源;采用显微和薄层色谱法对样品进行鉴别;采用高效液相色谱法测定木犀草素的含量:Waters Xselect C18 (250mm × 4.6mm,5μm);流动相:甲醇-0.2%磷酸水溶液(55∶45);检测波长:350nm;进样量10μl,流速为1.0ml/min。结果:将绿绒蒿的植物基源规定为罂粟科植物全缘绿绒蒿M.Integrifolia (Maxim.)Franch.、毛瓣绿绒蒿M. torquata Prain.及五脉绿绒蒿 M. quintuplinervia Regel的干燥全草,并进行薄层检测及含量测定;木犀草素线性范围为32.811~656.280μg,R2=1,方法回收率为94.86%,RSD为1.27%。结论:制定了藏药绿绒蒿的质量标准,为该品种的质量控制提供了参考依据。
【关键词】 绿绒蒿;高效液相色谱法;薄层色谱;木犀草素
【中图分类号】R29 【文献标志码】 A【文章编号】1007-8517(2016)11-0001-03
绿绒蒿为藏族习用药材,收载于《中华人民共和国卫生部药品标准·藏药》第一册[1]。藏药绿绒蒿具有清热,利尿,消炎,止痛等作用,用于治疗肺炎,肝炎,肝与肺的热症,水肿。在《中华人民共和国卫生部药品标准·藏药》第一册上只有其性状和显微鉴别,无其他检测项目,检测方法有限,且植物的基源有些混用。对绿绒蒿质量控制方法进行研究,以建立能有效控制其质量的药材标准。
1 仪器与材料
1.1 仪器 Spectra system液相色谱仪(Waters公司;Mettler XP205型电子天平(精密度为十万分之一);Mettler XP504电子天平(精密度为万分之一)。
1.2 材料 木犀草素对照品(批号:111520-200504,中国生物制品检定所);对照药材(取自西藏药检所标本室,经格桑索朗主任药师鉴定为全缘绿绒蒿)。乙腈、甲醇为色谱纯,水为纯净水,其它试剂为分析纯。10批绿绒蒿药材为各地采集或收集。见表1。
2 方法与结果
2.1 基源 卫生部颁《药品标准》藏药中,绿绒蒿为罂粟科植物全缘绿绒蒿Meconopsis integrifolia (Maxim.) Franch.及五脉绿绒蒿M.quintuplinervia Regel、长叶绿绒蒿M.Lancifolia Franch.等的干燥全草。
据本课题组在西藏,青海和云南等地实际样品采集过程中发现绿绒蒿药用来源主要为全缘绿绒M.integrifolia (Maxim.) Franch.及五脉绿绒蒿M.quintuplinervia Regel。后经文本考证[2-4],长叶绿绒蒿主要分布于东北和华北地区,藏医临床较少用。西藏藏医临床使用较多为全缘绿绒蒿及毛瓣绿绒蒿,青海、云南等藏医临床使用较多为五脉绿绒蒿。故将绿绒蒿的植物基源规定罂粟科植物全缘绿绒蒿M.Integrifolia (Maxim.)Franch.、毛瓣绿绒蒿M.torquata Prain.及五脉绿绒蒿M.quintuplinervia Regel的干燥全草。
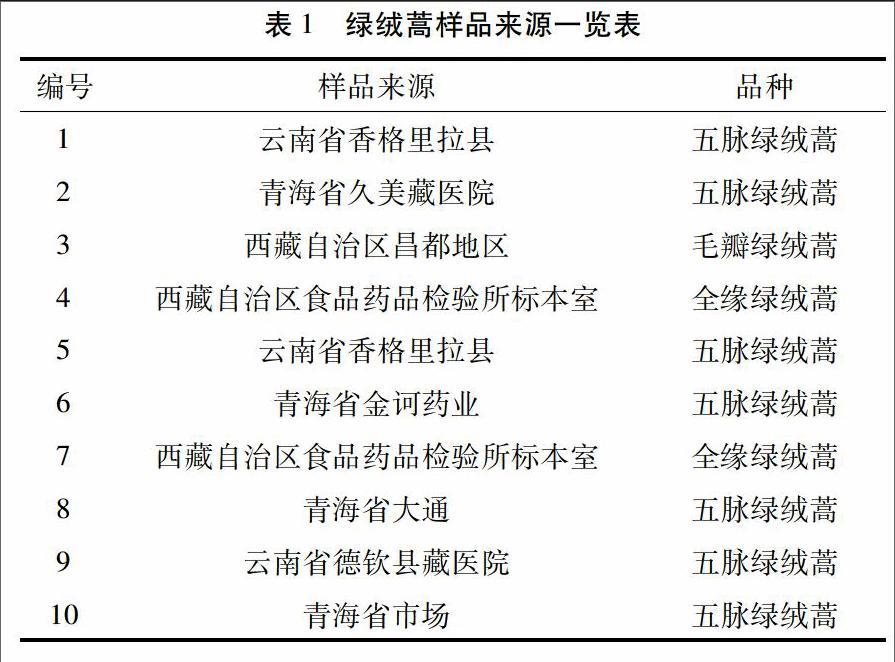
2.2 显微鉴别 采用常规生药鉴定方法,分别对上述样品粉末制片观察并对其进行了显微照相。主要特征如下:
2.2.1 全缘绿绒蒿 粉末呈浅橙黄色。表皮毛多见,多细胞组成,碎断,呈柱状,基部至顶端多分枝,顶细胞尖,直径约至45μm,可见圆形壁孔。导管较多见,直径约至15μm,单个,或数个结合,多碎断,具梯纹、网纹、纹孔排列整齐。花粉粒多见,圆球形,直径80μm,棕黄色,壁较厚,表明梳稀疣状突起。见图1。
2.2.2 五脉绿绒蒿 粉末灰绿色。表皮毛多见,多细胞组成,碎断,呈柱状,基部至顶端多分枝,顶细胞尖,直径约至75μm,可见圆形壁孔。导管多螺纹,亦见网纹及环纹,直径约至15μm。花粉粒多见,圆球形,直径约至50μm,棕黄色,壁薄,表明纹理状。气孔不定式,副卫细胞4~5个。
2.2.3 毛瓣绿绒蒿 粉末浅绿色。表皮毛多见,多细胞组成,碎断,呈柱状,基部至顶端多分枝,顶细胞尖,直径约至75μm,长至750μm,可见圆形壁孔。导管多为螺纹和梯纹,直径约至15μm。花粉粒多见,圆球形,直径约至50μm,棕黄色,壁较厚,表明紧密疣状突起。气孔不定式,副卫细胞4~5个。
2.3 薄层色谱鉴别
2.3.1 供试品溶液的制备 取本品粉末约2.0g,精密称定,置具塞锥形瓶中,精密加入甲醇20ml,密塞,超声处理(功率200 W,频率40kHz)两次,每次30min,过滤,合并滤液,浓缩并定容至10ml,即得。
2.3.2 对照药材溶液的制备 另取绿绒蒿对照药材1g,同法制成对照药材溶液。
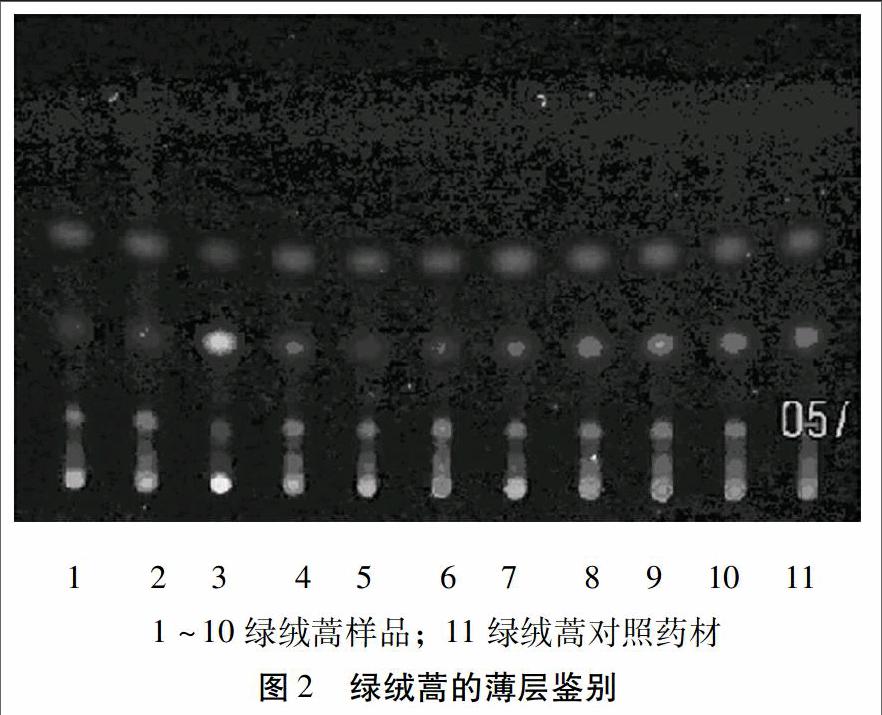
2.3.3 薄层色谱法 按照2010版中国药典一部附录VI B试验,吸取上述两种溶液各5μl,分别点于同一羧甲基纤维素钠溶液制备的硅胶G薄层板上。以环己烷-醋酸乙酯(6∶1)为展开剂,展开,取出,晾干。置紫外光灯(365 nm)下检视,供试品色谱中,在与对照药材色谱相应位置上显相同颜色的荧光斑点。见图2。
3 含量测定
3.1 色谱条件 色谱柱:Waters Xselect C18 (250 mm × 4.6 mm, 5μm);流动相:甲醇-0.2%磷酸水溶液(55∶45);检测波长:350nm;进样量10μl;流速为1.0ml/min;用紫外检测器检测。在此条件下,木犀草素和其它组分均能达到基线分离。供试品中木犀草素保留时间与对照品一致。见图3。
3.2 供试品溶液的制备 取本品粉末约2.0g,精密称定,置具塞锥形瓶中,精密加入甲醇20ml,密塞,超声处理(功率200W,频率40kHz)两次,每次30min,过滤,合并滤液,浓缩并定容至10ml,用0.45μm微孔滤膜过滤,取续滤液,即得。
3.3 对照品溶液的制备 取木犀草素对照品适量,精密称定,加甲醇制成每1ml含30μg的溶液,即得。
3.4 线性范围的考察 精密吸取对照品溶液各1、2、4、8、16、20μl,注入液相色谱仪,记录色谱图,测定其峰面积,并以峰面积为纵坐标,木犀草素量(μg)为横坐标进行线性回归,得回归方程Y=4021.6X+7903.7,R2=1(n=6)。结果表明:木犀草素在32.811~656.280μg之间与峰面积线性关系良好。见图4。
3.5 精密度试验 精密吸取对照品溶液(32.814μg/ml )10μl,注入液相色谱仪,共6次,记录色谱图,6次测定值的相对标准偏差低于2%,表明该方法精密度良好。
3.6 稳定性实验 将新配制的供试品溶液,在上述色谱条件下在0、1、3、8、15、24h测定测得木犀草素的峰面积,计算其RSD。结果表明:在24h内,该方法具有较好的稳定性。见表2。
3.7 加样回收试验 取已知含量的供试品(木犀草素的含量为0.306mg/g)6份,分别精密加入对照品溶液(0.9115mg/ml)0.5ml,再照供试品溶液的制备法提取,按确定的测定方法进行测定,计算回收率。结果表明:平均回收率为94.86%,RSD为1.27%,表明该方法回收率良好。见表3。
3.8 样品测定 取所收集的10批样品, 按上述提取和色谱条件,对10批次的绿绒蒿进行了含量测定,求得各样品中木犀草素的含量。,见表6。
4 讨论
4.1 从供试品的测定结果可以看出,绿绒蒿中木犀草素含量相差10倍多,若按以木犀草素含量平均值下浮20%制定其含量下限,西藏、云南、青海三地的一半绿绒蒿都不合格,容易造成资源的浪费。为了很好的控制药物质量,保护药材资源,故规定绿绒蒿中木犀草素(C15H10O6)的含量暂定为:本品每克含木犀草素(C15H10O6)不得少于0.050mg。
4.2 在质量标准研究中,新增了【检查】项下的水分、总灰分和酸不溶性灰分的检查以及【浸出物】等项,在这里不再一一列出。
4.3 实验用的样品基源有罂粟科植物全缘绿绒蒿、毛瓣绿绒蒿及五脉绿绒蒿。经过研究发现这三种绿绒蒿在薄层鉴别和含量测定中,实验结果均一致,说明本质量标准研究适用于这三种绿绒蒿的检测。
4.4 经过反复的试验,薄层色谱行为的重现性良好,专属性强, Rf值适中,分离效果好,因此可以将此方法定为绿绒蒿药材的定性鉴别。
4.5 将木犀草素对照品甲醇溶液在200~400nm内进行全波长扫描,测得其在349.4nm 有最大吸收。且对照品色谱峰与其它峰达到良好的基线分离,杂质干扰少,峰形好。
参考文献
[1] 中国卫生部药典委员会.中华人民共和国卫生部药品标准[S].藏药(第一册).1995:98-99.
[2] 罗达尚,孙安玲,夏光成.青藏高原藏药-绿绒蒿属植物资源初探[J].中草药,1984,15 (8): 23-24.
[3] 杨永昌. 藏药志[M]. 西宁: 青海人民出版社,1991:465-468.
[4] 中华本草编委会.中华本草(藏药卷)[M].上海:上海科技出版社,2002:101-102;169.
(收稿日期:2016.03.29)
