杏鲍菇菌株的rDNA ITS序列鉴定和同工酶分析*
2016-07-18罗先群黄雪星
罗先群,黄雪星
(广西科学院生物研究所,广西南宁 530007)
杏鲍菇菌株的rDNA ITS序列鉴定和同工酶分析*
罗先群,黄雪星
(广西科学院生物研究所,广西南宁530007)
摘要:【目的】鉴于诱变处理后杏鲍菇菌株在栽培性状上的明显差异,对两株杏鲍菇菌株(杏A和杏B)进行分子水平上的鉴定,分析两者的差异性。【方法】对杏鲍菇菌丝体样本的rDNA基因内转录间ITS片段进行PCR扩增并测序验证;同时应用同工酶电泳对菌丝体的酯酶、过氧化物酶和超氧化物歧化酶进行分析。【结果】通过GenBank数据库搜索和序列比对分析,两株菌株ITS序列相似度达到99%;菌丝体的酯酶、过氧化物酶和超氧化物歧化酶同工酶电泳检测无差异。【结论】杏A和杏B菌株为同一菌株,在分子水平上差异不明显。
关键词:杏鲍菇同工酶rDNA ITS序列分析
0引言
【研究意义】本研究前期对杏鲍菇菌株进行诱变处理,处理后的杏鲍菇菌株子实体在形态、产量上与未处理的菌株存在明显差异。而传统的菌种鉴定主要通过对菌丝、菌落和子实体形态的宏观观察以及不同菌株间发生的拮抗反应等来进行,具有一定的局限性和主观性[1]。鉴于此,本研究对两株杏鲍菇菌株进行分子水平上的鉴定,分析两者的差异性。【前人研究进展】近年来,同工酶分子标记技术已被应用于真菌的分类鉴定、遗传育种和种群分化研究中,成为菌株分类、种质鉴定的重要手段[2]。另外,目前国内外开展 RAPD、rDNA 等多种分子标记技术研究香菇、黑木耳、双孢蘑菇、草菇等的种质资源评价和菌种鉴别[3-8],并取得显著成效。其中,真核生物rDNA基因内转录间ITS片段因其序列保守性和科、属、种水平上的特异性,被广泛应用于真菌系统发育学与分类鉴定等方面的研究中[9-12],张丹等[13]对中国7个毛木耳菌株rDNA ITS进行克隆测序,并将其与木耳属其他种的相应序列进行对比,发现ITS 序列分析适用于属内种间的分类鉴定。【本研究切入点】本研究从真核生物rDNA ITS片段以及同工酶的两方面入手,对两株杏鲍菇菌株进行分子技术方面的鉴定。【拟解决的关键问题】通过GenBank数据库搜索和序列比对分析两株菌株ITS序列相似度,同时对菌丝体进行同工酶电泳检测。
1材料与方法
1.1供试菌株
两株杏鲍菇菌株系本所保藏,编号杏A、杏B(图1)。
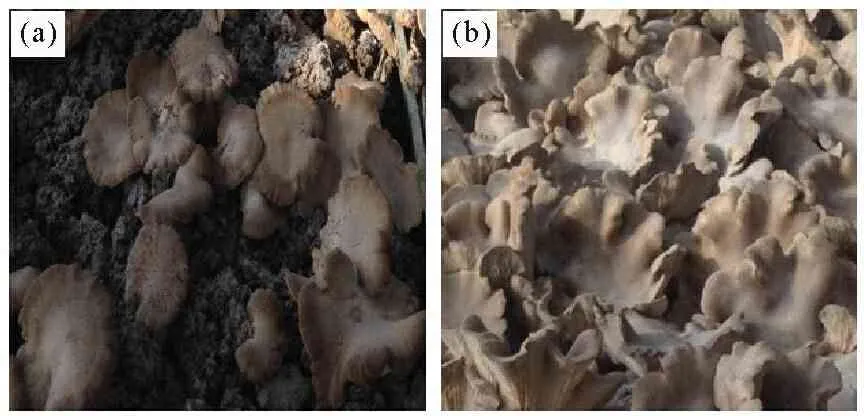
(a)对照菌株Control Pleurotus eryngii(杏A,Pleurotus eryngii A);(b)处理菌株Ultraviolet mutational breeding Pleurotus eryngii (杏B,Pleurotus eryngii B)
图1杏鲍菇
Fig.1Pleurotus eryngii
1.2方法
1.2.1ITS 序列鉴定
1.2.1.1总DNA提取
称取适量菌丝体样品,放入预冷研钵中,加入适量液氮研磨。将研磨粉末转移至无菌离心管中,采用CTAB法提取总DNA。
1.2.1.2样品rDNA ITS序列的PCR 扩增
所用引物如下:
ITS5:5′-GGAAGTAAAAGTCGTAACAAG-G-3′
ITS4:5′-TCCTCCGCTTATTGATATGC-3′
反应体系(50 μL):5 μL 10×Ex Taq Buffer,1 μL引物ITS5(10 μmol·L-1),1 μL ITS4(10 μmol·L-1),4 μL dNTPs(2.5 mmol·L-1),0.5 μL Ex Taq DNA聚合酶(5 U·μL-1,Takara),1 μL模板DNA(约50 ng),37.5 μL ddH2O。
反应程序:94℃预变性5 min;94℃变性1 min,60℃退火1 min,72℃延伸1 min,30个循环;最后,72℃延伸10 min。
1.2.1.3DNA纯化测序和分析
采用E.Z.N.A®.Cycle-Pure Kit(D6492,Omega Bio-Tek公司)纯化PCR 产物,纯化步骤参见试剂盒说明书,纯化后的PCR 产物送华大基因公司测序。
测得的ITS序列用Vector NTI 软件排序和Align分析,并通过BLAST进行同源序列比对。
1.2.2同工酶电泳
1.2.2.1同工酶提取
用无菌刮刀刮取0.5 g菌丝体,放置于预冷研钵中,加入适量液氮将菌丝体研磨至粉末状,并转移至无菌离心管中;加入0.5 mL Tris-HCl提取液,混匀,并于4℃,8 000 r/min条件下离心10 min,取上清液置于另一无菌离心管中,4℃保存备用。
1.2.2.2聚丙烯酰胺凝胶电泳(SDS-PAGE)
采用SDS-PAGE进行同工酶分析。SDS-PAGE(15%分离胶,W/V;4%浓缩胶,W/V;Tris-Gly缓冲液系统)电泳条件:上样量40 μL,浓缩胶区段电压为120 V,分离胶区段电压为180 V,4℃环境条件下电泳约4 h。
1.2.2.3染色
(1)酯酶
染色液配制:称取100 mg重氮固蓝,溶于5 mL丙酮中,再加入预先配制的1%(V/V)乙酸-α萘酯丙酮溶液1.5 mL和2%(V/V)乙酸-β萘酯丙酮溶液1.5 mL,最后用0.2 mol/L磷酸缓冲液(pH值为6.4)定容100 mL。使用前加入40%(V/V)甲醛0.5 mL,以降低凝胶的非特异性背景染色。
染色方法:预先用蒸馏水漂洗凝胶,然后放入染色液中,于37℃摇床保温震荡,待凝胶上显现酶带后停止染色,用7%(V/V)醋酸溶液漂洗凝胶2~3次,最后将凝胶保存于7%(V/V)醋酸溶液中。
(2)超氧化物歧化酶
染色液:A液,25 μmol/L NBT溶液;B液,用50 mmol/L,pH值为7.8的磷酸缓冲液(含1 mmol/L EDTA)配制成的0.01%(W/V)核黄素溶液。
染色方法:将凝胶置于A液中,室温下暗反应20 min;然后取出凝胶放入B液中于日光下曝光约20 min,直到凝胶显现出暗背景下的灰白色酶带,停止染色。
(3)过氧化物酶
染色液:C液,2%(W/V)联苯胺醋酸溶液;D液,4%(W/V)氯化铵溶液;E液,5%(W/V)EDTA-Na2溶液(pH值 6.0);F液,0.3%(V/V)H2O2溶液。其中,C液现用现配,D、E、F溶液在4℃条件下贮存备用。使用时按照C∶D∶E∶F∶水=1∶1∶1∶1∶8(V∶V∶V ∶V∶V)的比例配制成染色液,现配现用。
染色方法:预先用蒸馏水漂洗凝胶,然后放入染色液中,摇床震荡5 min,待凝胶上显现酶带后停止染色,用蒸馏水漂洗,保存于7%(V/V)醋酸溶液中。
2结果与分析
2.1ITS序列鉴定
杏A和杏B菌株的ITS序列经PCR扩增,产物约600 bp(图2)。从测序结果可知,扩增的杏A ITS片段长675 bp,杏B为672 bp。用Vector NTI 软件对ITS序列进行排序和Align分析,结果表明杏A和杏B菌株ITS序列相似度达到100%。
另外,ITS序列测定结果经GenBank数据库BLAST后,与数据库中HM561985、JX429941和DQ333235等杏鲍菇已有序列相似度达到99%。
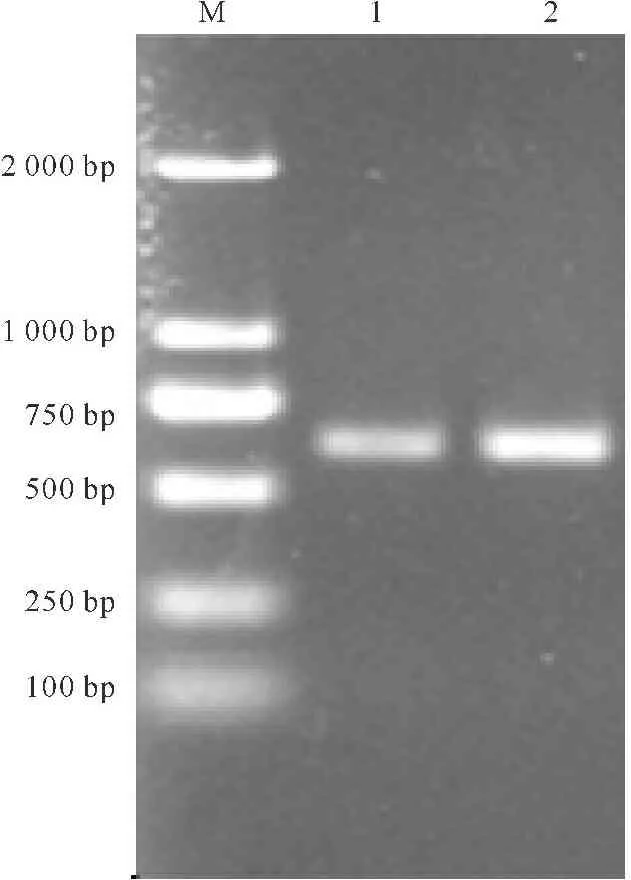
M:DL2000;1:杏A;2:杏B
M:DL2000;1:Pleurotus eryngii A;2:Pleurotus eryngii B
图2PCR产物电泳
Fig.2The PCR products electrophoregram
2.2同工酶电泳
从图3中可以看出,酯酶同工酶电泳结果显示两株菌的酯酶谱带较为丰富,培养15 d的菌株与培养13 d的菌株酯酶各谱带的表达峰度不同。另外,杏A和杏B菌株酯酶的提取用Tris-HCl缓冲液比用PBS缓冲液效果要好。
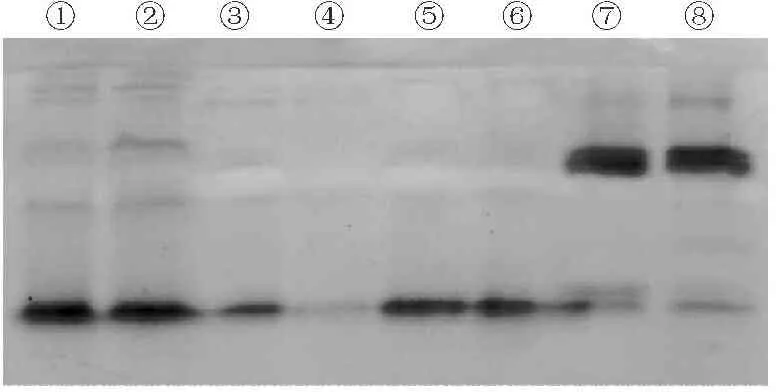
①,③,⑤,⑦:培养15 d、15 d 、13 d、13 d的杏A;②,④,⑥,⑧:培养15 d、15 d、13 d、13 d的杏B,其中①,②,⑦,⑧是用Tris-HCl缓冲液提取的样品,③,④,⑤,⑥是用PBS缓冲液提取的样品
①,③,⑤,⑦:Pleurotus eryngii A(15 d,15 d,13 d,13 d,respectively);②,④,⑥,⑧:Pleurotus eryngii B(15 d,15 d,13 d,13 d,respectively);Sample ①,②,⑦ and ⑧ were extracted by Tris-HCl buffer;Sample ③,④,⑤ and ⑥ were extracted by PBS buffer
图3酯酶同工酶电泳
Fig.3Esterase isozyme electrophoresis
如图4所示,培养15 d、13 d、11 d、9 d的杏A和杏B菌株的过氧化物酶酶带非常接近,不管是培养时间还是菌株之间,差别都不大。
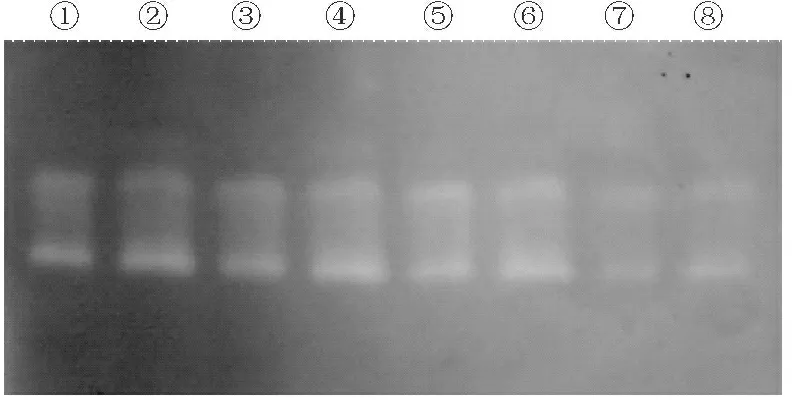
①,②,③,④:培养15 d、13 d、11 d、9 d的杏A;⑤,⑥,⑦,⑧:培养15 d、13 d、11 d、9 d的杏B
①,②,③,④:Pleurotus eryngii A(15 d,13 d,11 d,9 d,respectively);⑤,⑥,⑦,⑧:Pleurotus eryngii B(15 d,13 d,11 d,9 d,respectively)
图4过氧化物酶同工酶电泳
Fig.4Peroxidase isozyme electrophoresis
另外,培养15 d、13 d、11 d的超氧化物歧化酶同工酶电泳色带以培养15 d的最为丰富,杏A和杏B两菌株间无差异(图5)。
图3~5结果显示,杏A和杏B菌株所表达的同工酶无差异条带;两株菌的3种同工酶的表达中以酯酶的谱带最为丰富,而且培养15 d的菌株与培养13 d的菌株酯酶各谱带的表达峰度不同。

①,②,③:培养15 d、13 d、11 d的杏A;④,⑤,⑥:培养15 d、13 d、11 d的杏B
①,②,③:Pleurotus eryngii A(15 d,13 d,11 d,respectively);④,⑤,⑥:Pleurotus eryngii B(15 d,13 d,11 d,respectively)
图5超氧化物歧化酶同工酶电泳
Fig.5Superoxide dismutase isozyme electrophoresis
3讨论
同工酶分子标记对于研究菌株遗传多样性、菌种亲缘关系以及菌种鉴定均有一定作用[14]。酶是基因编码的产物,具有相当的稳定性和特异性;但是,同一生物在不同生长发育时期以及不同生长条件下其酶谱的多态性均不同,这些条件影响同工酶基因的开放、关闭及表达量的改变。因此,同工酶在食用菌菌种选育的应用上应保证培养时间、培养基以及所有操作条件一致的情况下,才可能得到稳定准确的分析结果[15-16]。另外,一些酶的异质性未经过专门的精细分辨,进而影响对生理性酶的多态性的区分[17]。
遗传多样性是生物多样性的基础,遗传多样性水平代表一个物种在特定环境中基因的丰富程度,是物种适应和进化的遗传基础。多样性的分析对了解物种的适应性、物种起源和基因资源的分布及育种亲本的选择等具有重要意义[18]。对秀珍菇菌株进行rDNA ITS 序列分析[19],表明rDNA ITS序列分析在食用菌菌株分析与鉴定上的应用日益广泛。
4结论
对杏A和杏B菌株进行rDNA ITS 序列分析和同工酶电泳分析,2株菌株ITS序列相似度达到99%,而且酯酶、过氧化物酶和超氧化物歧化酶等同工酶电泳检测无差异,据此认为杏A和杏B菌株为同一菌株,在分子水平上差异不明显。
参考文献:
[1]黄大斌,杨菁,林杰,等.寿宁花菇菌株的酯酶同工酶研究[J].中国食用菌,2000,19(3):33-34.
HUANG D B,YANG J,LING J.Study on esterase isozyme of Lentinula strains[J].Edible Fungi of China,2000,19(3):33-34.
[2]边银丙,罗信昌,周启.木耳栽培菌株酯酶同工酶的酶谱多样性研究[J].菌物系统,2000,19(1):87-90.
BIAN Y B,LUO X C,ZHOU Q.Esterase isozyme zymogram polymorphisms of cultivated strains in Auricularia auricula[J].Mycosystema,2000,19(1):87-90.
[3]杨晓兵,宋慧,刘麒,等.DNA分子标记在木耳属真菌中的应用研究进展[J].菌物系统,2010,8(3):181-186.
YANG X B,SONG H,LIU Q,et al.Application progress of DNA molecular markers in Auricularia[J].Mycosystema,2010,8(3):181-186.
[4]阎培生,罗信昌,周启.木耳属真菌 rDNA 特异性扩增片段的 RFLP 研究[J].菌物系统,1999,18(2):206-213.
YAN P S,LUO X C,ZHOU Q.RFLP analysis of amplified nuclear ribosomal DNA in the genus Auricularia[J].Mycosystema,1999,18(2):206-213.
[6]王镭,谭琦,陈明杰,等.从DNA水平上分析香菇不同菌株的遗传差异[J].食用菌学报,1997,4(4):21-24.
WANG L,TAN Q,CHEN M J,et al.A study on the RAPD amplification of different agaricus blazei and Agaricus bisporus strains[J].Acta Edulis Fungi,1997,4(4):21-24.
[7]罗信昌,曾东方.外生菌根蘑菇分离菌株的DNA鉴定方法[J].微生物学杂志, 2001,21(2):26-29.
LUO X C,ZENG D F.DNA identification methods for isolated strain of ectomycorrhizal mushrooms[J].Journal of Microbiology,2001,21(2):26-29.
[8]NICHOLSON M S,BUNYARD B A,ROYSE D J.
Phylogeny of the genus Lentinula based on ribosomal DNA restriction fragment length polymorphism analysis [J].Mycologia,1997,89(3):400-407.
[9]BUNYARD B A,CHAICHUCHOTE S,NICHOL-SON M S,et al.Ribosomal DNA analysis for resolution of genotypic classes of Pleurotus[J].Mycol Res,1996,100(2):143-150.
[10]BROWER A V Z,DESALLE R,VOGLER A.Gene trees,species treesand systematics:Acladistic perspective[ J] .Annu Rev Ecol Syst,1996,27:423-450.
[11]韩增华,张介驰,戴肖东,等.六株黑木耳两种同工酶的研究[J].中国食用菌,2002,21(6):42-44.
HAN Z H,ZHANG J C,DAI X D,et al.A study on the genetic characteristics of the six Auricularia auricula strains[J].Edible Fungi of China,2002,21(6):42-44.
[12]赵国柱,张天宇,张猛.核糖体基因簇在真菌系统学研究中的意义[J].生命的化学,2002,22(1):13-15.
ZHAO G Z,ZHANG T Y,ZHANG M.The significance of ribosomal gene in the study of fung system[J].The Chemistry of Life,2002,22(1):13-15.
[13]张丹,郑有良, 陈红, 等.中国 7个毛木耳(Auricularia polytricha)菌株 ITS 序列比较[J].应用与环境生物学报,2007,13(2):166-171.
ZHANG D,ZHENG Y L,CHEN H,et al.ITS sequence comparison of germplasm resources of Auricularia polytricha[J].Chinese Journal of Applied & Environmental Biology,2007,13(2):166-171.
[14]沈浩,刘登义.遗传多样性概述[J].生物学杂志,2001,18(3):5-8.
SHEN H,LIU D Y.Summary of genetic diversity[J].Journal of Biology,2001,18(3):5-8.
[15]梁建光,杨立红,王小洁,等.不同条件对食用菌酯酶同工酶谱多态性的影响[J].西南农业大学学报:自然科学版,2005,27(4):500-504.
LIANG J G,YANG L H,WANG X J,et al.Effects of different conditions on esterase isozyme of the in edible fungi Pleurotus ostreatus[J].Journal of Southwest Agricultural University:Natural Science,2005,27(4):500-504.
[16]杨立红,辛晓林,蔡德华,等.酯酶同工酶在食用菌菌种选育中的应用研究[J].中国食用菌,2005,27(6):12-14.
YANG L H,XIN X L,CAI D H,et al.Application of esterase isozyme in the selection and breeding of edible fungi[J].Edible Fungi,2005,27(6):12-14.
[17]宿红艳,王磊,王仲礼,等.十个白灵菇栽培菌株的遗传多样性分析[J].食品科学,2009,30(5):158-161.
SU H Y,WANG L,WANG Z L,et al.Analysis of genetic diversity of ten cultivated strains of Pleurotus nebrodensis[J].Food Science,2009,30(5):158-161.
[18]吴学谦,李海波,魏海龙,等.DNA分子标记技术在食用菌研究中的应用及进展[J].浙江林业科技,2004,24(2):75-80.
WU X Q,LI H B,WEI H L,et al.Application and development of DNA molecular marker technology in edible fungus research[J].Journal of Zhejiang Forestry Science and Technology,2004,24(2):75-80.
[19]罗先群,许黎明.秀珍菇rDNA序列与农艺性状分析[J].食用菌,2015,37(2):15-16.
LUO X Q,XU L M.Analysis of the rDNA sequence and the agronomic traits of Pleurotus geesteranus[J].Edible Fungi,2015,37(2):15-16.
(责任编辑:米慧芝)
收稿日期:2016-03-10
作者简介:罗先群(1965-),男,高级工程师,主要从事生物工程与技术的研究与开发。
中图分类号:Q55,Q78
文献标识码:A
文章编号:1002-7378(2016)02-0156-05
Analysis on Isozyme and rDNA ITS Sequence of Pleurotus eryngii Strains
LUO Xianqun,HUANG Xuexing
(Biology Institute,Guangxi Academy of Sciences,Nanning,Guangxi,530007,China)
Abstract:【Objective】In view of the fact that the mutation of Pleurotus eryngii strains is different in the cultivated character. Two strains of Pleurotus eryngii strains (A and B) are identified at molecular level and analyze their difference.【Methods】The rDNA fragment of Pleurotus eryngii mycelium samples was amplified by PCR and sequencing. Mycelium of esterase, peroxidase and superoxide dismutase enzyme are analyzed by isozyme electrophoresis. 【Results】Through the analysis of GenBank database search and sequence alignment,the similarity of ITS sequences of the two strains was reached to 99%;There was no difference between esterase,peroxidase and superoxide dismutase isozymes in the mycelium.【Conclusion】A and B strain is the same strain,at the molecular level with insignificant difference.
Key words:Pleurotus eryngii,isoenzyme,rDNA ITS,sequence analysis
网络优先数字出版时间:2016-05-12
网络优先数字出版地址:http://www.cnki.net/kcms/detail/45.1075.N.20160512.1517.020.html
*广西科学院基本科研业务费项目(15YJ22SW20)资助。
