沙蚕类性信息素研究进展*
2016-07-18于超勇宋静静盖珊珊于道德
于超勇,刘 名,刘 莹,周 健,宋静静,盖珊珊,徐 涛,于道德**
(1.山东省海洋生物研究院,山东青岛 266104;2.山东省渔业技术推广站,山东济南 250013)
沙蚕类性信息素研究进展*
于超勇1,刘名1,刘莹1,周健1,宋静静1,盖珊珊1,徐涛2,于道德1**
(1.山东省海洋生物研究院,山东青岛266104;2.山东省渔业技术推广站,山东济南250013)
摘要:沙蚕作为多毛类重要的经济种类,在生态环境和水产养殖业中都占有重要地位。沙蚕的特殊繁殖习性决定其在性信息素(sex pheromone)的化学本质以及交流过程的特殊性。例如利用多肽和嘌呤等作为性信息素,明显区别于脊椎动物,从而为其作为无脊椎动物基础研究的模式生物增添新的研究方向,本文综述沙蚕类性信息素研究现状,并对其未来的研究方向进行展望,为国内开展沙蚕大规模人工繁育和养殖提供一定的理论基础。
关键词:性信息素沙蚕多毛类繁殖
0引言
从个体生物学的角度来看,任何生命活动的正常进行,都离不开信息的传递。而从生态学的角度来看,信息的传递在种间以及与其他生物的种间关系维系上,显得更为重要。这不仅涉及到生物种群的繁衍,而且对于维持整个生态系统的平衡都起到至关重要的作用。生物体在信息传递的过程中会利用各种手段和途径,包括物理的、化学的以及行为学的信息传递。在进化的过程中,各种方式相互作用,形成了多源信息传递的特征。其中,种群之间的化学传递系统,广泛地存在于生物界,尤其对于种群内个体之间的信息交流起到核心作用。在种群内部,也就是同种类之间,这种核心作用的物质基础主要就是信息素(pheromones),信息素几乎存在于整个动物界,从低等的纤毛虫、酵母到最高等的人类[1-3]。相对地,在非同类之间进行的化学信息交流素称为化感物质(allelochemicals)。两者同属于信息化合物(semiochemicals)的范畴[4]。
信息素是由动物产生并释放于体外的,能够引起同种个体生理上和行为模式变化的一种化学物质,由于其在体外起作用,为了区别于内分泌激素,因此又称为外激素。1959年在昆虫中发现第一个信息素,之后在昆虫和哺乳类中进行了广泛地研究[5-6]。目前,昆虫信息素已经成功地应用于实际生产的病虫害防治中,这其中主要包括性信息素(sex pheromone)的诱导异性作用以及聚集信息素(schooling pheromone)的聚集作用等[7]。
不同于陆生动物,水生物种信息素的研究虽然起步较晚,进展缓慢,但是应用前景同样十分广阔,例如鱼类相关信息素的研究[4,8]。类似其他无脊椎动物,沙蚕类也是充分利用性信息素来协调其繁殖行为[9-10],由于其特殊的繁殖行为(群游,swarming;婚舞,nuptial dance)容易观察,以及特定性信息素的确立并能够人工合成(见下节),已经成为研究海洋无脊椎动物信息素的模式生物类群[11]。国内在此方面的研究和报道较少,仅见朱明远等[12-13]进行过相关研究。
由于沙蚕科的大部分种类都是重要的经济多毛类,除了在海水养殖业上占据重要的地位外,并且能够在自然界中降解有机质中的毒害物质,对于近岸水域海洋环境的修复和改善具有更大的生态价值,目前大规模人工繁殖和育苗技术正在开展,例如国内沙蚕的主要养殖品种有日本刺沙蚕(Neathes japocica)、多齿围沙蚕(Perinereis nuntia)和双齿围沙蚕(Perinereis aibuhitensis)等。国外的养殖和商业化已经非常成熟,主要是因为其在垂钓休闲渔业和渔业饵料中的重要地位。因此,对沙蚕等多毛类性信息素的研究,无疑会为其大规模人工繁育技术的突破提供帮助。
1信息素系统的主要特点
生物信息的传递如正常信息一样,也包括3个基本环节:信源、信道、信宿。不同于其他已经研究的动物,沙蚕信息素的唯一来源是体腔液,都是由具有导管的外分泌腺体分泌到体外,包括皮肤、胆汁、尿液等。沙蚕类独特的生存环境,使水域(包括海水、淡水和半咸水)与底质的界面成为其信息传递的唯一通道[14],在这一点上区别于陆生动物的空气传播途径,以及不同昆虫所具有的水体和空气两种传播方式。沙蚕信息素在作用上属于化学感应系统,所以对于信号的接收,也就是信宿主要涉及到嗅觉和味觉系统,与昆虫类相同。信息素系统产生的化学信号能够调节群体间很多生态意义上的行为,包括防御、繁殖、种群恢复以及摄食等[15-16]。因此可以根据信息素的功能,将沙蚕等多毛类的信息素划分为性信息素(sex pheromone)[17]、警戒信息素(alarm pheromone)[18]、集群信息素(schooling pheromone)等几大类。
信息素系统在同种类个体间的化学交流与内分泌系统激素在个体水平上的信息传递有很多相似之处[19]。1)两者都涉及到特定的化学受体:即在很低的浓度下,通过特殊的受体引起同类个体或者自身靶器官的生理性或者行为学效应。例如,琥珀刺沙蚕(Neathes succinea)半胱胺谷胱甘肽(CSSG)的浓度为10-7~10-6mol·L-1时可引起婚舞和繁殖行为[20],而更低的浓度可以吸引雄性接近雌性个体[21]。2)作为外源化学信使的信息素通常都是通过同类个体的内分泌和神经内分泌系统来发挥其作用,与自身激素的作用机理相同。3)大多数物种的信息素,尤其是陆生动物的性信息素,本身就是激素或者激素的代谢物,例如金鱼通过17α,20β-DP和PGF2a这两种性激素来协调自身的性腺发育与繁殖行为,而且能够利用两者作为外源的信息素来协调不同个体间繁殖行为的同步化[22];多毛类中的典型代表是覆瓦哈鳞虫(Harmothoe imbricata),其口前叶成熟激素(prostomial maturation hormone)能够诱导体腔成熟因子(coelomic maturation factor,CMF)的产生,后者能够启动卵母细胞第一次减数分裂过程的前期向中期过渡[23-24],雌性就是利用口前叶的激素作为外源信息素来协调不同个体间卵母细胞发育和繁殖行为的同步化,同时还能够吸引雄性完成繁殖[25-26]。4)信息素的保守性和通用性。类似于激素系统,信息素上的结构和功能性都存在保守性和通用性。例如褐片阔沙蚕(Platynereis dumerilii),琥珀刺沙蚕(N.succinea),多齿围沙蚕(Perinereis nuntia Savigny)等都是利用5-甲基-3-庚酮(5M3H)做为繁殖中的第一个性信息素来吸引同类的异性[27]。
2沙蚕类特殊繁殖习性
对沙蚕繁殖习性的了解是研究沙蚕性信息素的前提和基础。首先,沙蚕属于终生繁殖一次(semelparous)的生物,繁殖作为其生活史的最后一个事件,也就是繁殖后死亡。因此雌雄的同步成熟和集中繁殖对于提高个体繁殖成功率的重要性不言而喻。与其他无脊椎动物类似,沙蚕类在临近繁殖季节(一般为夏季)时,受到外界环境因素(温度、盐度、光照,潮汐或月亮周期等)和自身内分泌系统的双重调控[28-31]。沙蚕经过特殊生理变化,进行二次变态(区别于早期发育的变态过程),称为生殖态(epitoky)或婚前态(epitokous)成为异沙蚕体(heteronereis或heteronereids),在形态结构上,异沙蚕体发生的变化主要包括复眼的增大、为适应游动形成特殊刚毛、以及肠道和消化能力的消失[29]。异沙蚕体在特定时期(新月或满月的大潮期间)集中于水面,进行群游,当雌雄选择到合适的异性后,两者接近(距离小于3 cm时)进行婚舞,然后各自释放精子或卵子,完成一次受精。此后,部分雄性继续寻找其他雌性,而雌性产卵后沉入水底,死亡[29]。在此期间,性信息素与性类固醇激素共同作用,目的就是为了在不同层面和不同阶段保证雌雄配子成熟的同步性以及特殊繁殖行为的顺利进行。
3沙蚕性信息素的化学本质及特点
与其他物种类似,沙蚕的性信息素具有种属的特异性,并且在繁殖的不同阶段都有特异性的性信息素起作用,但基本都是一些易挥发的小分子化合物,例如烷酮类(甲基癸烷、辛烯酮等),小肽类(CSSG),尿酸等[32-34]。
异沙蚕体的体腔液是性信息素的来源,有些种类的异沙蚕体,整个体腔都可以充满性信息素[35]。最早发现的沙蚕性信息素是从褐片阔沙蚕(Platynereis dumerilii)体腔中提取的一种挥发性物质,为5-甲基-3-庚酮(5M3H),雌雄个体都能够分泌,唯一的区别是雌雄分泌的互为镜像异构体(enantiomers),雄性分泌的为S(+),吸引雌性个体;而雌性分泌R(-),吸引雄性个体[9]。第二种挥发性物质为辛二烯-[3,5]-酮-[2]。随后的实验证实,在琥珀刺沙蚕(Neanthes succinae)体腔液中也同时存在这两种物质[27],而5M3H的分布更广,作为性信息素存在于多种沙蚕的体腔液中[12]。5M3H的作用主要是使成熟的异沙蚕体在婚舞时增加游动速度和诱导围绕异性个体周围作小圈游动,同时雄性能够分泌少量的精液[12,27]。而接下来配子成熟诱导的性信息素却具有种类和雌雄的差异。雄性褐片阔沙蚕分泌的混合物(不确定)诱导雌性产卵,而雌性则分泌尿酸来做为性信息素刺激雄性排精[36-37]。
对于琥珀刺沙蚕(Neanthes succinae)来说,整个繁殖过程中,雌雄性都利用不同的信息素来诱导对方,包括性信息素的混合物,而且与其浓度相关[21]。首先雌性在群游行为时,产生一种被称为“nereithione”的四肽(即CSSG),其二硫化合物是主要的活性物质。低浓度的CSSG吸引雄性找到雌性个体,属于雌雄性认知过程[21];CSSG浓度较高时可诱导雄性初次排放精子,此时的精液量很小,但可以观察到[10];在雄性排放的少量精子中混杂着体腔液,体腔液中含有卵子释放的性信息素混合物(主要包括L-谷氨酸、L-谷氨酰胺和肌苷,第4种推测为鸟苷酸)[35,37],此时雌性接收到反馈信号后,才开始进行婚舞(在小范围内高速旋转游动,相对于群舞的速度要快),10~40 s内,释放卵子和含有诱导精子释放的性信息素(仍然是CSSG)的体腔液后,雄性跟随雌性进行最后的婚舞,释放最大量的精子,完成受精和繁殖过程。由此可见,CSSG是一个具有多重作用的信号分子:包括雌雄成熟个体的认知,群舞行为的发生和最后繁殖的完成,只是根据浓度的不同而发挥不同的作用(表1)。
其实,除了沙蚕外,很多水生物种(两栖类、甚至纤毛虫以及细菌等)在很大程度上都是利用多肽而不是类固醇激素来做为性信息素,用于同类间的交流[10-11]。这就造就了沙蚕性信息素系统的特殊性。由于生物转化作用,多肽类在海洋环境中半衰期很短[38],因此利用多肽作为信息化合物的物种必须能够严格控制多肽类在时空中的分布情况,尽量避免不必要的损失,以保证繁殖的成功率。
包括CSSG在内(半胱氨酸+谷胱甘肽),多数沙蚕性信息素都属于生物体内常见物质(表1),因此水域中存在的可能性特别高,所以作为信号物质必须要具有较高浓度,才能区别于水域背景中其他化学物质。例如,虽然尿酸是陆生动物常见排泄物(包括昆虫、软体动物、爬行类和鸟类等),在海洋环境中也具有一定的浓度,除了沙蚕类,部分海洋软体动物也排泄尿酸[39],尤其是潮间带种类,体内尿酸含量很高,例如滨海螺(Littorina littorea)。在高浓度尿酸下(6×10-7mol·L-1),雄性褐片阔沙蚕(Platynereis dumerilii)才会释放精子,这样高的阈值具有重要的生态意义。否则,过低的阈值会诱导雄性在没有达到有效值的范围内(最大限度靠近雌性沙蚕)提早排精,这样会导致受精率很低或失去受精卵子的机会,而沙蚕特殊的繁殖行为(群游、婚舞和一生繁殖一次)和卵子的特性(沉性卵和/或粘性卵),更好地说明了近距离受精对沙蚕繁殖成功的重要性和特殊性,这也是性信息素的主要作用。
其次,沙蚕类的性信息素大多数为混合物,因此具有协同作用。如琥珀刺沙蚕雄性能够分泌一种混合物,用来刺激卵子释放,其中有的成分(L-谷氨酰胺)单独存在时不起作用,而与其他成分混合则大大降低作用(大约4~8倍)[35]。另外一个作用就是,通过不同的成分作为主要的性信息素而起作用,可以避免与生态位重叠的近亲种类发生杂交,有效进行生殖前隔离。这种以混合物为性信息素的例证在动物界很常见,例如昆虫和鱼类等[40-41]。
表1性信息素情况归纳
Table 1Summarized of sex pheromones
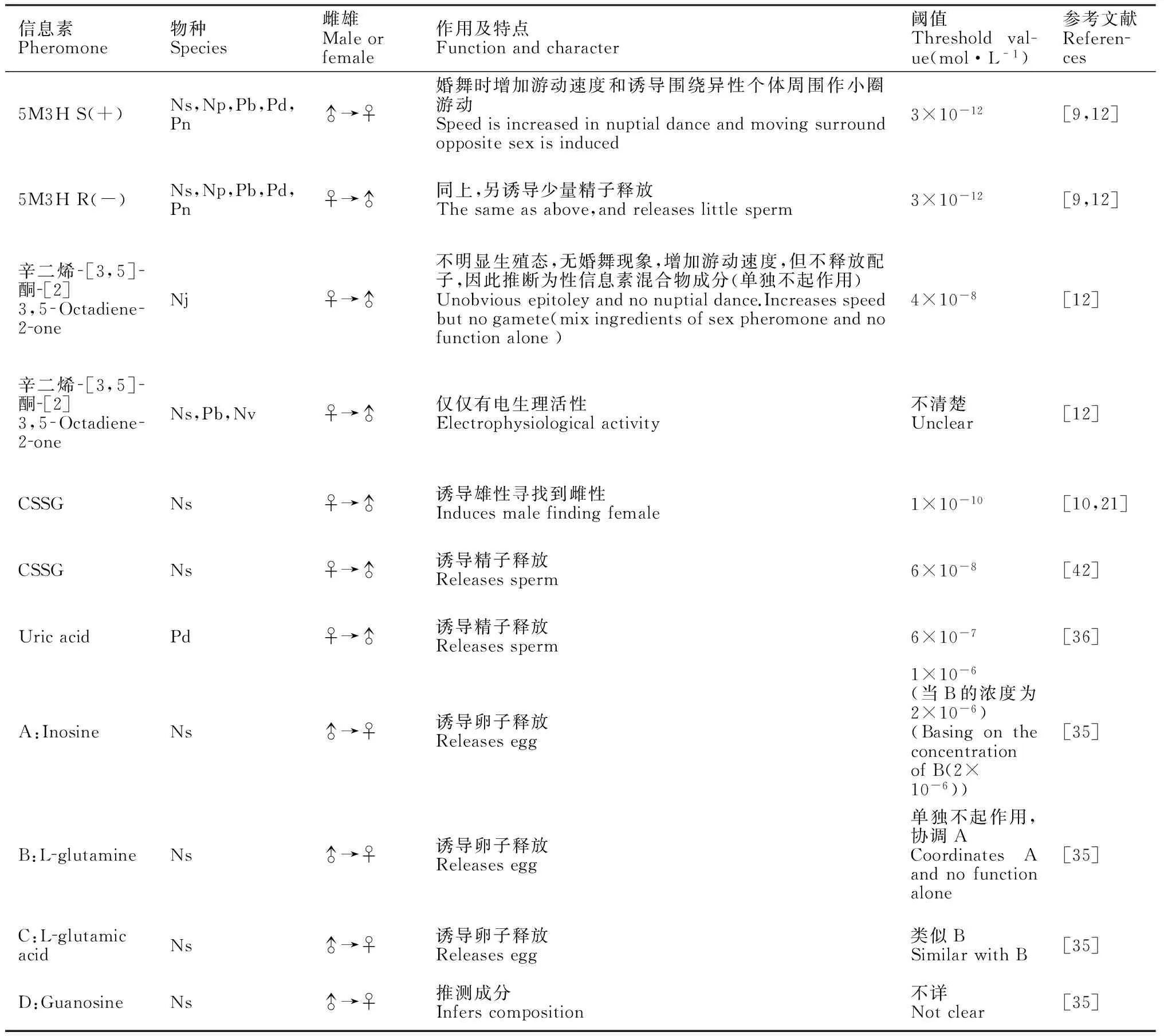
信息素Pheromone物种Species雌雄Maleorfemale作用及特点Functionandcharacter阈值Thresholdval-ue(mol·L-1)参考文献References5M3HS(+)Ns,Np,Pb,Pd,Pn♂→♀婚舞时增加游动速度和诱导围绕异性个体周围作小圈游动Speedisincreasedinnuptialdanceandmovingsurroundoppositesexisinduced3×10-12[9,12]5M3HR(-)Ns,Np,Pb,Pd,Pn♀→♂同上,另诱导少量精子释放Thesameasabove,andreleaseslittlesperm3×10-12[9,12]辛二烯[3,5]酮[2]3,5Octadiene2oneNj♀→♂不明显生殖态,无婚舞现象,增加游动速度,但不释放配子,因此推断为性信息素混合物成分(单独不起作用)Unobviousepitoleyandnonuptialdance.Increasesspeedbutnogamete(mixingredientsofsexpheromoneandnofunctionalone)4×10-8[12]辛二烯[3,5]酮[2]3,5Octadiene2oneNs,Pb,Nv♀→♂仅仅有电生理活性Electrophysiologicalactivity不清楚Unclear[12]CSSGNs♀→♂诱导雄性寻找到雌性Inducesmalefindingfemale1×10-10[10,21]CSSGNs♀→♂诱导精子释放Releasessperm6×10-8[42]UricacidPd♀→♂诱导精子释放Releasessperm6×10-7[36]A:InosineNs♂→♀诱导卵子释放Releasesegg1×10-6(当B的浓度为2×10-6)(BasingontheconcentrationofB(2×10-6))[35]B:LglutamineNs♂→♀诱导卵子释放Releasesegg单独不起作用,协调ACoordinatesAandnofunctionalone[35]C:LglutamicacidNs♂→♀诱导卵子释放Releasesegg类似BSimilarwithB[35]D:GuanosineNs♂→♀推测成分Inferscomposition不详Notclear[35]
注:Nj=日本刺沙蚕(Neathes japocica);Np=游沙蚕(Neanthes pelagica);Ns=琥珀刺沙蚕(N.succinae);Nv=绿沙蚕(Nereis virens);Pb=双管阔沙蚕(Platynereis bicanaliculata) ;Pd=褐片阔沙蚕(P.dumerilii);Pn=多齿围沙蚕(Perinereis nuntia)
4展望
实际上,任何物种,包括沙蚕类中研究最为透彻和详实的就是性信息素,这不仅仅是因为性信息素是沙蚕种群繁衍最关键的因素,而且性信息素引起沙蚕发生明显的繁殖行为,容易观察和操作等。然而,从个体发生的角度来看,性信息素只在繁殖季节起作用,除了时期的限制外,其出现的时序也应该是最后一个发挥功能的信息素,而且仅仅发挥一次作用(因为沙蚕繁殖后死亡)。
昆虫信息素应用于农业生产业已超过30年,相对地,沙蚕性信息素研究较晚,但是根据性信息素的功能区分和作用模式以及沙蚕类人工养殖的兴起,该类性信息素的研发和应用必然如同昆虫信息素一样在实际生产中发挥重要作用。性信息素的进化与物种的繁殖方式密切相关。因此,首先要对不同种类的繁殖行为和特点进行相关研究,侧重于特殊行为的发生和不同种类性信息素的关系。例如5M3H作为多种沙蚕的性信息素,却对日本刺沙蚕不起作用;对应地,日本刺沙蚕体内也不含有5M3H,从地理分布上来看,日本刺沙蚕仅仅分布于黄渤海及日本海域,为中日特有种。另外,其繁殖行为(婚舞)和婚前变态都不如其他沙蚕明显,这可能是特殊地理位置导致不同沙蚕的独立进化所致,因为有证据表明,日本刺沙蚕的性信息素含有另外一种成分——辛二烯-[3,5]-酮-[2]。CSSG虽然业已证实其在琥珀刺沙蚕繁殖过程中的多重作用,包括引起雄性的电生理反应,但是雌性调控合成和释放CSSG的机理,雄性对该信息素的分子受体的定位,以及其作用机制我们还一无所知[20-21]。因此,还需进一步对沙蚕繁殖以及性信息素相关的感觉器官的定位进行研究。
从本质上,信息素属于信息化合物。如上所述,野外观察和实验室实验都有证据表明特定沙蚕性信息素可以作用于同一生态位其他沙蚕类种群,也就是具有化感物质的作用。从另一个角度考虑,也说明信息素在进化上的保守性,最为经典的例子就是5M3H是多种沙蚕的性信息素[27]。无独有偶,H3NO(功能团为一氧化氮)也是作为很多鱼类的警戒信号(也就是警戒信息素)而存在[43]。因此,如何将性信息素的这一特点应用于生产值得我们进一步研究和探讨。
沙蚕类的性信息素都是比较常见的小分子物质,因此容易受到外界环境以及特殊污染物的干扰。例如,石油中的五碳烷基化芳烃系列物具有类似性信息素的作用,在很低的浓度下(甚至低于天然性信息素)诱导沙蚕的繁殖行为[44]。这类似于以雌激素为主的内分泌干扰物(Endocrine disrupting chemicals,EDCs)对两栖类和鱼类的影响,涉及到生长和外部形态、行为学、繁殖生理、性别分化和性逆转等诸多方面[45-46]。因此,该方向的研究和机理性的探讨有利于我们进一步了解沙蚕类性信息素,包括性信息素类似物的干扰作用及作用方式,是否存在功能团以及功能团的确定。如鱼类的警戒信息素的功能团为NO,因此含有一氧化氮功能团的一系列芳香化合物,都可以作为鱼类的警戒信息素而起作用[43]。生物体利用的性信息素大部分为性激素类,典型的例子为鱼类。多肽类的应用也不少,而沙蚕类利用肌苷、次黄嘌呤等含有嘌呤环的化合物还属于生物界的第一个例证。这种利用新型化合物来作为性信息素是否具有进化上和生态上的意义,例如用于避开其他物种繁殖的干扰:因为在潮间带和珊瑚礁区域,存在大量不同物种同时繁殖的现象,5~6 d内,有近130个物种同时进行繁殖[47]。如此大量的物种种类和数量,势必会造成局域海水混合大量不同的性信息素,且浓度很高,为了避免产生错误的繁殖信号(异种的化感作用),除了通过增加浓度外,直接改变化合物的结构似乎更是明智之举。而在自然界,这种异种类性信息素影响繁殖行为的例子的确存在[17]。沙蚕是否是据此进化出利用嘌呤类化合物作为性信息素,还需要进一步研究和探讨。
信息素在农业(昆虫病害治理)和渔业管理上的应用(如利用信息素来治理五大湖鳗鲡问题),使人工合成信息素产业显示出巨大的生命力[48]。性信息素作为信息素的重要种类,随着人工合成技术的实现,将为沙蚕类信息素的利用开辟新的途径。现阶段沙蚕的收获仍然没有较好的方式,一般利用农药等化学物,容易造成环境污染。如果能利用性信息素创造出沙蚕类收获(诱集)的方法,必将会为沙蚕养殖产业的大规模生产提供新的契机。
参考文献:
[1]ROBERTO T,MICHELE D,SIMONE P,et al.From pheromones to behavior[J].Physiological Reviews,2009,89(3):921-956.
[2]KODAMA T,HISATOMI T,KANEMURA T,et al.Molecular cloning and DNA analysis of a gene encoding a mating pheromone from the yeast Saccharomyces naganishii[J].Yeast,2003,20(2):109-115.
[3]LA TERZA A,DOBRI N,ALIMENTI C,et al.The water-borne protein signals (pheromones) of the Antarctic ciliated protozoan Euplotes nobilii:Structure of the gene coding for the En-6 pheromone[J].Canadian Journal of Microbiology,2009,55(1):57-62.
[4]CORKUM L D,BELANGER R M.Use of chemical communication in the management of freshwater aquatic species that are vectors of human diseases or are invasive[J].Gen Comp Endocrinol,2007,153(1/2/3):401-417.
[5]PLIMMER J R,GAMMON D.Insect Pheromones [M].[S.l.]:John Wiley & Sons Inc,2003.
[7]BAKER T C,HEATH J J,LAWRENCE I G,et al.Pheromones:Function and use in insect control[M]//Comprehensive Molecular Insect Science.Amsterdam:Elsevier,2005:407-459.
[8]CHUNG-DAVIDSON Y W,HUERTAS M,LI W,et al.A Review of Research in Fish Pheromones in Chemical Communication in Crustaceans[M].THOMAS B,MARTIN T(eds.).New York:Springer,2011:467-482.
[9]ZEECK E,HARDEGE J,BARTELS-HARDEGE H,et al.Sex pheromone in a marine polychaete:Determination of the chemical structure[J].Journal of Experimental Zoology,1988,246(3):285-292.
[10]HARDEGE J D,BARTELS-HARDEGE H,MÜLL-ER C T,et al.Peptide pheromones in female Nereis succinea[J].Peptides,2004,25(9):1517-1522.
[11]HARDEGE J D.Nereidid polychaetes as model organisms for marine chemical ecology[J].Hydrobiologia,1999,402(402):145-161.
[12]朱明远,杨宇,吴宝铃.日本刺沙蚕的性信息素研究[J].黄渤海海洋,1995,13:40-46.
ZHU M Y,YANG Y,WU B L.A study of sex pheromones of Nereis japonica[J].Journal of Oceanography of Huanghai & Bohai Seas,1995,13:40-46.
[13]朱明远,杨宇,吴宝铃.沙蚕科性信息素的种间作用[J].海洋学报,1992,14(5):95-100.
ZHU M Y,YANG Y,WU B L.The interaction of sex pheromone in Nereid[J].Acta Oceanologica Sinica,1992,14(5):95-100.
[14]WEISSBURG M J.The fluid dynamical context of chemosensory behavior[J].Biological Bulletin,2000,198(2):188-202.
[15]ZIMMER R K,BUTMAN C A.Chemical signaling processes in the marine environment[J].Biological Bulletin,2000,198(2):168-187.
[16]FERRARI M C O,WISENDEN B D,CHIVERS D P.Chemical ecology of predato-prey interactions in aquatic ecosystems:A review and prospectus[J].Canadian Journal of Zoology,2010,88(7):698-724.
[17]WATSON G J,BENTLEY M G,GAUDRON S M,et al.The role of chemical signals in the spawning induction of polychaete worms and other marine invertebrates[J].Journal of Experimental Marine Biology and Ecology,2003,294:169-187.
[18]WATSON G J,HAMILTON K M,TUFFNAIL W E.Chemical alarm signalling in the polychaete Nereis (Neanthes) virens (Sars) (Annelida:Polychaeta)[J].Animal Behaviour,2005,70(5):1125-1132.
[19]HUBARD P,SCOTT A.Pheromone and other chemical communication[J].General and Comparative Endocrinology,2007,153 (1/2/3):390-391.
[20]RAM J L,MLLER C T,BECKMANN M,et al.The spawning pheromone cysteine-glutathione disulfide(“Nereithione”) arouses a multicomponent nuptial behaviour and electrophysiological activity in Nereis succinea males[J].The Faseb Journal,1999,13(8):945-952.
[21]RAM J L,FEI X,DANAHER S M,et al.Finding females:Pheromone-guided reproductive tracking behavior by male Nereis succinea in the marine environment[J].Journal of Experimental Biology,2008,211(pt5):757-765.
[22]STACEY N E,SORENSEN P W.Fish Hormonal Pheromones,in Hormones,Brain and Behavior[M].PFAFF D W,ARNOLD A P,ETGEN S,et al(eds.).New York:Academic Press,2002:375-435.
[23]WATSON G J,BENTLEY M G.Action of CMF(Coelomic Maturation Factor) on oocytes of the polychaete Arenicola marina (L.)[J].Journal of Experimental Zoology,2015,43(5):65-71.
[24]WATSON G J,BENTLEY M G.Evidence for a coelomic maturation factor controlling oocyte maturation in the polychaete Arenicola marina(L.)[J].Invertebrate Reproduction and Development,1997,31(1):297-306.
[25]GAUDRON S M,WATSON G J,BENTLEY M G.Induction of pairing in male scale worm Harmothoe imbricata (Polychaeta:Polynoidae) by chemical signals[J].Journal of the Marine Biological Association,United Kingdom,2007,87(5):1115-1116.
[26]WATSON G J,LANGFORD F M,GAUDRON S M,et al.Factors influencing spawning and pairing in the scale worm Harmothoe imbricata (Annelida:Polychaeta)[J].Biological Bulletin,2000,199(1):50-58.
[27]ZEECK E,HARDEGE J D,BARTELS-HARDEGE H D.Sex pheromones and reproductive isolation in two nereid species,Nereis succinea and Platynereis dumerilii[J].Marine Ecology Progress Series,1990,67:183-188.
[28]MERCIER A,ZHAO S,BAILLON S,et al.Lunar rhythms in the deep sea:Evidence from the reproductive periodicity of several marine invertebrates[J].Journal of Biological Rhythms,2011,26(1):82-86.
[29]HARDEGE J D,BARTELS-HARDEGE H D,ZEECK E,et al.Induction of swarming of Nereis succinea[J].Marine Biology,1990,104(2):291-295.
[30]OLIVE P J W,GARWOOD P R.The importance of long term endogenous rythms in the maintenance of reproductive cycles of marine invertebrates:A reappraisal[J].International Journal of Invertebrate Reproduction,1983,6(5):339-347.
[31]ANDRIES J C.Endocrine and environmental control of reproduction in Polychaeta[J].Canadian Journal of Zoology,2001,79(2):254-270.
[32]HARDEGE J D,BENTLEY M G,BECKMANN M,et al.Sex pheromones in marine polychaetes:Volatile organic substances isolated from Arenicola marina[J].Marine Ecology Progress Series,1996,139(1/2/3):157-166.
[33]LINDSAY S M.Ecology and biology of chemoreception in polychaetes[J].Zoosymposia,2009,2:339-367.
[34]BARTELS-HARDEGE H D,HARDEGE J D,ZEECK E,et al.Sex pheromones in marine polychaetes V:A biologically active volatile compound from the coelomic fluid of female Nereis (Neanthes) japonica (Annelida:Polychaeta)[J].Journal of Experimental Marine Biology and Ecology,1996,201(1/2):275-284.
[35]ZEECK E,HARDER T,BECKMANN M.Inosine,L-glutamic acid and L-glutamine as components of a sex pheromone complex of the marine polychaete Nereissuccinea (Annelida:Polychaeta)[J].Chemoecology,1998,8(2):77-84.
[36]ZEECK E,HARDER T,BECKMANN M.Uric acid:
The sperm-release pheromone of the marine Polychaete Platynereis dumerilii[J].Journal of Chemical Ecology,1998,24(1):13-22.
[37]ZEECK E,HARDER T,BECKMANN M,et al.Marine gamete-release pheromones[J].Nature,1996,382(6588):214.
[38]RITTSCHOF D.Peptide-mediated behaviors in marine organisms evidence for a common theme[J].Journal of Chemical Ecology,1990,16(1):261-272.
[39]RYTHER J H,DUNSTAN W M.Nitrogen,phosphorus,and eutrophication in the coastal marine environment[J].Science,1971,171(3975):1008-1013.
[40]FINE J,SORENSEN P.Isolation and biological activity of the multi-component sea lamprey migratory pheromone[J].Journal of Chemical Ecology,2008,34(10):1259-1267.
[41]SILVERSTEIN R M,YOUNG J C.Insects generally use multicomponent pheromones[J].Acs Symp Ser Amer Chem Soc,1976,170(23):1-29.
[42]ZEECK E,MÜLLER C T,BECKMANN M,et al.
Cysteine-glutathione disulfide,the sperm-release pheromone of the marine polychaete Nereis succinea (Annelida:Polychaeta)[J].Chemoecology,1998,8(1):33-38.
[43]BROWN G E,ADRIAN J C,SMYTH E,et al.Ostariophysan alarm pheromones:Laboratory and field tests of the functional significance of nitrogen oxides[J].Journal of Chemical Ecology,2000,26(1):139-154.
[44]MÜLLER C T,PRIESNITZ F M,BECKMANN M.Pheromonal communication in Nereids and the likely intervention by petroleum derived pollutants[J].Integrative and Comparative Biology,2005,45(1):189-193.
[45]KNACKER T,BOETTCHER M,FRISCHE T,et al.Environmental effect assessment for sexual endocrine-disrupting chemicals:Fish testing strategy[J].Integrated Environmental Assessment and Management,2010,6(4):653-662.
[46]KLOAS W,URBATZKA R,OPITZ R,et al.Endocrine disruption in aquatic vertebrates[J].Annals of the New York Academy of Sciences,2009,1163(1):187-200.
[47]BABCOCK R C,BULL G D,HARRISON P L,et al.Synchronous spawnings of 105 scleractinian coral species on the Great Barrier Reef[J].Marine Biology,1986,90(3):379-394.
[48]SORENSEN P W,STACEY N E.Brief review of fish pheromones and discussion of their possible uses in the control of non-indigenous teleost fishes[J].New Zealand Journal of Marine and Freshwater Research,2004,38(3):399-417.
(责任编辑:陆雁)
收稿日期:2016-03-30
作者简介:于超勇(1985-),男,研究实习员,主要从事海洋生物研究。 **通讯作者:于道德(1978-),男,副研究员,主要从事海水养殖研究, E-mail:wensentte@163.com。
中图分类号:S966.9
文献标识码:A
文章编号:1002-7378(2016)02-0129-07
Research Progress in Sex Pheromones of Nereid Polychaetes
YU Chaoyong1,LIU Ming1,LIU Ying1,ZHOU Jian1,SONG Jingjing1,GE Shanshan1,XU Tao2,YU Daode1
(1.Marine Biology Institute of Shandong Province,Qingdao,Shandong,266104,China;2.Shandong Province Fisheries Technology Extension Station,Jinan,Shandong,250013,China)
Abstract:As the most important polychaete,Nereid polychaetes play a vital role in the ecological environment and aquaculture.Nereid polychaetes have a specialized sex pheromone system in chemical nature and the mode of communication.Most Nereid polychaetes use polypeptides and purines as sex pheromones,which is quite different from vertebrate-mainly sex steroid hormone,and also some other invertebrate group,and this also help to find out a new future research as an invertebrate model organism.This review focuses on the current research status of sex pheromones of Nereid polychaetes and forecasts the future study,hoping that this review could provide some certain in theoretical for in the future Nereid polychaetes commercial aquaculture.
Key words:sex pheromone,Nereid,polychaete,reproduction
网络优先数字出版时间:2016-05-17
网络优先数字出版地址:http://www.cnki.net/kcms/detail/45.1075.N.20160517.0907.002.html
*山东省农业良种工程“优质抗病速生鱼类良种选育——速生耐温工厂化适养品种-大菱鲆选育”和山东省现代农业产业体系鱼类创新团队项目(SDAIT-14-011-04)资助。
