烟草种质资源的遗传多样性分析
2016-07-18张铭真李晓辉邢雪霞徐世晓杨铁钊
张铭真,李晓辉,王 袁,邢雪霞,徐世晓,杨铁钊
(河南农业大学烟草学院,河南 郑州 450002)
烟草种质资源的遗传多样性分析
张铭真,李晓辉,王袁,邢雪霞,徐世晓,杨铁钊*
(河南农业大学烟草学院,河南 郑州 450002)
摘 要:从200对SSR引物中筛选出69对条带清晰、多态性强的引物,对80份烟草种质资源材料(来自多个国家和地区)的全基因组DNA进行扩增,采用荧光ABI–3500 xl遗传分析仪进行多态性检测,结果69对引物在烟草种质材料中共检测出503个多态性条带,平均每对引物可检测到的等位变异数为7.91个,观测杂合度(Ho)平均值为0.276 4,预期杂合度(He)平均值为0.574 7。Shannon’s信息指数I为1.082 6;Nei’s多样性指数H为0.571 1、遗传分化系数Fst为0.141 6,基因流Nm为1.515 3,遗传相似系数为0.55~0.90。说明80份烟草种质的遗传多样性相对丰富,居群间的遗传分化为14.16%,大部分位点均表现偏离Hardy–Weinberg平衡,杂合度不足,居群间基因交流少。
关 键 词:烟草;种质资源;简单序列重复;遗传多样性
投稿网址:http://xb.ijournal.cn
烟草种质资源可划分为野生烟、烤烟、晾晒烟、香料烟、白肋烟、黄花烟和雪茄烟几种类型[1]。烟草是最早应用于分子生物学和基因工程研究的模式植物之一[2]。由于烟草育种使用的亲本日趋集中,导致育成烟草品种的遗传背景较为狭窄,产量和质量的进一步提高受到限制。对现有的烟草种质资源进行遗传多样性研究,可为挖掘现有种质资源、筛选有利基因提供理论指导。近年来利用分子标记技术对烟草种质遗传多样性进行了较为广泛的研究。用于种质资源鉴定及育种的分子标记主要有RFLP、RAPD、AFLP、SSR[3],简单序列重复(SSR)被认为能最有效检查种群内遗传多样性和种群之间的差异[4–5]。2007年,Bindler等[6]利用282对SSR引物绘制出烟草微卫星标记遗传图谱。聂琼等[7]利用SSR和ISSR标记分析了23份烟草种质的遗传多样性,结果显示 SSR引物能够对烟草差异进行分析。陈杰等[8]利用69份烤烟种质资源进行形态学标记和SSR分子标记多样性分析,发现分子标记技术为确定品种间的遗传差异提供了可靠的检测方法,形态学标记特征则受环境的影响较大。杨柳等[9]利用14对SSR引物对25份烟草种质资源进行亲缘关系与遗传多样性分析,结果表明,SSR标记可有效用于烟草种质遗传多样性研究。这些研究大多针对烤烟种质资源,而对晾晒烟、香料烟及黄花烟种质资源遗传多样性的研究涉及少。笔者收集了晾晒烟、黄花烟、香料烟等共80份种质材料(分别来自中国、美国、波兰、津巴布韦、日本、保加利亚等多个国家),利用SSR分子标记对烟草种质资源进行遗传多样性研究,以期为烟草种质资源利用、有利基因发掘和品种选育提供理论依据。
1 材料与方法
1.1 材料
选取的80份烟草种质,来自多个国家和地区,包含白肋烟、黄花烟、香料烟、晾晒烟几种类型,另有18份为未知类型(表1)。

表1 烟草种质资源Table 1 Nicotiana tabacum germplasm
1.2 方法
烟草种子播于河南农业大学试验园区。采集烟草苗期幼嫩叶片于2 mL离心管中,并迅速放入液氮罐中冷冻,置于–70 ℃超低温冰箱中保存备用。
1.2.1 烟草基因组DNA的提取
将冷冻烟草幼叶置于磨样机上研磨,磨碎后用TaKaRa新型植物基因组DNA提取试剂盒(宝生物工程(大连)有限公司)提取基因组DNA。经2%琼脂糖凝胶电泳检测其完整性后,用紫外分光光度计检测DNA纯度与浓度,将其稀释至10 ng/μL,–20 ℃保存,备用。
1.2.2 PCR扩增与引物筛选
采用Bindler等[10]公开发表的引物及童治军[11]设计的SSR引物200对,引物合成由苏州金唯智生物有限公司完成。
SSR–PCR反应体系为 10 μL:2 μL基因组DNA,0.6 μL Mg2+,1 μL 10×Buffer,0.15 μL dNTP,0.1 μL rTaq酶,带荧光标记的M13正向引物0.1 μL,正向引物0.05 μL,反向引物0.15 μL,水5.85 μL。PCR程序:94 ℃预变性5 min;94 ℃模板变性 30 s,引物和模板充分退火(各引物退火温度不同)30 s,72 ℃ 延伸30 s,循环30次,最后72 ℃延伸5 min,4 ℃保存。进而对80个烟草种质进行引物筛选,最终选出条带清晰、多态性高的SSR引物对所有材料进行遗传多样性分析。
1.2.3 毛细管电泳检测及数据分析
吸取2 μL PCR产物加于有6 μL变性剂的384孔板中,95 ℃变性5 min。PCR产物用ABI–3500xl自动分析仪进行检测,用Genographer软件进行条带读取。在不同位点上将有条带的记录为1,无条带记为0。根据相对分子质量大小对扩增结果读带,从大到小一次记为A,B,C…,只有1条带的为纯合子,记为AA,BB,CC…,2条带的为杂合子,记为AB,BC,AC…。统计每条引物在不同个体中的扩增情况。利用Popgene3.2软件计算遗传多样性指标;用NTSYSpc Version 2.10e软件对80份种质资源材料进行聚类分析。
2 结果与分析
2.1 PCR扩增和引物筛选结果
从200对SSR引物中筛选出69对条带清晰、杂带少且多态性高的引物。图1为其中几对引物的筛选结果,后3对引物多态性较低,前2对引物杂带较少,多态性高,可用于遗传多样性分析。

图1 部分引物的筛选结果Fig. 1 Screening results for part of the primers
2.2 SSR标记的遗传多样性分析
80个烟草种质的遗传多样性分析结果(表 2)表明,69对 SSR引物检测等位基因数(Na)平均值为4.913个。位点TM10136等位基因数为22个,其等位基因数最多。有效等位基因数(Ne)的平均值为2.999 7个,TM10081的等位基因数最少,为1.148 8个;位点TM10136的有效等位基因数最大,为15.860 2。观测杂合度(Ho)变化范围为0.038 0~0.987 3,平均值为0.276 4;期望杂合度(He)的变化范围为0.130 4~0.942 9,平均值为0.574 7。平均Nei’s多样性指数(H)为0.571 1,平均Shannon’s信息指数(I)为1.082 6。不同位点间遗传差异存在差别,He的平均值大于0.5,表明研究所用的SSR位点的遗传多样性相对丰富,显示烟草遗传多样性方面存在较大差异。
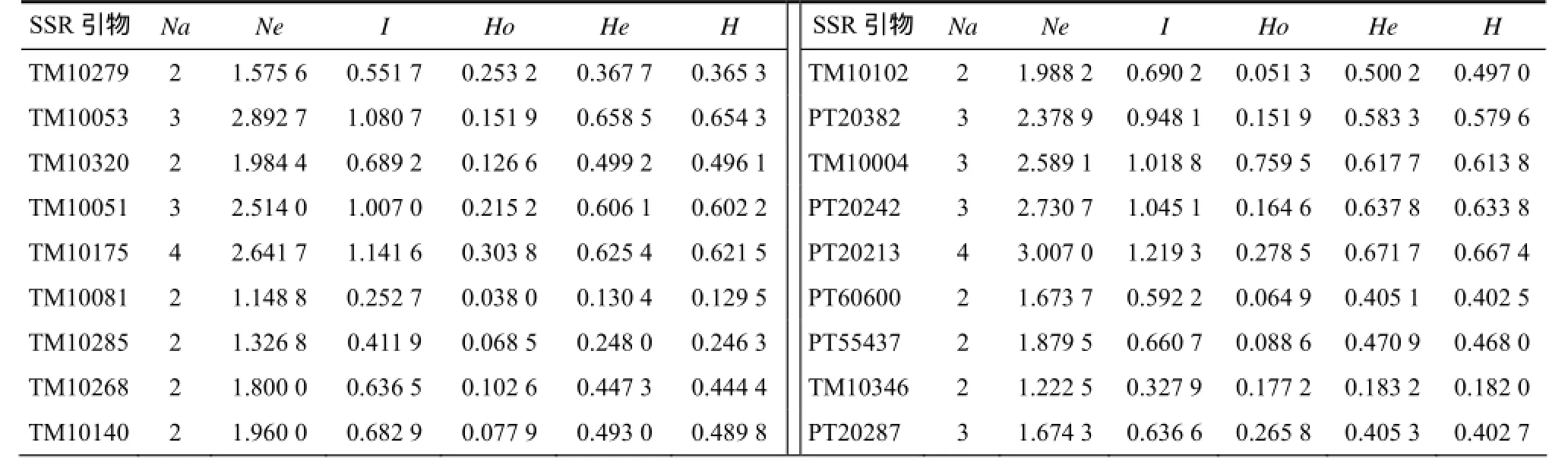
表2 烟草种质资源的遗传多样性Table 2 Genetic diversity of Nicotiana tabacum germplasm
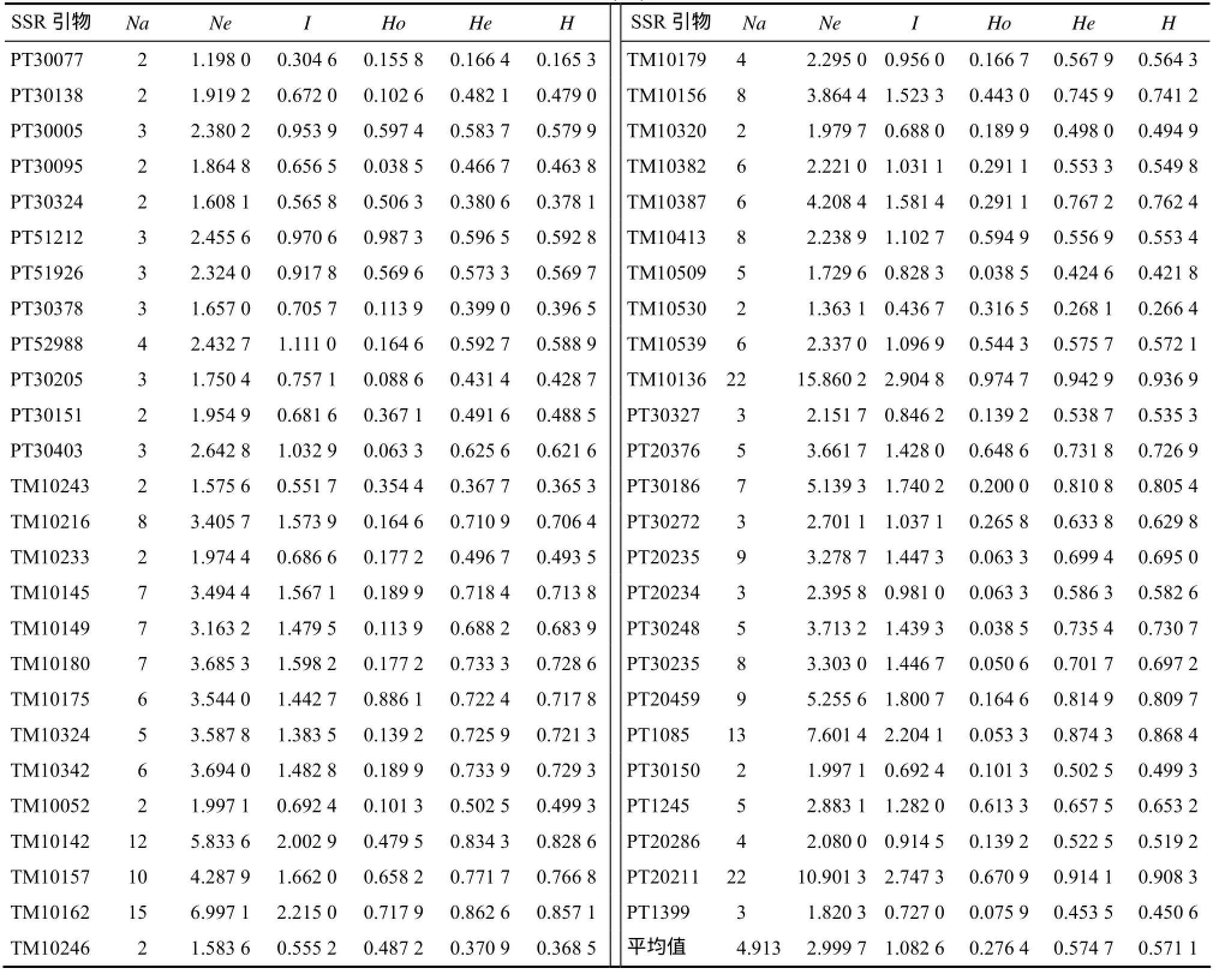
表2 (续)
2.3 基于SSR标记的烟草种质遗传多样性的聚类
根据69对SSR引物扩增的503条多态性条带0–1数据统计结果,利用NTSYSpc Version2.10e软件,采用UPGMA法聚类得到80份烟草种质的聚类树状图(图2),在相似系数为0.65处可划分为2个类群,第Ⅰ类群包括62个种质,第Ⅱ类群包括18个种质,其中,Pobeda3与巴斯玛16号、Szabolcsi与北大CA04相似系数最大,为0.90,遗传差异较小,亲缘关系较近;Krusevacki Prosocan与朝刀烟的相似系数最小,为0.55,遗传差异明显,亲缘关系较远。
2.4 烟草种质的遗传分化
由80份烟草种质的遗传分化结果(表3)可知,其遗传分化系数(Fst)的变化范围为0.009 1~0.295 5,平均值为0.141 6,即有14.16%的遗传变异存在于群体间,85.84%变异存在于群体内,居群内的遗传分化大于居群间的遗传分化,居群内变异是居群的主要变异来源。烟草居群间的基因流(Nm)的变化范围为0.596 1~27.279 5,平均值为1.515 3,基因流较小,表明居群间的基因交流较弱,PT51212位点基因流最大,为 27.279 5。居群内偏离 Hardy–Weinberg平衡的程度(Fis)为–0.651 6~0.936 3,其中PT30248位点最高,为0.936 3,说明位点PT30248在各居群内偏离Hardy–Weinberg平衡程度最大,纯合度高;PT51212位点最低,说明该位点偏离Hardy–Weinberg平衡程度最小,纯合度偏高;偏离Hardy–Weinberg平衡程度的平均值为0.422 2,多数位点表现纯合度偏高。总居群偏离Hardy–Weinberg平衡程度(Fit)为–0.636 6~0.967 4,其中PT1085位点的Fit最大,表明该位点在总居群纯合度偏高;PT51212位点的Fit最小,该位点杂合度偏高。Fit的平均值为0.504,总居群杂合子不足。
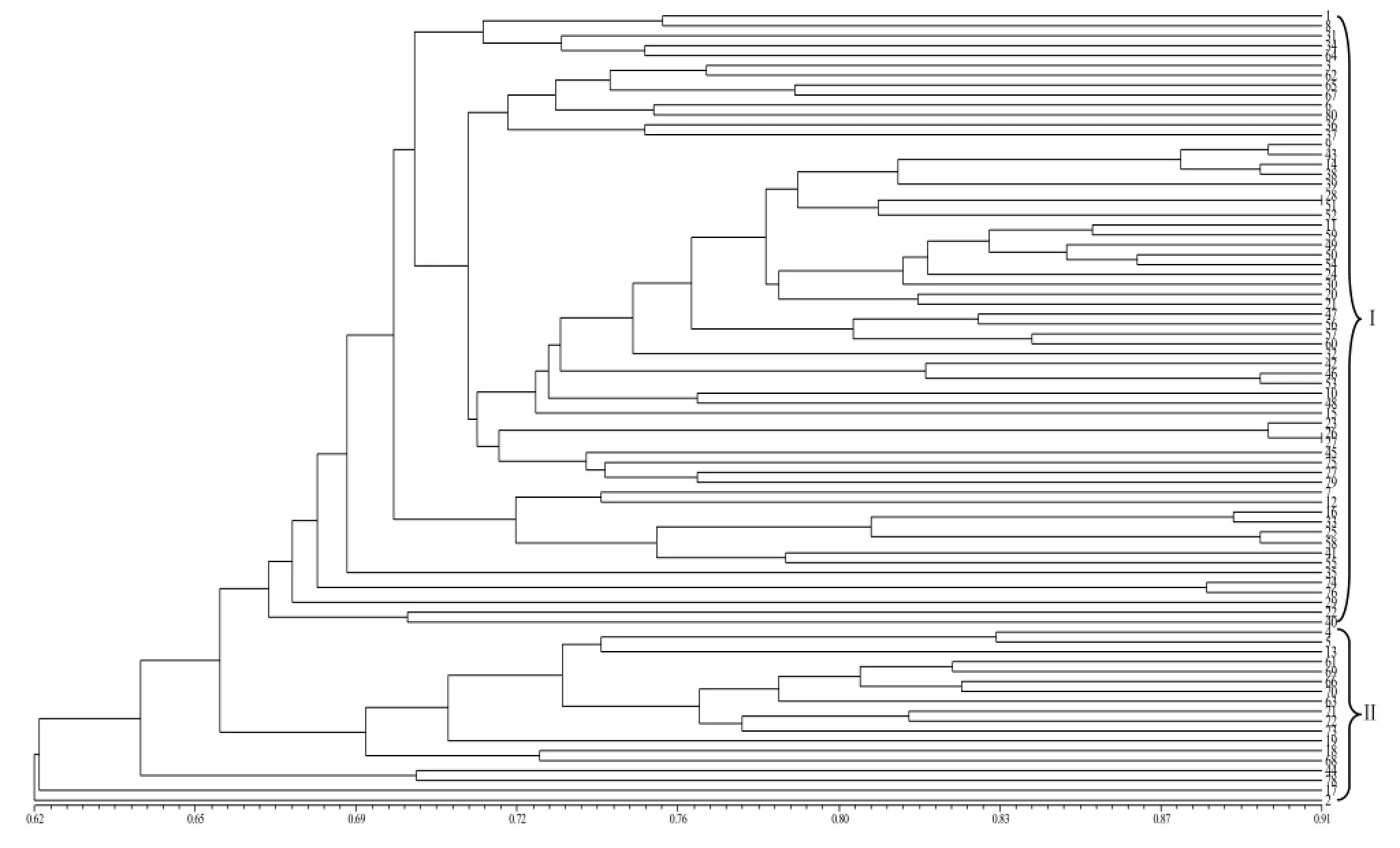
图2 烟草种质资源聚类Fig.2 Dendrogram of Nicotiana tabacum based on SSR data

表3 烟草种质资源F–统计量和基因流Table 3 F–statistics and gene flow for Nicotiana tabacum germplasm

表3 (续)
2.5 居群间遗传距离、遗传一致度及不同居群的UPGMA聚类分析
为进一步分析烟草种质资源居群间的遗传关系,根据烟草种质类型,将其分为5个居群,即黄花烟、晒烟、白肋烟、香料烟及未知类型。计算 5个居群间的遗传距离(GD)和遗传一致度(GI)。结果(表4)表明,晒烟与黄花烟遗传距离最大,为0.427 1,遗传一致度最低,为0.652 4;香料烟与白肋烟2个居群遗传距离最小,为0.054 9,遗传一致度最高,为0.946 6。
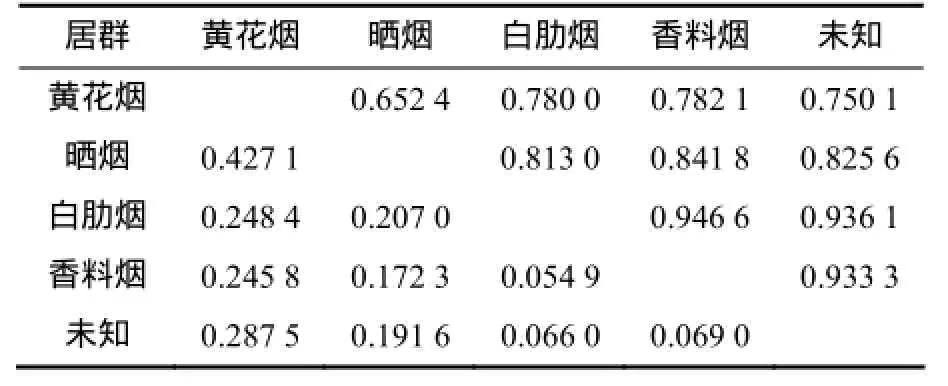
表4 烟草类群间的Nei’s遗传距离(左下三角)和遗传一致度(右上三角)Table 4 Nei’s genetic distance (diagonal below) and genetic identity (diagonal ab ove) be tween Nicotiana tabacum populations
根据DNA扩增统计结果,采用POPGEN1.31软件计算出5个居群的遗传一致度为0.652 4~0.946 6。遗传聚类图(图3)显示,香料烟与白肋烟聚在一起,黄花烟与其他4个居群遗传距离较远;未知居群和香料烟、白肋烟居群聚集在一起,未知居群内可能包括香料烟和白肋烟种质。
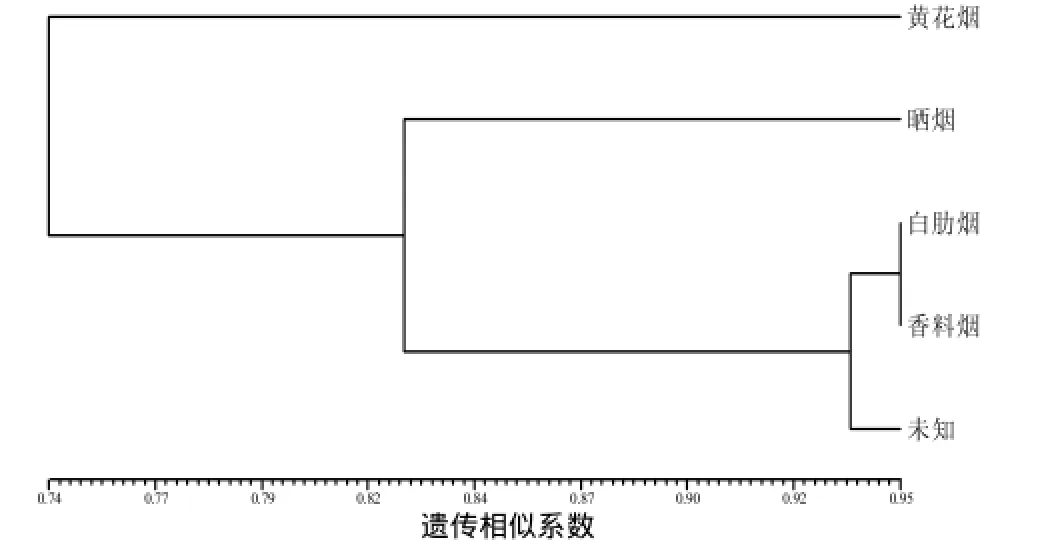
图3 基于遗传一致度(GI)的5个居群的UPGMA聚类Fig.3 UPMGA dendrogram among 5 populations based on GI
3 讨论
中国烟草种类较多,分布较广。国内对烤烟品种的遗传多样性研究较多,传统的方法是根据形态学特征进行遗传变异分析,这种方法易受到自然环境及人为因素的影响[12]。以分子标记为基础的遗传多样性分析更具可靠性和准确性。SSR标记具有多态性丰富、大多数为共显性标记等优点。SSR的多态性往往仅有几个碱基对的差异,常规PAGE电泳技术只能用分子量Maker作为对照,以肉眼粗略地估计片段大小,无法对产物进行定量,不能准确读出分子片段大小,且不同批次之间的扩增条件、电泳时间条件不一致,导致数据采集分析时对数据整合有一定的困难。刘晓鑫等[13]将ABI全自动遗传分析仪分析法与聚丙烯酰胺凝胶电泳银染法进行对比,总结了ABI全自动遗传分析仪的优点:可准确读出每个等位基因片段大小;高度自动化与程序化;可精确定量扩增产物。本研究也是基于ABI–3500xl全自动测序分析仪,因而得出的结果应准确可靠。
遗传多样性丰富是维持物种长期生存的基础,一个只有纯合子构成的物种会因不断变化的环境压力而难以长期维持稳定[14]。刘艳华等[15]利用SRAP标记对81份烟草种质进行遗传多样性分析,结果显示种质材料遗传相似系数为0.11~0.99,种质资源遗传变异丰富。何川生等[16]研究表明,现阶段推广的烤烟品种遗传基础狭窄,主体亲本较集中。本研究结果表明,烟草种质的遗传多样性较丰富,种质资源遗传变异丰富,种间遗传差异较大,黄花烟与其他4个居群的遗传距离较远,这与刘艳华等[15]、Bogani等[17]及 Ren等[18]的研究结果一致。这一结果同时说明,中国对黄花烟种质材料的利用较少。Nei’s遗传多样性指数平均值为0.571 1,Shannon’s多样性指数平均值为1.082 6,表明80份烟草种质遗传变异丰富,有利于烟草品种的选育和遗传改良。类群间基因流较低,种质间基因交流较少,烟草种质资源遗传分化系数高,表明大部分变异来自于居群内,这可能与试验材料有关。由于烟草类型被人为划分,导致不同类型间的烟草种质基因交流较低,遗传分化度较高。Hardy–Weinberg平衡可以用来反映交配系统对基因型频率的影响程度[19]。烟草种质资源大部分位点均偏离 Hardy–Weinberg平衡,杂合度不足,纯合体所占比例高;黄花烟居群与其他类型居群遗传距离较大,提示在育种工作中应当多利用黄花烟为亲本进行杂交,既能够提高烟草种质间的基因流,也能够充分利用杂交优势。
参考文献:
[1] 任民,王志德,牟建民,等.我国烟草种质资源种类与分布状况[J].中国烟草科学,2009,30(增刊):8–14.
[2] 刘建丰,王志德,刘艳华,等.应用SRAP标记研究烟草种质资源的遗传多样性[J].中国烟草科学,2007,28(5):49–53.
[3] 朱思元,陈金湘,刘爱玉,等.利用SSR标记对不同类型抗虫棉品种的遗传多样性分析[J].湖南农业大学学报(自然科学版),2006,32(5):469–472.
[4] Selkoe K A,Toonen R J.Microsatellites for ecologists:a practical guide to using and evaluating microsatellite markers[J].Ecology Letters,2006,9(5):615–629.
[5] Geleta N,Labuschagne,M T.Genetic diversity analysis in sorghum germplasm as estimated by AFLP,SSR and morpho-agronomical markers[J].Biodiversity & Conservation,2006,15(10):3251–3265.
[6] Bindler G,Hoeven R,Gunduz I,et al.A microsatellite marker based linkage map of tobacco[J].Theor Appl Genet,2007,114(2):341–349.
[7] 聂琼,刘仁祥.23份烟草种质遗传多样性的 SSR和ISSR标记分析[J].西南农业学报,2011,24(1):15–19.
[8] 陈杰,杨静,陈建军,等.烤烟种质资源形态学标记及 SSR标记的多样性研究[J].华南农业大学学报,2013,34(4):450–457.
[9] 杨柳,汪斌,童治军,等.25份普通烟草种质资源遗传多样性的SSR标记分析[J].福建农林大学学报(自然科学版),2013,42(2):171–175.
[10] Gregor Bindler,Jorg Plieske,Nicolas Bakaher.A high density genetic map of tobacco (Nicotiana tabacum L.)obtained from large scale microsatellite marker development [J].Theor Appl Genet,2011,123:219–230.
[11] 童治军.烟草微卫星标记的开发与利用[D].杭州:浙江大学,2012.
[12] 王彪,常汝镇,陶莉.分析中国栽培大豆遗传多样性所需引物的数目[J].分子植物育种,2003,1(1):82–88.
[13] 刘晓鑫,谢传晓,赵琦,等.基于SSR荧光标记技术的玉米群体混合样本基因频率分析方法[J].中国农业科学,2008,41(12):3991–3998.
[14] 李俊清.植物遗传多样性保护及其分子生物学研究方法[J].生态学杂志,1994,13(6):27–33.
[15] 刘艳华,王志德,牟建民,等.不同烟草群体间遗传多样性分析[J].中国烟草科学,2009,30(增刊):19–24.
[16] 何川生,何兴金,葛颂,等.烤烟品种资源的 RAPD分析[J].植物学报,2001,43(6):610–614.
[17] Bogani P,Lio P,Intrieri M C,et al.A physiological and molecular analysis of the genus Nicotiana[J].Molecular Phylogenetics and Evolution,1997,7(1):62–70.
[18] Ren N,Timko M P.AFLP analysis of genetic polymorphism and evolutionary relationship among cultivated and wild Nicotiana species [J].Genome,2001,44(4):559–571.
[19] Stark A E.A clarification of the Hardy–Weinberg law[J].Genetics,2006,174(3):1695–1697.
责任编辑:罗慧敏
英文编辑:罗 维
Analysis of genetic diversity of germplasm resources of Nicotiana tabacum
Zhang Mingzhen, Li Xiaohui, Wang Yuan, Xing Xuexia, Xu Shixiao, Yang Tiezhao*
(College of Tobacco Science, Henan Agricultural University, Zhengzhou 450002, China)
Abstract:Total genomic DNA of 80 tobacco materials (originated from China, America, Poland, Zimbabwe, Japan,Bulgaria, Zambia, Terkey, Yugoslavia, India, the Soviet Union, Albania) were amplified by 69 polymorphic SSR markers screened from a total of 200 SSR primer pairsand the length polymorphism of the amplified fragment was analyzed using Biosystems 3500xl Genetic Analyzer. The results revealed that a sum of 503 polymorphic bands were amplified using 69 SSR primer pairs. And an average of 7.91 alleles were observed for each primer pair with average heterozygosity(Ho)0.2764, average expected heterozygosity(He) 0.574 7. Shannon’s index was 1.082 6, Nei’s index was 0.571 1, coefficient of genetic differentiation was 0.141 6, gene flow was1.515 3 and genetic similarity coefficient ranged from 0.55-0.90. The results showed that the genetic diversity of 80 tobacco germplasm was relatively abundant, the genetic differentiation was 14.16% between populations, most sites were seriously deviating from the Hardy Weinberg equilibrium indicating a low heterozygosity and a low gene flow between populations.
Keywords:Nicotiana tabacum; germplasm resources; simple sequence repeat (SSR); genetic diversity
中图分类号:S572.03
文献标志码:A
文章编号:1007−1032(2016)03−0280−07
收稿日期:2016–03–15 修回日期:2016–04–05
基金项目:中国烟草总公司重大项目(110201402004)
作者简介:张铭真(1992—), 女,河南巩义人,硕士研究生,主要从事烟草遗传育种与生理研究,yczhangmingzhen@163.com;*通信作者,杨铁钊,教授,主要从事烟草遗传育种研究,yangtiezhao@126.com
