IFCC促甲状腺激素国际溯源和检测一致性系列研究(三)
2016-07-18陈文霏余小六余枝广
于 翔,陈文霏,余小六,江 明,李 可,余枝广
(广东省深圳迈瑞生物医疗电子股份有限公司免疫试剂开发部 518057)
IFCC促甲状腺激素国际溯源和检测一致性系列研究(三)
于翔,陈文霏,余小六,江明,李可,余枝广△
(广东省深圳迈瑞生物医疗电子股份有限公司免疫试剂开发部518057)
目的采用迈瑞促甲状腺激素(TSH)测定试剂盒,按照国际临床化学和实验室医学联盟(IFCC)甲状腺功能检测标准化委员会(C-STFT)提供的一致性研究方案,测试发放的第二期和第三期健康人体标本和病理标本,验证经过第一期标本重校准后的迈瑞TSH检测结果的一致性;同时尝试将第三期标本作为标准血清盘,建立校准品的计量学溯源性。方法使用迈瑞标准试剂和工作校准品搭配测试IFCC发放的人体病理标本,与C-STFT提供的所有测量程序修剪均值(APTM)比对,评估一致性;使用第三期标本为迈瑞工作校准品赋值,评估重新赋值后的迈瑞TSH测试结果与APTM的一致性。结果使用Passing & Bablok回归,迈瑞测试结果与APTM的斜率为1.0,相关系数(r)大于0.975;但如果采用IFCC第三期标本作为溯源链的最高等级对工作校准品重新赋值,再行计算标本TSH浓度,则结果与APTM不具有理想的一致性。结论通过测试C-STFT统一发放的血清盘和提供的APTM值,实现了迈瑞与国际参与厂家TSH检测结果的一致性;但是,使用标准血清盘建立校准品计量学溯源性的方法还有待研究和商榷。
促甲状腺激素;化学发光免疫分析法;国际临床化学甲状腺功能检测标准化委员会;测量程序修剪均值
自2010年开始,国际临床化学和实验室医学联盟(IFCC)甲状腺功能检测标准化委员会(C-STFT)尝试推出特定的血清盘及所有测量程序修剪均值(APTM)的概念,在全球范围征集了具有代表性的10个厂家的检测系统,包括罗氏、雅培、贝克曼、西门子、迈瑞等,分阶段进行促甲状腺激素(TSH)检测结果一致性的可行性研究[1-2]。迈瑞于2014年加入TSH一致性可行性研究,免疫检测系统CL-2000i和配套TSH试剂盒对首期20例健康人标本的测试结果,满足C-STFT设定的精密度、批间差异控制和方法学比对等性能要求[3-4];从而依次进入了第二期和第三期,除正常标本外,还包括甲状腺功能减退和甲状腺功能亢进症等病理标本的研究工作。C-STFT结合所有参与厂家系统的测试结果,对迈瑞CL-2000i系统TSH测试结果的可靠性和一致性进行了客观地评价;同时,迈瑞根据C-STFT的研究目的,尝试将C-STFT发放的第三期标本作为校准品溯源链中的一个等级,研究C-STFT标准血清盘代替世界卫生组织(WHO)标准品(NIBSC 81/565)直接给校准品赋值的可行性。
1资料与方法
1.1一般资料第二期标本共89份,第三期标本共101份,包含甲状腺功能减退、正常和甲状腺功能亢进症标本,均由Invent和Solomon Park Research Laboratories (www.solomonpark.com)两个商务机构收集[5]。第三期高值标本部分来源于服用高剂量表达TSH药物(Thyrogen)的患者,标本一式两份,每份0.5 mL。标本长期冻存,运送过程温度控制在-20 ℃以下。这些血清标本TSH的浓度,来自已经完成一致性研究的数个国际生产厂家检测系统的具有代表性的测试结果[6];C-STFT通过因子分析(FA)模型对厂家测试结果进行统计处理,一些明显离群值被剔除,取而代之以模拟的数值,最终获得各标本的APTM[7-8]。
1.2方法采用经第一期标本测试结果重校准后的迈瑞CL-2000i全自动化学发光免疫检测系统,包括CL-2000i发光仪,及配套的TSH试剂盒、迈瑞工作校准品和甲状腺功能复合质控品。测试前须完成仪器维护并通过基础性能验证。标本测试前后,甲状腺功能复合定值质控品的测试结果均应在靶值±2s范围内。
1.3C-STFT标本测试第二期标本共89份(其中6份因部分国际厂家TSH试剂盒检测灵敏度过低,无法获取浓度值,从而APTM值无法计算);标本按随机顺序正序测试一次,再逆序测试一次,用以评估检测系统随时间的漂移,及监测可能发生的跳变。第二期标本测试结果通过C-STFT审核后,进入第三期标本的测试;第三期标本共101份,同一标本一式两份,在不同的日期复融和开瓶,混匀后各测试一次,每个标本共得到两批测试结果。
1.4C-STFT血清盘作为溯源标准的尝试使用C-STFT第三期标本作为标准血清盘,以标本APTM为标定值,以迈瑞CL-2000i系统测试所得标本的相对发光值拟合4参数对数校准曲线,根据工作校准品的相对发光值测试结果,计算出迈瑞工作校准品的标定浓度;以迈瑞工作校准品新的标定浓度重新计算第一期和第二期的标本测试结果,并评估与APTM的一致性。
2结果
仪器基础性能测试结果满足要求。在C-STFT标本测试前、后,用迈瑞TSH试剂盒检测内部质控结果均在靶值±2s内,系统均在控。第二期标本正序(Run 1)和逆序(Run 2)测试所得两批测试结果的漂移和跳变分析见图1,结果表明两批测试结果之间无漂移和跳变。迈瑞测试结果均值相与APTM的相关系数(r)大于0.975;Passing & Bablok回归线斜率约为1.0,见图2;同时说明经过第一期标本测试结果重校准后,迈瑞测试结果与APTM已实现一致性,不需要再进行重校准。
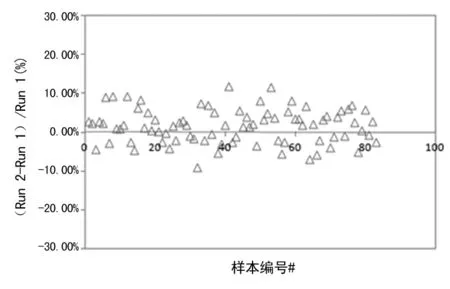
图1 第二期标本测试结果漂移与跳变
第三期标本两批测试结果(Run 1和Run 2)无漂移和跳变,见图3;迈瑞测试结果均值与APTM的r大于0.975,Passing & Bablok回归线斜率在0.9~1.1,见图4;以上分析均不包括系统检测范围以外的点;测试结果符合C-STFT的要求,已获准参与第四期参考范围的研究工作。
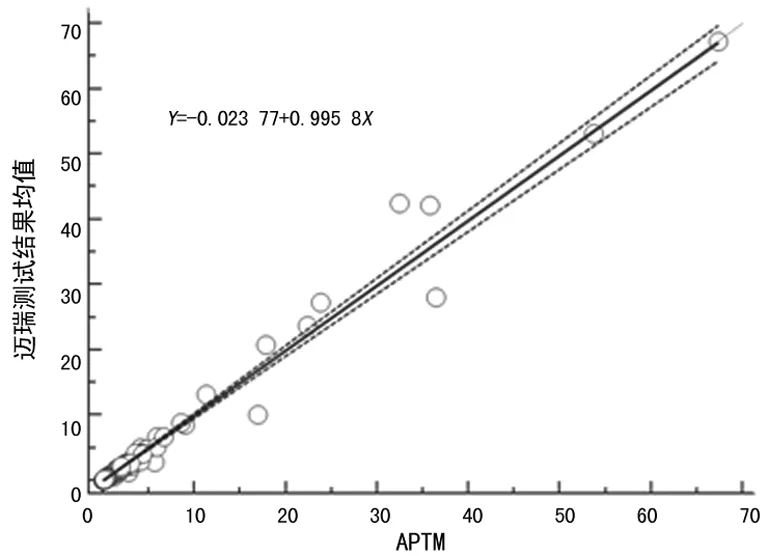
图2 第二期标本Passing & Bablok回归
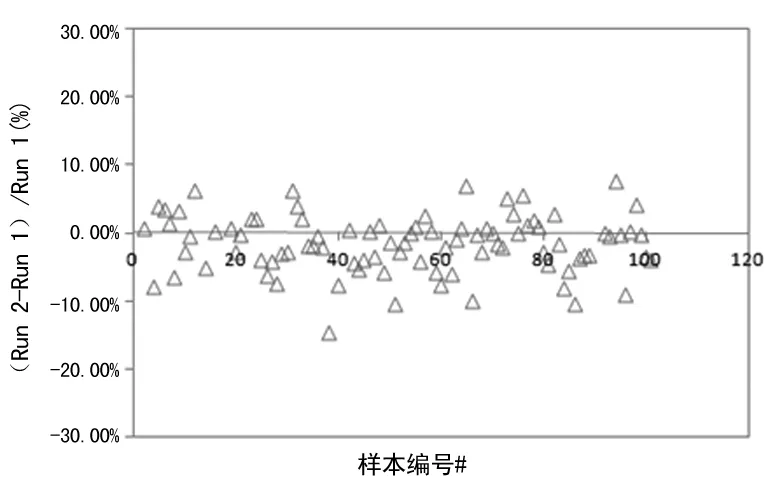
图3 第三期标本测试结果漂移与跳变
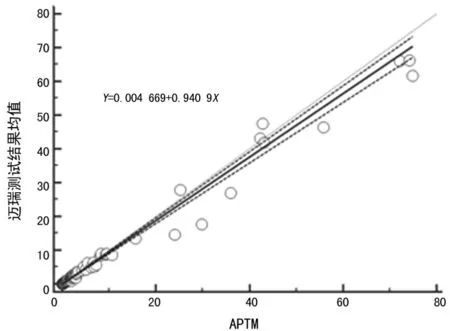
图4 第三期标本Passing & Bablok回归

注:WHO为世界卫生组织,IFCC为国际临床化学与实验室医学联盟;APTM为所有测量程序修剪均值。
图5校准品溯源链
笔者尝试根据C-STFT的意图,将标准血清盘作为校准品溯源链的一个等级,见图5,建立迈瑞TSH校准品计量学溯源性;使用第三期标本校准迈瑞CL-2000i系统为迈瑞工作校准品赋值,获得系统主校准曲线,见图6;使用该校准曲线重新校准计算C-STFT第一期和第二期标本的浓度值,并评估与APTM的一致性。结果表明如果迈瑞校准品溯源至C-STFT第三期病理血清盘,则难以实现C-STFT第一期和第二期标本测试结果与APTM的一致性,见图7~8。
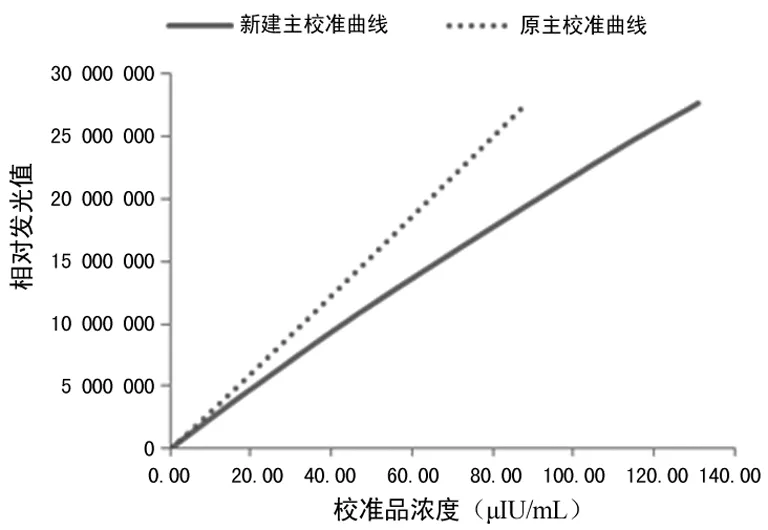
图6 新建主校准曲线
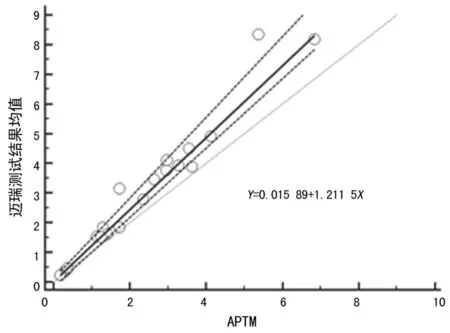
图7 第一期标本测试结果重新计算
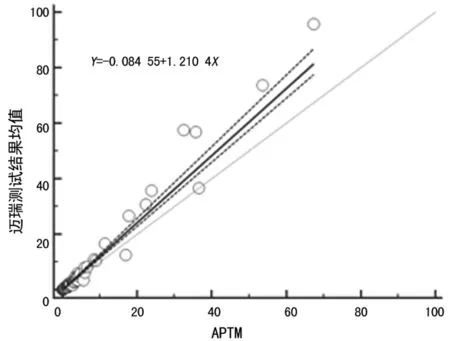
图8 第二期标本测试结果重新计算
3讨论
对于第二期和第三期标本,C-STFT汇总各个参与厂家的测试数据,结果显示病理标本比第一期的正常标本趋于复杂,数据质量有所下降;在低值区域,有3~6个国际厂家检测系统灵敏度过低,对小于0.04 mIU/L的标本测量误差过大,不能给出可靠的浓度值,无法纳入APTM的统计计算;大约有2%左右的标本检测结果在某些系统呈现为离群值,需要模拟出替代值用于APTM的计算。
对于第一期健康人体标本的测试,迈瑞根据测试结果对校准曲线进行了修正,实现了与APTM的一致性;但是这个过程并没有建立计量学溯源性,因为校准品浓度值与C-STFT标本之间并无校准溯源链联系。目前厂家广泛使用WHO的TSH标准品可能存在基质效应和互换性问题。因此,笔者尝试借助浓度覆盖整个检测范围的第三期标本,对迈瑞校准品进行赋值实验,验证具有APTM标定值的C-STFT血清盘用以替代WHO标准品是否可行。结果表明,直接由血清盘为校准品赋值,很难实现真实标本在不同检测系统上最终测试结果的一致性。其主要原因是血清盘标本浓度的分布不均和高浓度标本测试质量的影响:大多数标本的浓度主要集中在参考范围附近,但较少数的高值标本由于浓度值远大于参考范围浓度,在拟合校准曲线时所占权重较大;因此高值测试结果的少许偏离,都会直接影响主校准曲线的形状,并最终导致了标本测试结果失去了一致性;这将是所有厂家在尝试使用C-STFT血清盘为校准品赋值时所面临的一个共同的问题。
综上所述,使用C-STFT未来推出的标准血清盘作为TSH校准品溯源链的一个等级,对于实现不同检测系统测试结果的一致性可能存在风险;需要对标准血清盘的制备方法和使用方法,与IFCC及其他国际代表性厂家进一步研究和探讨。
[1]Thienpont LM.Traceability to a common standard for protein measurements by immunoassay for in-vitro diagnostic purposes[J].Clinica Chimica Acta,2010,411(23):2058-2061.
[2]van Uytfanghe K,Linde A,Thienpont LM.A “Step-Up” approach for harmonization[J].Clinica Chimica Acta,2014,432(1):62-67.
[3]闫玉峰,张娟,李可,等.IFCC促甲状腺性激素(TSH)国际溯源和检测一致性系列研究[J].国际检验医学杂志,2016,37(4):496-498.
[4]于翔,陈文霏,余小六,等.IFCC促甲状腺性激素(TSH)国际溯源和检测一致性系列研究(二)[J].国际检验医学杂志,2016,37(6):751-753.
[5]van Houcke SK,Thienpont LM.“Good samples make good assays”-the problem of sourcing clinical samples for a standardization project[J].Clin Chem Lab Med,2013,51(5):967-972.
[6]Thienpont LM,van Uytfanghe K,van Houcke S,et al.A progress report of the IFCC committee for standardization of thyroid function tests[J].Eur Thyroid J,2014,3(2):109-116.
[7]Stǒckl D,Van Uytfanghe K,van Aelst S,et al.A statistical basis for harmonization of thyroid stimulating hormone immunoassays using a robust factor analysis model[J].Clin Chem Lab Med,2014,52(7):965-972.
[8]van Houcke SK,van Aelst S,van Uytfanghe K,et al.Harmonization of immunoassays to the all-procedure trimmed mean-proof of concept by use of data from the insulin standardization project[J].Clin Chem Lab Med,2013,51(5):e103-e105.
2016-01-28修回日期:2016-03-18)
10.3969/j.issn.1673-4130.2016.12.054
A
1673-4130(2016)12-1719-03
·临床研究·
