激光共聚焦检测双酚A致精母细胞损伤后线粒体膜电位的变化
2016-07-18王丽婷孙
王丽婷孙 玮*
激光共聚焦检测双酚A致精母细胞损伤后线粒体膜电位的变化
王丽婷①孙 玮①*

王丽婷,女,(1982- ),本科学历,实验师。第三军医大学生物医学分析测试中心,从事生物医学分析测试工作。
目的:运用激光扫描共聚焦显微镜(LSCM)技术检测双酚A(BPA)致精母细胞损伤后线粒体膜电位的变化,探讨其作用机制。方法:将培养的GC-2小鼠精母细胞分为对照组、低剂量组和高剂量组,分别加入0、10 μmol/L、100 μmol/L的BPA,一同培养3 h后使用荧光探针JC-1对3个组样本分别进行标记,采用LSCM检测胞内线粒体内JC-1荧光强度的变化。利用LSCM专用软件分析荧光强度,通过荧光颜色的转变检测线粒体膜电位的变化,用红绿荧光的相对比例衡量线粒体去极化的比例。结果:对照组、低剂量组和高剂量组之间红绿荧光的比值有着显著差异。BPA低剂量组和高剂量组的胞内线粒体膜电位明显低于对照组,而高剂量组的胞内线粒体膜电位较低剂量组低。结论:BPA对精母细胞有损伤,且随着剂量加大,损伤越严重。LSCM技术方法灵敏度高,能够实时监测细胞内线粒体膜电位的变化。
激光扫描共聚焦显微镜;双酚A;精母细胞;线粒体膜电位;荧光成像;荧光探针JC-1
10.3969/J.ISSN.1672-8270.2016.02.034
①第三军医大学生物医学分析测试中心 重庆 400038
[First-author’s address] Biomedical Analysis Center, Third Military Medical University, Chongqing 400038, China.
随着工业技术的发展,存在于环境中一些人工合成的化学物质具有体内雌激素的生物效应可干扰实验动物体内正常的内分泌功能,并可造成动物的雄雌性别改变及畸形,这类物质称为环境雌激素,已经成为人类健康的潜在威胁[1]。
双酚A[双酚基丙烷(bisphenol A,BPA)]是烷基酚类环境雌激素的一种,作为工业生产聚碳酸脂、环氧树脂的前体物质,是塑料制品、合成树脂的重要原料和添加剂。BPA被广泛应用于食品、牙齿密封剂及婴儿奶瓶等家用器具的制造[2]。当这些物品反复使用或暴露于高温、酸和碱的环境中时,BPA则会从中释放或溶出,人体可通过食物和水经常暴露低剂量的BPA[3]。BPA的化学结构与雌激素类似,具有弱雌激素活性及较强的抗雄激素活性,能直接或通过其衍生物干扰生物的正常内分泌功能,BPA可导致生精细胞大量凋亡[4-6]。
线粒体是细胞内重要的细胞器,是细胞进行有氧呼吸和能量代谢的中心。作为细胞内氧化磷酸化的主要场所,细胞内约90%的氧在线粒体被消耗,因此线粒体在维持细胞生命活动中起着极为重要的作用。线粒体的损伤可致线粒体膜屏障功能减弱甚至丧失、跨膜电位降低、细胞能量供应中断以及凋亡因子释放等并激活下游凋亡信号通路,这些改变将直接或间接导致细胞凋亡和坏死[7-8]。而线粒体膜电位的下降是细胞凋亡早期的一个标志性事件。
本研究使用线粒体膜电位探针JC-1标记精母细胞线粒体,同时应用激光扫描共聚焦显微镜(laser scanning confocal microscope,LSCM)技术,通过JC-1荧光从红色到绿色的转变检测细胞膜电位的变化,从而探讨不同剂量的BPA作用于体外培养精母细胞引起线粒体膜电位的变化诱发细胞早期凋亡的分子机制。
1 实验材料与方法
1.1 实验材料
(1)仪器。采用TCS SP5型激光扫描共聚焦显微镜(德国,徕卡公司)。
(2)试剂。JC-1荧光探针(碧云天,中国南通);Tyrode’s盐溶液,含NaCl 115 mmol/L,KCl 5.4 mmol/L,MgCl21 mmol/L,NaH2PO41 mmol/L、CaCl21.8 mmol/L,HEPES 5 mmol/L,葡萄糖 10 mmol/L,pH=7.4。DMEM培养基,含葡萄糖4.5 g/ L,L-谷氨酰胺4.5 g/L,丙酮酸钠110 mg/L,盐酸吡哆醇110 mg/L,10%的胎儿牛血清(洛根,UT)和青霉素-链霉素100 U/ml。
(3)耗材。共聚焦成像专用培养皿GBD-35-20 (NEST Biotechnology Co.LTD.耐思生物科技有限公司,无锡)。
(4)细胞。GC-2小鼠精母细胞系(第三军医大学劳动卫生学教研室刘川惠赠)。
1.2 实验方法
1.2.1 细胞培养
将获得的精母细胞系使用DMEM+10%胎牛血清培养于37 ℃、5%CO2环境。
1.2.2 细胞处理
细胞在对数生长期时,分为对照组(无处理),低剂量组(BPA 10 μmol/L),高剂量组(BPA 100 μmol/L)3组,分别处理3 h。
1.2.3 细胞荧光标记
(1)JC-1工作液配制。向装有JC-1(200×)1 μl的EP管中加入超纯水160 μl,JC-1缓冲液40 μl,颠倒混匀后避光放置。
(2)染色缓冲液配制。取JC-1染色缓冲液(5×)100 μl置于500μl的EP管中,向EP管中加入400μl超纯水(1∶4),配制适量的JC-1染色缓冲液(1×)放置于冰浴中。按同样的步骤再配制2管染色缓冲液。
(3)细胞荧光标记。单层贴壁细胞用PBS漂洗2次后,向每个培养皿中加入JC-1染色工作液100 μl,混匀,于37 ℃条件下孵育20 min。37 ℃孵育结束后,吸除上清,用JC-1染色缓冲液(1×)洗涤2次。向每个培养皿加入2 ml培养液,使用LSCM进行检测。
1.2.4 细胞内线粒体膜电位检测
使用LSCM检测对照组、低剂量组和高剂量组胞内线粒体膜电位的变化。
1.2.5 仪器参数的设置
JC-1单体的最大激发波长为514 nm,最大发射波长为529 nm;JC-1聚合物的最大激发波长为585 nm,最大发射波长为590 nm。据此,设置单体的激发波长为488 nm,聚合物的激发波长为561 nm。使用63×油浸物镜(数值孔径1.40)。所有图像在同一条件(针孔大小、光电倍增管电压高低等)下采集。
1.3 统计学方法
采用SPSS 11.0软件进行数据统计。每组样本数均为100(n=100),数据以均数±标准差(±s)表示,两组间均数的比较采用非配对t检验,以P≤0.01为差异有统计学意义。
2 结果
2.1 LSCM检测图像
JC-1染料表现出电势依赖性的积聚在线粒体内,可以检测细胞、组织或纯化的线粒体膜电位。当细胞处于理想状态时线粒体膜电位较高,JC-1聚集在线粒体的基质(matrix)中,形成聚合物(J-aggregates)可产生红色荧光;当细胞受到不同程度损伤后线粒体膜电位会逐渐降低,JC-1不能聚集在线粒体的基质中,此时JC-1解聚为单体(monomer)可产生绿色荧光。因此,细胞颜色的变化非常直接的反映出线粒体膜电位的变化。
(1)线粒体的去极化程度通过红绿荧光强度的比值衡量,精母细胞在正常培养条件下,表现为绿色荧光弱或红色荧光强,如图1-Control所示。
(2)加入10 μmol/L BPA培养3 h后,表现为绿色荧光略有增强,红色荧光略有减弱,如图1-10 μmol/ L BPA所示。
(3)随着BPA处理浓度进一步升高,绿色荧光明显强于对照组和低剂量组,红色荧光除个别细胞比较强以外,主要也成下降趋势,如图1-100 μmol/L BPA所示。
2.2 LSCM检测细胞内荧光比率变化
图1显示,细胞染毒3 h后与对照组相比,10 μmol/L和100 μmol/L BPA低剂量组和高剂量组细胞JC-l聚合物红光和(或)JC-1单体绿光的值降低非常显著;与10 μmol/L BPA低剂量组和高剂量组相比,100 μmol/LBPA低剂量组和高剂量组细胞JC-l聚合物红光和(或)JC-1单体绿光的值显著降低(t=21.61,t=18.48;P<0.05),表明随处理浓度(10μmol/L和100μmol/L)的升高,细胞线粒体膜电位显著下降;对照组及低剂量组和高剂量组胞内JC-1红和(或)绿荧光比率测定值见表1。

图1 不同浓度BPA处理后的GC-2精母细胞系JC-1荧光图像
3 讨论
线粒体是细胞内重要细胞器,线粒体膜电位是指线粒体内膜两侧离子浓度不同所产生的跨膜电位差,是三磷酸腺苷(adenosin triphosphate,ATP)合成和释放的动力,该跨膜电位对维持线粒体正常功能是必要的,是评价线粒体功能的敏感指标[9]。研究表明,线粒体是介导细胞凋亡的重要细胞器。凋亡机制的深入研究表明,在所有诱导剂引起的各种类型的细胞凋亡中均出现线粒体膜电位下降,并且这种改变发生于凋亡细胞的形态学改变之前,提示线粒体膜电位下降为凋亡早期阶段。有实验研究证明,一旦出现线粒体膜电位下降,细胞即进入不可逆的凋亡过程[10-11]。精母细胞是介导生殖功能的雄性生殖细胞,线粒体膜电位的下降可导致精母细胞功能变化,可能是精母细胞功能障碍的原因之一。因此,线粒体膜电位的下降可作为观测毒物对精母细胞功能的重要指标之一。
表1 双酚A处理后细胞内JC-1红绿荧光比值的变化(±s)
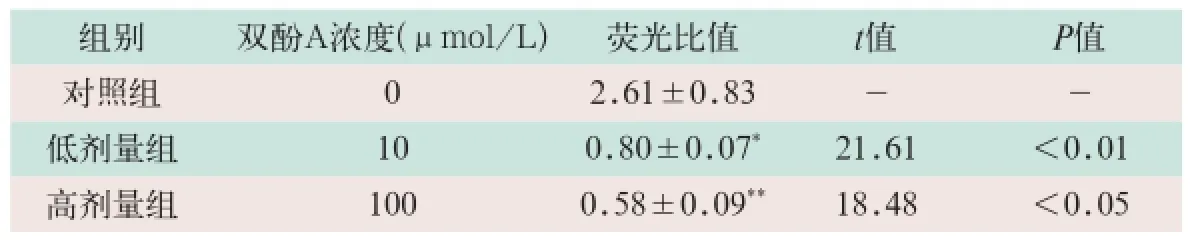
表1 双酚A处理后细胞内JC-1红绿荧光比值的变化(±s)
注:表中*为低剂量组与对照组比较;**为高剂量组与低剂量组比较。
低对组 剂照别 量组 组双酚A浓度1 00 ( μ mol/L) 0 2.荧.860 光1±±比00.值.087 3*21 t值-.6 1 <P0-值.01高剂量组 100 0.58±0.09**18.48 <0.05
BPA是塑料制品的主要环境污染成分,可能是导致男性生殖功能损伤的重要因素。既往研究发现,BPA可能损伤线粒体功能,有数据表明,BPA暴露增加细胞色素C,诱导凋亡因子Caspase-3和Caspase-9以及Bax的蛋白和mRNA的表达水平,增强Caspase-3和Caspase-9的活动,并增加生精细胞凋亡指数。此外,BPA暴露后观察到线粒体结构异常以及Bcl-2基因和蛋白表达水平减少。这些结果表明,线粒体途径凋亡参与介导BPA暴露引起的生殖系统功能损害[12]。BPA暴露后可以导致细胞内的过氧化物酶和线粒体超氧化物增多,并在较低剂量下观察到双酚A损害肝脏线粒体功能[13-14]。实验证明,青春期BPA暴露引起睾丸生殖细胞凋亡不仅通过Fas、FasL信号转导通路,而且也通过线粒体凋亡途径[15]。
本实验研究发现,BPA具有降低精母细胞线粒体膜电位的作用,提示线粒体膜电位降低是导致精母损伤的可能机制。本实验研究以红和(或)绿荧光强度的比值来衡量线粒体膜电位变化,该实验得到的结果可知,BPA作用于精母细胞即出现线粒体膜电位的降低。低剂量组和高剂量组较正常对照组线粒体膜电位下降非常显著;BPA高剂量组较低剂量组线粒体膜电位下降有显著性差异。鉴于红和(或)绿荧光强度的比例越小,胞内线粒体膜电位下降越显著,表明BPA对精母细胞有损伤,且随着剂量加大损伤越严重。BPA处理精母细胞线粒体膜电位的降低,表示精母细胞出现早期凋亡,证明BPA可能具有导致精母细胞损伤的能力,提示BPA具有男性生殖系统损伤的潜在能力。
4 结论
目前线粒体膜电位的检测方法主要有LSCM技术及流式细胞技术。流式细胞仪能够一次检测多个细胞(通常>10000个),得到统计数据,避免个体差异,但是需要先把细胞消化成单细胞悬液,可能会造成细胞损伤。而LSCM检测比较简单,观察效果直观,方便且实用。本实验采用体外培养的雄性小鼠精母细胞,采用以不同剂量的BPA进行诱导,建立双酚A的损伤模型,以JC-1进行负载,通过激光扫描共聚焦显微镜获取细胞内线粒体膜电位的图像,不仅能定量分析不同低剂量的BPA能够引起精母细胞内线粒体膜电位的变化趋势,还能够直观线粒体形态,以及随着损伤程度加大线粒体形态的变化。本研究不但为BPA致精母损伤提供依据,同时为细胞内线粒体膜电位研究提供了可靠灵敏的实验方法。
[1]Geefer F,Gandini P,Andy S,et a1.Mechanism of apoptosis by EDs[J].Mol Biol,1999,11:479-500.
[2]Waring RH,Harris RM.Endocrine disruptors-A threat to women health[J].Maturitas,2011,68(2): 111-115.
[3]Rubin BS.Bisphenol A:An endocrine disruptor with widespread exposure and multiple effects[J].J Steroid Biochem Mol Biol,2011, 127(1-2):27-34.
[4]Sander C,Green DR.Estrogen-induced apoptos is in a tamoxifen stimulated MCF-7 model[J].Breast Cancer,200l,34:l246-1251.
[5]Van der Ven LT,Van de Kuil T,Verhoef A,et a1.Endocine effects of tetrabromobisphenol-A(TBBPA)in Wistar rats as tested in a onegeneration reproduction study and a subacute toxicity study[J].Toxicology,2008,245(1-2): 76-89.
[6]靳翠红,赵剑,金一和,等.双酚A对雄性小鼠生殖系统影响[J].中国医科大学学报,2002,31(2):123-124.
[7]Szydlowska K,Tymianski M.Calcium,isehemia and excitotoxicity[J].Cell Calcium,2010,47(2): 122-129.
[8]Rasheva Vl,Domingos PM.Cellular responses to endoplasmic reticulum stress and apoptosis[J].Apoptosis,2009,14(8):996-1007.
[9]Kroemer G,Zamzami N,Susin SA.Mitochondrial control of apoptosis[J].Immunology Today,1977, 18(1):44-51.
[10]Yuan-Jie Li,Tian-Bao Song.Bisphenol A Exposure Induces Apoptosis and Upregulation of Fas/FasL and Caspase-3 Expression in the Testes of Mice[J].TOXICOLOGICAL SCIENCES, 2009,108(2):427-436.
[11]孟祥东,于景华,严云勤,等.双酚A体外诱导雄性小鼠生殖细胞凋亡及其分子机制[J].毒理学杂志, 2007,21(3):201-204.
[12]Wang P,Luo C,Li Q,et al.Mitochondrionmediated apoptosis is involved in reproductive damage caused by BPA in male rats[J].Environ Toxicol Pharmacol,2014,38(3):1025-1033.
[13]Babu S,Uppu S,Claville MO,et a1.Prooxidant actions of bisphenol A(BPA)phenoxyl radicals:implications to BPA-related oxidative stress and toxicity[J].Toxicol Mech Methods, 2013,23(4):273-280.
[14]Moon MK,Kim MJ,Jung IK,et al.Bisphenol A impairs mitochondrial function in the liver at doses below the no observed adverse effect level[J].J Korean Med Sci,2012,27(6):644-652.
[15]Wang Q,Zhao XF,Ji YL,et al.Mitochondrial signaling pathway is also involved in bisphenol A induced germ cell apoptosis in testes[J].Toxicol Lett,2010,30,199(2):129-135.
The changes of mitochondrial membrane potential detected by confocal microscopy in spermatocyte induced by bisphenol A
WANG Li-ting, SUN Wei// China Medical Equipment,2016,13(2):106-109.
Objective: To detect changes in mitochondrial membrane potential after sperm mother cell damage induced by bisphenol A by laser scanning confocal microscopy(LSCM) and underline its potential action mechanism.Methods: The cultured spermatogenic cells were divided into 3 groups, respectively.Then 0, 10μmol/L, 100 μmol/L of Bisphenol A(BPA) were added into the culture, after 3 hours culture, fluorescence probe JC-1 was used to lable the three groups.The fluorescence intensity of JC-1 in mitochondrial was then detected by LSCM.LSCM software was used to analyze the fluorescence intensity.Change of the mitochondrial membrane potential was represented by the change of fluorescence colors (relative proportion of red and green fluorescence is commonly used to measure mitochondrial depolarization ratio).Results: The ratio between the red and green fluorescence in the control group, low dose group and high dose group had significant difference.Intracellular mitochondrial membrane potential of Bisphenol A treatment group was lower than that of the control group, while mitochondrial membrane potential of high dose group was lower than that of the low dose group.Conclusion: Bisphenol A could damage spermatocytes, and as the dose increased, the more serious the injury.The method could real-time monitor with high sensitivity the change of intracellular mitochondrial membrane potential.
Laser scanning confocal microscopy; Bisphenol A; Sperm mother cell; Mitochondria membrane potential; Fluorescence imaging; Fluorescence probe JC-1
sunwei772@126.com
1672-8270(2016)02-0106-04
R197.324
A
2015-10-26
