注射用丹参多酚酸盐的稳定性再评价
2016-07-18黄铁英石苏英周黎琴
黄铁英,石苏英,周黎琴
(诸暨市人民医院 药剂科,浙江 诸暨 311800)
注射用丹参多酚酸盐的稳定性再评价
黄铁英Δ,石苏英,周黎琴
(诸暨市人民医院 药剂科,浙江 诸暨 311800)
目的 建立丹参多酚酸盐中丹酚酸B含量测定方法,并补充丹参多酚酸盐与2种溶剂配伍后的稳定性数据。方法 HPLC法测定丹酚酸B的含量,色谱柱为YMC-ODS C18(250 mm×4.6 mm ,5 μm),流动相为乙腈-0.03%磷酸,流速为1.0 mL/min,检测波长为280 nm。同时将注射用丹参多酚酸盐与0.9%氯化钠溶液及5%葡萄糖溶液2种溶剂模拟临床用药比例配伍,进行丹参多酚酸盐稳定性考察。结果 在浓度6.18~61.80 μg/mL的范围内,丹酚酸B浓度与峰面积呈良好的线性关系,该方法的精密度、稳定性、重复性、准确度良好。样品中所含丹酚酸B含量在751.82~791.83 mg/g范围内波动,较稳定。室温状态下各配伍液的外观,pH值,稳定性和吸收度均无明显变化。配伍液在6 h内测得10 μm以上的微粒95粒,25 μm以下的微粒18粒,符合药典规定。结论 以HPLC法测定丹酚酸B含量灵敏度高、重现性好,能够满足注射用丹参多酚酸盐的分析要求;注射用丹参多酚酸盐与溶剂配伍后6 h内稳定,可安全用于临床。
丹参多酚酸盐;丹酚酸B;含量测定;稳定性研究
中药注射剂是指药材经提取、纯化后制成的供注入人体内的溶液、乳状液及供临用前配制成溶液的粉末或浓溶液的无菌制剂[1]。2005年SFDA颁发的注射用丹参多酚酸盐是从单味中药丹参中提取的以丹参乙酸(丹酚酸B,salvianolic acid B,Sal B)镁为主要成分的丹参多酚酸盐类化合物,为浅棕色疏松块状物,味微苦,微涩[2]。活血、化瘀、通脉,用于冠心病稳定型心绞痛,症见胸痛、胸闷、心悸,其药品说明书中用法用量为“200 mg用5%葡萄糖注射液或0.9%氯化钠注射液250 mL~500 mL溶解后静脉滴注”,注意事项为“谨慎联合用药,如确需联合使用其他药品时,因谨慎考虑与本品的间隔是时间以及药物相互作用等问题,目前尚无药物相互作用研究资料”。本项目研究建立注射用丹参多酚酸盐中丹酚酸B含量测定方法,完成注射用丹参多酚酸盐与0.9%氯化钠溶液以及5%葡萄糖溶液2种溶剂配伍后的稳定性研究,为临床使用注射用丹参多酚酸盐提供更多参考。
1 材料与方法
1.1 仪器与试剂 Prostar系列高效液相色谱仪(美国 Varian);JK-300DB超声波清洗器(合肥金尼克机械制造有限公司);紫外-可见分光光度计(美国 Varian);精密pH计(上海雷磁仪器厂)。
注射用丹参多酚酸盐(上海绿谷制药有限公司,批号1303312);5%葡萄糖注射液(广州百特医疗用品有限公司,批号GS1309053);0.9%氯化钠注射液(杭州民生药业有限公司 F1406103);丹酚酸B对照品(中国药品生物制品检定所,111562-200807),甲醇、乙腈为色谱纯,其余试剂均为分析纯。
1.2 方法
1.2.1 色谱条件:色谱柱:YMC-ODS C18(250 mm×4.6 mm,5 μm);流动相:乙腈-0.03%磷酸(30:70);流速:1.0 mL/min;检测波长:280 nm;柱温:30 ℃;进样量:10 μL;对照品溶液及供试品溶液的色谱图,见图1。
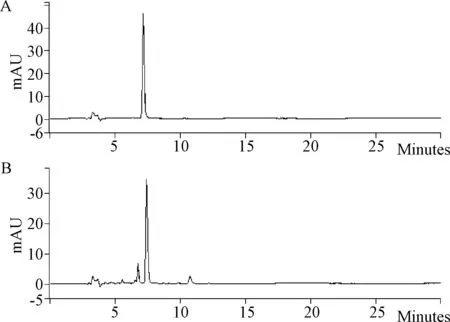
图1 丹酚酸B对照品和供试品溶液的液相色谱图A:对照品;B:供试品Fig.1 Chromatogram of Sal B of reference and test samplesA: reference sample;B:test sample
1.2.2 供试品溶液的制备:取装量差异项下的内容物,混匀,取20 mg,精密称定,置50 mL 量瓶中,用流动相溶解并稀释至刻度,摇匀,精密量取1 mL,置10 mL量瓶中,用流动相稀释至刻度,摇匀,滤过,即得。
1.2.3 对照品溶液的制备:取丹酚酸B对照品适量,精密称定,加甲醇制成每1 mL 含 309 μg的溶液,即得。
1.2.4 线性关系考察:精密吸取对照品溶液(0.309 mg/mL)0.1、0.2 、0.4、0.6、0.8、1.0 mL置5 mL量瓶中,加甲醇稀释至刻度,摇匀,即得。分别精密吸取各对照品溶液10 μL,注入液相色谱仪,测定并记录峰面积。
1.2.5 精密度试验:分别精密吸取对照品溶液(37.08 μg/mL)和供试品溶液各10 μL,进样6次,记录峰面积并计算。
1.2.6 稳定性试验:分别精密吸取对照品溶液(37.08 μg/mL)和供试品溶液各10 μL,分别于5天进样,记录峰面积并计算。
1.2.7 重复性试验:取本品20 mg,共5份,精密称定,置50 mL量瓶中,按供试品溶液的制备方法处理,分别精密吸取10 μL,进样,记录峰面积并计算。
1.2.8 加样回收率试验:取本品10 mg,共9份,精密称定,分别加入不同量的对照品溶液,按供试品溶液的制备方法处理,分别精密吸取10 μL,注入液相色谱仪,记录峰面积并计算。
1.2.9 样品测定:取不同批次的样品各20 mg,精密称定,置50 mL量瓶中,按供试品溶液的制备方法处理样品,测定并计算含量。
1.3 注射用丹参多酚酸盐的稳定性研究
1.3.1 配伍溶液的制备:模拟临床用药比例,精密取注射用丹参多酚酸盐200 mg,加0.9%氯化钠溶液使其溶解,定容至250 mL,作为供试品溶液1(简称:供试品1)。精密取注射用丹参多酚酸盐200 mg,加5%葡萄糖溶液使溶解,定容至250 mL,作为供试品溶液2(供试品2)。
1.3.2 外观观察:室温下将供试品1、供试品2放置6 h,按0、1、2、4、6 h进行观察,观察配伍液有无浑浊、沉淀生成和气泡产生。
1.3.3 吸收度测定:将供试品1、供试品2在310 nm处进行测定,分别在0、1、2、4、6 h内读取吸收度,考察其吸收度变化情况。
1.3.4 pH考察:室温下将供试品1、供试品2放置6 h,按0、1、2、4、6 h分别测定配伍液的pH值。
1.3.5 不溶性微粒考察:室温下将供试品1、供试品2放置6 h,按0、1、2、4、6 h进行观察,测得10 μm以上的微粒和25 μm以下的微粒。
2 结果
2.1 线性关系考察 以对照品溶液的浓度x(μg/mL)为横坐标,峰面积y为纵坐标,绘制标准曲线,y=61213x-80985,r=0.9998,在浓度6.18~61.80 μg/mL的范围内,丹酚酸B浓度与峰面积呈良好的线性关系。见表1、图2。
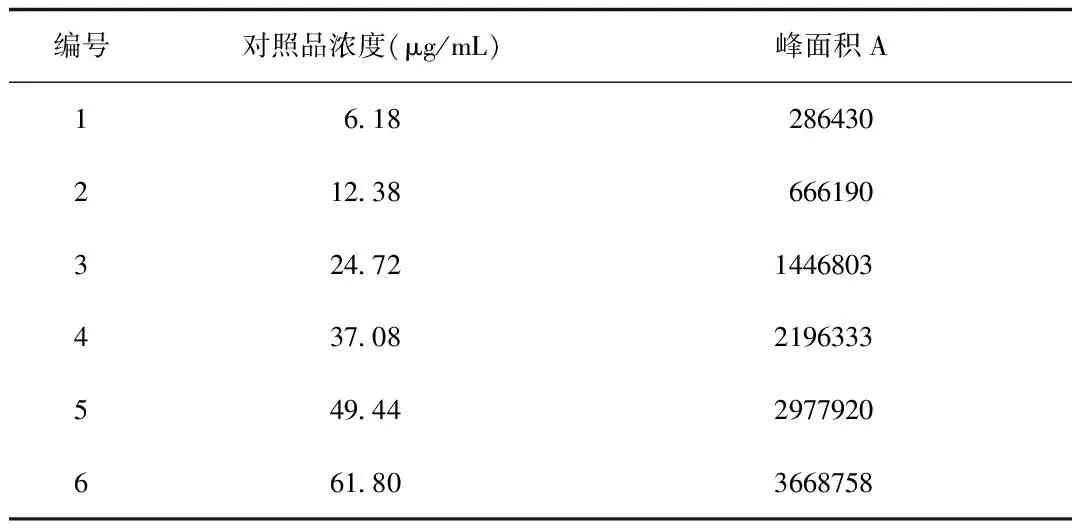
表1 线性关系考察

图2 丹酚酸B标准曲线Fig.2 The standard curve of Sal B
2.2 精密度试验 结果显示对照品的RSD为1.17%,供试品的RSD为0.99%,表明该方法的精密度良好,见表2。

表2 精密度考察结果
2.3 稳定性试验 结果显示对照品的RSD为1.70%,供试品的RSD为2.71%,表明该方法的稳定性良好,见表3。

表3 稳定性考察结果
2.4 重复性试验 结果显示本品中丹酚酸B的平均含量为771.94 mg/g,RSD为2.40%,表明该方法的重复性良好,见表4。

表4 重复性试验结果
2.5 加样回收率试验 结果显示平均加样回收率为99.63%,RSD为1.55%,表明本方法的准确度良好,见表5。
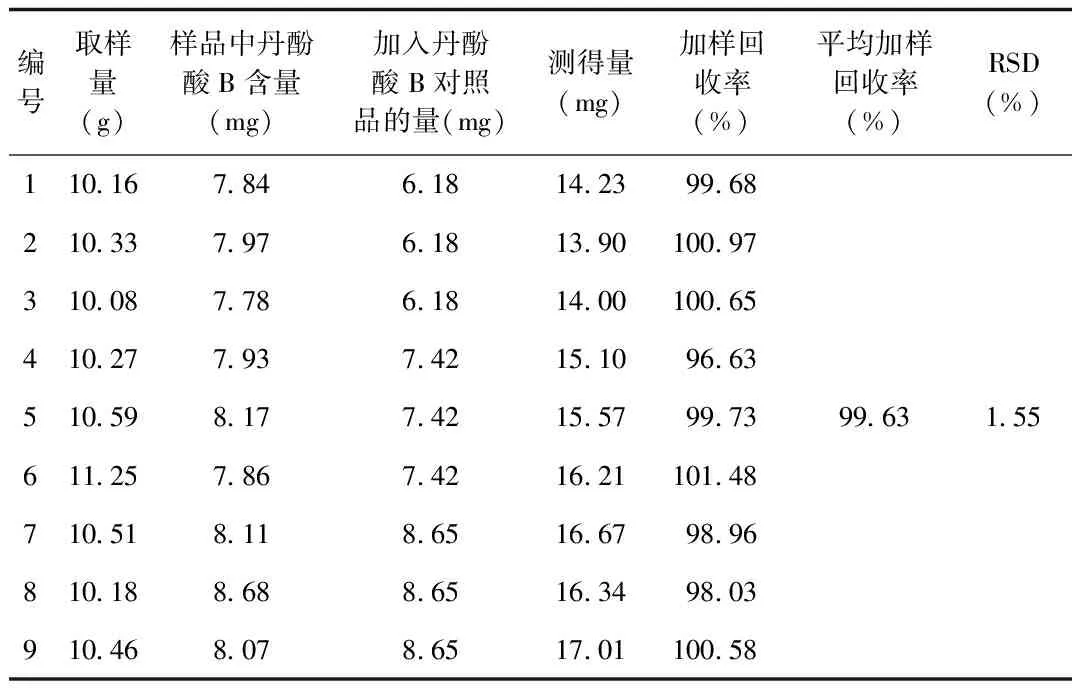
表5 加样回收率考察结果
2.6 样品测定 结果显示样品中所含丹酚酸B含量在751.82~791.83 mg/g范围内波动,较稳定。见表6。

表6 不同批次样品中丹酚酸B的含量
2.7 配伍液的外观观察 室温下将配伍液放置6 h,按0、1、2、4、6 h进行观察,配伍液无浑浊沉淀生成,无气泡产生。
2.8 配伍液的吸收度、pH值及含量变化 结果显示配伍液在6 h内其吸收度A,pH值以及丹酚酸B含量基本保持稳定,表明按照临床使用剂量配伍后在6 h内可安全使用,稳定性较好。见表7。
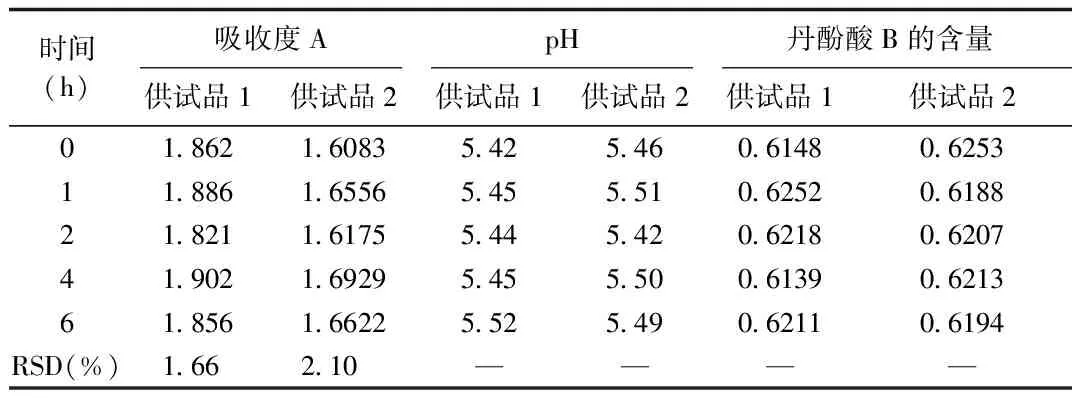
表7 配伍液的吸收度、pH值及含量变化结果
2.9 配伍液的微粒考察 室温下将上述配伍液放置6 h,按0、1、2、4、6 h进行观察,6 h内测得10 μm以上的微粒95粒,25 μm以下的微粒18粒。
3 讨论
中药注射剂是当代中药剂型的突破性创新,具有重要的学术意义和现实意义。但它尚未进入成熟的发展阶段,难免存在诸多问题。中药注射剂的不良反应在整个中药的临床使用过程中所占比例较高[3-5],有些中药注射剂与溶媒配伍后稳定性发生变化,甚至一些中药注射剂与按药品说明书上规定的溶媒配伍,不溶性微粒明显多于空白剂[6]。同时,由于各种原因制约,中药注射剂说明书存在各种缺点[7],绝大部分中药注射剂说明书中“药物相互作用” 项均为“目前尚无充分的药物相互作用研究资料”,这些都不能满足中药注射剂的临床使用需要。因此为完善中药注射剂的安全信息,推行中药注射剂上市后安全性再评价迫在眉睫。丹酚酸B又称为丹参酸乙或丹参乙酸(salianic acid B)或紫草酸B(lithospermic acid B),是丹参中治疗心血管疾病最重要、最有效的活性成分[8-9],已成为丹参类制剂的质控标准。本研究以注射用丹参多酚酸盐为研究对象,以丹酚酸B为指标性成分运用HPLC技术,建立了注射用丹参多酚酸盐中丹酚酸B含量的测定方法[10-11]。实验中分别比较了甲醇-乙腈-甲酸-水、乙腈-0.03%磷酸溶液、甲醇-0.8%乙酸等流动相系统,最后确定色谱条件为:以乙腈-0.03%磷酸(30:70)为流动相,流速为1.0 mL/min,检测波长为280 nm,柱温为30 ℃。在此条件下,丹酚酸B色谱峰与相邻色谱峰的分离度为4.2,理论塔板数为108732。通过对指标成分的含量监测在某种程度上反映药物组分的变化。结果表明,该方法灵敏度高、重现性好,能够满足注射用丹参多酚酸盐的分析要求,为控制制剂的质量打下良好的基础。同时与药品说明书中规定的5%葡萄糖注射液及0.9%氯化钠注射液两种溶剂进行配伍考察[12],考察其各项配伍指标的变化,结果表明注射用丹参多酚酸盐分别与0.9%氯化钠溶液和5%葡萄糖溶液配伍后配伍液均无浑浊沉淀生成,pH值在6 h基本稳定;通过注射用丹参多酚酸盐分别与0.9%氯化钠溶液和5%葡萄糖溶液配伍后溶液的微粒考察,测得微粒均符合药典所规定;通过对配伍液的丹酚酸B含量测定,表明其在6 h内基本稳定。
本项目研究作为注射用丹参多酚酸盐临床再评价试验中的一部分,有针对性的补充注射用丹参多酚酸盐在注射配伍时的稳定性数据,为配置中心配置药物,临床合理安排工作流程提供参考;同时,探索上市后药品安全性再评价的新方法。
[1] 国家药典委员会.中华人民共和国药典(二部).北京:中国医药科技出版社.2010:附录13.
[2]王侠,李小庆,吴焕林.丹参多酚酸盐治疗心绞痛的非随机、同期对照临床研究[J].实用医学杂志,2010,26(1):111-113.
[3]王爱梅.300例中药不良反应报告的分析[J]. 中国医药指南, 2013, 11(9): 17-18.
[4]赵娜萍, 严天虹, 王晶, 等. 我院136中药不良反应分析[J]. 实用药物与临床, 2011,14(4):328-330.
[5]冯艳霜. 187例中药致过敏反应文献分析[J]. 药物不良反应杂志, 2002, 4(2): 81-83.
[6]李湘萍,朱敏文,朱小艳,等. 丹参多酚酸注射液使用情况分析[J]. 中南药学,2010,8(8):633-635.
[7]刘鸣义,焦立红,谢雁鸣,等. 中药注射剂说明书解读与分析[J]. 中国中药杂志,2012,37(18):2707-2709.
[8]Kasimu R, Tanaka K, Tezuka Y,et al.Comparative study of seventeen salvia plants: aldose reductase inhibitory activity of water and MEOH extracts and liquid chromatography-mass spectrometry (LC-MS) analysis of water extracts [J].Chem Pharm Bull, 1998, 46(3):500-504.
[9]周长新, 丹羽正武. 丹参中水溶性成分的研究 [J]. 中国药科大学学报, 1999(30):
[10]柳丽,张洪泉.丹参活性成分的现代中药药理研究进展[J].中国野生植物资源,2003,22(6):1-4.
[11]密静英,崔金国,魏慧珍等.不同厂家复方丹参片中丹参酸B的含量比较[J].江西中医学院学报,2006,18(5):40.
[12]张彬,周学兴,吴建国.参附注射液与果糖注射液、氯化钠注射液配伍稳定性研究[J].中国中医急症,2008,17(12):1737-1739.
(编校:王俨俨)
Reevaluation of stability of the salvianolate for injection
HUANG Tie-yingΔ, SHI Su-ying, ZHOU Li-qin
(Department of Pharmacy,People’s Hospital of Zhuji, Zhuji 311800, China)
ObjectiveTo establish the method of content determination of Sal B in salvianolate for injection, and supply the stability data of salvianolate for injection after the compatibility with 2 solvents.MethodsThe content of Sal B was determined by HPLC.The HPLC procedure was performed on the chromatographic column of YMC-ODS C18(250 mm×4.6 mm, 5 μm), and the mobile phase was acetonitrile - 0.03%phosphoric acid solution.The flow velocity was 1.0 mL/min and the detection wavelength was 280 nm.At the same time, by simuating clinical medication, salvianolate for injection was mixed with 0.9%sodium chloride solution and 5%glucose solution in order to investigate the stability of salvianolate.ResultsWithin the range of concentration of 6.18~61.80 μg/mL, Sal B concentration and peak area showed a good linear relationship, the method was good in precision, stability, repeatability and accuracy.The content of Sal B fluctuated from 751.82 mg/g to 791.83 mg/g.At the room temperature, there was no significant change in appearance, pH value, stability and the absorbance.The mixed solution was measured 95 particles above 10 μm, 18 particles below 25 μm within 6 h.ConclusionThe Sal B content determined by HPLC has high sensitivity, good reproducibility, and could meet the analysis requirements of salvianolic for injection, it is stabilized within 6h after mixing, it could be safely used in clinical.
salvianolic acid; Sal B; content determination; stability
黄铁英,通信作者,女,本科,副主任药师,研究方向:医院药学,E-mail:13857515600@163.com。
R942
A
10.3969/j.issn.1005-1678.2016.03.52
