维生素C对藏猪精液4℃保存及其精子全基因组DNA甲基化的影响
2016-07-16任子利赵彦玲王建洲李瑜鑫强巴央宗
任子利,赵彦玲,王建洲,李瑜鑫,商 鹏,强巴央宗
维生素C对藏猪精液4℃保存及其精子全基因组DNA甲基化的影响
任子利,赵彦玲,王建洲,李瑜鑫,商 鹏,强巴央宗*
(西藏农牧学院动物科学学院,林芝860000)
摘 要:旨在研究维生素C对藏猪精液4℃保存效果及其精子全基因组DNA甲基化的影响。用手握法采集健康藏猪精液,在改进的猪精液低温稀释液中添加不同浓度的维生素C(0.0、2.5、5.0、7.5、10.0g·L-1),4℃保存到第5天时,以藏猪精子活力、精子畸形率、精子顶体完整率和质膜完整率为评价指标,探讨维生素C对藏猪精液4℃保存的效果;用甲基化荧光定量法检测藏猪新鲜精液组、保存到第5天时未添加维生素C组、添加维生素C组(添加维生素C最佳效果组5.0g·L-1)精液DNA甲基化的水平,以探讨维生素C对藏猪精液4℃保存所造成的精子全基因组DNA甲基化的影响。结果显示:添加5.0g·L-1维生素C组其精子活力、畸形率、顶体完整率和质膜完整率均显著好于其它组(P<0.05);鲜精组、未添加维生素C组、添加维生素C组的DNA甲基化水平分别为(0.604 7±0.040 3)、(0.920 2±0.016 9)、(0.656 9±0.048 3)ng,鲜精组与添加组均显著低于未添加组(P<0.05),而鲜精组与添加组间差异不显著(P>0.05)。综上表明,在改进的猪精液稀释液中添加5.0g·L-1维生素C可以明显改善藏猪精液4℃保存的效果,并且可以明显降低4℃保存对藏猪精液精子全基因组DNA甲基化的影响,这将为藏猪精液低温保存的生产应用奠定基础。
关键词:维生素C;藏猪精液;4℃保存;DNA甲基化
藏猪主要分布于雅鲁藏布江流域中游河谷区和藏东三江流域中游高山深谷区,是中国特有的能适应高海拔地区的一个重要品种[1],有“高原之珍”的美誉。为促进藏猪产业的大发展,开展人工授精是不可或缺的环节,这就需要解决藏猪精液的妥善保存问题。冷冻能长期保存猪精液,但人工授精的受胎率低至1%[2],常温保存人工授精的效果好又方便经济,但受到保存时间的限制,且公猪精液18℃保存会引发脂质过氧化,降低线粒体膜电位,提高等离子体膜透性[3]。低温保存比如4℃从理论上讲,因低温下精子代谢活动水平更低,保存时间比常温长,同时可应用普通冰箱保存,经济方便。但是,在精液低温保存过程中,猪精子对低温的耐受能力比其他家畜差,容易发生冷休克,精子处于氧化应激状态,产生大量的活性氧(ROS),对精子结构及功能造成损伤,甚至诱发其凋亡[4-5]。精子的DNA甲基化异常能预示男性的生育能力及其胚胎质量[6]。维生素C是一种廉价易得的抗氧化剂,如在藏猪精液4℃保存稀释液中添加维生素C,就有可能对抗低温对精子造成的活性氧及基因组甲基化水平异常,也就可能提高藏猪精液4℃保存的效果。李芳[7]认为6mg·mL-1维生素C能有效提高猪精液冷冻质量,陆媚等[8]认为添加2.00mg·mL-1水蛭素能显著提高猪精液低温保存的效果。M.Benchaib等[9]研究辅助生殖技术中精子的DNA甲基化。F.J.Cisneros[10]研究DNA甲基化与男性不育的关系。但关于维生素C对藏猪精液4℃保存及其精子全基因组DNA甲基化的影响的研究目前未见相关报道。因此,本研究拟在改进的猪精液低温稀释液中添加不同质量浓度的维生素C(0.0、2.5、5.0、7.5、10.0g·L-1),4℃保存到第5天时,以藏猪精子活力、精子畸形率、精子顶体完整率和质膜完整率为评价指标,探讨维生素C对藏猪精液4℃保存的效果;用甲基化荧光定量法检测藏猪新鲜精液组、保存到第5天时未添加维生素C组、添加维生素C组(添加维生素C最佳效果组5.0g·L-1)精子DNA甲基化的水平,以探讨维生素C对藏猪精液4℃保存所造成的精子全基因组DNA甲基化的影响,为藏猪精液低温保存的进一步研究奠定基础。
1 材料与方法
2015年5月-11月在西藏大学农牧学院藏猪研究中心进行试验。
1.1 材料
1.1.1 主要试剂与仪器设备 维生素C(西安利君制药有限公司)、考马斯亮蓝(国药集团化学试剂有限公司)、Diff-Quik染液、亚卫牌精液稀释粉(丹麦)、琼脂糖(西班牙)、溴化乙锭(EB)(Sigma公司)、MethylFlashTMMethylated DNA Quantification Kit(Epigentek公司)、新鲜藏猪精液由西藏大学农牧学院实习基地提供。
倒置荧光显微镜(NI-KON TE2000,日本)、冰箱(青岛海尔股份有限公司)、电热恒温水槽(上海精宏实验设备有限公司)、NanoDrop?ND-1000紫外分光光度计(美国NanoDrop公司)、Eppendorf Centrifuge 5417R离心机(德国Eppendorf公司)、M200荧光酶标仪(TECAN公司)。
1.1.2 改进的低温稀释液配制 参照孙时军等[11]的试验结果,使用亚卫牌精液稀释剂作为基础稀释剂,在稀释后的精液中加入1%乙二醇作为低温保护剂。
1.1.3 精液采集及处理 用手握法采集健康藏猪精液,采用两次稀释法将藏猪精液(精子活力0.8以上)做4倍稀释,用数层纱布包裹后放入培养箱中,17℃平衡2h后,放入冰箱4℃保存。
1.2 试验方法
1.2.1 精子质量评价 精子活力:用平板压片法测出直线前进运动的精子占总精子的百分率。精子畸形率:用商品化Diff-Quik染液染色检测畸形率。精子顶体完整率:考马斯亮蓝R250染色法。精子质膜完整率:低渗肿胀试验—HOST。具体方法参照文献[4]。
1.2.2 精子基因组DNA甲基化检测 用苯酚—氯仿抽提法提取藏猪新鲜精液组、保存到第5天时未添加维生素C组、添加维生素C组(添加5.0g·L-1维生素C最佳效果组)这3组精液其精子的基因组DNA,用NanoDrop?ND-1000紫外分光光度计检测其浓度、纯度,用琼脂糖凝胶电泳检测其完整性,当其纯度为1.8~2.0、检测结果为未扩散的清晰、单一、整齐的条带时,表明所提取的DNA质检合格,然后按照MethylFlashTMMethylated DNA Quantification Kit说明书提供的方法进行操作,再按照要求作出标准曲线后,计算样品DNA中甲基化的DNA量。
1.3 试验设计
1.3.1 维生素C对藏猪精液4℃保存的影响试验分5组,在改进的猪精液低温稀释液中添加不同质量浓度的维生素C(0.0、2.5、5.0、7.5、10.0 g·L-1,分别对应第1、2、3、4、5组),4℃保存到第5天时以藏猪精子活力、精子畸形率、精子顶体完整率和质膜完整率为评价指标,探讨维生素C对藏猪精液4℃保存的效果。试验重复3次。
1.3.2 维生素C对藏猪精液4℃保存所造成的精子全基因组DNA甲基化的影响 试验分3组:藏猪新鲜精液组、保存到第5天时未添加维生素C组、添加维生素C组(添加维生素C 5.0g·L-1最佳效果组)。用甲基化荧光定量法检测这3组精液DNA甲基化的水平,以探讨维生素C对藏猪精液4℃保存所造成的精子全基因组DNA甲基化的影响。试验重复3次。
1.4 数据分析
所得试验数据用Excel进行前期处理,再用SPSS17.0软件进行单因素方差分析,并进行多重比较,试验结果用“平均数±标准误”表示,确定差异的显著性,P<0.05为差异显著,柱状图使用Sigma-Plot 10.0软件制作。
2 结 果
2.1 维生素C对藏猪精液4℃保存的影响
由表1可以看出,藏猪精液4℃保存到第5天时,第3组即添加5.0g·L-1维生素C组的精子活力、精子畸形率、精子顶体完整率和质膜完整率:0.69、15.11%、64.58%、61.33%,这4个指标均显著好于其他组(P<0.05)。

表1 维生素C对藏猪精液4℃保存的影响Table 1 Effect of vitamin C at 4℃on the preservation of Tibetan boar semen
2.2 DNA质检结果
经NanoDrop?ND-1000紫外分光光度计检测提取到的3组藏猪精液的精子全基因组DNA,其浓度为300~350ng·μL-1、纯度为1.9~2.0、凝胶电泳图结果如图1所示,条带未扩散且清晰、单一、整齐,表明所提取的DNA质检合格,把浓度均稀释成100ng·μL-1,可用于后续试验。
2.3 藏猪精子基因组DNA甲基化水平检测结果
2.3.1 标准曲线 标准曲线用的6个点的阳性对照(50%甲基化的DNA)的量分别为0.0、0.5、1.0、 2.0、5.0、10.0ng。如图2所示,线性回归分析取前4个点,拟合的曲线:y=1 115.5x+119.2,拟合度R2为0.990 4。根据该斜率计算5-mC含量及百分比。
根据前4个点拟合的曲线线性较好,结果可靠。
2.3.2 藏猪精子基因组DNA甲基化水平定量结果 如图3所示,鲜精组、未添加维生素C组、添加维生素C组的DNA甲基化水平((0.604 7± 0.040 3)、(0.920 2±0.016 9)、(0.656±0.048 3)ng)中,鲜精组与添加组均显著低于未添加组(P<0.05),而鲜精组与添加组间差异不显著(P>0.05)。结果表明,添加质量浓度5.0g·L-1维生素C可以明显改善藏猪精液4℃保存的效果,并且可以明显降低4℃保存对藏猪精子DNA甲基化的影响。
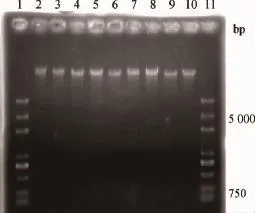
图1 DNA电泳Fig.1 Electrophoresis results of genomic DNA
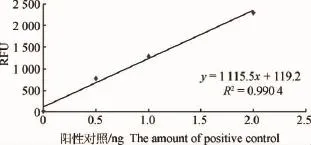
图2 5-mC检测得到的标准曲线Fig.2 Standard curve of 5-mC quantity

图3 100ng精子DNA中5-mC的量Fig.3 5-mC amount of every 100ng sperm DNA
3 讨 论
3.1 维生素C对藏猪精液4℃保存的影响
李芳[7]认为黄酮类、维生素C、多不饱和脂肪酸和维生素E这些抗氧化剂对猪冷冻精子均有保护作用,其中6mg·mL-1维生素C的适宜添加浓度为6mg·mL-1,而本研究中添加5.0g·L-1维生素C则可以明显改善藏猪精液4℃保存的效果,二者结果基本一致,至于需要添加的维生素C浓度略有不同,这可能是4℃保存产生的活性氧比冷冻少些,所以需要的维生素C浓度也相对稍低。适宜浓度的L-精氨酸也可以明显改善4℃猪精液的保存效果[12]。可见,以藏猪精子活力、精子畸形率、精子顶体完整率和质膜完整率为评价指标,这些抗氧化剂均能对猪精液4℃保存有较好的效果。
3.2 维生素C对藏猪精液4℃保存所造成的精子基因组DNA甲基化的影响
表观遗传修饰是精子的特征性标志物,对保证精子的正常形态和机能至关重要,DNA甲基化、组蛋白修饰、RNAs以及精蛋白等异常会导致精子机能降低和胚胎发育失败,甚至诱发后代表观遗传疾病的发生[13]。K.E.Waterhouse等[14]研究表明,冷冻程序改变了牛精子DNA的完整性。G.B.Boe-Hansen等[15]用精子染色质结构分析(SCSA)研究公猪精液液体保存后其精子染色质结构的完整性与生育力的关系,认为SCSA技术可能能鉴定出个体的低繁殖力甚至(由这些个体输精所导致的)低窝产仔数,而且将来能在成本效益分析后应用于养猪业。全基因组DNA甲基化的分析揭示了一个正常的启动子甲基化CpG岛[16]。M.Benchaib等[17]通过免疫组化染色,用流式细胞仪定量分析表明:在正常的辅助生殖程序中,研究人类精子是否具有让人受孕能力的一种新方法便是看精子全基因组DNA甲基化水平。全基因组DNA甲基化与水牛生育能力有关[18]。O.Tunc等[19]研究也有类似的结论,即人类精子DNA片段化同全基因组DNA甲基化间存在负相关,添加抗氧化剂可以减少DNA损伤并且使精子DNA甲基化状态正常。这与本研究结果一致。然而,也有相反的结论,认为冷冻保存对于人类精子DNA甲基化没有影响[20],这可能与物种及试验条件等有关,若究其原因,尚需进一步研究。
4 结 论
本研究结果表明,在改进的猪精液稀释液中添加5.0g·L-1维生素C可以明显改善藏猪精液4℃保存的效果,并且可以明显降低4℃保存对藏猪精子基因组DNA甲基化的影响,这将为藏猪精液低温保存的生产应用奠定基础。
参考文献(References):
[1] 强巴央宗,谢 庄,田发益.高原藏猪现状与保种策略[J].中国畜牧杂志,2001,37(6):46-47.CHAMBA Y Z,XIE Z,TIAN F Y.Status and protective strategy of plateau Tibet pig[J].Chinese Journal of Animal Science,2001,37(6):46-47.(in Chinese)
[2] YESTE M.Recent advances in boar sperm cryopreservation:state of the art and current perspectives [J].Reprod Domest Anim,2015,50(Suppl 2):71-79.
[3] KUMARESAN A,KADIRVEL G,BUJARBARUAH K M,et al.Preservation of boar semen at 18degrees C induces lipid peroxidation and apoptosis like changes in spermatozoa[J].Anim Reprod Sci,2009,110 (1-2):162-171.
[4] 胡传活,许春荣,陆 媚,等.黄芪多糖对猪精液低温保存的影响[J].中国兽医学报,2015,35(1):150-154.HU C H,XU C R,LU M,et al.Effects of astragalan on low temperature preservation of boar semen[J].Chinese Journal of Veterinary Science,2015,35(1):150-154.(in Chinese)
[5] JOHNSON L A,WEITZE K F,FISER P,et al.Storage of boar semen[J].Anim Reprod Sci,2000,62(1-3):143-172.
[6] ASTON K I,UREN P J,JENKINS T G,et al.Aberrant sperm DNA methylation predicts male fertility status and embryo quality[J].Fertil Steril,2015,104 (6):1388-1397.
[7] 李 芳.四种抗氧化剂对猪精液冷冻保存效果的研究[D].杨凌:西北农林科技大学,2012.LI F.Study on four antioxidants for crypreservation of boar spermatozoa[D].Yangling:Northwest A &F University,2012.(in Chinese)
[8] 陆 媚,许春荣,刘德玉,等.水蛭素对猪精液低温保存的影响[J].黑龙江畜牧兽医,2014(17):68-72.LU M,XU C R,LIU D Y,et al.Effects of hirudin on low temperature preservation of boar semen[J].Heilongjiang Animal Science and Veterinary Medicine,2014(17):68-72.(in Chinese)
[9] BENCHAIB M,AJINA M,BRAUN V,et al.DNA sperm methylation in assisted reproductive techniques [J].Gynecol Obstet Fertil,2006,34(9):836-839.
[10] CISNEROS F J.DNA methylation and male infertility [J].Front Biosci,2004,9:1189-1200.
[11] 孙时军,朱华鸿,陈晓峰,等.低温保护剂对4℃保存猪精液活率的影响[J].上海畜牧兽医通讯,2012(4):28-29.SUN S J,ZHU H H,CHEN X F,et al.Effects of sperm motility of cryoprotectant on 4℃temperature preservation of boar semen[J].Shanghai Journal of Animal Husbandry and Veterinary Medicine,2012 (4):28-29.(in Chinese)
[12] 许春荣,陆 媚,刘德玉,等.L-精氨酸对猪精液低温保存效果的影响[J].西北农业学报,2014,23(11):12-16.XU C R,LU M,LIU D Y,et al.Effects of L-Arg on low temperature preservation of boar semen[J].Acta Agriculturae Boreali-occidentalis Sinica,2014,23 (11):12-16.(in Chinese)
[13] 葛少钦,赵峥辉,张雪倩,等.精子表观遗传修饰及其在胚胎发育过程中的潜在作用[J].遗传,2014,36 (5):439-446.GE S Q,ZHAO Z H,ZHANG X Q,et al.Epigenetic modifications in human spermatozoon and its potential role in embryonic development[J].Hereditas,2014,36(5):439-446.(in Chinese)
[14] WATERHOUSE K E,GJELDNES A,TVERDAL A,et al.Alterations of sperm DNA integrity during cryopreservation procedure and in vitro incubation of bull semen[J].Anim Reprod Sci,2010,117(1-2):34-42.
[15] BOE-HANSEN G B,CHRISTENSEN P,VIBJERG D,et al.Sperm chromatin structure integrity in liquid stored boar semen and its relationships with field fertility[J].Theriogenology,2008,69(6):728-736.
[16] SHEN L,KONDO Y,GUO Y,et al.Genome-wide profiling of DNA methylation reveals a class of normally methylated CpG island promoters[J].PLoS Genet,2007,3(10):2023-2036.
[17] BENCHAIB M,BRAUN V,RESSNIKOF D,et al.Influence of global sperm DNA methylation on IVF results[J].Hum Reprod,2005,20(3):768-773.
[18] VERMA A,RAJPUT S,DE S,et al.Genome-wide profiling of sperm DNA methylation in relation to buffalo(Bubalus bubalis)bull fertility[J].Theriogenology,2014,82(5):750-759.
[19] TUNC O,TREMELLEN K.Oxidative DNA damage impairs global sperm DNA methylation in infertile men[J].J Assist Reprod Genet,2009,26(9-10):537-544.
[20] KLÄVER R,BLEIZIFFER A,REDMANN K,et al.Routine cryopreservation of spermatozoa is safe--evidence from the DNA methylation pattern of nine spermatozoa genes[J].J Assist Reprod Genet,2012,29(9):943-950.
(编辑 程金华)
Effect of Vitamin C on Tibetan Boar Semen Preserved at 4℃and Levels of the Sperm Global Genome DNA Methylation
REN Zi-li,ZHAO Yan-ling,WANG Jian-zhou,LI Yu-xin,SHANG Peng,CHAMBA Yangzom*
(Faculty of Animal Science,Tibet Agricultural and Animal Husbandry College,Linzhi 860000,China)
Abstract:This research was conducted to study the effect of vitamin C on Tibetan boar semen preserved at 4℃and the subsequent influence on global genome DNA methylation.The semen was collected from Tibetan boar and preserved at 4℃in modified medium supplemented with vitamin C at 0.0,2.5,5.0,7.5,10.0g·L-1.Sperm motility,abnormality,acrosome integrity and plasma membrane integrity were evaluated 5days after preservation.And the global methylation level of the fresh and preserved sperm was detected by using MethylFlashTM.The results showed that a significantly higher sperm motility and plasma membrane integrity,acrosome integrity and less abnormality was observed in group supplemented with 5.0g·L-1vitamin C(P<0.05).DNA methylation levels of fresh sperm(0.604 7±0.040 3)ng and sperm preserved with vitamin C(0.656 9±0.048 3)ng were significantly lower than those preserved without vitamin C (0.920 2±0.016 9)ng(P<0.05),but no significant difference was found between fresh semenand sperm preserved with vitamin C(P>0.05).These results indicated that supplementation of vitamin C at 5.0g·L-1semen extender could improve quality of Tibetan boar semen preservation at 4℃and mitigate effect on DNA methylation of Tibetan boar sperm.The results in the current study would be helpful for further investigation of the freezing protocol for Tibetan boar semen.
Key words:vitamin C;Tibetan boar semen;preservation at 4℃;DNA methylation
中图分类号:S828.8+9.2;S814.8
文献标志码:A
文章编号:0366-6964(2016)05-1057-05
doi:10.11843/j.issn.0366-6964.2016.05.025
收稿日期:2015-11-25
基金项目:2014年畜牧资源平台建设;2013年畜牧体系研究团队;科技部支撑项目(2012BAD03B03);西藏自治区自然科学基金资助项目(2015ZR-13-32)
作者简介:任子利(1969-),男,河南卫辉人,副教授,博士,主要从事动物繁殖研究,E-mail:zlren0925@163.com,Tel:0894-5822924
*通信作者:强巴央宗,教授,E-mail:qbyz628@126.com
