鸭I-FABP基因的克隆、组织表达模式及功能研究
2016-07-16卢立志
陈 芳,张 昊,卢立志
鸭I-FABP基因的克隆、组织表达模式及功能研究
陈 芳1,2,3*,张 昊1,2,3,卢立志3
(1.湖北省农业科学院畜牧兽医研究所,武汉430064;2.动物胚胎工程及分子育种湖北省重点实验室,武汉430064;3.浙江省农业科学院畜牧兽医研究所,杭州310021)
摘 要:本研究旨在探讨鸭I-FABP基因的结构与功能。本试验以绍兴麻鸭为研究材料,运用RACE、RT-PCR方法扩增鸭I-FABP基因mRNA全序列,运用qRT-PCR方法检测该基因在小肠不同区段的表达特性,运用siRNA干扰、qRT-PCR分析其功能。结果表明,鸭I-FABP基因共编码132个氨基酸,在不同物种间保守性较高,且在第60位氨基酸处发现一个Ile/Thr的突变位点;I-FABP在空肠前半段和十二指肠中表达量较高,与微粒体甘油三酯转移蛋白(Microsomal triglyceride transferprotein,MTTP)和载脂蛋白B(Apolipoprotein B,ApoB)基因在小肠不同肠段具有相似的表达变化情况,而与肝脏型脂肪酸结合蛋白基因(Liver fatty acid binding protein,L-FABP)存在差异;干扰I-FABP基因表达后,MTTP和ApoB基因的表达量显著降低,而L-FABP未发生显著变化。该结果预示了I-FABP基因在鸭的小肠脂肪酸吸收与转运通路中的重要作用,也为该基因的深入研究奠定了基础。
关键词:鸭;I-FABP;小肠;脂肪酸
由于家禽现代育种工作对生长速度的过度追求,造成家禽体脂过度沉积。这不仅影响畜禽产品品质,还造成饲料资源的浪费。人体食入过量的脂肪易导致肥胖,糖尿病、动脉粥样硬化、冠心病等发病率的提高对健康造成损害。随着生活水平的不断提高,人们对畜禽产品品质的要求越来越高。因此,减少畜禽体脂沉积、增加肌间脂肪含量已成为畜禽工作者的重要研究目标。从分子机理上研究鸭脂类代谢过程可以为其育种和营养调控提供理论依据。
小肠型脂肪酸结合蛋白(Intestinal fatty acid binding protein,I-FABP),又称FABP2,是特异性的在小肠上皮细胞中表达的脂肪酸结合蛋白家族成员,可与长链不饱和脂肪酸结合,携带其穿过细胞膜并运送到脂肪酸组装为乳糜微粒的位置——内质网[1]。I-FABP是机体脂肪代谢过程中重要的调控因子之一,亦可作为小肠成熟度和损伤的标记[2]。I-FABP基因多态性与人类高脂血症、Ⅱ型糖尿病以及肥胖等代谢疾病有关[3-5]。I-FABP在控制肉鸡腹脂重这一性状中起重要作用[6],且在该基因发现多处多态位点与生长和屠体性状显著相关[7],但关于鸭I-FABP的研究较少。
本试验通过克隆鸭I-FABP基因全序列,分析该基因在不同肠段的表达以及该基因对脂肪酸吸收利用通路中关键基因的影响,研究I-FABP在小肠脂肪酸吸收与转运中的作用,旨在为鸭育种和营养调控提供理论依据。
1 材料与方法
1.1 试验材料
本试验选取4只初生重相近的1日龄绍兴鸭,屠宰后将小肠按长度等分为12段,样品采集后于液氮中过夜,之后保存于-70℃;提取RNA并反转录后用于不同肠段基因表达谱分析。另采集26只1日龄绍兴鸭十二指肠样本(共计30只),进行多态位点验证分析。细胞培养选用孵化至25d左右的绍兴鸭鸭胚。
1.2 试验方法
1.2.1 引物设计 根据GenBank公布的鸡IFABP序列扩增出鸭部分序列后,设计RACE引物。根据基因序列跨内含子设计定量引物。RACE和定量引物由上海英骏公司合成。干扰RNA由上海吉玛公司设计合成。本试验所用到引物序列见表1。

表1 试验所用引物序列Table 1 The sequence of primers
1.2.2 RACE反应扩增I-FABP序列 RACE试剂盒选用SMART RACE cDNA Amplification Kit试剂盒(TaKaRa,大连),根据其说明书进行RNA样品反转录及5′-RACE和3′-RACE反应。扩增出的片段回收纯化后克隆测序。根据所获得的序列拼接并与NCBI网站上其他物种该序列信息比对确认后获得鸭I-FABP基因cDNA全序列。基因多态位点确认采取扩增DNA片段后直接测序的方法完成。
1.2.3 基因表达分析 组织和细胞总RNA提取采用Trizol法,按照Trizol试剂盒(TaKaRa,Japan)说明书进行;cDNA第一链合成采用M-MLV反转录酶(TaKaRa,Japan)合成,按照说明书进行;基于qRT-PCR的基因表达分析由ABI 7300(Applied Biosystems,Foster City,CA,USA)完成,以鸭β-actin基因为内参,采用SYBR Premix Ex TaqTMⅡ(TaKaRa,Japan)进行。反应体系:SYBR Premix Ex TaqⅡ10μL,cDNA 2μL,上下游引物各0.4μL,ROX reference dye 0.4μL,灭菌超纯水补至20μL。qRT-PCR反应程序:94℃3min;94℃10s,60℃30 s,40个循环。每个循环后采集荧光生成扩增曲线。每个样本设3个重复,每次测定设空白对照。
1.2.4 细胞培养与干扰 选用孵化至25d左右的鸭胚,对鸭蛋表面进行酒精消毒后,打开鸭蛋取出鸭胚放入培养皿。取出鸭胚空肠前1/2段放入常温PBS中。去除肠系膜,注射器多次冲洗肠段后打开肠段并尽量剪碎,清洗干净后加入10~20倍体积的1g·L-1胶原酶Ⅰ,37℃水浴锅摇晃消化30min后收集细胞,清洗离心后加入含10%FBS的完全培养基,细胞培养于37℃,5%CO2培养箱中,24h换液一次。细胞汇合至80%左右时,进行细胞干扰试验。转染试剂选用Lipofectamine2000,操作步骤按试剂盒说明进行。干扰4h后换液,继续培养20 h后收集细胞,提取RNA。每个处理4个重复。
1.3 统计分析
本试验采用DNAMAN软件进行序列比对分析;采用SPSS统计软件进行差异显著性检验;各基因相对表达量用2-ΔCt方法计算,以β-actin作为内参基因,重复次数为3次,ΔCt=Cttarget gene-Ctβ-actin。
2 结 果
2.1 鸭I-FABP序列分析
本试验以绍兴鸭肝为材料,分别通过5′-RACE 和3′-RACE扩增获得I-FABP基因片段387和418bp,如图1所示。将扩增序列与NCBI数据库比对并拼接后,获得鸭I-FABP基因cDNA序列共648bp,NCBI序列号:JN_202313。
I-FABP基因cDNA序列包括33bp的5′非编码区和216bp的3′非编码区。其中3′非编码区包含27bp的Ploy-A结构。CDS区编码132个氨基酸。不同物种间氨基酸序列比对如图2所示。该氨基酸序列在不同物种间较保守,与鸽子同源性高达90.15%,与鸡同源性为88.64%。
本试验在克隆该基因序列时,发现一个T/C的多态位点,如图3A所示。本试验在30只鸭样品中验证该多态位点,其中TT基因型的个体数为17,CT基因型的个体数为13,未检测到CC基因型。该位点可导致预测氨基酸序列的第60位氨基酸由Ile转变为Thr,该突变位点位于I-FABP蛋白二级结构的βD折叠处,如图3B所示。

图1 鸭I-FABP基因扩增产物电泳图Fig.1 Agarose gel electrophoresis patterns of duck IFABPgene PCR products
2.2 鸭I-FABP基因在小肠不同区段的表达
本试验对鸭小肠不同肠段I-FABP基因的表达情况进行分析,结果如图4所示。从图中可以看出,鸭I-FABP基因在空肠上半段表达量最高,其次为十二指肠,在空肠末段和回肠段表达量较低。
2.3 鸭小肠不同肠段中脂肪酸吸收和转运相关基因的表达
本试验分析了与脂肪酸结合转运相关的LFABP、MTTP和Apob基因的表达情况,结果如图5所示。从总体水平上可以看出,L-FABP在小肠中的表达丰度远低于I-FABP。MTTP和Apob基因在小肠不同肠段的表达趋势一致:在空肠中段表达量最高,其次为空肠前段和十二指肠,在空肠末端和回肠中表达量较低。

图2 多物种I-FABP基因氨基酸序列比对Fig.2 Alignment of the amino acid sequences of I-FABPgene among different species
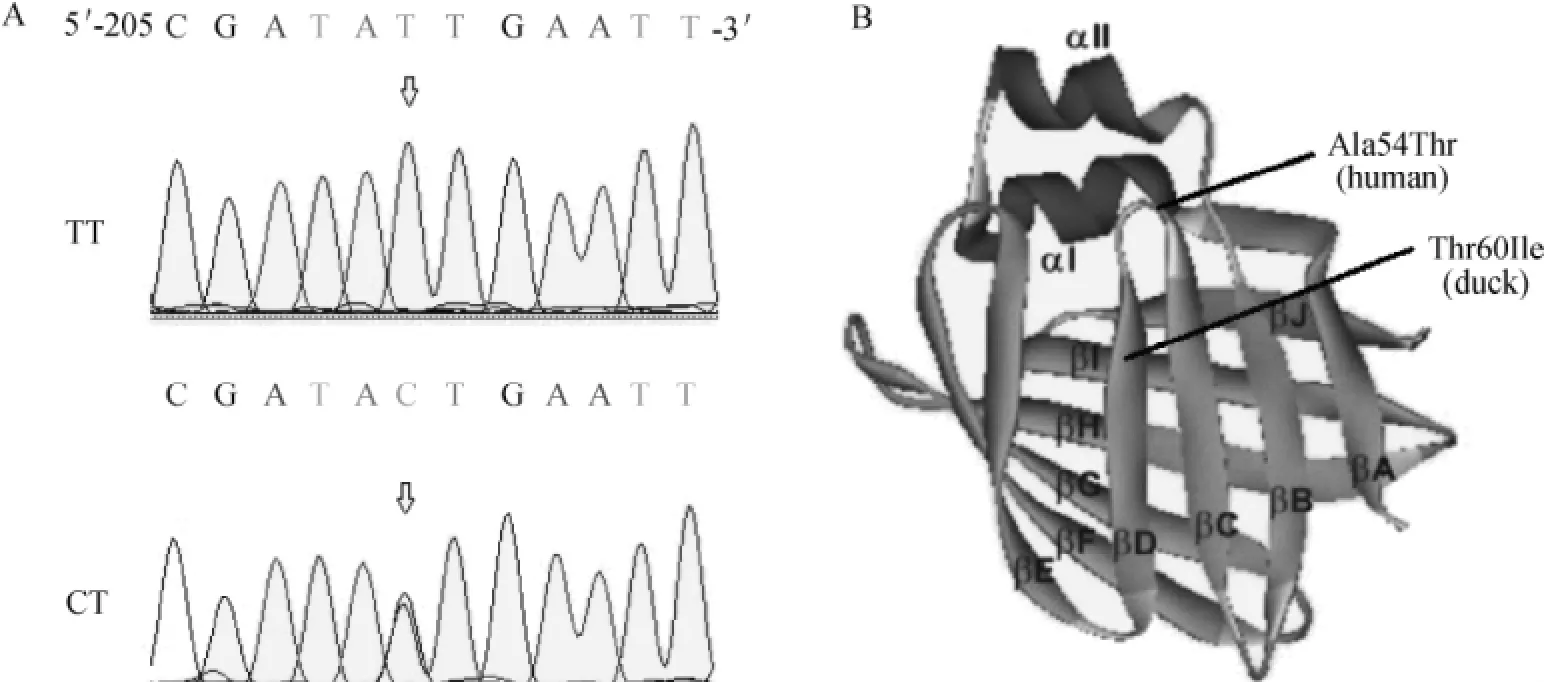
图3 鸭I-FABP基因多态位点Fig.3 SNP of duck I-FABPgene
2.4 干扰鸭I-FABP基因表达后对小肠其他脂肪酸吸收和转运相关基因表达的影响
为研究I-FABP基因对其他脂肪酸吸收与转运相关基因表达的影响,本试验采用合成si-IFABP RNA干扰鸭小肠原代上皮细胞I-FABP基因表达后,检测其他基因mRNA表达变化情况。从图6可以看出,干扰组I-FABP表达量下降为对照组表达量的42.89%。干扰I-FABP基因表达后,MTTP表达量降低至对照组的61.92%,ApoB表达量降低至对照组的44.68%,均达到极显著水平(P<0.01),而L-FABP表达水平未发生显著变化。

图4 I-FABP基因在鸭小肠不同肠段表达Fig.4 Relative abundance of duck I-FABP mRNA in different intestine segments
3 讨 论
脂肪酸在维持机体正常生命过程中起重要作用。食物中的甘油三酯在体内消化分解成脂肪酸和甘油后经小肠吸收才能被机体利用。小肠对脂肪酸的吸收主要通过两种方式:一种是通过磷脂双分子层的简单扩散,另一种是蛋白参与的转运,而后者在调节脂质吸收过程中起重要作用[8]。小肠上皮细胞中参与脂质转运的蛋白主要有FABPs、NPC1L1、CD36、SR-BI等,而FABPs在这一过程中起极其重要的作用。在小肠中表达的FABP家族成员主要有I-FABP、L-FABP和回肠型脂肪酸结合蛋白(Ileal lipid binding protein,ILBP),其中I-FABP和L-FABP主要参与长链脂肪酸的吸收转运,ILBP主要参与回肠中胆汁酸的吸收转运[1]。
I-FABP为小肠特异性表达的脂肪酸结合蛋白,在不同品种间保守性很高。本试验扩增的鸭I-FABP基因CDS序列共编码132个氨基酸,与鸽子的同源性高达90.15%。鸭I-FABP基因第2外显子上有一个T/C突变,该突变可导致编码的第60位氨基酸由异亮氨酸变为苏氨酸,且该突变位点位于该蛋白质空间结构的βD折叠上,与人Ala54Thr突变位点位置相近。人Ala54Thr突变位点位于βC-D折叠,该结构与α-Ⅱ螺旋远端形成门户入口,且该结构的第31、36、57赖氨酸位点与长链脂肪酸结合密切相关[9]。人I-FABP蛋白第54位氨基酸Thr可增加该蛋白在体外对长链脂肪酸的结合力[10]。在口服脂肪情况下,Thr54型个体表现为更高的血浆甘油三酯乳糜微粒和极低密度脂蛋白水平[11]。空腹情况下,Thr54型个体血脂具有更高的甘油三酯、低密度脂蛋白胆固醇水平和较低的高密度脂蛋白胆固醇水平[12]。此外,该多态位点还和肥胖、Ⅱ型糖尿病等相关[13-14]。鸭60位氨基酸突变位点紧邻该蛋白门户入口区,且野生型与突变型氨基酸亲疏水性不同。在本次试验用于检测多态位点的绍兴鸭样本中,未检测到CC基因型,这可能由所选用品种特性决定。关于鸭I-FABP基因的这个有义突变能否对脂肪酸的结合能力产生影响,以及该位点与鸭脂类代谢相关性状的关系还有待进一步研究确定。
I-FABP与L-FABP同在小肠上皮细胞中表达,是参与长链脂肪酸吸收与转运的主要蛋白。但两者在小肠中的表达丰度、表达模式以及与脂肪酸的结合能力等均存在差异。鸭小肠中I-FABP的表达丰度远高于L-FABP。鸭I-FABP在空肠前段表达量最高,在十二指肠与空肠中段也具有较高的表达量,而L-FABP在空肠中段表达量最高,且远高于十二指肠和空肠。这两个基因在不同肠段的表达模式与鼠的研究结果存在差异:小鼠I-FABP在靠近回肠段表达量最高,L-FABP在空肠近端表达量最高[15],这可能是家禽消化系统与哺乳动物存在差异的结果。I-FABP与长链脂肪酸的亲和力高于L-FABP[16],I-FABP特异性的于小肠表达,一分子蛋白可与一分子长链脂肪酸结合;而L-FABP除在小肠表达外,在肝和肾也表达,且一分子蛋白可以结合两分子长链脂肪酸[17];在标准饮食条件下,IFABP主要参与TG的合成与分泌,而L-FABP更倾向于PL合成、膜保护以及基因调控等[15];IFABP转运脂肪酸进入细胞采取的是与细胞膜碰撞的方式,而L-FABP则不需与膜发生反应且促进脂肪酸在细胞内的水溶扩散[18];除此之外,I-FABP和L-FABP缺陷型小鼠具有明显的表型差异证明了两者在小肠上皮细胞中功能的差异性[19]。在干扰I-FABP表达后,L-FABP基因的表达未发生显著的变化,两者的差异性可能是产生这一结果的主要原因。本试验选择进行细胞培养的为小肠空肠前半段,在该段中L-FABP的表达量较低,这也可能是产生该结果的原因。关于小肠中几种脂肪酸结合蛋白之间的相互作用关系还需进一步的试验验证。
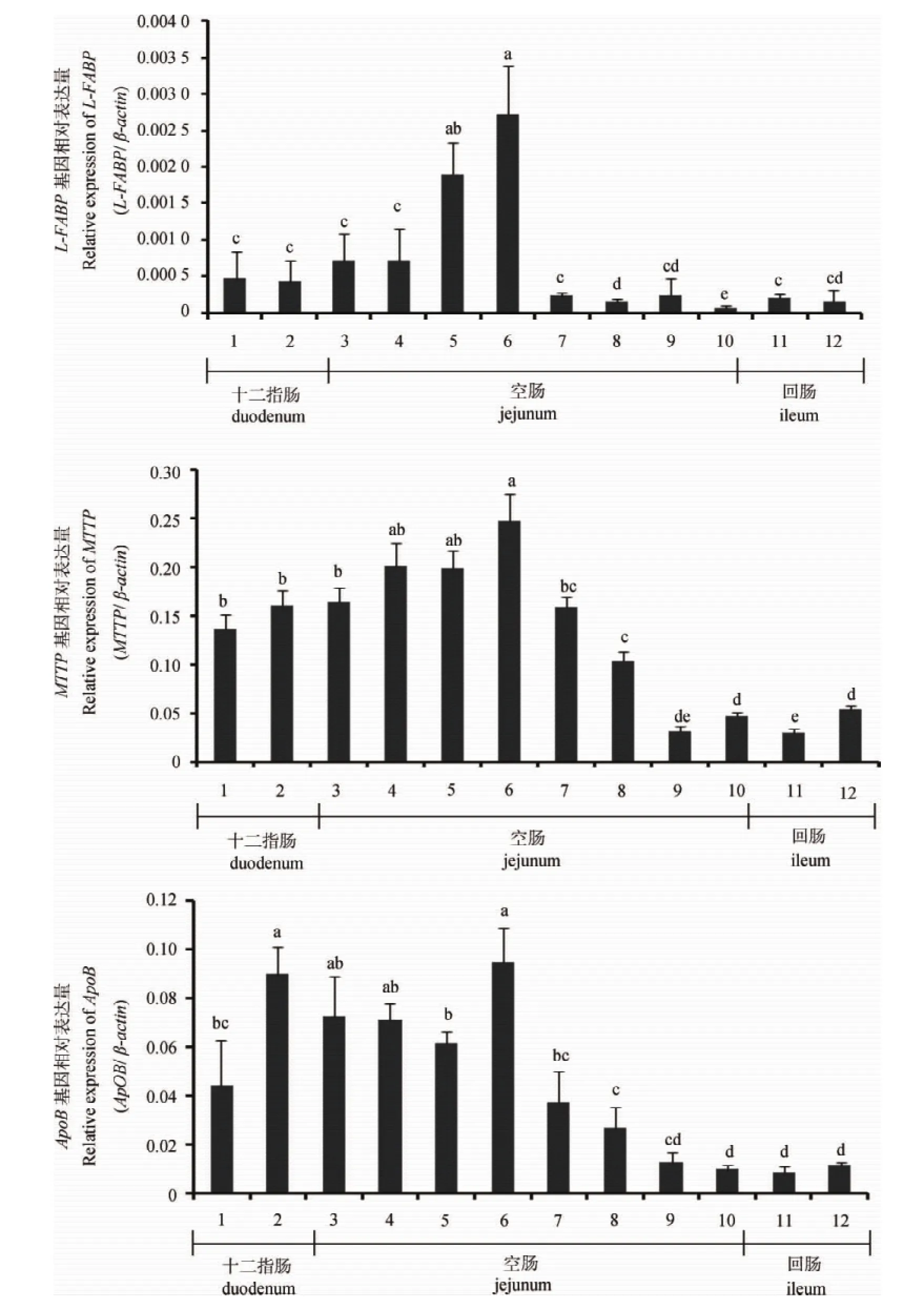
图5 L-FABP、MTTP与ApoB基因在鸭小肠不同肠段的表达Fig.5 Relative abundance of duck L-FABP,MTTPand ApoBmRNA in different intestine segments
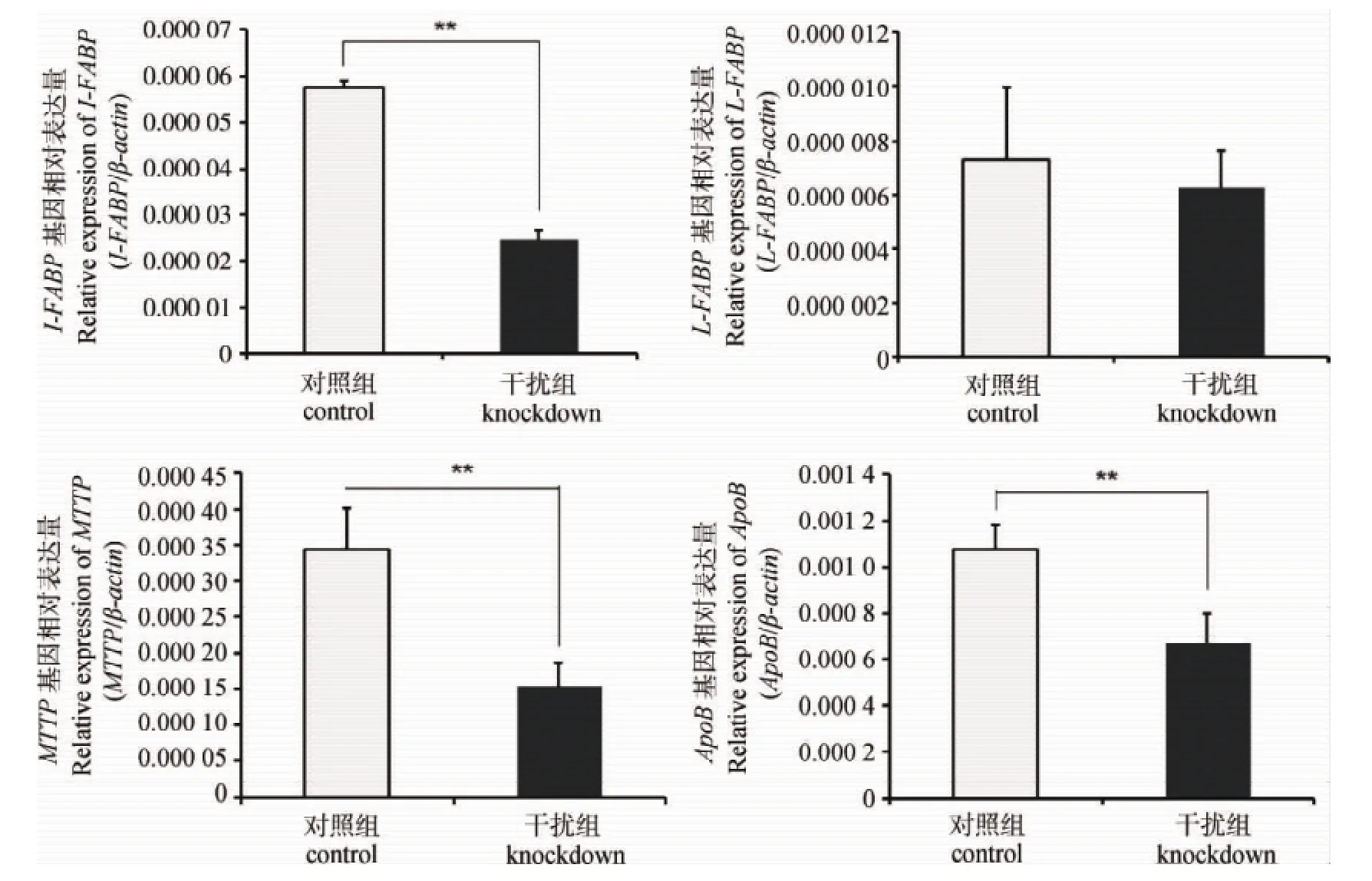
图6 鸭小肠上皮细胞干扰I-FABP基因表达后对L-FABP,MTTP和ApoB基因表达的影响Fig.6 Effects of I-FABPknockdown on the mRNA expression of L-FABP,MTTPand ApoBin duck primary small intestinal epithelia cells
MTTP和ApoB基因参与小肠脂类的吸收与转运。家禽食物中长链脂肪酸运送到内质网后,会重新酯化生成甘油三酯并以乳糜微粒的形式分泌到血液循环中,而小肠上皮细胞中乳糜微粒的组装和分泌依赖于MTTP和ApoB[20-21]。本试验分析了不同肠段MTTP和ApoB基因的表达情况,结果表明,两基因在小肠的表达模式很相似,均在空肠前半段和十二指肠中高表达,在空肠后段和回肠中低表达。在干扰I-FABP基因表达后,MTTP和ApoB基因mRNA的表达水平都明显下调。这证明了I-FABP基因在小肠脂肪酸吸收与转运中的重要作用。
总之,I-FABP在长链脂肪酸的吸收、转运及脂类合成分解代谢中起重要的作用,研究I-FABP基因的结构特点、多态性、组织分布及其基因表达调控机制对深入了解脂类代谢异常的发生机制及为家禽育种和营养调控寻找有效的靶点具有重要的意义。
参考文献(References):
[1] ABUMRAD N A,DAVIDSON N O.Role of the gut in lipid homeostasis[J].Physiol Rev,2012,92(3):1061-1085.
[2] REISINGER K W,ELST M,DERIKX J P,et al.Intestinal fatty acid-binding protein:apossible marker for gut maturation[J].Pediatr Res,2014,76(3):261-268.
[3] SALGUERO M L,LEON R E,SANTOS A,et al.The role of FABP2gene polymorphism in alcoholic cirrhosis[J].Hepatol Res,2005,33(4):306-312.
[4] SHABANA,HASNAIN S.The fatty acid binding protein 2(FABP2)polymorphism Ala54Thr and obesity in Pakistan:A population based study and a systematic meta-analysis[J].Gene,2015,574(1):106-111.
[5] LIU P,YU D,JIN X,et al.The association between the FABP2Ala54Thr variant and the risk of type 2 diabetes mellitus:a meta-analysis based on 11casecontrol studies[J].Int J Clin Exp Med,2015,8(4):5422-5429.
[6] HU G,WANG S,TIAN J,et al.Epistatic effect between ACACA and FABP2gene on abdominal fat traits in broilers[J].J Genet Genomics,2010,37(8):505-512.
[7] 初丽丽,王启贵,关天竹,等.I-FABP基因侧翼区多态性与鸡生长和胴体组成性状的相关研究[J].东北农业大学学报,2008,39(9):70-74.CHU L L,WANG Q G,GUAN T Z,et al.Association analyses between SNPs in the flanking region of I-FABP gene and growth and carcass composition traits[J].Journal of Northeast Agricultural University,2008,39(9):70-74.(in Chinese)
[8] HAJRI T,ABUMRAD N A.Fatty acid transport across membranes:relevance to nutrition and metabolic pathology[J].Annu Rev Nutr,2002,22:383-415.
[9] ZHANG F,LÜCKE C,BAIER L J,et al.Solution structure of human intestinal fatty acid binding protein with a naturally-occurring single amino acid substitution(A54T)that is associated with altered lipid metabolism[J].Biochemistry,2003,42(24):7339-7347.
[10] BAIER L J,SACCHETTINI J C,KNOWLER W C,et al.An amino acid substitution in the human intestinal fatty acid binding protein is associated with increased fatty acid binding,increased fat oxidation,and insulin resistance[J].J Clin Invest,1995,95(3):1281-1287.
[11] AGREN J J,VALVE R,VIDGREN H,et al.Postprandial lipemic response is modified by the polymorphism at codon 54of the fatty acid-binding protein 2 gene[J].Arterioscler Thromb Vasc Biol,1998,18 (10):1606-1610.
[12] ZHAO T,NZEKEBALOUDOU M,IV J.Ala54Thr polymorphism of fatty acid-binding protein 2gene and fasting blood lipids:a meta-analysis[J].Atherosclero-sis,2010,210(2):461-467.
[13] ALBALA C,VILLARROEL A,SANTOS J L,et al.FABP2Ala54Thr polymorphism and diabetes in Chilean elders[J].Diabetes Res Clin Pract,2007,77(2):245-250.
[14] PRATLEY R E,BAIER L,PAN D A,et al.Effects of an Ala54Thr polymorphism in the intestinal fatty acid-binding protein on responses to dietary fat in humans[J].J Lipid Res,2000,41(12):2002-2008.
[15] BESNARD P,NIOT I,POIRIER H,et al.New insights into the fatty acid-binding protein(FABP)family in the small intestine[J].Mol Cell Biochem,2002,239(1-2):139-147.
[16] ZIMMERMAN A W,VAN MOERKERK H T,VEERKAMP J H.Ligand specificity and conformational stability of human fatty acid-binding proteins [J].Int J Biochem Cell Biol,2001,33(9):865-876.
[17] NIOT I,POIRIER H,TRAN T T,et al.Intestinal absorption of long-chain fatty acids:evidence and uncertainties[J].Prog Lipid Res,2009,48(2):101-115.
[18] THUMSER A E,STORCH J.Liver and intestinal fatty acid-binding proteins obtain fatty acids from phospholipid membranes by different mechanisms[J].J Lipid Res,2000,41(4):647-656.
[19] GAJDA A M,STORCH J.Enterocyte fatty acid-binding proteins(FABPs):different functions of liver and intestinal FABPs in the intestine[J].Prostaglandins Leukot Essent Fatty Acids,2015,93:9-16.
[20] HUSSAIN M M,SHI J,DREIZEN P.Microsomal triglyceride transfer protein and its role in apoB-lipoprotein assembly[J].J Lipid Res,2003,44(1):22-32.
[21] HUSSAIN M M,IQBAL J,ANWAR K,et al.Microsomal triglyceride transfer protein:a multifunctional protein[J].Front Biosci,2003,8:500-506.
(编辑 郭云雁)
Molecular Cloning,Expression Pattern and Function of Duck I-FABP Gene
CHEN Fang1,2,3*,ZHANG Hao1,2,3,LU Li-zhi3
(1.Institute of Animal Husbandry and Veterinary Sciences,Hubei Academy of Agricultural Sciences,Wuhan 430064,China;2.Hubei Key Laboratory of Animal Embryo Engineering and Molecular Breeding,Wuhan 430064,China;3.Institute of Animal Husbandry and Veterinary Sciences,Zhejiang Academy of Agricultural Sciences,Hangzhou310021,China)
Abstract:This study aimed to analyze the structure and function of duck I-FABPgene.The Shaoxing duck was used.The sequence of duck I-FABPmRNA was cloned by RACE and RT-PCR.The expression patterns of I-FABPin different parts of small intestine were detected by qRTPCR.The function was analyzed by siRNA and qRT-PCR.The duck I-FABPgene encodes a 132-amino acid protein.A mutation from T to C resulting in a substitution from Ile to Thr was found at codon 60in exon 2of the I-FABP.I-FABP,MTTPand ApoBmRNA had high expression levels in duodenum and the first half of jejunum and had slight differences with the expression of L-FABP.After the I-FABPinterfered,the expression of MTTPand ApoBwere decreased significantly,but no obvious change at the expression level of L-FABP.The results verify the important role of I-FABPin uptake and translocation of fatty acid in small intestine of ducks and provide the foundation for further research.
Key words:duck;I-FABP;intestine;fatty acids
中图分类号:S834;S813.3
文献标志码:A
文章编号:0366-6964(2016)05-1041-08
doi:10.11843/j.issn.0366-6964.2016.05.023
收稿日期:2015-06-25
基金项目:湖北省创新团队项目(2016-620-000-001-028);动物胚胎及分子育种湖北省重点实验室开放课题及湖北省农业科学院青年基金(2015NKYJJ27)
作者简介:陈 芳(1987-),女,四川眉山人,助理研究员,博士,主要从事动物营养调控机理研究
*通信作者:陈 芳,E-mail:zhhchenfang0730@hotmail.com
