副猪嗜血杆菌SC096株荚膜多糖抗猪肺泡巨噬细胞吞噬能力的研究
2016-07-14贺现辉阳巧梅冯赛祥樊惠英
周 琪,贺现辉,阳巧梅,冯赛祥,樊惠英*,廖 明*
(1.华南农业大学兽医学院,广州 510642;2.邵阳职业技术学院,邵阳 422000)
副猪嗜血杆菌SC096株荚膜多糖抗猪肺泡巨噬细胞吞噬能力的研究
周琪1,贺现辉1,阳巧梅2,冯赛祥1,樊惠英1*,廖明1*
(1.华南农业大学兽医学院,广州 510642;2.邵阳职业技术学院,邵阳 422000)
为探讨荚膜多糖在副猪嗜血杆菌(Haemophilusparasuis)抗猪肺泡巨噬细胞吞噬中的作用,作者用间接免疫荧光试验和流式细胞术对H.parasuisSC096分离株及其荚膜缺陷型菌株进行了抗巨噬细胞吞噬试验。间接免疫荧光试验显示野生菌株组的H.parasuis大多数存在于巨噬细胞外,而荚膜多糖缺失突变体则主要存在于巨噬细胞内。流式细胞仪检测结果表明,对应的野生型菌株组巨噬细胞总的吞噬率为12.51%,吞入效率为89.61%;而荚膜多糖缺陷型组巨噬细胞总的吞噬率为27.18%,吞入效率为91.06%。加入外源荚膜多糖后,野生型菌株组巨噬细胞总的吞噬率降为2.72%,吞入效率降为32.72%;荚膜多糖缺陷型组巨噬细胞总的吞噬率降为3.59%,吞入效率基本不变,为91.36%。荚膜多糖缺失后H.parasuis抗巨噬细胞吞噬能力降低,表明H.parasuisSC096株荚膜多糖具有抑制巨噬细胞吞噬能力的作用。
副猪嗜血杆菌;荚膜多糖;猪肺泡巨噬细胞;吞噬能力
副猪嗜血杆菌(Haemophilusparasuis)是猪上呼吸道的一种共栖菌,可在特定的条件下入侵机体而引起严重的全身性疾病[1]。一般认为该病的暴发与猪群的运输等应激因素和免疫状况有着重要关系[2]。研究发现荚膜对其致病过程起着重要作用,H.parasuis分为有荚膜菌株和无荚膜菌株,T.Morozumi等通过十六烷基三甲基溴化铵沉淀和荚膜染色等方法鉴定了H.parasuis的荚膜结构,有荚膜菌株一般是球杆菌样,而不是通常的棒状或丝状,从健康猪上鼻腔分离的H.parasuis菌株多数具有荚膜,而分离自患病猪的感染的实质性器官等部位的H.parasuis菌株却只有少数具有荚膜[3]。有研究表明从健康猪鼻腔中分离的H.parasuis不能有效逃避肺巨噬细胞的吞噬作用,而在发病脏器中分离的副猪嗜血杆菌逃避肺巨噬细胞吞噬的能力更强。同时,在和肺泡巨噬细胞作用之后体外传代丢失的荚膜结构可以恢复,这暗示了这种荚膜结构可能使副猪嗜血杆菌更有效地逃避肺巨噬细胞的吞噬,但具体的抗吞噬机制还需要进一步的研究[4]。荚膜多糖(CPS)对巨噬细胞吞噬作用的影响机制尚不明确。目前已知细胞松弛素B会影响巨噬细胞的吞噬作用,细胞松弛素B通过降解细胞的微丝来阻断吞噬泡的形成,从而抑制细胞的吞噬[5]。
因此,本研究利用H.parasuisSC096分离株及其荚膜多糖缺陷型菌株和纯化的荚膜多糖及细胞松弛素B分别进行抗巨噬细胞吞噬试验,用间接免疫荧光试验和流式细胞术检测巨噬细胞的吞噬效率,研究荚膜多糖对H.parasuis抗巨噬细胞吞噬能力的影响,鉴定H.parasuis荚膜多糖功能,为进一步开展H.parasuis致病机制研究提供理论基础。
1 材料与方法
1.1菌株与细胞
副猪嗜血杆菌SC096分离株及其荚膜多糖缺陷型菌株由华南农业大学农业部兽用疫苗创制重点实验室保存。猪肺泡巨噬细胞(PAMs)购自美国ATCC(细胞编号CRL-2845)。
1.2主要仪器与试剂
流式细胞仪(贝克曼公司,美国),显微镜(奥林巴斯CX311,日本),超声波破碎仪(宁波新芝生物科技股份有限公司 JY96-IIn);TSA(胰蛋白胨大豆琼脂)、TSB(胰蛋白胨大豆肉汤)和LB培养基为青岛海博试剂有限公司产品;细胞膜红色荧光探针 (DiI)为碧云天生物技术研究所产品;预染蛋白质Marker PageRulerTMPrestained Protein Ladder SM0671为加拿大 Fermentas公司产品。试验所用抗体见表1。
表1试验所用抗体
Table 1Antibodys used in this study

名称Name宿主Host来源SourceH.parasuisSC096capsularpolysaccharidedeficientstrainPolyclonalAntibodyRabbitOurlaboratoryBovineserumalbuminPolyclonalAntibodyMouseMillipore,USAMouseIgGPolyclonalAntibodylinkedFITCGoatMillipore,USARabbitIgGPolyclonalAntibodylinkedFITCGoatMillipore,USAMouseIgGPolyclonalAntibodylinkedPIGoatMillipore,USARabbitIgGPolyclonalAntibodylinkedPIGoatMillipore,USA
1.3细菌及细胞培养
副猪嗜血杆菌在TSA上复苏,取单菌落接种于TSB中培养12 h作为种子液,将上述种子液按照1%比例接种于新鲜TSB中,37 ℃,180 r·min-1振荡培养。将PAMs细胞(CRL-2845)解冻后转移至75 cm2细胞瓶,置于5% CO2培养箱37 ℃培养。待细胞长满时传代,按1∶2的比例扩增细胞。
1.4间接免疫荧光检测H.parasuis抗巨噬细胞吞噬试验
将细胞传至12孔培养板中,加入细胞膜红色荧光探针 (DiI)。待细胞长至对数期(约4.0×105·孔-1)时,分别加入FITC染色的H.parasuisSC096株野生型和荚膜多糖缺陷型菌株(约1.0×107CFU·孔-1),37 ℃孵育1 h,再用无菌预冷PBS洗5遍,洗去未被吞噬的细菌。每个样品均有重复孔,试验重复3次。然后用pH 7.4的PBST清洗细胞3遍,4%多聚甲醛固定20 min。PBST洗涤3次,每次5 min,0.25% Triton X-100作用30 min。PBST洗涤3次,每次5 min,滴加5%脱脂奶粉封闭1 h或者4 ℃过夜。PBST洗涤3次,每次5 min,分别滴加抗相应H.parasuis菌株的一抗,37 ℃湿盒作用1 h或者4 ℃过夜。PBST洗涤3次,每次5 min,滴加稀释的FITC标记的荧光抗兔二抗,室温作用1 h。PBST洗涤3次,每次5 min,荧光显微镜观察。
1.5流式细胞术检测H.parasuis抗巨噬细胞吞噬试验
1.5.1荚膜多糖(CPS)提取及纯化将培养好的细菌用PBS洗两遍,离心。将细菌团用60 ℃水饱和酚进行萃取[6]。30 min后,所得到的苯酚和水相合并,并用蒸馏水透析以除去苯酚。透析液通过离心澄清并浓缩,冷冻干燥。粗制剂在缓冲液(10 mmol·L-1pH为7.5的Tris-HCl,1 mmol·L-1的氯化镁,1 mmol·L-1的氯化钙,50 μg·mL-1核糖核酸酶A和50 μg·mL-1DNA酶Ⅰ)中37 ℃振荡温育3 h,加入蛋白酶K 50 μg·mL-160 ℃消化3 h,离心取上清。CPS 100 000 g 离心6 h后,将凝胶样CPS团块重悬于无热原水,冻干。从粗品CPS中去除LPS污染物:将样品以5 mg·mL-1浓度溶解于2%乙酸,100 ℃孵育2 h。经水解的样品冷却至室温,通过离心澄清将上清液小心地取出并再次透析。将透析后液体冷冻干燥浓缩,冻干的样品以20 mg·mL-1溶解于PBS中,并过滤灭菌。纯化的CPS进行SDS-PAGE并银染。
1.5.2细胞的处理参考A.Olvera等的报道[4],将H.parasuisSC096株野生型和荚膜多糖缺陷型菌株与荧光染料FITC孵育1 h着色,洗去多余染料。将细胞传至12孔细胞培养板中,待细胞长至对数生长期(约4.0×105·孔-1)时,分别加入FITC 染色的H.parasuisSC096 株野生型和荚膜多糖缺陷型菌株(约1.0×107CFU·孔-1),另一组同时加入30 μg提纯的荚膜多糖(另设不加荚膜多糖,而是加细胞松驰素B的对照),放回培养箱孵育1 h后,用无菌预冷PBS洗5遍,洗去未被吞噬的细菌。每个样品均设重复孔,试验重复3次。
1.5.3流式细胞术冰上小心刮取细胞,轻轻将细胞悬液转移到5 mL离心管中,800 g离心5 min收集细胞,用2 mL预冷PBS洗涤细胞一次,800 g离心5 min。用2 mL 4%多聚甲醛室温固定细胞40 min,800 g离心5 min;2 mL PBS重悬细胞,800 g离心5 min;用1 mL含0.2% Triton-X100和5% 血清的PBS重悬细胞,冰上放置10 min,800 g离心5 min。分别加入H.parasuisSC096 株野生型和荚膜多糖缺陷型菌株抗体,冰上放置40 min,800 g离心5 min,用2 mL冷的PBS 重悬细胞,800 g离心5 min,洗去未结合一抗,重复一次。加入荧光标记(PI)的二抗,冰上避光放置40 min后,800 g离心5 min,去上清,PBS洗涤两次。加入0.5 mL 1%多聚甲醛重悬细胞;流式细胞仪检测。
2 结 果
2.1间接免疫荧光检测副猪嗜血杆菌SC096株抗巨噬细胞吞噬试验
间接免疫荧光结果显示,H.parasuisSC096野生型菌株和肺泡巨噬细胞孵育后,抗吞噬能力较强,细菌(绿色)多分布在巨噬细胞细胞膜(棕红色环)区域之外(图1A,白色箭头所示处);而荚膜多糖缺陷型菌株抗吞噬能力较弱,细菌(绿色)多分布在巨噬细胞细胞膜(棕红色环)区域之内(图1B,白色箭头所示处)。
2.2流式细胞术检测副猪嗜血杆菌SC096株抗巨噬细胞吞噬试验2.2.1荚膜多糖的提取SDS-PAGE银染结果显示,提取的H.parasuisSC096株荚膜多糖在35 ku处有一个清晰的条带,泳道背景清晰,无其他杂带(图2,泳道1),脂多糖对照条带出现在15~25 ku,条带清晰,泳道背景清晰,无其他杂带(图2,泳道2)。
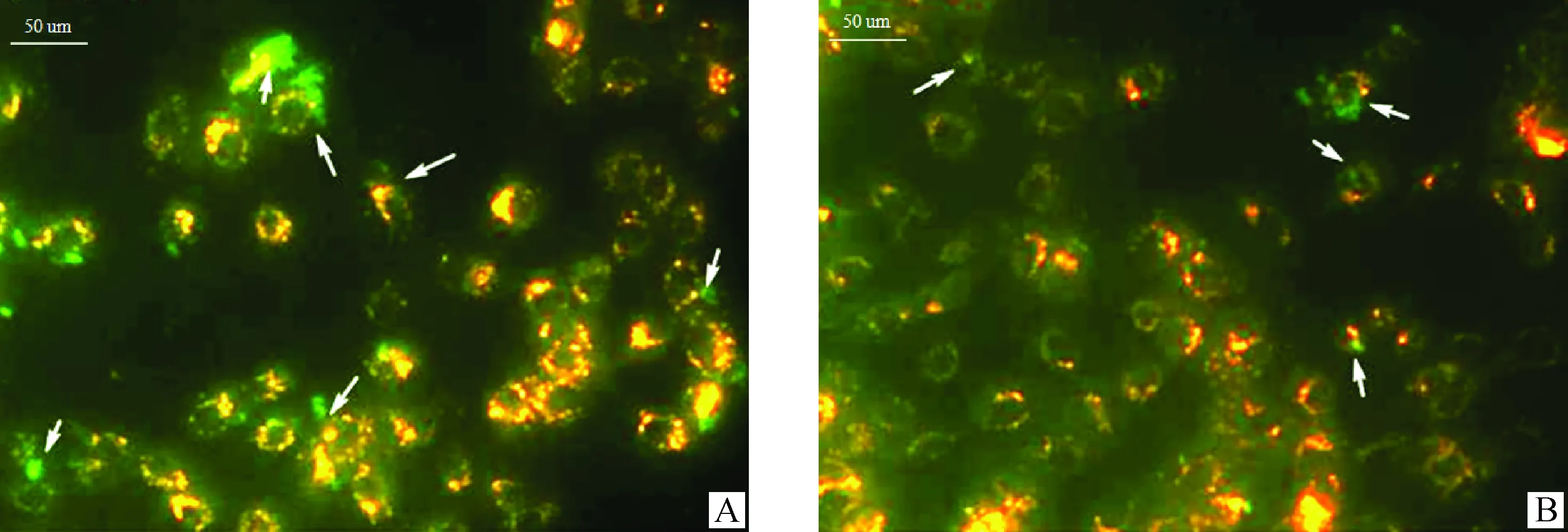
A.野生型菌株抗巨噬细胞吞噬,绿色为细菌,棕红色环为巨噬细胞细胞膜,细菌多在细胞膜外,见白色箭头所示;B.荚膜多糖缺陷型菌株抗巨噬细胞吞噬,绿色为细菌,棕红色环为巨噬细胞细胞膜,细菌多在细胞膜内,见白色箭头所示A.Wild-type strain inhibit phagocytosis of macrophages,bacteria are stained green,the cell membrane of macrophages are stained red in circle shape,and most bacteria located outside the membrane (white arrow);B.Capsular polysaccharide-deficient strain anti-macrophage phagocytosis,bacteria are stained green,the cell membrane of macrophages are stained red in circle shape,and most bacteria located inside the membrane (white arrow)图1 H.parasuis SC096株野生型及荚膜多糖缺陷型菌株抗巨噬细胞吞噬试验(间接免疫荧光)Fig.1 Anti-macrophage experimental results of H.parasuis SC096 strains wild-type and capsular polysaccharide-deficient strain (By indirect immunofluorescence assay)

M.PageRulerTM Prestained Protein Ladder SM0671;1.H.parasuis SC096株荚膜多糖;2.H.parasuis SC096株脂多糖M.PageRulerTM Prestained Protein Ladder SM0671;1.Capsular polysaccharide of H.parasuis SC096 strain;2.Lipopolysaccharide of H.parasuis SC096 strain图2 H.parasuis SC096株荚膜多糖提取结果Fig.2 Capsular polysaccharide of H.parasuis SC096 strain
2.2.2流式细胞术检测结果统计结果显示(表2),野生型菌株组巨噬细胞总的吞噬率为12.51%,吞入效率为89.61%;荚膜多糖缺陷型组巨噬细胞总的吞噬率为27.18%,吞入效率为91.06%。加入外源荚膜多糖后,野生型菌株组巨噬细胞总的吞噬率降为2.72%,吞入效率降为32.72%;荚膜多糖缺陷型组巨噬细胞总的吞噬率降为3.59%,吞入效率基本不变,为91.36%。加入和外源荚膜多糖等量的细胞松弛素B后,野生型菌株组总的吞噬率降为5.52%,荚膜多糖缺陷型降为15.59%。
流式细胞仪双通道检测结果显示为4个区间,B1对应红色荧光,B2对应既有红色荧光又有绿色荧光,B3对应无荧光,B4对应只有绿色荧光(图3)。其中,绿色荧光结果表示H.parasuis带有的荧光,红色荧光为吞噬结束后抗H.parasuis抗体结合上的荧光。当H.parasuis被巨噬细胞吞噬吞入到细胞内时,则抗体无法把红色荧光标记到细菌上,而当其被捕获在巨噬细胞细胞膜上,未被完全吞噬进去时,抗体可以把红色荧光结合到细菌上。即,只有绿色荧光的细胞为完全吞入H.parasuis的巨噬细胞,既有红光又有绿光的为未完全吞入H.parasuis的巨噬细胞。
表2流式细胞术检测H.parasuisSC096株野生型及荚膜多糖缺陷型菌株试验统计结果
Table 2Statistical results of anti-macrophage by results ofH.parasuisSC096 strains wild-type and capsular polysaccharide-deficient strain (By flow cytometry)

%

A.野生型组;B.野生型+荚膜多糖组;C.野生型+细胞松弛素B组;D.荚膜多糖缺陷型组;E.荚膜多糖缺陷型+荚膜多糖组;F.荚膜多糖缺陷型+细胞松弛素B组A.Wild-type;B.Wild-type +CPS;C.Wild-type +Cytochalasin B;D.Capsular polysaccharide-deficient strain;E.Capsular polysaccharide-deficient strain +CPS;F.Capsular polysaccharide-deficient strain +Cytochalasin B图3 H.parasuis SC096株野生型及荚膜多糖缺陷型菌株抗巨噬细胞吞噬试验结果(流式细胞术)Fig.3 Anti-macrophage experimental results of H.parasuis SC096 strains wild-type and capsular polysaccharide-deficient strain (By flow cytometry)
3 讨 论
荚膜是细胞壁外包围的一层黏液性物质,有黏附、营养、抗干燥、抗吞噬及抗有害物质损伤等作用,在细菌的生存中起重要的作用。荚膜的主要成分是多糖和多肽,多糖有助于细菌躲避宿主的免疫攻击,在宿主还没有产生特异性抗体时,荚膜多糖对抵抗宿主非特异性免疫攻击起到关键的作用,它能阻碍补体因子与细菌表面有效的激活因子接触,从而阻止膜攻击复合体(MAC)对细菌的攻击[7-8]。有些细菌的荚膜多糖可以抑制巨噬细胞的细胞膜脂微区(lipid microdomains)形成,进一步抑制巨噬细胞的吞噬能力[9],还有细菌的荚膜多糖可以与宿主细胞表面蛋白相互作用,抑制细胞IL-8的释放[10]。
副猪嗜血杆菌荚膜多糖合成基因座的位置比较保守,但是不同血清型菌株的基因组成相差较大,荚膜多糖的遗传和结构差异决定了副猪嗜血杆菌血清型具有多样性[11]。H.parasuis荚膜通常在抵御宿主补体攻击中具有作用,有研究发现高抗血清杀伤的H.parasuis菌株SH0165荚膜多糖基因座上的capD基因是关键的毒力因子,capD缺陷会使SH0165致病能力下降以及对补体敏感[12]。荚膜结构对H.parasuis抗巨噬细胞吞噬也有重要作用,A.Olvera等[4]发现分离自有全身症状猪的H.parasuis,在与PAMs细胞相互作用后可观察到有明显的荚膜,这表明在抗吞噬作用中荚膜表面结构发挥了一定的作用。研究发现Wza基因编码荚膜多糖输出蛋白[13],敲除Wza基因的突变株表现出对猪肺泡巨噬细胞的吞噬作用更加敏感[14]。关于荚膜多糖抗巨噬细胞吞噬的原理,在其他细菌上也有过报道,有的细菌荚膜靠模拟宿主体内成分逃避免疫识别的方法,进而逃避巨噬细胞的吞噬,有的细菌荚膜多糖可以抑制巨噬细胞吞噬结构的形成,进一步抑制巨噬细胞的吞噬作用[15-17]。
本研究中作者先采用间接免疫荧光法检测了PAMs细胞对H.parasuisSC096株及其荚膜多糖缺陷型菌株的吞噬情况,发现H.parasuisSC096株多存在于PAMs细胞外,而荚膜多糖缺陷型菌株则主要存在于PAMs细胞内,说明荚膜多糖缺陷型菌株更易被巨噬细胞吞噬,其抗吞噬能力较SC096亲本株弱。这一结果表明荚膜多糖缺失后H.parasuis抗巨噬细胞吞噬能力降低,荚膜多糖在H.parasuis抗巨噬细胞吞噬过程中可能起重要作用。
作者还运用流式细胞术分别统计了PAMs细胞对SC096野生型菌株及其荚膜多糖缺陷型菌株的吞噬数。数据表明无论是总的吞噬率还是吞入效率,野生型菌株组均小于荚膜多糖缺陷型菌株组,说明荚膜多糖缺失后的菌株更易被巨噬细胞捕捉和吞噬。加入外源荚膜多糖后,野生型菌株组和荚膜多糖缺陷型菌株组的巨噬细胞吞噬率都有所降低,说明外源的荚膜多糖可以降低巨噬细胞对H.parasuis的吞噬效率,抑制巨噬细胞的吞噬能力,但野生型组的PAMs细胞吞噬率仍远低于荚膜多糖缺陷型组,这提示菌体表面的荚膜结构可以抵御巨噬细胞的吞噬。另外,细胞松弛素B可以抑制巨噬细胞形成吞噬结构,进而抑制其吞噬能力。加入和外源荚膜多糖等量的细胞松弛素B后,野生型菌株组和荚膜多糖缺陷型菌株组总的吞噬率也有所降低,但降低程度不如外源荚膜多糖。这提示外源性荚膜多糖抑制巨噬细胞吞噬的能力强于细胞松弛素B。研究结果初步解释了H.parasuisSC096株荚膜多糖抗巨噬细胞吞噬的机制,为进一步研究副猪嗜血杆菌的致病机制提供了理论基础。
4 结 论
比较H.parasuisSC096株野生型和荚膜缺陷型菌株抗猪肺泡巨噬细胞吞噬的能力,发现荚膜丢失后H.parasuis抗巨噬细胞吞噬的能力下降。H.parasuisSC096株荚膜多糖可以明显抑制巨噬细胞对该菌的吞噬能力。
[1]OLIVEIRA S,PIJOAN C.Haemophilusparasuis:new trends on diagnosis,epidemiology and control[J].VetMicrobiol,2004,99(1):1-12.
[2]SOLANO G I,SEGALÉS J,COLLINS J E,et al.Porcine reproductive and respiratory syndrome virus (PRRSv) interaction withHaemophilusparasuis[J].VetMicrobiol,1997,55(1-4):247-257.
[3]MOROZUMI T,NICOLET J.Morphological variations ofHaemophilusparasuisstrains[J].JClinMicrobiol,1986,23(1):138-142.
[4]OLVERA A,BALLESTER M,NOFRARIAS M,et al.Differences in phagocytosis susceptibility inHaemophilusparasuisstrains[J].VetRes,2009,40(3):24.
[5]李卓娅,GEMSA D,冯新为.细胞骨架系统对TNF-α 产生的影响[J].上海免疫学杂志,1995,15(5):261-263.
LI Z Y,GEMSA D,FENG X W.Effect of the cytoskeletal system on TNF-α production[J].ShanghaiJournalofImmunology,1995,15(5):261-263.(in Chinese)
[6]HEISS C,BURTNICK M N,WANG Z,et al.Structural analysis of capsular polysaccharides expressed byBurkholderiamalleiandBurkholderiapseudomallei[J].CarbohydrRes,2012,349:90-94.
[7]FRANK M M,JOINER K,HAMMER C.The function of antibody and complement in the lysis of bacteria[J].RevInfectDis,1987,9(Suppl 5):S537-S545.
[8]HOWARD C J,GLYNN A A.The virulence for mice of strains ofEscherichiacolirelated to the effects of K antigens on their resistance to phagocytosis and killing by complement[J].Immunology,1971,20(5):767-777.
[9]HOUDE M,GOTTSCHALK M,GAGNON F,et al.Streptococcussuiscapsular polysaccharide inhibits phagocytosis through destabilization of lipid microdomains and prevents lactosylceramide-dependent recognition[J].InfectImmun,2012,80(2):506-517.
[10]SHARMA A,QADRI A.Vi polysaccharide ofSalmonellatyphitargets the prohibitin family of molecules in intestinal epithelial cells and suppresses early inflammatory responses[J].ProcNatlAcadSciUSA,2004,101(50):17492-17497.
[11]HOWELL K J,WEINERT L A,LUAN S L,et al.Gene content and diversity of the loci encoding biosynthesis of capsular polysaccharides of the 15 serovar reference strains ofHaemophilusparasuis[J].JBacteriol,2013,195(18):4264-4273.
[12]WANG X,XU X,WU Y,et al.Polysaccharide biosynthesis proteinCapDis a novel pathogenicity-associated determinant ofHaemophilusparasuisinvolved in serum-resistance ability[J].VetMicrobiol,2013,164(1-2):184-189.
[13]曹瑞娟.副猪嗜血杆菌wza基因在其粘附和抗吞噬中的作用研究[D].武汉:华中农业大学,2014.
CAO R J.The research on adhesion and resisting phagocytosis ofwzainHaemophilusparasuis[D].Wuhan:Huazhong Agricultural University,2014.(in Chinese)
[14]康磊,李军星,王一成,等.副猪嗜血杆菌Wza基因缺失株的构建及生物学特性研究[J].农业生物技术学报,2015,23(6):806-815.
KANG L,LI J X,WANG Y C,et al.Construction and biological characteristic ofWza-deficient mutant ofHaemophilusparasuis[J].JournalofAgriculturalBiotechnology,2015,23(6):806-815.(in Chinese)
[15]王斯阳.肺炎克雷伯杆菌感染小鼠白细胞IL-10及其mRNA的变化[D].沈阳:中国医科大学,2012.
WANG S Y.Diversificationin of IL-10 and its mRNA in mice infected withKlebsiellapneumoniae[D].Shenyang:China Medical University,2012.(in Chinese)
[16]李平,谭宏月,胡婵,等.新生隐球菌GXM的纯化及其对巨噬细胞甘露糖受体表达调节的研究[J].中国真菌学杂志,2012,7(5):265-268.
LI P,TAN H Y,HU C,et al.Purification of capsular polysaccharide GXM fromCryptococcusneoformansand it’s role in regulating MR expression in macrophages[J].ChineseJournalofMycology,2012,7(5):265-268.(in Chinese)
[17]丁丹丹.猪链球菌2型cps2E基因缺失株构建及生物学特性研究[D].武汉:华中农业大学,2014.
DING D D.Construction and characterization ofcps2Edeleted mutants ofStreptococcussuisserotype 2[D].Wuhan:Huazhong Agricultural University,2014.(in Chinese)
(编辑白永平)
Role of Capsular Polysaccharide inHaemophilusparasuisSC096 Strain Anti-Porcine Alveolar Macrophage Phagocytosis
ZHOU Qi1,HE Xian-hui1,YANG Qiao-mei2,FENG Sai-xiang1,FAN Hui-ying1*,LIAO Ming1*
(1.CollegeofVeterinaryMedicine,SouthChinaAgriculturalUniversity,Guangzhou510642,China;2.ShaoyangPolytechnic,Shaoyang422000,China)
The aim of the experiment was to clarify the role of the capsular polysaccharide in anti-porcine alveolar macrophage phagocytosis ofHaemophilusparasuis.The anti-phagocytosis test was conducted by using indirect immunofluorescence method and flow cytometry withH.parasuisSC096 wild-type strain,and capsular deficient strain.The results showed that theH.parasuisSC096 wild-type strains were observed mainly outside the macrophages,while capsular polysaccharide-deficient were observed in macrophages by indirect immunofluorescence experiments.Flow cytometry results showed that the total macrophage phagocytosis rate was 12.51% and swallowed efficiency was 89.61% in the wild-type strain group;the total macrophage phagocytosis rate was 27.18% and swallowed efficiency was 91.06% in the capsular polysaccharide-deficient group.By adding exogenous capsular polysaccharide,total macrophage phagocytosis rate was reduced to 2.72%,swallowed efficiency was reduced to 32.72% in the wild-type strain group;the total macrophage phagocytosis rate dropped to 3.59%,swallowed efficiency was nearly unchanged at 91.36% in the capsular polysaccharide-deficient group.The ability of anti-macrophage phagocytosis ofH.parasuiswas reduced through removing capsular polysaccharide,which demonstrated that capsular polysaccharide may inhibit the ability of macrophage phagocytosis.
Haemophilusparasuis;capsular polysaccharide;porcine alveolar macrophage;phagocytosis
10.11843/j.issn.0366-6964.2016.06.019
2015-10-21
农业部公益性行业科研专项经费项目(201303034);农业科研杰出人才及其创新团队-现代农业人才支撑计划项目[农财发(2012)160号];教育部博士点基金项目(20114404110016);广东省"三高"农业专项资金(5500-F15071)
周琪(1991-),女,江西兴国人,硕士生,主要从事动物传染病学研究,E-mail: 15909348676@163.com
廖明,男,教授,E-mail: mliao@scau.edu.cn; 樊惠英,女,教授,E-mail:hyfan@scau.edu.cn
S852.61
A
0366-6964(2016)06-1232-07
