扩散加权成像在肝细胞癌中的应用
2016-07-13唐艳华叶慧义
唐艳华 叶慧义
扩散加权成像在肝细胞癌中的应用
唐艳华 叶慧义
【关键词】肝肿瘤;磁共振成像,弥散;扩散加权成像;综述
扩散加权成像(DWI)是采用MRI无创检测活体组织功能状态的一种技术[1],目前已成熟应用于中枢神经系统影像诊断、鉴别诊断和定量评估中。在平面回波成像快速序列的应用下,DWI越来越多地应用于腹部影像检查中,尤其是在肝脏影像方面[2]。肝细胞癌(hepatocellular carcinoma,HCC)是最常见、最主要的肝脏恶性肿瘤,发病率和死亡率均很高[3]。本文就DWI在HCC中的临床应用和进展进行综述。
1 DWI在HCC鉴别诊断的应用
DWI序列信号强度取决于水分子扩散,水分子扩散的越多,信号丢失越多;扩散越少,则信号丢失越少[2]。恶性肿瘤细胞密度较高,细胞核多,细胞外间隙少,水分子扩散受限明显[4],这为DWI序列帮助鉴别HCC和其他肝脏局灶性病变提供了一定的理论支持。Lee等[5]比较了MRI钆塞酸增强肝细胞期和高b值DWI(b值为0、800 s/mm2)在区分慢性肝病患者中高分化HCC和肝细胞良性结节方面的评估能力,结果表明DWI序列单一应用和联合钆塞酸增强肝细胞期信号对比应用均可以很好地帮助鉴别高分化HCC和肝细胞良性结节。
DWI可以无创性地反映组织内部结构和特点,而表观扩散系数(ADC)值是在DWI序列上测得的可用于对病变进行水分子扩散活动量化分析的一个定量指标,其受水分子流动性和毛细血管灌注情况的影响,可反映组织的细胞密度和细胞膜完整性情况[6]。郑辉等[7]纳入40例HCC、20例肝血管瘤、20例肝囊肿和20例正常肝脏对照组,分别比较ADC值,结果表明DWI对HCC病灶具有特异性检验,可与肝血管瘤和肝囊肿相区分。Sandrasegaran等[8]比较了57个肝硬化背景患者中HCC和良性肝细胞结节的ADC值差异,结果表明良性肝细胞结节的ADC值较HCC的ADC值更高,提示ADC值有助于鉴别HCC和良性肝细胞结节。
2 DWI对HCC的检出效能
DWI序列可以帮助提高HCC诊断检出率和诊断准确性,尤其是在病灶≤2 cm的小HCC方面。Xu等[9]对37例慢性肝病患者进行肝脏MRI检查,包括b值为500 s/mm2的屏气DWI序列、T1、T2和常规动态增强扫描,结果显示联合DWI序列的常规动态增强扫描较单独应用常规动态增强扫描能明显提高慢性肝病患者中的小HCC病灶检出灵敏度。Park等[10]研究了108例患者,102个HCC病灶和29个肝脏良性结节(21个癌前结节和2个大的再生结节),40例无HCC病灶患者进行DWI扫描和钆塞酸增强扫描,结果表明联合DWI和钆塞酸MRI增强扫描的HCC诊断标准,能够可靠地诊断小HCC(包括少血供的HCC)。
此外,DWI也可以帮助监测肝细胞结节转化为HCC的进展。Di Pietropaolo等[11]分析了DWI在评估HCC和有高风险转化为HCC的肝细胞结节方面的作用,结果表明DWI上高信号显示与进展为HCC相关。
3 DWI与HCC病理分级的相关性
低级别HCC提示预后较差、肿瘤复发率较高[12-13],许多外科医师认为应该相应地修改低分化HCC的治疗方式[14-15],因此治疗前预测HCC病理分级对于治疗方法策略的选择和指导预后非常重要[1,16]。2015年,Chen等[17]的Meta分析指出,在众多影像学指标无创地预测HCC病理分级的方法中,DWI是最可靠的无创性定量指标。
An等[18]采用分析DWI图像上病变是否扩散受限(是否为高信号)、MRI钆塞酸动态增强扫描动脉期与预扫图像减影情况判断肿瘤动脉血供情况及肝胆期肝细胞损伤(肝细胞不摄取对比剂呈低信号)情况与病理学分级相关性进行分析,结果表明采用DWI或动脉期血供减影方法有助于预测HCC病理分级,尤其是两种方法协同使用时有更高的阳性预测值(100%)。
除通过采用DWI信号强度来判断HCC病理分级外,ADC值也越来越多地应用于定量评估HCC病理分级。既往研究[19-20]表明,低分化HCC与高分化和中分化HCC相比有更低的ADC值。Nasu等[1]研究表明,尽管低分化HCC的ADC值低于高分化HCC,但是ADC值与所有的HCC病理学分级之间的相关性并不明确。肿瘤分级不是简单地与细胞间质相关[21],HCC细胞数不总是随着肿瘤分化程度的减低而增多。此外,b值的个数和非布朗水运动过程中假扩散(如血流因素)的影响[22],这些均可能是造成ADC值与HCC病理分级相关性不明确的原因。
此外,Le Moigne等[23]进行了T2和DWI与病灶≤2 cm的小HCC的病理分级相关性研究,结果发现DWI(b值为50、400、800 s/mm2)和T2测量的病灶和肝实质的相对增强比(relative contrast ratio,RCR)能明显区分出高分化和中分化的小肝癌,RCR计算方法见公式(1)。因此,DWI的RCR测量也许也可以帮助无创性预测小HCC的病理分级。

4 DWI评估HCC治疗的效能
目前HCC的治疗方法有手术切除、经动脉导管化疗栓塞(TACE)、射频消融、微波消融、肝移植、靶向药物治疗、放射治疗等[24-28]。实性肿瘤疗效反映标准、WHO标准、欧洲肝脏研究协会标准[29-32]等传统治疗后反应评估标准是根据肿瘤大小作为肿瘤负荷测量,因肿瘤大小容易在影像资料上测量。而在新的靶向治疗和肝脏定向治疗中,简单的肿瘤解剖改变常落后于生物学改变。因此在治疗早期阶段,通过测量肿瘤生存能力和(或)灌注情况监测治疗反应逐渐受到关注[28]。DWI和ADC图能通过反映水分子在组织中的热运动情况而进一步了解肿瘤组织微观结构改变[33]。与治疗前相比,肿瘤坏死后细胞膜破裂,水分子扩散程度增加,进而反映为DWI上病灶信号减低(图1)和ADC值升高[34]。Yuan等[35]综述了针对DWI在当前HCC局部性治疗的临床疗效评估中的作用,发现基于肿瘤大小作为肿瘤负荷测量的影像测量简单易行而继续应用于临床,而靶向药物和区域性治疗的评估方面,DWI越来越广泛地应用于HCC疗效的评估中。
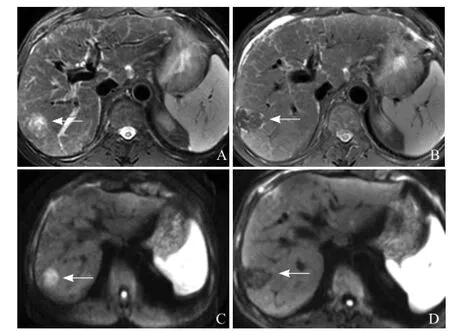
图1 男,57岁,肝细胞癌。T2WI示肝右叶前上段病变呈稍高信号(箭,A);射频消融后3个月复查,T2WI上病变呈低和稍高信号(箭,B);治疗前DWI病变呈高信号(箭,C);治疗后DWI病变呈低信号(箭,D),提示DWI可以帮助评估肝细胞癌射频消融疗效
Sahin等[36]采用DWI序列对HCC的TACE术后疗效进行评估,结果表明术前及术后肿瘤平均直径无明显改变,而术后ADC值(1.27×10-3mm2/s)明显高于术前(1.10×10-3mm2/s),表明ADC值可以帮助评估HCC的TACE疗效。此外,Mannelli等[37]纳入36例HCC患者共47个癌灶,比较TACE前后ADC值发现,TACE术前评估ADC值可以帮助预测HCC的疗效。
随着经皮穿刺局部消融治疗HCC在临床上的应用逐渐开展,消融后早期治疗灶周边的炎性反应与可能残存的肿瘤均可以表现出强化,因此CT和MRI常规检查和动态增强扫描无法很好地评估治疗后的早期疗效[33,38-39]。潘晶晶等[40]采用DWI对热消融(射频消融和微波消融)的HCC疗效进行探讨评估,21个HCC病灶消融前、消融后24 h内进行了不同b值下的DWI检查,结果发现相同b值下肿瘤消融后的ADC值均较消融前升高,b值为1000 s/mm2时,ADC界值为1.09×10-3mm2/s时诊断肿瘤坏死的灵敏度为89.5%,特异度为63.2%,而ADC界值为1.26×10-3mm2/s时诊断肿瘤坏死的灵敏度为52.6%,特异度为89.5%,表明DWI对早期评估热消融HCC的疗效有帮助。
5 最新的进展:体素内不相干运动扩散加权成像(IVIM-DWI
由于传统单b值DWI不能很好地区分出组织扩散情况和组织微血管灌注影响,而近几年关于IVIM-DWI在肝脏中的应用越来越多,也开始应用于HCC研究。IVIM是一种采用DWI的更先进的方法,可以分开扩散和灌注影响,而IVIM理论指出,毛细血管内的血液流动会导致施加扩散梯度时血液磁化失相位[41]。Le Bihan等[42]通过公式(2)来描述信号产生的衰减。其中S是体素内信号强度;Sb是取某个b值(b≠0)时的信号强度;S0为b=0时的信号强度;f是扩散分数,与组织微循环灌注有关,毛细血管越丰富,f值越大;D是真扩散系数;D*是假扩散系数,描述了由于不相干的毛细血管内血流造成的无效信号。得到上述参数要至少采用4个不同的扩散加权b值(包括b=0 s/mm2)。
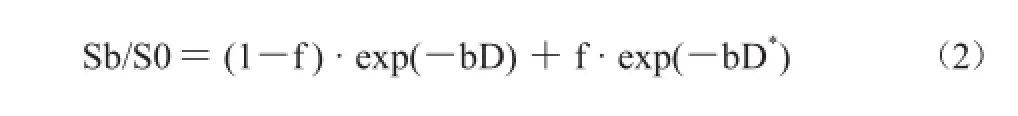
李玉博等[22]进行了IVIM对HCC术前分级的应用研究结果表明高级别HCC组D值低于低级别组,其原因可能是由于HCC分化程度越差,其细胞增殖越多,细胞小而数目密集,细胞核大而细胞质少,细胞间隙明显减少导致的肿瘤组织内水分子扩散受限更明显。D*值取决于肿瘤组织内毛细血管密度,而肿瘤组织恶性度高时,毛细血管密度高,组织微循环灌注越丰富。除应用于HCC术前病理分级外,目前也有IVIM关于应用于TACE术后HCC疗效评估中的尝试[43]
然而,在IVIM的可重复性方面可能存在一定的问题Kakite等[44]评估了HCC和肝实质的IVIM扩散参数和ADC值的短期试验-复试验和观察者间的可重复性,计算了D值D*值、灌注分数值(PE)和ADC值,结果表明HCC和肝实质的D值和ADC值可重复性良好,而D*/PF值可重复性较差
综上所述,DWI在HCC中的应用广泛,未来还需要进一步研究,以更好地帮助临床进行HCC的诊断分类、治疗前评估病理分级和疗效评估。
参考文献
[1] Nasu K, Kuroki Y, Tsukamoto T, et al. Diffusion-weighted imaging of surgically resected hepatocellular carcinoma: imaging characteristics and relationship among signal intensity, apparent diffusion coefficient, and histopathologic grade. Am J Roentgenol, 2009, 193(2): 438-444.
[2] Mannelli L, Bhargava P, Osman SF, et al. Diffusion-weighted imaging of the liver: a comprehensive review. Curr Probl Diagn Radiol, 2013, 42(3): 77-83.
[3] El-Serag HB. Hepatocellular carcinoma - an epidemiologic view. J Clin Gastroenterol, 2002, 35(5, 2): S72-S78.
[4] Gourtsoyianni S, Papanikolaou N, Yarmenitis S, et al. Respiratory gated diffusion-weighted imaging of the liver: value of apparent diffusion coefficient measurements in the differentiation between most commonly encountered benign and malignant focal liver lesions. Eur Radiol, 2008, 18(3): 486-492.
[5] Lee MH, Kim SH, Park MJ, et al. Gadoxetic acid-enhanced hepatobiliary phase MRI and high-b-value diffusion-weighted imaging to distinguish well-differentiated hepatocellular carcinomas from benign nodules in patients with chronic liver disease. Am J Roentgenol, 2011, 197(5): W868-W875.
[6] Mungai F, Morone M, Villanacci A, et al. Diffusion weighted MR and apparent diffusion coefficient measurement in classification and characterization of noncystic focal liver lesions: does a clinical role exist? Medicine, 2014, 93(6): e40.
[7] 郑辉, 张国华, 黄勇, 等. MR扩散加权成像在肝细胞癌诊断中的应用价值. 医学影像学杂志, 2014, 24(3): 494-497.
[8] Sandrasegaran K, Tahir B, Patel A, et al. The usefulness of diffusion-weighted imaging in the characterization of liver lesions in patients with cirrhosis. Clin Radiol, 2013, 68(7): 708-715.
[9] Xu PJ, Yan FH, Wang JH, et al. Added value of breathhold diffusion-weighted MRI in detection of small hepatocellular carcinoma lesions compared with dynamic contrast-enhanced MRI alone using receiver operating characteristic curve analysis. J Magn Reson Imaging, 2009, 29(2): 341-349.
[10] Park MJ, Kim YK, Lee MH, et al. Validation of diagnostic criteria using gadoxetic acid-enhanced and diffusion-weighted MR imaging for small hepatocellular carcinoma (<= 2.0 cm) in patients with hepatitis-induced liver cirrhosis. Acta Radiol, 2013, 54(2):127-136.
[11] Di Pietropaolo M, Briani C, Federici GF, et al. Comparison of diffusion-weighted imaging and gadoxetic acid-enhanced MR images in the evaluation of hepatocellular carcinoma and hypovascular hepatocellular nodules. Clin Imaging, 2015, 39(3): 468-475.
[12] Kim SH, Lee WJ, Lim HK, et al. SPIO-enhanced MRI findings of well-differentiated hepatocellular carcinomas: correlation with MDCT findings. Korean J Radiol, 2009, 10(2): 112-120.
[13] Pérez-Saborido B, De Los Galanes SJ, Menéu-Díaz JC, et al. Tumor recurrence after liver transplantation for hepatocellular carcinoma: recurrence pathway and prognostic factors. Transplant Proc, 2007, 39(7): 2304-2307.
[14] Okusaka T, Okada S, Ueno H, et al. Satellite lesions in patients with small hepatocellular carcinoma with reference to clinicopathologic features. Cancer, 2002, 95(9): 1931-1937.
[15] Zhou L, Rui JA, Wang SB, et al. Clinicopathological predictors of poor survival and recurrence after curative resection in hepatocellular carcinoma without portal vein tumor thrombosis. Pathology & Oncology Research, 2015, 21(1): 131-138.
[16] Suh KS, Cho EH, Lee HW, et al. Liver transplantation for hepatocellular carcinoma in patients who do not meet the Milan criteria. Digestive Diseases, 2007, 25(4): 329-333.
[17] Chen J, Wu MP, Liu RB, et al. Preoperative evaluation of the histological grade of hepatocellular carcinoma with diffusionweighted imaging: a meta-analysis. PLoS One, 2015, 10(2):e0117661.
[18] An C, Park MS, Jeon HM, et al. Prediction of the histopathological grade of hepatocellular carcinoma using qualitative diffusionweighted, dynamic, and hepatobiliary phase MRI. Eur Radiol, 2012, 22(8): 1701-1708.
[19] Chang WC, Chen RC, Chou CT, et al. Histological grade of hepatocellular carcinoma correlates with arterial enhancement on gadoxetic acid-enhanced and diffusion-weighted MR images. Abdom Imaging, 2014, 39(6): 1202-1212.
[20] Nakanishi M, Chuma M, Hige S, et al. Relationship between diffusion-weighted magnetic resonance imaging and histological tumor grading of hepatocellular carcinoma. Ann Surg Oncol, 2012, 19(4): 1302-1309.
[21] Hirohashi S, Ishak KG, Kojiro GM, et al. Hepatocellular carcinoma//Hamilton SR, Aaltonen AL. Pathology and Genetics of Tumors of the Digestive System. Lyon: LARC Press, 2000: 159-172.
[22] 李玉博, 高雪梅, 程敬亮, 等. 基于体素内不相干运动扩散加权成像在肝细胞癌术前分级中的应用分析. 临床放射学杂志, 2015, 34(3): 389-393.
[23] Le Moigne F, Boussel L, Haquin A, et al. Grading of small hepatocellular carcinomas (≤2 cm): correlation between histology, T2 and diffusion-weighted imaging. Br J Radiol, 2014, 87(141):20130763.
[24] Poggi G, Tosoratti N, Montagna B, et al. Microwave ablation of hepatocellular carcinoma. World J Hepatol, 2015, 7(25): 2578-2589.
[25] Paul SB, Sharma H. Role of transcatheter intra-arterial therapies for hepatocellular carcinoma. J Clin Exp Hepatol, 2014, 4(Suppl 3):S112-S121.
[26] Kumaran V. Role of liver transplantation for hepatocellular carcinoma. J Clin Exp Hepatol, 2014, 4(Suppl 3): S97-S103.
[27] Kalogeridi MA, Zygogianni A, Kyrgias G, et al. Role of radiotherapy in the management of hepatocellular carcinoma: a systematic review. World J Hepatol, 2015, 7(1): 101-112.
[28] Arora A, Kumar A. Treatment response evaluation and follow-upin hepatocellular carcinoma. J Clin Exp Hepatol, 2014, 4(Suppl 3):S126-S129.
[29] Miller AB, Hoogstraten B, Staquet M, et al. Reporting results of cancer treatment. Cancer, 1981, 47(1): 207-214.
[30] Rosen MA. Use of modified RECIST criteria to improve response assessment in targeted therapies: challenges and opportunities. Cancer Biol Ther, 2010, 9(1): 20-22.
[31] Bruix J, Sherman M, Llovet JM, et al. Clinical management of hepatocellular carcinoma. Conclusions of the Barcelona-2000 EASL conference. European Association for the Study of the Liver. J Hepatol, 2001, 35(3): 421-430.
[32] Koh DM, Collins DJ. Diffusion-weighted MRI in the body:applications and challenges in oncology. Am J Roentgenol, 2007, 188(6): 1622-1635.
[33] Vossen JA, Buijs M, Kamel IR. Assessment of tumor response on MR imaging after locoregional therapy. Tech Vasc Interv Radiol, 2006, 9(3): 125-132.
[34] Jiang ZX, Peng WJ, Li WT, et al. Effect of b value on monitoring therapeutic response by diffusion-weighted imaging. World J Gastroenterol, 2008, 14(38): 5893-5899.
[35] Yuan Z, Zhang J, Yang H, et al. Diffusion-weighted MR imaging of hepatocellular carcinoma: current value in clinical evaluation of tumor response to locoregional treatment. J Vasc Interv Radiol, 2016, 27(1): 20-30.
[36] Sahin H, Harman M, Cinar C, et al. Evaluation of treatment response of chemoembolization in hepatocellular carcinoma with diffusion-weighted imaging on 3.0-T MR imaging. J Vasc and Interv Radiol , 2012, 23(2): 241-247.
[37] Mannelli L, Kim S, Hajdu CH, et al. Serial diffusion-weighted MRI in patients with hepatocellular carcinoma: prediction and assessment of response to transarterial chemoembolization Preliminary experience. Eur J Radiol, 2013, 82(4): 577-582.
[38] Dromain C, De Baere T, Elias D, et al. Hepatic tumors treate with percutaneous radio-frequency ablation: CT and MR imagin follow-up. Radiology, 2002, 223(1): 255-262.
[39] Lim HS, Jeong YY, Kang HK, et al. Imaging features o hepatocellular carcinoma after transcatheter arterial chemoem bolization and radiofrequency ablation. Am J Roentgenol, 2006 187(4): W341-W349.
[40] 潘晶晶, 于杰, 钟燕, 等. 磁共振扩散加权成像早期评估热消融肝癌疗效的价值. 中国临床医学影像杂志, 2013, 24(10): 706 708, 711.
[41] Lemke A, Stieltjes B, Schad LR, et al. Toward an optima distribution of b values for intravoxel incoherent motion imaging Magn Reson Imaging, 2011, 29(6): 766-776.
[42] Le Bihan D, Breton E, Lallemand D, et al. Separation of diffusio and perfusion in intravoxel incoherent motion MR imaging Radiology, 1988, 168(2): 497-505.
[43] Park YS, Lee CH, Kim JH, et al. Using intravoxel incoheren motion (IVIM) MR imaging to predict lipiodol uptake in patient with hepatocellular carcinoma following transcatheter arteria chemoembolization: a preliminary result. Magn Reson Imaging 2014, 32(6): 638-646.
[44] Kakite S, Dyvorne H, Besa C, et al. Hepatocellular carcinoma short-term reproducibility of apparent diffusion coefficient an intravoxel incoherent motion parameters at 3.0T. J Magn Reson Imaging, 2015, 41(1): 149-156.
(本文编辑 张春辉
书评
由阜外心血管病医院赵世华教授主编的《心血管磁共振诊断学》已于2011年5月由人民军医出版社出版发行该书的出版得到刘玉清院士和胡大一教授的充分肯定和高度评价,并亲自作序。该书系统阐述了心脏MR成像技术及其在常见心血管疾病中的诊断价值、优势及不足。本书全部内容是作者根据自己的临床经验以及多年来所总结的心得历尽心血凝练而成,病种全面,内容翔实,具有较强的临床实用性,是该领域具有国内领先水平的参考书可供医学影像学医师,心脏内、外科医师阅读参考。
本书定价98元,各新华书店、当地医学书店和当当、卓越、京东网上书店均有销售。
为方便读者购买,人民军医出版社可以邮购。邮购联系人:王兰,电话:010-51927252。
【中图分类号】R735.7;R730.42
【作者单位】解放军总医院放射科MRI室 北京 100853
【通讯作者】叶慧义 E-mail: 13701100368@163.com
Doi:10.3969/j.issn.1005-5185.2016.03.023
【收稿日期】2016-01-08 【修回日期】2016-03-06
