应用气-质联机和同位素双标记技术对土壤微生物吸收有机氮的研究
2016-07-12杨立杰张丽莉武志杰房娜娜王玲莉
杨立杰,张丽莉,陈 伟,宫 平,武志杰,薛 妍,房娜娜,王玲莉
1.中国科学院沈阳应用生态研究所,辽宁 沈阳 110016 2.中国科学院大学,北京 100049
应用气-质联机和同位素双标记技术对土壤微生物吸收有机氮的研究
杨立杰1, 2,张丽莉1*,陈 伟1, 2,宫 平1,武志杰1,薛 妍1, 2,房娜娜1,王玲莉1
1.中国科学院沈阳应用生态研究所,辽宁 沈阳 110016 2.中国科学院大学,北京 100049
土壤微生物对小分子有机氮的直接吸收和利用是目前微生物氮素营养研究的新方向。本研究通过气相色谱-质谱(GC-MS)对双标记氨基酸(13C,15N)的测定技术探讨土壤微生物对有机氮分子的直接吸收和利用。结果表明:加入土壤中的甘氨酸被微生物迅速利用,半衰期为2.9 h。培养4 h后在微生物体内检测到最大量的双标记甘氨酸(相当于甘氨酸加入量的10%),说明甘氨酸可以被微生物以完整分子形式所吸收。通过此手段也可检测到土壤溶液和微生物体内的单标记a-酮酸(双标记甘氨酸分解后的产物),但含量极少,说明加入的甘氨酸主要向微生物提供C源供其生命活动。本研究证明专性化合物同位素双标记手段结合氯仿熏蒸技术是检测微生物吸收小分子有机氮的有效手段。
专性化合物稳定性同位素分析技术; 双标记甘氨酸; a-酮酸
引 言
另一种方法是向土壤中加入13C和15N双标记氨基酸,培养后测定土壤微生物体内单标记15N和13C的量,如果二者的富集量有极显著的线性相关关系,那么认为氨基酸被微生物直接吸收[11]。但仅仅通过比值来做出判断依然是间接方法,近年兴起的专性同位素化合物分子的分析技术为此类研究提供了新的技术手段,本研究应用气相色谱-质谱(GC-MS)测定技术结合氯仿熏蒸方法测定土壤微生物吸收的双标记氨基酸的量,用微生物体内的双标记氨基酸来证实微生物直接吸收和利用小分子有机氮。本研究证实:通过GC-MS测定15N和13C双标记氨基酸结合氯仿熏蒸法能够验证微生物对小分子有机氮的直接吸收和利用。
1 实验部分
1.1 土壤采集
供试土壤采自位于中国科学院沈阳生态实验站(43°31′N, 123°22′E)的长期定位试验田,土壤类型为典型的潮棕壤。该定位试验研究自2007年开始,截止采样时间已持续6年,此地区为玉米连作的耕作制度。该站位于松辽平原南端,辽河平原中部偏东,典型的农业生产区,气候类型为暖温带半湿润大陆性气候,年均气温7~8 ℃,>10 ℃年活动积温为3 300~3 400 ℃,太阳总辐射量为5 409.9~5 598.9 kJ·cm-2。年降雨量为650~700 mm,干燥度为0.9,无霜期为147~164 d。
1.2 培养试验
称取相当于6 g风干土重的湿土,置于40 mL玻璃培养器皿中。将包含双标记氨基酸的溶液0.64 mL均匀加入到玻璃器皿中,调整至最大含水量的50%,加入的甘氨酸浓度为5mg N kg-1干土,相当于0.33 mmol·kg-1干土。将此培养器皿放置于12 L塑料容器中,盖上盖子,在塑料瓶内部放置湿纸巾防止水份蒸发,在室温条件下培养(22 ℃)。分别在培养的0, 0.5, 1, 2, 4, 12和24 h后,破坏性采取4个重复,将此四个重复分成两份,一份样品用30 mL 0.5 mol·L-1K2SO4溶液立即提取, 另一份样品用氯仿熏蒸24 h后震荡提取,氯仿熏蒸步骤参见文献[12]。用漩涡振荡器震荡1 h过滤得到上清液(Fisherbrand, Q5)。
1.3 样品衍生和测定
由于气相色谱只能分离气态化合物,氨基酸在测定之前需要进行衍生。衍生方法依据Smart(2010)的研究进行[15]。基本步骤为: 180 μL土壤提取液加入到试管中, 加入20 μL d-2,3,3,3-丙氨酸溶液(10 mg N L-1) 作为内标物,之后向试管中加入167 μL甲醇,32 μL嘧啶和20 μL氯甲碳甲酯,样品在漩涡振荡器上震荡30 s,再向反应体系中加入400 μL氯仿,震荡10 s后加入400 μL NaHCO3(50 mmol·L-1)溶液,再次震荡10 s后,试管中的反应液分成两层,去掉上层的水相后,将大约200 μL的反应液移至琥珀色玻璃小瓶中,用盖拧紧,上机测定。上述步骤均在通风橱中完成,有效防止试剂挥发。所有样品在衍生后12 h内测定,所使用的仪器为瓦里安3 800气相色谱和瓦里安离子俘获质谱仪,气相色谱配备安捷伦VF-1701毛细管柱。气相色谱执行程序按Smart等所述进行设定[13]。


1.5 数据分析
所有的数据结果按风干土计,土壤水分含量测定时用烘箱在105 ℃条件下烘干24 h后测定。采用ECXEL2010进行数据分析,SPSS16.0进行统计分析。
2 结果与讨论
2.1 甘氨酸的检测
未标记甘氨酸分子量为75,经过衍生后,形成分子量为147的物质[图1(a)]而双标记甘氨酸分子量为77,经过衍生后,形成分子量为149的物质[图1(b)]。
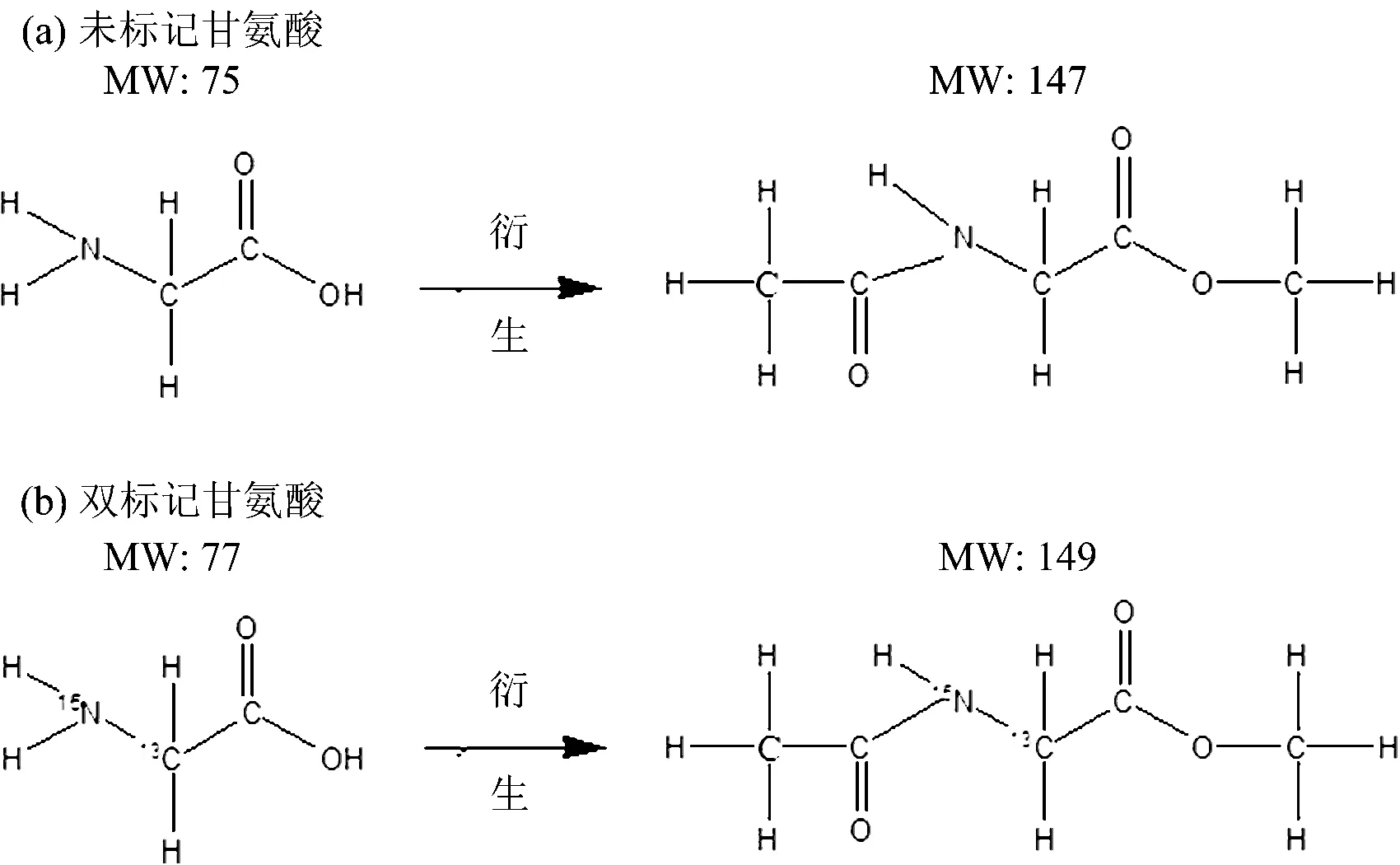
图1 甘氨酸分子结构式及衍生后形成的新物质的结构式
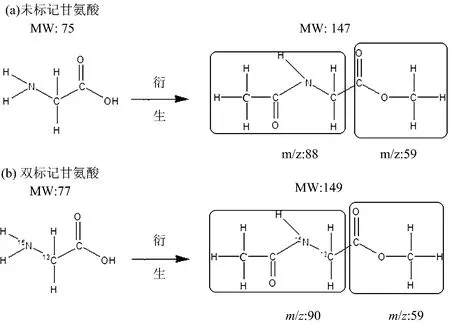
图2 质谱检测的甘氨酸衍生物的结构碎片

表1 使用GC-MS检测的化合物的相关参数
*未标记甘氨酸的m/z比标记的甘氨酸小2个单位,未标记乙醛酸盐的m/z比标记的小1个单位
*Them/zfor unlabeled glycine is two units lower, for unlabeled keto acid 1 unit lower
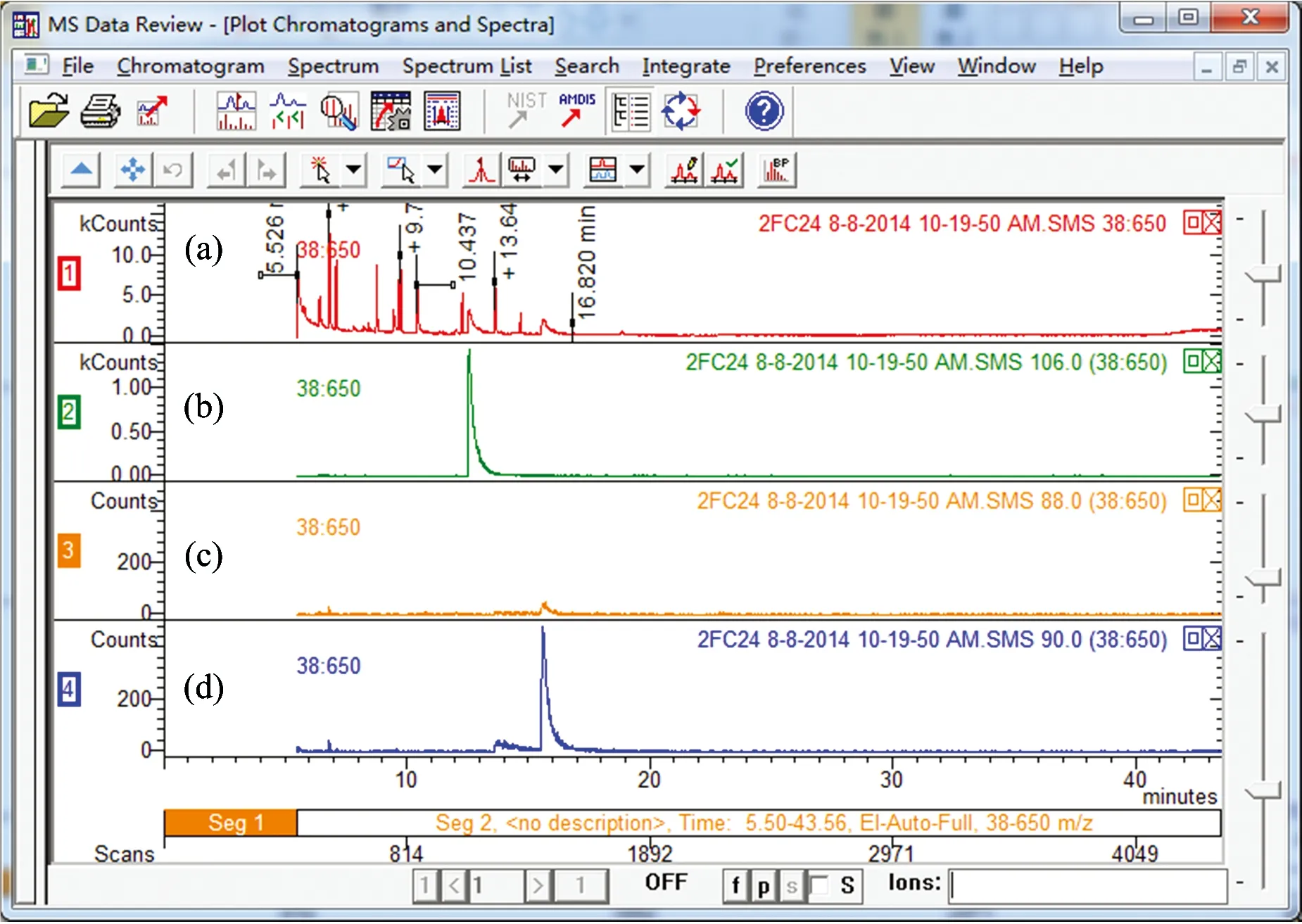
图3 使用GC-MS检测的样品峰图
(a): 样品整体出峰图(m/z10~660); (b): 内标物出峰图(m/z106); (c): 未标记甘氨酸峰图(m/z88); (d): 双标记甘氨酸峰图(m/z90)
Fig.3 Sample peaks detected by GC-MS
(a): All the detected peaks(m/z10~660); (b): Peak of standard substance(m/z106); (c): Peak of unlabeled glycine(m/z88); (d): Peak of double labeled glycine(m/z90)
图3是从仪器上截取的出峰图,从上至下分别为样品的整体出峰图[图3(a)] ,内标物质出峰图[图3(b)], 未标记氨基酸出峰图[图3(c)]以及双标记甘氨酸的出峰图[图3(d)]。由图3(c)和(d)所示:由于加入土壤中的甘氨酸为双标记态物质,在m/z值为88的位置没有检测到衍生物质,而在m/z为90处则有明显的出峰,说明微生物以完整分子形式吸收了甘氨酸。通过峰面积和标准曲线获得样品中所测定物质的量。
2.2 土壤和溶液中的甘氨酸
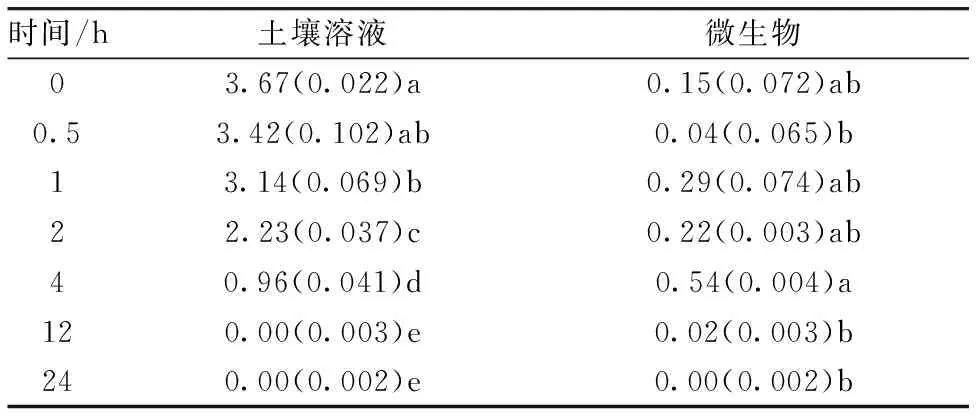
表2 土壤溶液和微生物体内的双标记甘氨酸浓度(mg N kg-1 烘干土)
注:表中所有数据均为重复的平均值(n=4),括号中数据表示标准偏差。在同一列中相同字母指具有显著差异(p<0.05)
Note: All data are means(n=4) with SE given in parathesis.Means followed by a different within each column are significantly different atp<0.05
表3 土壤溶液和土壤微生物体内来源于双标记甘氨酸的酮酸(μmol·kg-1soil)
Table 3 Keto acid originating from the double-labeled glycine extracted from soil solution and the microbial biomass(μmolkg-1soil)
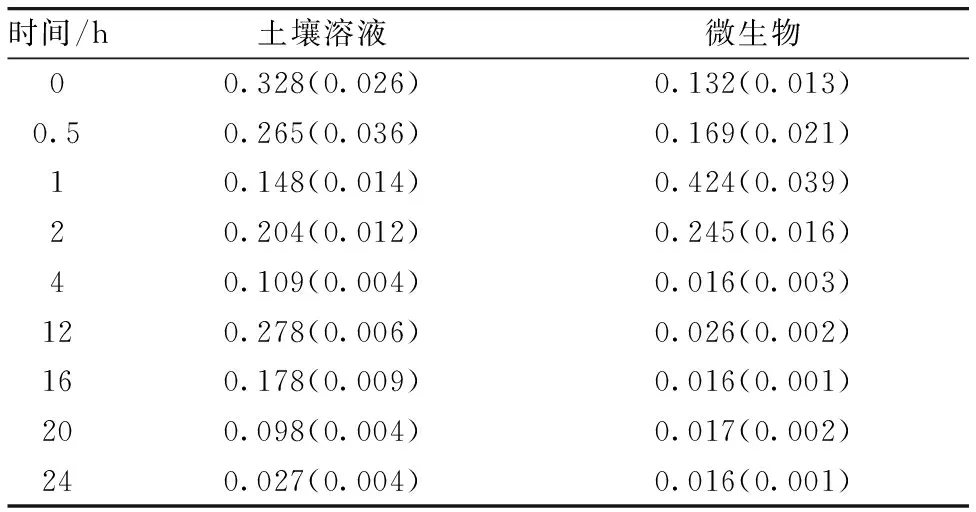
时间/h土壤溶液微生物00.328(0.026)0.132(0.013)0.50.265(0.036)0.169(0.021)10.148(0.014)0.424(0.039)20.204(0.012)0.245(0.016)40.109(0.004)0.016(0.003)120.278(0.006)0.026(0.002)160.178(0.009)0.016(0.001)200.098(0.004)0.017(0.002)240.027(0.004)0.016(0.001)
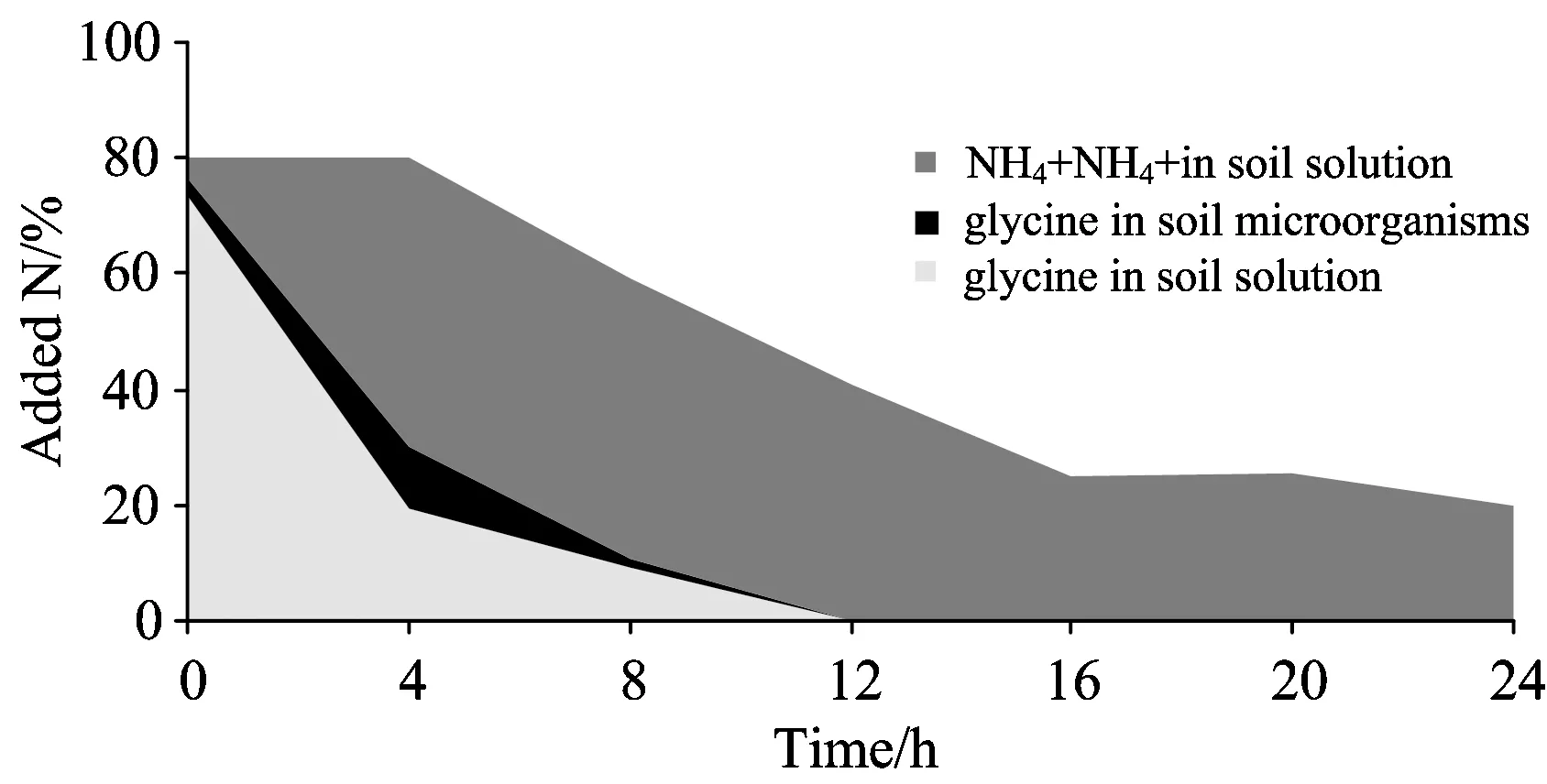
图4 氮(氨基酸和在土壤和溶液中的分布
3 结 论
证明同位素双标记技术结合氯仿熏蒸方法可以区分和测定土壤和微生物体内的自由氨基酸和酮酸。通过此方法明确了氨基酸分子确实可以被土壤微生物直接吸收和利用。本研究亦证实专性氨基酸同位素分析技术是研究土壤微生物对小分子有机氮利用的有效手段。
[1] Jansson S L.Annals of the Royal Agriculture College Sweden, 1958, 24: 101.
[2] Sanchez S, Demain A L.Microbial Biotechnology, 2008, 1(4): 283.
[3] Geisseler D, Horwath W R, Doane T A.Soil Biology and Biochemistry, 2009, 41(6): 1281.
[4] Luxhoi J, Bruun S, Stenberg B, et al.Soil Science Society of America Journal, 2006, 70(4): 1121.
[5] Geisseler D, Horwath W R, Joergensen R G, et al.Soil Biology and Biochemistry, 2014, 74: 100.
[6] Jones D L, Kemmitt S J, Wright D, et al.Soil Biology & Biochemistry, 2005, 37(7): 1267.
[7] Klose S, Tabatabai, M.A.Journal of Plant Nutrition and Soil Science, 2002, 165: 125.
[8] Braun M, Kim J M, Schmid R D.Applied Microbiology and Biotechnology, 1992, 37(5): 594.
[9] Geisseler D, Joergensen R G, Ludwig B.European Journal of Soil Biology, 2012, 53: 107.
[10] Andresen L C, Michelsen A, Jonasson S, et al.Applied Soil Ecology, 2011, 51: 94.
[11] Clemmensen K E, Sorensen P L, Michelsen A, et al.Oecologia, 2008, 155(4): 771.
[12] Brookes P C, Landman, A., Pruden, G, et al.Soil Biology and Biochemistry, 1985, 17: 837.
[13] Smart K F, Aggio R B M, Van Houtte J R, et al.Nature Protocols, 2010, 5(10): 1709.
[14] Brooks P D, Stark J M, Mcinteer B B, et al.Soil Science Society of America Journal, 1989, 53(6): 1707.
[15] Vinolas L C, Healey J R, Jones D L.Biology and Fertility of Soils, 2001, 33(1): 67.
[16] Jones D L, Kielland K, Sinclair F L, et al.Global Biogeochemical Cycles, 2009, 23.
[17] Boddy E, Hill P W, Farrar J, et al.Soil Biology and Biochemistry, 2007, 39(4): 827.
[18] Farrell M, Prendergast-Miller M, Jones D L, et al.Soil Biology and Biochemistry, 2014, 77: 261.
(Received Oct.23, 2014; accepted Feb.21, 2015)
*Corresponding author
The Study of Organic Nitrogen Uptake by Soil Microorganisms Using Gas Chromatography-Mass Spectrometry and Double Isotope Labeling Technique
YANG Li-jie1, 2,ZHANG Li-li1*,CHEN Wei1, 2,GONG Ping1,WU Zhi-jie1,XUE Yan1, 2,FANG Na-na1,WANG Ling-li1
1.Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, 2.University of Chinese Academy of Sciences, Beijing 100049, China
The direct absorption and utilization of low-molecular weight organic nitrogen (N) by soil microbial is a new subject in the research of microbial N nutrition.The study used gas chromatography-mass spectrometry to trace dual-labeled (13C,15N) glycine from the soil solution and microorganisms.The results showed that glycine added to the soil was quickly taken up by soil microorganisms, with the half-life of glycine being 2.9 h.Withthe incubation of 4 h, the maximum amount of dual-labeled glycine in the microbial biomass was measured (equivalent to 10% of glycine added), indicating that added glycine was absorbed as intact molecular by soil microorganisms.The single labeled-Keto acid was detected in soil solution and in the microorganisms (decomposed production by double labeled glycine), but the content is extremely low, suggesting that added glycine mainly served as carbon (C) source for soil microbial life activities.This study demonstrated that compound specific stable dual labeled isotope analysis combined with chloroform fumigation technique was an effective method for detecting the low-molecular organic N utilized by soil microorganisms.
Compound specific stable isotope analysis; Double labeled glycine; a-Keto acid
2014-10-23,
2015-02-21
国家自然科学基金项目(41571290),公益性行业(农业)科研专项经费项目(201303095-9)和国家科技支撑计划项目(2011BAD11B04,2012BAD14B02)资助
杨立杰,1988年生,中国科学院沈阳应用生态研究所博士研究生 e-mail: ylj402@163.com *通讯联系人 e-mail: llzhang@iae.ac.cn
O657.3
A
10.3964/j.issn.1000-0593(2016)05-1478-05
