小球藻生长过程脂肪含量动态变化快速无损检测方法研究
2016-07-12蒋璐璐赵艳茹邵咏妮裘正军
魏 萱,蒋璐璐,赵艳茹,邵咏妮,裘正军,何 勇*
1.福建农林大学机电工程学院,福建 福州 350002 2.浙江大学生物系统工程与食品科学学院,浙江 杭州 310058 3.浙江经济职业技术学院,浙江 杭州 310018
小球藻生长过程脂肪含量动态变化快速无损检测方法研究
魏 萱1, 2,蒋璐璐3,赵艳茹2,邵咏妮2,裘正军2,何 勇2*
1.福建农林大学机电工程学院,福建 福州 350002 2.浙江大学生物系统工程与食品科学学院,浙江 杭州 310058 3.浙江经济职业技术学院,浙江 杭州 310018
微藻-生物柴油转化生产要求产油微藻细胞内大量积累脂肪,而藻类脂肪的积累受外界环境影响较大,因此,微藻生长过程中对藻体脂肪变化进行快速检测和分析有着非常重要的意义。以小球藻(Chlorellasp.)为研究对象,利用可见/近红外光谱技术和高光谱成像技术对不同光源培养条件下微藻生长过程脂肪动态变化和脂肪含量分布可视化分析进行了研究。研究结果表明,虽然利用两种技术获取的小球藻透射光谱和反射光谱有差异,利用连续投影算法进行特征波长也不完全相同,但基于两种技术获得的对于脂肪含量的特征波段光谱建立的小球藻脂肪含量多元线性回归模型的预测结果接近,分别为rpre=0.940,RMSEP=0.003 56和rpre=0.932,RMSEP=0.004 23。研究中小球藻接种初期至生长指数期初期藻体内脂肪含量相对平稳,积累增加发生在生长对数期的末期,而在生长平稳期时的小球藻藻液中,脂肪含量较高的藻体呈现出聚集生长的状态。小球藻生长过程中生命信息快速无损检测方法的实现为微藻实际生产培养和收获策略的制定提供了理论依据和技术手段。
可见/近红外光谱; 高光谱成像; 小球藻; 脂肪; 生物能源
引 言
洁净能源-生物柴油由植物油或动物脂的脂肪酸烷基单酯组成,是可再生性能源中重要的一种[1]。其中,微藻具有光合作用效率高、生长周期短、生长迅速、占地面积小、单位面积生产力高、易于培养及生长过程中可高效固定二氧化碳同时减少环境污染等显著优势,是生物质能源理想的原材料,有些微藻含油量可达50%以上[2]。目前,国内外研究学者广泛开展了微藻作为生物质能原料的研究[3-7]。微藻高效培养是微藻生物能源开发利用的关键和前提[8],将微藻作为生物柴油生产的原料要求藻体内有较高脂肪含量积累,因此,如果能够快速获取微藻生长过程中脂肪含量的生长信息,将有助于养殖者对微藻的生长环境参数(如光照、温度、营养元素等)进行优化,制定适宜微藻生长的管理和控制策略。常规的检测方法虽然可以实现藻体细胞内脂肪含量的测定,但工作量较大以及会产生化学试剂污染,因此,需要快速简便的无损检测方法对微藻的生命信息进行获取分析,进而指导实际生产。
近红外光谱与有机分子中含氢基团(O—H,N—H,C—H)振动的合频和各级倍频的吸收区一致,利用该技术可以快速实现样品定性或定量分析测定,已经广泛被用于工业、农业、食品检测等领域[9-10]。高光谱具有光谱包含丰富的物质内部信号的优点,又拥有图像包含丰富的空间分布信息的优点[11-12],可为微藻的生命信息快速无损检测提供新的方法和手段。
本文利用可见/近红外光谱和高光谱-图像两种技术对在不同组合光源培养条件下对微藻生长过程中的脂肪含量变化和可视化分布进行分析研究。对比分析获取小球藻藻液的透射光谱和反射光谱对检测结果的影响,探讨这两种技术在微藻生长过程中脂肪快速无损检测的可行性,为微藻生命信息快速获取提供技术支持和理论基础。
1 实验部分
1.1 材料
小球藻(Chlorellasp.)藻种购买于中国科学院淡水藻种库(Freshwater Algae Culture Collection at the Institute of Hydrobiology,FACHB-collection)培养于BG11培养基。实验室室内温度保持在25 ℃,相对湿度在80%左右,置于四种不同组合光源培养条件下(100%红光、90%红光+10%蓝光,70%红光+30%蓝光,50%红光+50%蓝光),白光为对照组,光强均为2 500 Lux,光照周期为12L∶12D。每个培养瓶中放入磁力转子,利用磁力搅拌器早中晚各三次进行搅拌,以确保CO2在瓶中的溶解量。同时利用血球计数板在奥林巴斯CX31三目生物显微镜(Optical Analysis Corp., Nashua, NH)下进行计数。
1.2 BG11培养基
1 L BG11培养基中包含100 mL浓度为15.0 g·L-1的NaNO3,10 mL浓度为2 g/500 mL的K2HPO4,10 mL浓度为3.75 g/500 mL的MgSO4·7H2O,10 mL浓度为1.8 g/500 mL的CaCl2·2H2O,10 mL浓度为0.3 g/500 mL的柠檬酸,10 mL浓度为1.0 g/500 mL的EDTANa2,1 mL微量元素混合液A5。其中,每1 L的A5微量元素混合溶液包括2.86 g的H3BO3,1.86 g的MnCl2,0.22 g的ZnSO4·7H2O,0.39 g的Na2MoO4·2H2O,0.08 g的CuSO4·5H2O,0.05 g的Co(NO3)2·6H2O。培养基用去离子水配制,配制完后置于高温高压灭菌锅内在121 ℃条件下灭菌30 min,待冷却至室温后,在超净台内进行接种。
1.3 脂肪含量测定
小球藻分6个批次进行培养,根据生长曲线分别采集生长适应期、指数期和平稳期的小球藻样本。采集样本前,在显微镜下采用血球计数板计数检验,根据微藻数目进一步对应生长曲线中的天数。在采集小球藻可见/近红外透射光谱和高光谱反射光谱之后,对小球藻的脂肪含量进行测定。每种培养条件分别采样,每只培养瓶进行3次重复试验,然后取平均获得一个样本数据。脂肪提取时,取30 mL藻液,50 ℃烘干至恒重,称重后加入2 mL水、4 mL甲醇、2 mL氯仿,超声震荡辅助提取,静置4 h后离心取上层氯仿层移至干燥的培养皿中,25 ℃烘箱中烘至恒重称重,用式(1)进行计算
X=(m3-m2)/(m1-m0)
(1)
式中:X为微藻中脂肪含量(%)。
m0为50 mL离心管重量,m1为藻粉和50 mL离心管重量,m2为培养皿重量,m3为藻油和培养皿重量。
1.4 可见/近红外光谱与高光谱-图像获取与分析
可见/近红外光谱和高光谱成像系统获取藻液光谱方式分别如图1(a)和图1(b)所示。可见/近红外光谱采用美国ASD公司的Handheld Field Spec光谱仪,其光谱采样间隔1 nm,测定范围为325~1 075 nm,扫描次数30次。采集前,藻液充分混合均匀,以空培养皿作为空白,然后将摇匀后的藻液倒入培养皿中,每个培养瓶中采集3组光谱,然后求平均得到检测时刻的一条光谱曲线。
高光谱成像系统(ImSpector V10E, Spectral Imaging Ltd., Oulu, Finland)光谱相机的光谱分辨率为2.8 nm,所采集的光谱范围为380~1 030 nm。高光谱仪器采集装置的参数设置为:曝光时间2.0 ms,载物移动平台移动速度为3.5 mm·s-1。在获取藻液的反射光谱时,为了消除光源等仪器差异因素等对样本的影响,在采集高光谱图像前进行黑白板矫正,对获得的图像用以下的公式进行校正
R=(I0-Idark)/(Iwhite-Idark)
(2)
其中,I0是采集的样本原始光谱图,Idark是全黑图像(反射率约0%);Iwhite是白色聚四氟乙烯板全白图像(反射率约100%)。
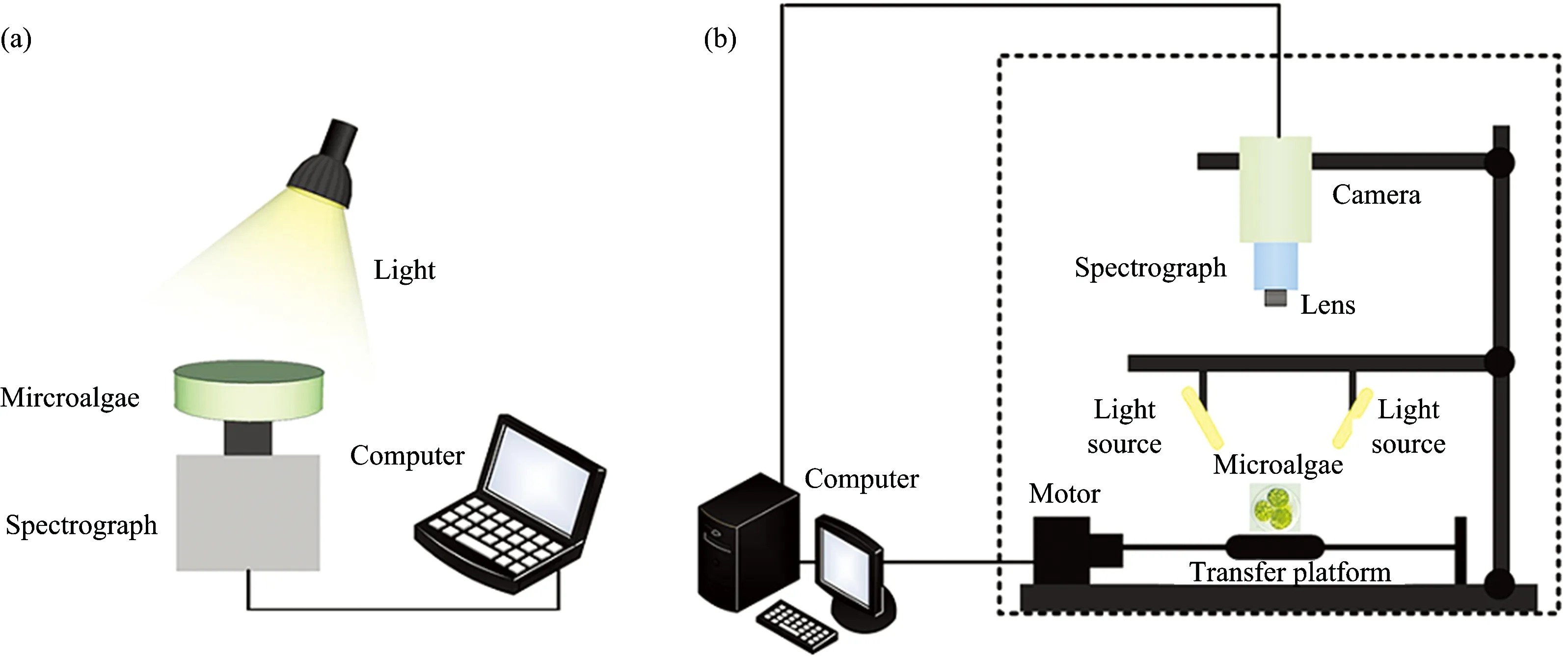
图1 (a)获取小球藻透射光谱的可见/近红外光谱系统图; (b) 获取小球藻反射光谱的高光谱成像系统图
1.5 分析方法和软件
采用化学计量学和图像处理进行数据建模分析。采用偏最小二乘回归(partial least squares regression,PLSR)和多元线性回归(multivariable linear regression, MLR)两种方法进行光谱建模分析,利用连续投影算法(successive projections algorithm,SPA)进行特征波段提取。运算过程通过Unscrambler version 9.6 (CAMO PROCESS AS,Norway),ENVI 4.6((ITT Visual Information Solutions, Boulder, CO))和Matlab 7.10 R2010b (The MathWorks, Natick, USA)等数据处理软件实现。
2 结果与讨论
2.1 小球藻生长曲线
小球藻接种后,分别在接种后隔天即第2,4,6,8,10,12,14和16 d用血球计数板在显微镜下计数。计数前,首先摇匀,静置片刻,然后取少量藻液进行计数。图2为绘制的小球藻一个生长周期的生长曲线图,各试验组小球藻的生长阶段相似,第2天到第6天生长都比较平缓,呈缓慢增长趋势,到第6天开始,不同组合光源培养条件下,小球藻均进入了生长指数期,速度略有差异,持续时间不完全相同,在16 d左右,小球藻生长均已完全进入生长平稳期。
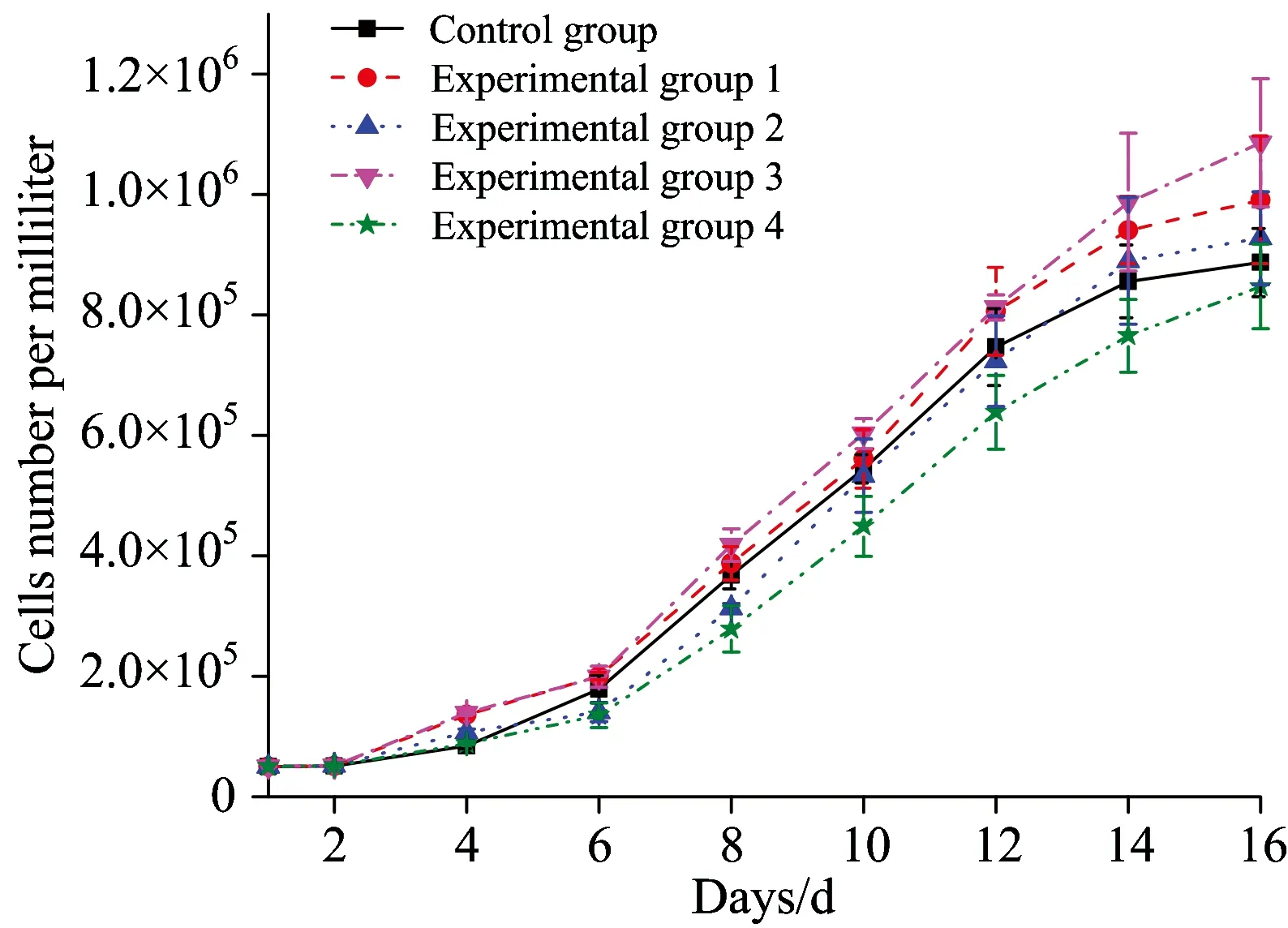
图2 小球藻生长曲线
2.2 脂肪含量分析
按照测得的脂肪含量多少排序,将2/3的样本作为校正集,剩余1/3为预测集,保证校正集脂肪含量范围包含所有的预测集,小球藻校正集与预测集脂肪的统计值见表1。

表1 小球藻脂肪含量统计分析
2.3 光谱分析
图3中实线光谱是小球藻可见/近红外吸收平均透射光谱转变后的吸收光谱。由于光谱数据在采集范围的首端与末端产生了部分噪音,因此选用400~1 049 nm的光谱范围进行分析。采用ImSpector V10E高光谱成像仪采集的微藻高光谱图像如图4(a)所示。利用ENVI 4.6软件中的ROI(Regions of Interest)功能获取培养皿中的微藻图像[图4(b)]。从图中提取每个波段下感兴趣区内所有像素点的平均光谱值,从而得到一条平均光谱值的光谱曲线,去掉噪音范围,选取400~1 020 nm波长范围内的光谱数据进行分析,转变成为吸光度值,如图3虚线所示。从平均光谱来看,两种信息获取方式转变成为藻液吸光度后波峰与波谷差值差异较大,但是主要的吸收峰位置基本一致,450和675 nm附近色素吸收波段以及975 nm附近水分的吸收波段均有显著的吸收峰[13]。

图3 可见/近红外光谱系统获取的小球藻平均吸收光谱和通过高光谱图像获取的小球藻平均吸收光谱
Fig.3 The average absorbance spectra obtained by Vis/NIR spectroscopy and the spectra of ROI in the near-infrared area ofChlorellasp.obtained by hyperspectral imaging system

图4 可见/近红外光谱范围内高光谱图像和小球藻样本的感兴趣区域示意图
Fig.4 The hyperspectral images ofChlorellasp.and ROI area in visible/near-infrared spectral region
2.4 微藻脂肪含量光谱检测模型
2.4.1 可见/近红外光谱模型
对比原始光谱和不同光谱预处理之后所建立的脂肪含量预测模型结果(未列出),Savitzky-Golay卷积平滑处理后模型效果最好,此时光谱中包含650个波长,rpre为0.962,RMSEP为0.002 45。对预处理之后光谱实施连续投影算法,进行与脂肪含量相关特征波段的优选,选出的波段分别是664,1 017和1 043 nm。利用这三个波段对脂肪建立多元线性回归预测模型,回归方程和基于特征波段的脂肪预测模型结果分别如式(3)和表2所示。
从表2中可以看出,利用特征波长建立的脂肪含量预测模型预测值与真实值相关性较好。由于接种前3 d小球藻生长生物量较少,在一个生长周期内从第4天开始,基于建立的预测模型对小球藻脂肪含量动态变化进行连续预测检测。从图5中可以看出,随着接种时间的增加,在最初的8 d以内脂肪的含量都相对稳定,第9天开始,脂肪开始出现小幅上升。此时,小球藻的细胞个数增长速度开始减少,培养液中各种营养元素大量消耗,有研究表明[14-17],微藻细胞内的中性脂肪包括三酰甘油(TAG)、二酰甘油(DAG)和胆固醇等,通常是细胞在压力条件下(如缺氮、高光等)积累的产物,用于储存能量以便在条件适宜时重新支持细胞的生长和分裂,因此在生长对数末期氮元素的减少有利于脂肪积累。
Y=0.729A665+1.718A1 017-1.987A1 043+0.385
(3)
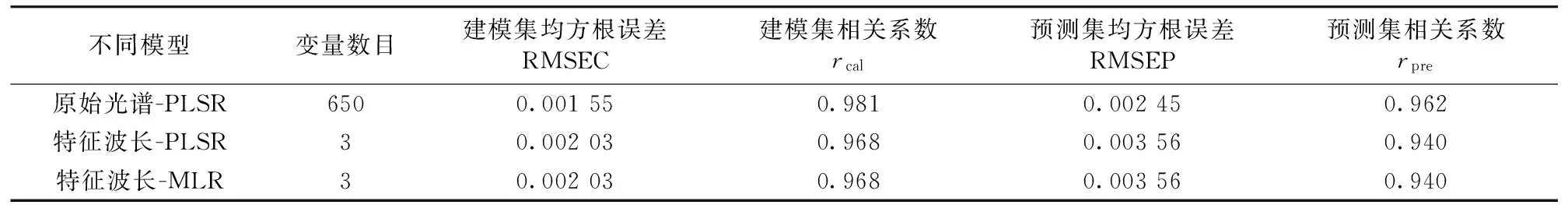
表2 基于可见/近红外光谱对小球藻脂肪含量建立不同预测模型结果
根据分析可以看出,随着营养元素的减少,光合作用受到抑制,生物量的增长减慢,但是脂肪的合成却开始增长。这为微藻养殖培养过程中优化整体脂肪产量提供了方法和理论基础,在以脂肪积累为目标的培养过程中,首先应以提高微藻细胞生长密度为目的,在培养环境中提供充分的营养元素,以促进微藻细胞生长,待细胞大量增殖以后将它们转移到缺乏营养的培养液中继续培养以促使细胞积累脂肪。
2.4.2 高光谱图像可视化分析
利用高光谱成像系统获取的反射光谱与通过可见/近红外光谱获得的小球藻透射光谱均转化为吸收光谱之后,通过上述分析可以看出有差异。在对ROI区域获取的光谱实施SPA方法之后,共有5个波长被优选出来,它们分别是412.9,483.8, 670.7, 816.8和993.7 nm。造成光谱上差异的原因能来自于仪器的分辨率和波段范围不完全相同,但建立的预测模型结果较接近。

图5 通过预测模型获得的不同光源培养条件下一个生长周期内小球藻脂肪含量

表3 基于高光谱对小球藻脂肪含量建立不同预测模型结果
结合多元线性回归模型,在Matlab软件中,利用特征波段下的图像,对高光谱图像的每个像素点进行脂肪含量的可视化分析,结果如图6所示。从图中可以看出,不同光源培养环境下,即使是在同一生长系统,藻体中脂肪含量分布也并不相同,这说明各藻体细胞内的脂肪含量有差异。这可能跟测定时藻体细胞还不完全处于同一生长时期有关。通过对脂肪可见/近红外光谱分析可以看出,小球藻藻液的总脂肪含量随着时间的缓慢增长而逐步积累,由此可以推测出处于不同生长时期的藻体单个细胞内脂肪的含量并不一致,且个体差异较大。从可视化图像看,脂肪含量更高的藻体呈现出聚集的趋势,有可能是因为该生长阶段的活体藻体还在不断积累脂肪,而活体藻体往往聚集在一起,因此,从脂肪含量的可视化分析来看,脂肪的分布在藻液中也不是呈现均匀分布。
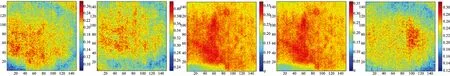
图6 不同光源培养条件下小球藻生长平稳期脂肪含量分布图
3 结 论
采用可见/近红外光谱技术和高光谱成像技术实现了对小球藻脂肪含量动态变化快速无损检测。研究结果表明,这两种技术获取的小球藻光谱信息有差异,通过数据挖掘和特征波段提取分析,所得到的特征波段也不完全相同,后者获得的特征波长波段多于前者,预测能力略低于前者,但预测效果均较好,预测集相关系数在0.930以上。本研究中利用可见/近红外光谱技术实现了小球藻藻体脂肪含量动态变化快速无损检测。研究结果表明小球藻在接近生长平稳期时脂肪出现大量积累。利用高光谱-图像对藻液中小球藻脂肪含量的分布分析后,发现生长后期脂肪大量积累时脂肪含量更高的藻体呈现出聚集生长的状态。本文的研究结果为微藻生长和油脂含量等生命信息快速无损检测提供了方法,为实际生产培养和收获策略制定提供了理论依据和技术支持。
[1] Schenk P, Thomas-Hall S, Stephens E, et al.Bioenerg Res.,2008, 1(1): 20.
[2] Yusuf C.Biotechnol Adv.,2007, 25(3): 294.
[3] Velasquez-Orta S B, Lee J G M, Harvey A P.Biochem.Eng.J.,2013, 76: 83.
[4] Bahadar A, Bilal Khan M.Renewable and Sustainable Energy Reviews,2013, 27(0): 128.
[5] Shu C H, Tsai C C, Liao W H, et al.J.Chem.Technol.Biotechnol., 2012, 87(5): 601.
[6] Tang H, Abunasser N, Garcia M E D, et al.Appl.Energ.,2011, 88(10): 3324.
[7] Chen C Y, Yeh K L, Aisyah R, et al.Bioresource Technol.,2011, 102(1): 71.
[8] Seo Y H, Cho C, Lee J Y, et al.Bioresource Technol.,2014, 173: 193.
[9] Jie Dengfei, Xie Lijuan, Rao Xiuqin, et al.Postharvest Biol.Tec., 2014, 90: 1.
[10] Wu Di, Nie Pengcheng, He Yong, et al.Int.J.Food Prop., 2013, 16(5): 1002.
[11] Elmasry G, Kamruzzaman M, Sun D-W, et al.Crit.Rev.Food Sci., 2012, 52(11): 999.
[12] Wei Xuan, Liu Fei, Qiu Zengjun, et al.Food Bioprocess Technol., 2013: 1.
[13] Jie Dengfei, Xie Lijuan, Fu Xiaping, et al.J.Food Eng., 2013, 118(4): 387.
[14] Klok A J, Martens D E, Wijffels R H, et al.Bioresource Technol., 2013, 134: 233.
[15] Packer A, Li Y, Andersen T, et al.Bioresource Technol.,2011, 102(1): 111.
[16] Solovchenko A E.Russ.J.Plant Physiol., 2012, 59(2): 167.
[17] Li Yuqin, Han Fangxin, Xu Hua, et al.Bioresource Technol., 2014, 174: 24.
(Received Dec.19, 2014; accepted Apr.12, 2015)
*Corresponding author
Study on the Nondestructive Detection Methods for Dynamica Change of Lipid Content inChlorellasp.
WEI Xuan1, 2,JIANG Lu-lu3,ZHAO Yan-ru2,SHAO Yong-ni2,QIU Zheng-jun2,HE Yong2*
1.College of Mechanical and Electronic Engineering,Fujian Agriculture and Forestry University,Fuzhou 350002, 2.College of Biosystems Engineering and Food Science, Zhejiang University, Hangzhou 310058, 3.Zhejiang Technology Institute of Economy, Hangzhou 310018, China
Microalgae based biodiesel production requires a large amount of lipid accumulation in the cells, and the accumulation is greatly influenced by the environment.Therefore, it is necessary to find fast and non-destructive methods for lipid change detection.In this paper,Chlorellasp.was adopted as the objective, which was cultured under different light condition consisted of red and blue lights with different proportion.We applied the visible near-infrared spectroscopy (Vis/NIRs) technique to detect the dynamic change of lipid during the microalgae growth processes and utilized hyperspectral imaging technology for visualization of lipid distribution in the suspension.The transmittance and reflectance spectra of microalgae were acquired with Vis/NIRs and hyper-spectroscopy, respectively.In the comparison of the transmittance and reflectance spectra, they showed some different characteristics.Meanwhile it also varied in terms of the number and the area of feature wavelengths obtained by successive projections algorithm (SPA) based on the different spectra.But the established multiple linear regression (MLR) model for lipid content prediction had similar results with rpre of 0.940, RMSEP of 0.003 56 andrpreof 0.932, RMSEP of 0.004 23, respectively.Based on the predictive model, we obtained the spectra and analyzed the lipid dynamic change in microalgae in one life cycle.In the life cycle, the lipid content inChlorellasp.was relatively stable from the beginning of inoculation to exponential phase, the increase and accumulation of lipid phenomenon occurred in the late exponential phase.Combined with the MLR model and the hypersepctral images, we studied the visualization result of microalgae suspension in the steady phase.The stimulated images showed that the microalgae with higher lipid content appeared gathering.This study compared the difference and the feasibility of the Vis/NIRs and hyperspectral imaging technique in lipid content detection applied in microalgae growing microalgae.The results are meaningful for the fast and non-destructive detection of the growth information of microalgae.It has boththeoretical and practical significance for developing microalgal culture and harvest strategy in practice.
Visible/near infrared spectroscopy (Vis/NIRs); Hyperspectral imaging;Chlorella; Lipid; Biofuel
2014-12-19,
2015-04-12
浙江省自然科学基金项目(LY14C130008),国家自然科学基金项目(31072247)和浙江省教育厅项目(Y201327409)资助
魏 萱,1987年生,福建农林大学机电工程学院讲师 e-mail: xuanweixuan@126.com *通讯联系人 e-mail: yhe@zju.edu.cn
TP391.41
A
10.3964/j.issn.1000-0593(2016)05-1352-06
