培育方式对双胞胎湖羊羔羊肝基因表达的影响
2016-07-11王海超张乃锋柴建民刁其玉
王海超,张乃锋,柴建民,王 波,刁其玉
(中国农业科学院饲料研究所 农业部饲料生物技术重点实验室,北京 100081)
培育方式对双胞胎湖羊羔羊肝基因表达的影响
王海超,张乃锋,柴建民,王波,刁其玉*
(中国农业科学院饲料研究所 农业部饲料生物技术重点实验室,北京 100081)
摘要:旨在研究培育方式对双胞胎湖羊羔羊肝基因表达的影响。选取24对双胞胎湖羊公羔羊,采用配对试验设计,将每对双胞胎羔羊均匀分成两组,一组为试验组,7日龄后实行人工哺育代乳粉(Artificially reared,AR);另一组为对照组,进行随母哺乳(Ewe reared,ER),每组24只羔羊。两组羔羊均在60日龄断奶,之后饲喂开食料至90日龄。羔羊在60和90日龄时,分别随机选取3对双胞胎羔羊进行屠宰。用基因芯片技术和生物信息学的方法分析肝组织的差异表达基因。通过基因芯片分析,本试验发现了许多差异表达基因。AR组和ER组间差异表达基因在60和90日龄都发生改变的基因有7个,它们是OR1E2、S1PR3、KMO、APOA4、ORM2、HTR4和FADS1;60和90日龄间的差异表达基因在AR组和ER组中表达也发生变化的基因有20个,它们是ACO1、HBA1、MFSD2A、CYSJ、LOC785954、FCN、GRB2、LOC100037663、ORM2、RXRG、LOC100602447、SQLE、HSD17B2、CYP4F2、INHBE、EAAT2,其中有4个未知基因,探针号为14780690、14815720、14845504、14854080;在不同日龄和不同处理中,表达均发生改变的基因是ORM2。GO功能显著性富集分析发现,这些差异表达基因主要参与氨基酸、小分子化合物和有机酸代谢的生物过程、酶活性反应生物过程和免疫反应过程。KEGG代谢途径分析发现,这些差异表达基因主要参与氨基酸代谢、脂类代谢、激素合成和信号转导途径。综上所述,不同的培育方式导致肝的基因表达发生了改变,发现了肝差异表达基因参与的生物学过程及其发挥的生物学功能,初步揭示了羔羊早期培育的分子机理。
关键词:双胞胎羔羊;早期断奶;代乳粉;差异表达基因;基因芯片
随着人类基因组计划(Human genome project,HGP)的完成,研究人员将重点聚焦在基因功能的研究上。而以高通量为主要特点的基因芯片技术的出现,使科学家能够高效快捷地实现这一宏伟目标。1991年,美国Affymetrix公司生产的第一块原位杂交合成的寡聚核苷酸基因芯片问世[1]。1994年,美国斯坦福大学E.M.Southern等用直接点样法成功制备出第一块cDNA微阵列芯片[2]。从此,基因芯片技术便迅速得到普及和推广。基因芯片的快速发展使人们能够深入剖析生命现象,从DNA水平研究生命机理。1998年,基因芯片技术被美国科学促进会(America association for the advancement of science,AAAS)评为1998年度世界自然科学领域十大科技突破之一[3]。2001年,美国国家牛功能基因组研究协会第一次应用芯片对牛刀豆球蛋白A (Concanavalin A)刺激的外周血单核细胞开展研究后[4],人们开始利用芯片技术对反刍动物的胚胎发育机理[5]、组织特异性表达基因[6]、免疫机理[7]、营养分子机理[8]进行探索。2005 年,Y.H.Wang 等[9]通过对日本和牛与荷斯坦牛背最长肌差异基因进行分析,获得影响肉质和脂肪代谢的候选基因。生物信息网络数据库能够将基因芯片所挖掘的数据信息转换为生命的语言,赋予其生物学意义。基因芯片技术和生物信息学方法成为研究系统生物学的主要工具和方法[10]。
湖羊是世界上著名的多胎绵羊品种之一,平均产羔率达220%,产双胞胎的几率很高。双胞胎具有相似的遗传背景,在这个具有纯化性的先天因素条件下,后天环境对双胞胎表达出的不同征候或者表型的影响能够清晰的体现出来,有利于对影响因子进行详细剖析[11]。双胞胎动物以其得天独厚的优越条件成为一种非常理想的试验模型。本试验选用双胞胎湖羊羔羊作为试验动物,通过比较屠宰试验方法,采用基因芯片的手段对肝样品的差异表达基因进行生物信息学分析,测定肝基因表达的变化情况,初步探讨营养素对羔羊早期生长发育和代谢调控等生命活动的影响,为羔羊早期培育的营养调控提供科学理论基础。
1材料与方法
1.1 试验时间和地点
本试验于2013年10月—2014年2月在江苏省姜堰市海伦羊业有限公司进行。
1.2试验设计
本试验采用配对试验设计,选取发育正常,出生日龄和体重相近,遗传基础相同的双胞胎湖羊羔羊24对。将每对双胞胎羔羊均匀的分成两组,一组为试验组,7日龄后实行人工哺育代乳粉(Artificial reared,AR);另一组为对照组,进行随母哺乳(Ewe reared,ER),每组24只羔羊。两组羔羊均于60日龄断奶,之后饲喂开食料至90日龄。羔羊在60和90日龄时,分别随机选取3对双胞胎羔羊进行屠宰试验。
1.3试验日粮
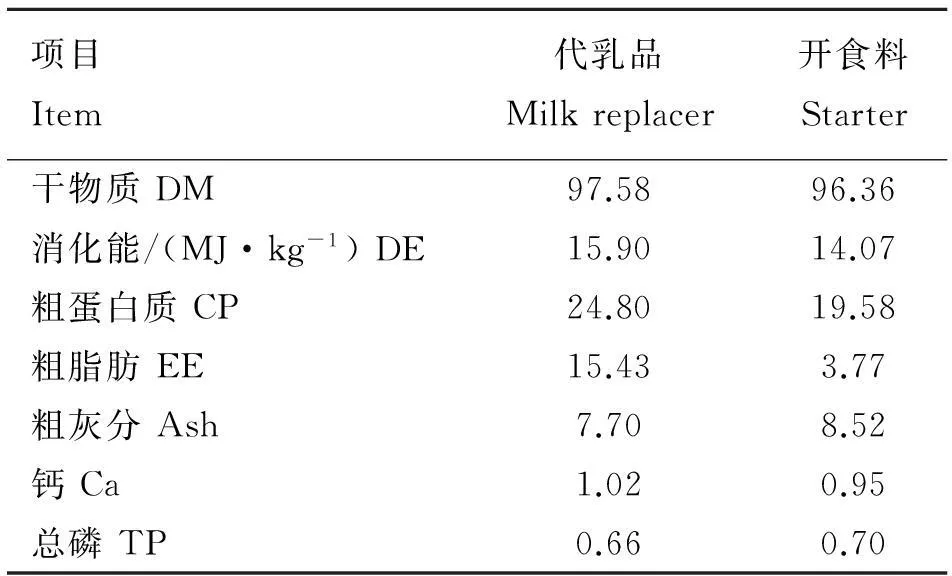
试验所需代乳粉由中国农业科学院饲料研究所提供,代乳粉的主要成分参照我国发明专利ZL 201210365927.6 “中0~3月龄羔羊的代乳品及其制备方法”[12]。试验中的代乳粉和开食料的营养水平见表1。
1.4饲养管理
羊舍为半开放式暖棚,通风良好。所有试验羔羊均打耳号,并按照羊场的正规程序进行免疫和消毒。试验组羔羊自出生至7日龄随母羊哺乳,8日龄时开始由母羊哺乳逐渐过渡到饲喂代乳粉,至10日龄时完全饲喂代乳粉。羔羊在11~50和51~60日龄期间,代乳粉的饲喂量分别以体重的2.0%和 1.5%为标准[13]。在试验过程中,根据羔羊的采食和健康状况调整代乳粉的饲喂量。30日龄前,每日饲喂3次(07:00、13:00和19:00),31~60日龄每日饲喂两次(08:00和18:00)。代乳粉饲喂前用煮沸后冷却至50 ℃的热水按代乳粉∶水=1∶5的比例冲泡,再冷却至(40±1) ℃饲喂。每次饲喂后及时用干净的毛巾将羔羊嘴边的乳液擦拭干净。对照组羔羊每日在上述时间和母羊接触一次哺乳,每次10 min。试验羔羊均于15日龄开始训练采食相同的开食料,自由采食和饮水。
表1代乳粉和开食料的营养水平(干物质基础)
Table 1Nutrient levels of milk replacer and starter(DM basis)
%
表中所列项目均为实测值。配方由于涉及专利内容,未公开
The items in the table were measured values.The formulas involved in patent could not be opened to the public
1.5样品采集
羔羊在60和90日龄时,分别随机选取3对双胞胎羔羊于清晨08:00进行屠宰。宰前16 h禁水禁食。试验羊经二氧化碳气体致晕后,颈脉放血屠宰。羔羊解剖后将肝分离,在处理组和对照组的羔羊肝相同的位置分别取肝组织样品,用生理盐水冲洗干净后放到预先标记好的1.5 mL冻存管中,并迅速置于液氮中速冻,运到实验室后存放到-80 ℃冰箱中备用。
1.6总RNA的提取
用化学有机试剂法提取绵羊肝组织的总RNA,然后分别用琼脂糖凝胶电泳和分光光度计检测所提RNA的质量。
1.7芯片操作
对于1%琼脂糖凝胶电泳初步质检合格的样品,进一步测定该样品的总RNA浓度,并将全部样品的总RNA液均稀释至浓度为2.0 μg·μL-1。以两两配对为设计原则,采用Affmetrix绵羊组织基因芯片对不同处理和不同日龄的羔羊肝组织中的表达基因进行检测,芯片试验操作由北京博奥生物有限公司按照Affmetrix表达分析技术手册完成。
1.8基因芯片的数据分析
采用Affymetrix GeneChip®Scanner 3000扫描仪对杂交芯片进行扫描,扫描的图像结果被保存成.DAT文件,然后将.DAT 文件转存为.JPG 图片文件。接着用Affymetrix AGCC软件将图像信号(.DAT文件)转化为数字信号(.CEL文件),.CEL文件记录每个探针(Probe) 的荧光信号强度。然后用RMA算法[14]对原始数据进行预处理。用cluster 3.0软件进行聚类分析,并用Treeview软件进行可视化。
1.9差异表达基因的筛选
按照S.Audic等[15]提出的方法筛选差异表达基因。按照Y.Benjamini等[16]提出的错误发现率(False discovery rate,FDR) 对P值进行多重假设检验校正,记为q值(qvalue)。本试验采用的差异表达基因筛选标准是q<0.05,并且差异倍数(Fold change)>2[17],差异表达倍数计算方法为同一个基因在两个样本中表达量比值的log2对数。
1.10差异表达基因的GO功能分析和通路分析
利用DAVID(the Database for Annotation,Visualization and Integrated Discovery)在线分析系统(http://david.abcc.ncifcrf.gov/)对差异表达基因进行基因注释(基因基本信息来源于NCBI Entrez Gene 数据库,http://www.ncbi.nlm.nih.gov/gene/)、GO功能聚类分析(Gene Ontology数据库,http://www.geneontology.gov/)和KEGG(Kyoto Encyclopedia of Genes and Genomes)通路分析(http://www.genome.jp/kegg/)。
2结果
2.1 RNA质检结果
经过1%琼脂糖凝胶电泳检测,从图1中可以看到,电泳条带总体比较清晰,部分RNA 样品略有降解,28S rRNA与18S rRNA 条带亮度的比值接近1∶1或更大。另外,分光光度计的结果显示,提取的总RNA的A260 nm/A280 nm比值为1.9~2.1,质量基本符合表达谱芯片的试验要求。
2.2芯片质检结果
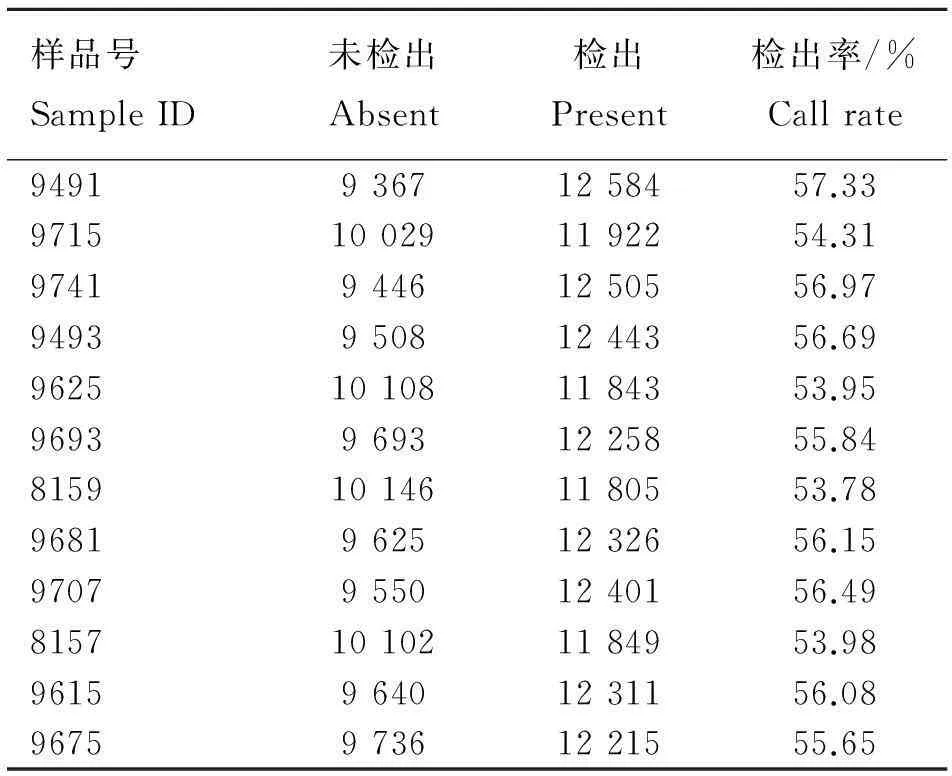
通过对芯片中检测到的表达基因进行统计,不同芯片中的基因检出率为50%~60%(表2),最低检出率为53.78%,最高检出率达到57.33%,符合芯片试验的结果。芯片表达谱的聚类分析显示(图2),60日龄时的两个不同处理聚在了一起,90日龄的两个不同处理聚在了一起,这符合试验分组和处理的要求。
2.3差异表达基因的筛选
60日龄时,代乳粉组和母乳组(60ARvs60ER)差异表达的基因有60个,其中33个基因表达上调,27个基因表达下调;90日龄时,代乳粉组和母乳组(90ARvs90ER)差异表达的基因有80个,其中58个基因表达上调,22个基因表达下调;代乳粉组中,60日龄和90日龄相比(60ARvs90AR),差异表达的基因有102个,其中64个基因表达上调,38个基因表达下调;母乳组中,60日龄和90日龄相比(60ERvs90ER),差异表达的基因有76个,其中49个基因表达上调,27个基因表达下调(图3)。
表2基因芯片检出率
Table 2The call rate of gene in microarray
样品号SampleID未检出Absent检出Present检出率/%Callrate949193671258457.339715100291192254.31974194461250556.97949395081244356.699625101081184353.95969396931225855.848159101461180553.78968196251232656.15970795501240156.498157101021184953.98961596401231156.08967597361221555.65
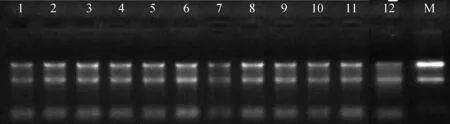
图1 湖羊肝总RNA电泳图Fig.1 The electrophoregram of total RNA in Hu sheep
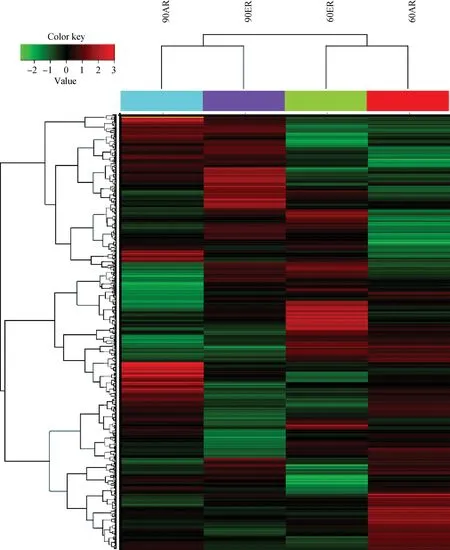
图2 芯片表达谱聚类热图Fig.2 The heat map of microarray clustering
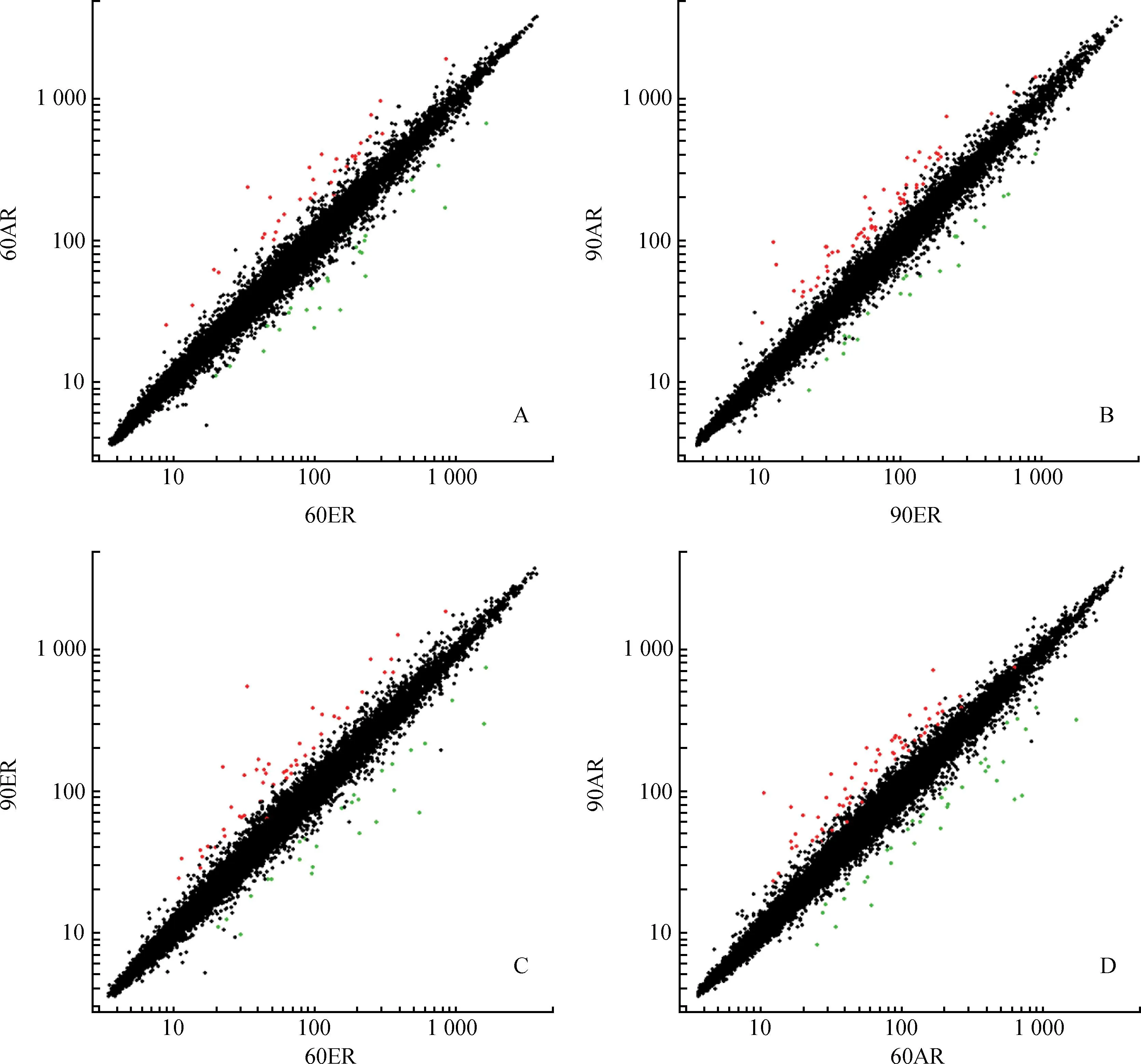
A是60日龄时,代乳粉组与母乳组的差异表达基因;B是90日龄时,代乳粉组与母乳组的差异表达基因;C是母乳组中,60日龄与90日龄的差异表达基因;D是代乳粉组中,60日龄与90日龄的差异表达基因。红点表示上调表达基因,绿点表示下调表达基因,黑点表示基因表达无差异A.DEGs of 60AR vs 60ER;B.DEGs of 90AR vs 90ER;C.DEGs of 60ER vs 90ER;D.DEGs of 60AR vs 90AR.Dots in red mean up regulated genes;Dots in green mean down regulated genes;Dots in black mean no differences图3 差异表达基因散点图Fig.3 Scatter plot of differentially expressed genes
由韦恩图(图4)可以看出,在60日龄时,AR组和ER组的差异表达基因中有7(=1+2+4)个基因在90日龄的不同处理之间也发生了改变,它们是OR1E2、S1PR3、KMO、APOA4、ORM2、HTR4和FADS1。组间差异基因APOA4在60日龄时表达上调,在90日龄时表达下调。而组间差异基因ORM2则相反,它在60日龄时表达下调,在90日龄时表达上调。组间差异基因S1PR3和HTR4的表达在不同日龄中的表达均上调,OR1E2、KMO和FADS1的表达在不同日龄中的表达均下调(表3);在AR组中,60日龄和90日龄的差异表达基因中有20(=15+2+2+1)个基因在ER组的不同日龄中也发生了改变,其中有4个基因尚不清楚其符号(Gene symbol)和功能,它们的探针号分别为14780690、14815720、14845504、14854080,其他的16个基因是ACO1、HBA1、MFSD2A、CYSJ、LOC785954、FCN、GRB2、LOC100037663、ORM2、RXRG、LOC100602447、SQLE、HSD17B2、CYP4F2、INHBE、EAAT2。不同日龄差异表达基因ORM2和LOC100602447在AR组中上调表达,在ER组中下调表达。而MFSD2A在AR组中下调表达,在ER组中上调表达。CYSJ、FCN、RXRG、SQLE、HSD17B2、CYP4F2、INHBE和EAAT2在不同处理组之间的表达均上调,ACO1、HBA1、LOC785954、LOC100037663和4个未知的基因在不同处理组之间的表达均下调(表4);在不同日龄和不同处理中,表达均发生改变的基因是ORM2。2.4差异表达基因的GO分析
通过GO(Gene ontology)功能显著性分析,结果发现,60日龄时,AR组和ER组的差异表达基因参与的生物学过程主要是氨基酸分解代谢过程、小分子分解代谢过程、有机酸代谢过程和胺代谢过程等(表5);90日龄时,AR组和ER组的差异表达基因参与的生物学过程包括炎症反应过程、脂蛋白代谢过程和免疫反应过程等(表6);AR组中,60和90日龄差异表达的基因参与的生物过程包括胰核糖核酸酶活性反应过程、单氧化酶活性反应过程、离子结合过程和蛋白酶活性反应过程等(表7);ER组中,60和90日龄差异表达的基因参与的生物过程包括底物跨膜过程、离子交换过程、电子传递过程和有机酸跨膜转运过程等(表8)。
2.5差异表达基因的Pathway分析
对差异表达基因进行KEGG pathway 代谢途径显著性富集分析。结果发现,在60日龄时,AR组和ER组的差异表达基因参与的生物学途径主要是甘氨酸、丝氨酸和苏氨酸代谢途径、色氨酸代谢途径、鞘糖脂生物合成途径、半胱氨酸和甲硫氨酸代谢途径以及糖类的消化和吸收(表9);90日龄时,AR组和ER组的差异表达基因参与的生物学途径主要是固醇类激素生物合成途径、氨基糖和核苷酸糖代谢途径、谷胱甘肽代谢途径、细胞色素P450介导的药物代谢途径、P53信号途径、神经活性腺体受体互作途径(表10);AR组中,60和90日龄差异表达的基因参与的生物途径主要是花生四烯酸代谢途径、氨基糖和核苷酸糖代谢途径、固醇类激素生物合成途径和胆汁分泌途径(表11);ER组中,60和90日龄差异表达基因参与的生物途径主要是PPAR信号途径、固醇生物合成途径、胆汁分泌途径、萜类化合物骨架生物合成途径、卟啉代谢途径、固醇类激素生物合成途径、视黄醇代谢途径和细胞色素P450介导的外源性物质代谢途径(表12)。

图4 差异表达基因韦恩图Fig.4 Venny view of differentially expressed genes
表3不同处理组的差异表达基因在不同日龄时表达也发生改变的基因
Table 3Differentially expressed genes in both 60ARvs60ER and 90ARvs90ER
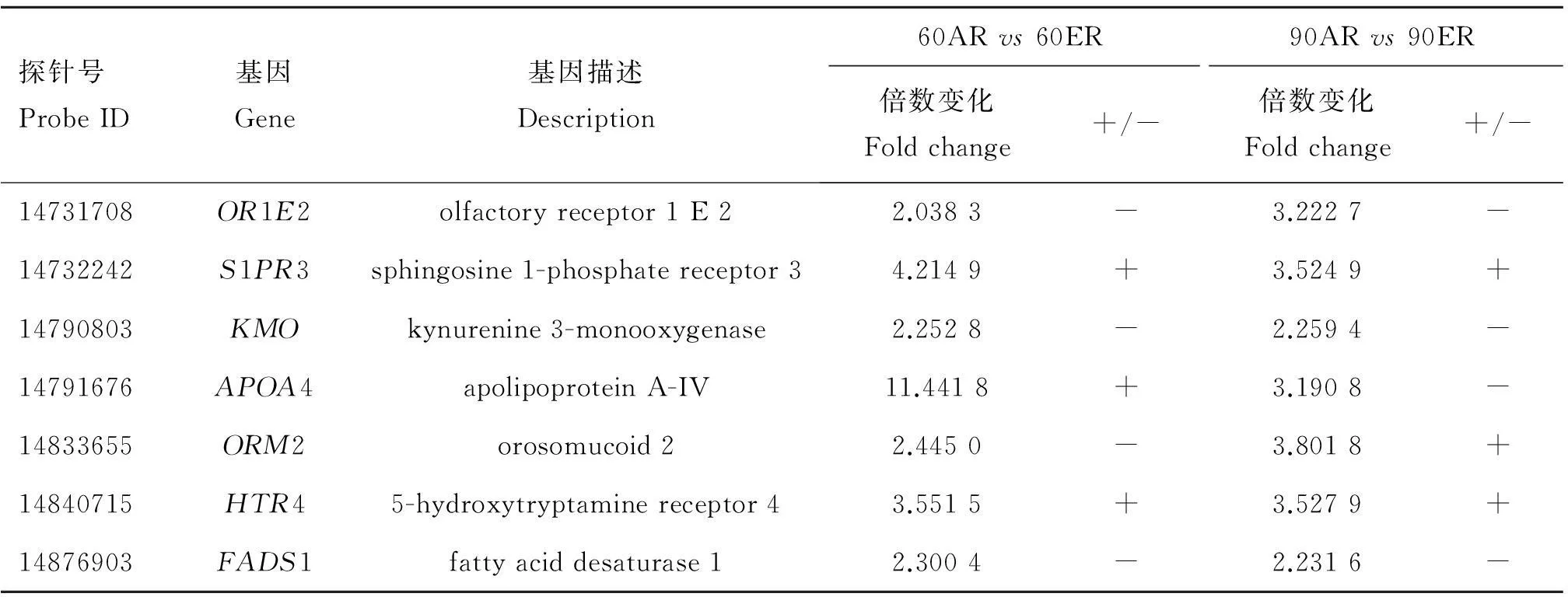
探针号ProbeID基因Gene基因描述Description60ARvs60ER90ARvs90ER倍数变化Foldchange+/-倍数变化Foldchange+/-14731708OR1E2olfactoryreceptor1E22.0383-3.2227-14732242S1PR3sphingosine1-phosphatereceptor34.2149+3.5249+14790803KMOkynurenine3-monooxygenase2.2528-2.2594-14791676APOA4apolipoproteinA-IV11.4418+3.1908-14833655ORM2orosomucoid22.4450-3.8018+14840715HTR45-hydroxytryptaminereceptor43.5515+3.5279+14876903FADS1fattyaciddesaturase12.3004-2.2316-
“+” 表示表达上调;“-” 表示表达下调。下同
“+” means up regulated;“-” means down regulated.The same as below
表4不同日龄的差异表达基因在不同处理组之间表达也发生改变的基因
Table 4Differentially expressed genes in both 60ARvs90AR and 60ERvs90ER
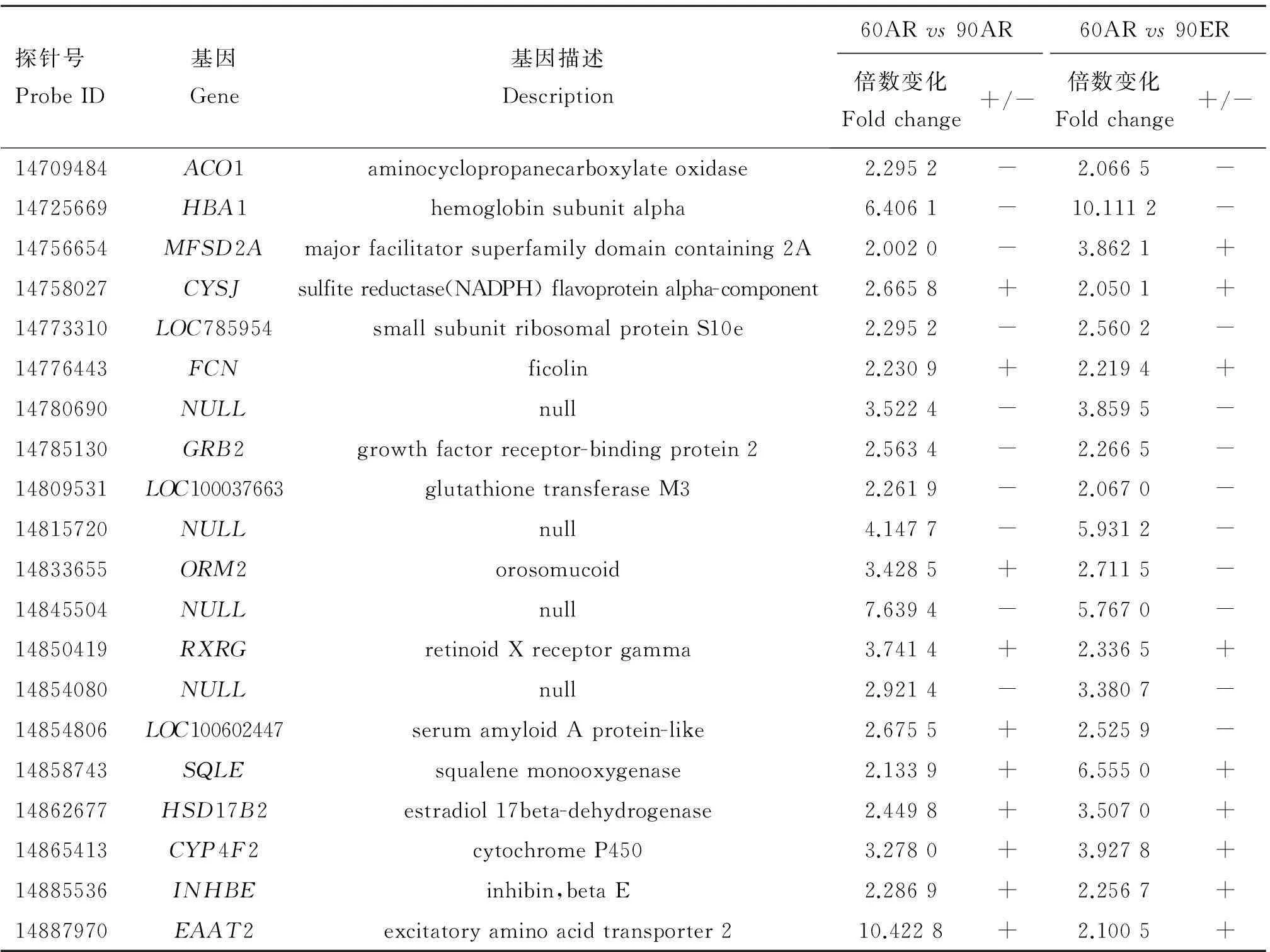
探针号ProbeID基因Gene基因描述Description60ARvs90AR60ARvs90ER倍数变化Foldchange+/-倍数变化Foldchange+/-14709484ACO1aminocyclopropanecarboxylateoxidase2.2952-2.0665-14725669HBA1hemoglobinsubunitalpha6.4061-10.1112-14756654MFSD2Amajorfacilitatorsuperfamilydomaincontaining2A2.0020-3.8621+14758027CYSJsulfitereductase(NADPH)flavoproteinalpha-component2.6658+2.0501+14773310LOC785954smallsubunitribosomalproteinS10e2.2952-2.5602-14776443FCNficolin2.2309+2.2194+14780690NULLnull3.5224-3.8595-14785130GRB2growthfactorreceptor-bindingprotein22.5634-2.2665-14809531LOC100037663glutathionetransferaseM32.2619-2.0670-14815720NULLnull4.1477-5.9312-14833655ORM2orosomucoid3.4285+2.7115-14845504NULLnull7.6394-5.7670-14850419RXRGretinoidXreceptorgamma3.7414+2.3365+14854080NULLnull2.9214-3.3807-14854806LOC100602447serumamyloidAprotein-like2.6755+2.5259-14858743SQLEsqualenemonooxygenase2.1339+6.5550+14862677HSD17B2estradiol17beta-dehydrogenase2.4498+3.5070+14865413CYP4F2cytochromeP4503.2780+3.9278+14885536INHBEinhibin,betaE2.2869+2.2567+14887970EAAT2excitatoryaminoacidtransporter210.4228+2.1005+
null表示暂无基因信息
null mean no gene information found
表560日龄AR组和ER组差异表达基因最显著富集的10个GO条目
Table 5Top 10 significantly enriched GO terms at 60ARvs60ER

GO号和条目GOIDandterms基因符号GenesymbolP值PvalueGO:0043436//oxoacidmetabolicprocessACMSD;AFMID;KMO;LOC100297420;SDS;GNMT;IDNK;ELOVL7;LPIN1;FADS1;GLCE;DDAH13.85E-06GO:0006082//organicacidmetabolicprocessACMSD;AFMID;KMO;LOC100297420;SDS;GNMT;IDNK;ELOVL7;LPIN1;FADS1;GLCE;DDAH14.70E-06GO:0019752//carboxylicacidmetabolicprocessACMSD;AFMID;KMO;LOC100297420;SDS;GNMT;IDNK;ELOVL7;LPIN1;FADS1;DDAH19.11E-06GO:0016054//organicacidcatabolicprocessAFMID;KMO;SDS;IDNK;LPIN1;DDAH12.29E-05GO:0046395//carboxylicacidcatabolicprocessAFMID;KMO;SDS;IDNK;LPIN1;DDAH12.29E-05GO:1901605//alpha-aminoacidmetabolicprocessAFMID;KMO;LOC100297420;SDS;GNMT;DDAH14.19E-05GO:0044282//smallmoleculecatabolicprocessAFMID;KMO;SDS;IDNK;LPIN1;DDAH11.24E-04GO:0044712//single-organismcatabolicprocessAFMID;KMO;SDS;IDNK;LPIN1;DDAH11.24E-04GO:0046874//quinolinatemetabolicprocessACMSD;KMO1.85E-04GO:1901606//alpha-aminoacidcatabolicprocessAFMID;KMO;SDS;DDAH11.91E-04
表690日龄AR组和ER组差异表达基因最显著富集的10个GO条目
Table 6Top 10 significantly enriched GO terms at 90ARvs90ER

GO号和条目GOIDandterms基因符号GenesymbolP值PvalueGO:0006953//acute-phaseresponseORM2;ENSBTAP00000030311-D2;ENSBTAP00000052221-D4;SAA14.45E-06GO:0006954//inflammatoryresponseENSBTAP00000030311-D2;ENSBTAP00000052221-D4;S1PR3;CHI3L1;ORM2;SAA1;CXCL102.71E-05GO:0002526//acuteinflammatoryresponseORM2;ENSBTAP00000030311-D2;ENSBTAP00000052221-D4;SAA13.99E-05GO:0034364//high-densitylipoproteinparticleAPOA4;ENSBTAP00000030311-D2;ENSBTAP00000052221-D4;SAA11.5E-06GO:0034358//plasmalipoproteinparticleAPOA4;ENSBTAP00000030311-D2;ENSBTAP00000052221-D4;SAA18.22E-06GO:0005615//extracellularspaceENPP2;PAI-1;CHI3L1;APOA4;ORM2;ENSBTAP00000030311-D2;ENSBTAP00000052221-D4;SAA1;LCN2;CRELD2;CXCL108.83E-06GO:0032994//protein-lipidcomplexENSBTAP00000030311-D2;ENSBTAP00000052221-D4;APOA4;SAA19.4E-06GO:0005576//extracellularregionENPP2;PAI-1;AGR2;IL1R1;CHI3L1;APOA4;ENSBTAP00000030311-D2;ENSBTAP00000052221-D4;ORM2;RNASE12;BRB;SAA1;MANF;LCN2;CES4A;CRELD2;CXCL102.12E-05GO:0044421//extracellularregionpartENPP2;PAI-1;CHI3L1;APOA4;ORM2;ENSBTAP00000030311-D2;ENSBTAP00000052221-D4;SAA1;LCN2;CRELD2;CXCL101.41E-04GO:0006955//immuneresponseENPP2;BCL6;IL1R1;ENSBTAP00000031029-D2;APOA4;IL18BP;SAA1;LCN2;CXCL102.4E-04
表7AR组60和90日龄差异表达基因最显著富集的10个GO条目
Table 7Top 10 significantly enriched GO terms at 90ARvs60AR
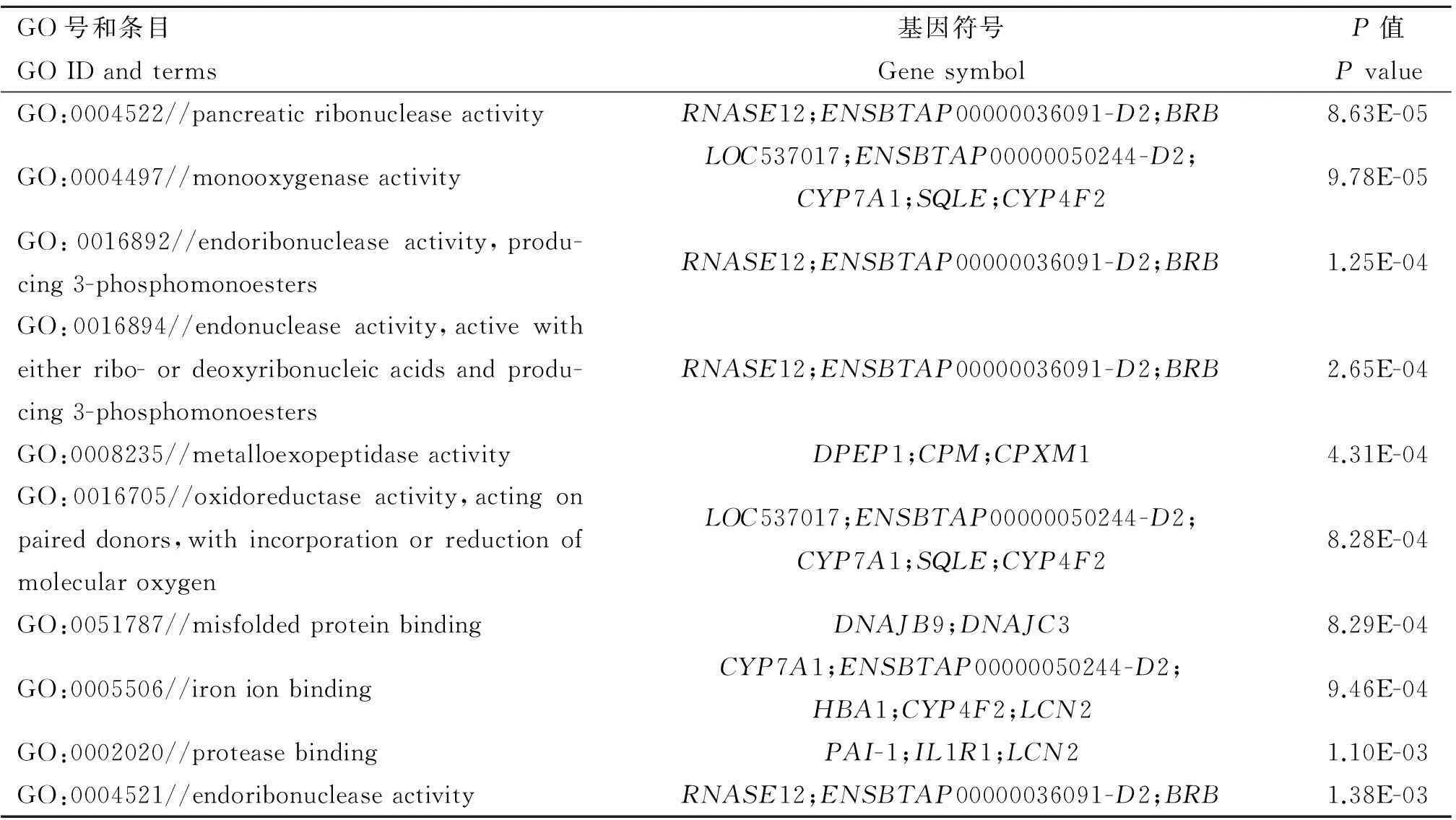
GO号和条目GOIDandterms基因符号GenesymbolP值PvalueGO:0004522//pancreaticribonucleaseactivityRNASE12;ENSBTAP00000036091-D2;BRB8.63E-05GO:0004497//monooxygenaseactivityLOC537017;ENSBTAP00000050244-D2;CYP7A1;SQLE;CYP4F29.78E-05GO:0016892//endoribonucleaseactivity,produ-cing3-phosphomonoestersRNASE12;ENSBTAP00000036091-D2;BRB1.25E-04GO:0016894//endonucleaseactivity,activewitheitherribo-ordeoxyribonucleicacidsandprodu-cing3-phosphomonoestersRNASE12;ENSBTAP00000036091-D2;BRB2.65E-04GO:0008235//metalloexopeptidaseactivityDPEP1;CPM;CPXM14.31E-04GO:0016705//oxidoreductaseactivity,actingonpaireddonors,withincorporationorreductionofmolecularoxygenLOC537017;ENSBTAP00000050244-D2;CYP7A1;SQLE;CYP4F28.28E-04GO:0051787//misfoldedproteinbindingDNAJB9;DNAJC38.29E-04GO:0005506//ironionbindingCYP7A1;ENSBTAP00000050244-D2;HBA1;CYP4F2;LCN29.46E-04GO:0002020//proteasebindingPAI-1;IL1R1;LCN21.10E-03GO:0004521//endoribonucleaseactivityRNASE12;ENSBTAP00000036091-D2;BRB1.38E-03
表8ER组60和90日龄差异表达基因最显著富集的10个GO条目
Table 8Top 10 significantly enriched GO terms at 90ERvs60ER
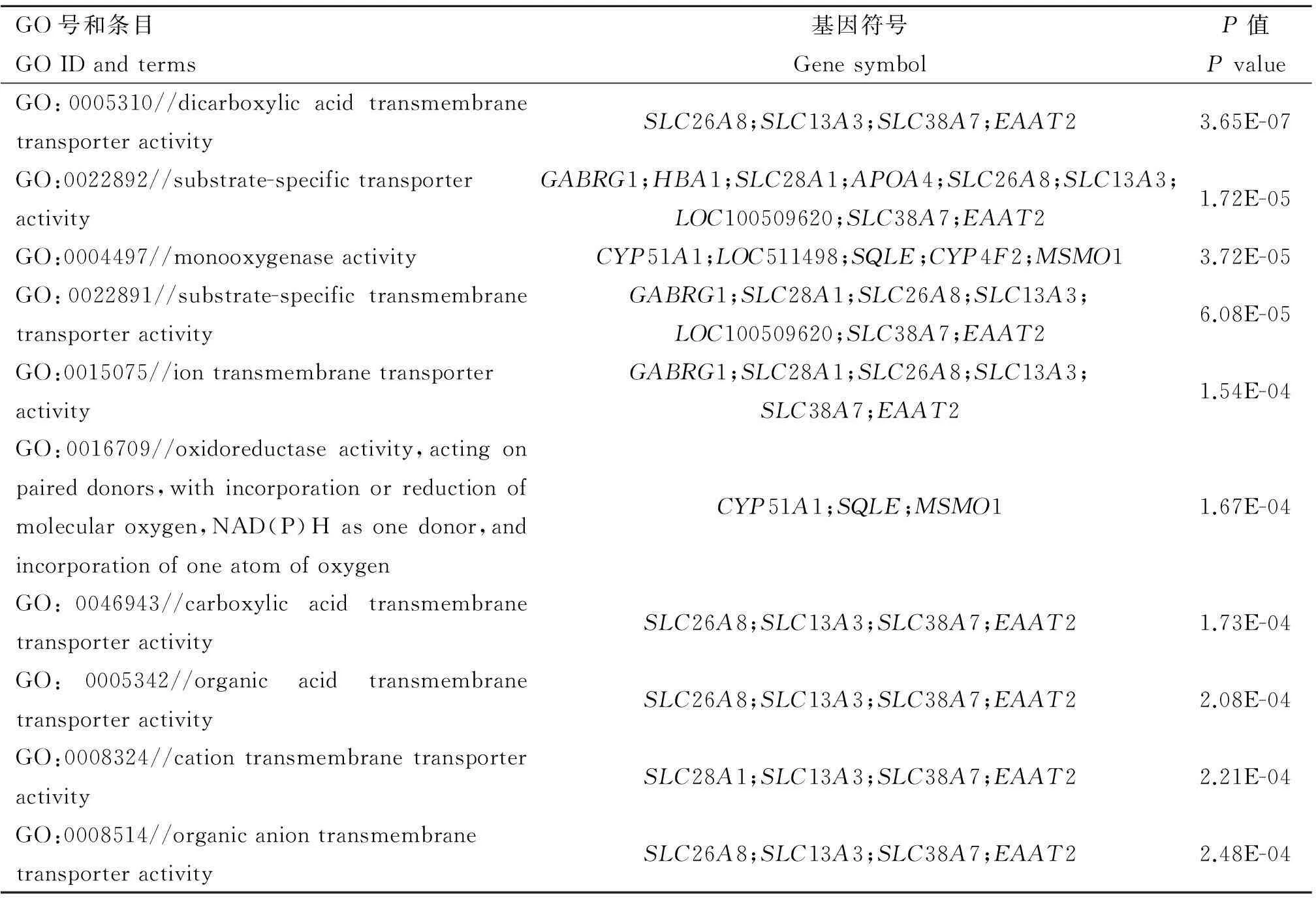
GO号和条目GOIDandterms基因符号GenesymbolP值PvalueGO:0005310//dicarboxylicacidtransmembranetransporteractivitySLC26A8;SLC13A3;SLC38A7;EAAT23.65E-07GO:0022892//substrate-specifictransporteractivityGABRG1;HBA1;SLC28A1;APOA4;SLC26A8;SLC13A3;LOC100509620;SLC38A7;EAAT21.72E-05GO:0004497//monooxygenaseactivityCYP51A1;LOC511498;SQLE;CYP4F2;MSMO13.72E-05GO:0022891//substrate-specifictransmembranetransporteractivityGABRG1;SLC28A1;SLC26A8;SLC13A3;LOC100509620;SLC38A7;EAAT26.08E-05GO:0015075//iontransmembranetransporteractivityGABRG1;SLC28A1;SLC26A8;SLC13A3;SLC38A7;EAAT21.54E-04GO:0016709//oxidoreductaseactivity,actingonpaireddonors,withincorporationorreductionofmolecularoxygen,NAD(P)Hasonedonor,andincorporationofoneatomofoxygenCYP51A1;SQLE;MSMO11.67E-04GO:0046943//carboxylicacidtransmembranetransporteractivitySLC26A8;SLC13A3;SLC38A7;EAAT21.73E-04GO:0005342//organicacidtransmembranetransporteractivitySLC26A8;SLC13A3;SLC38A7;EAAT22.08E-04GO:0008324//cationtransmembranetransporteractivitySLC28A1;SLC13A3;SLC38A7;EAAT22.21E-04GO:0008514//organicaniontransmembranetransporteractivitySLC26A8;SLC13A3;SLC38A7;EAAT22.48E-04
表960日龄AR组和ER组差异表达基因显著富集的途径
Table 9The significantly enriched pathways of DEGs at 60ARvs60ER

KEGG号和通路KEGGIDandpathway基因符号GenesymbolP值Pvalueko00260Glycine,serineandthreoninemetabolismLOC100297420;SDS;GNMT0.0014ko00380TryptophanmetabolismACMSD;AFMID;KMO0.0023ko00601Glycosphingolipidbiosynthesis-lactoandneolactoseriesB3GALT5;ST3GAL40.0092ko00270CysteineandmethioninemetabolismLOC100297420;SDS0.0214ko04973CarbohydratedigestionandabsorptionTFF2;SLC2A50.0214
表1090日龄AR组和ER组差异表达基因显著富集的途径
Table 10The significantly enriched pathways of DEGs at 90ARvs90ER

KEGG号和通路KEGGIDandpathway基因符号GenesymbolP值Pvalueko00140SteroidhormonebiosynthesisHSD17B14;ENSBTAP00000030543-D14;LOC7857620.0019ko00520Aminosugarandnucleotidesugarme-tabolismLOC537017;CHI3L1;AMIGO30.0078ko05146AmoebiasisSERPINI2;IL1R1;MCTP20.0159ko00480GlutathionemetabolismENSP00000420168-D2;AGR20.0295ko00982Drugmetabolism-cytochromeP450ENSP00000420168-D2;FMO50.0435ko04115p53signalingpathwayPAI-1;STEAP40.0446ko04080Neuroactiveligand-receptorinteractionGABRG1;S1PR3;GRIA1;ENSBTAP000000530180.0452
表11AR组60和90日龄差异表达基因显著富集的途径
Table 11The significantly enriched pathways of DEGs at 90ARvs60AR

KEGG号和通路KEGGIDandpathway基因符号GenesymbolP值Pvalueko00590ArachidonicacidmetabolismENSBTAP00000040874-D5;CYP4F2;LCN20.0076ko00520Aminosugarandnucleotidesugarme-tabolismLOC537017;CHI3L1;AMIGO30.0130ko00140SteroidhormonebiosynthesisCYP7A1;HSD17B20.0359ko04976BilesecretionCYP7A1;NR0B20.0412
表12ER组60和90日龄差异表达基因显著富集的途径
Table 12The significantly enriched pathways of DEGs at 90ERvs60ER
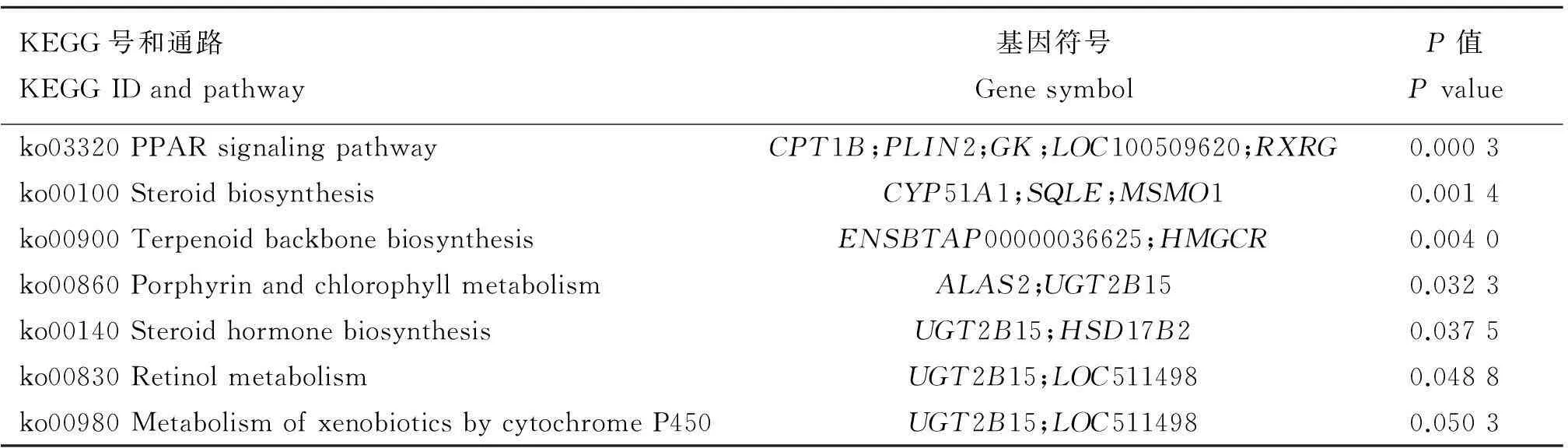
KEGG号和通路KEGGIDandpathway基因符号GenesymbolP值Pvalueko03320PPARsignalingpathwayCPT1B;PLIN2;GK;LOC100509620;RXRG0.0003ko00100SteroidbiosynthesisCYP51A1;SQLE;MSMO10.0014ko00900TerpenoidbackbonebiosynthesisENSBTAP00000036625;HMGCR0.0040ko00860PorphyrinandchlorophyllmetabolismALAS2;UGT2B150.0323ko00140SteroidhormonebiosynthesisUGT2B15;HSD17B20.0375ko00830RetinolmetabolismUGT2B15;LOC5114980.0488ko00980MetabolismofxenobioticsbycytochromeP450UGT2B15;LOC5114980.0503
3讨论
基因芯片技术是研究差异表达基因的有效手段,在本试验中发现了许多差异表达基因。60日龄时,代乳粉组和母乳组(60ARvs60ER)差异表达的基因有60个;90日龄时,代乳粉组和母乳组(90ARvs90ER)差异表达的基因有80个;代乳粉组中,60和90日龄相比(60ARvs90AR)差异表达的基因有102个;母乳组中,60和90日龄相比(60ERvs90ER)差异表达的基因有76个。
酸性糖蛋白(ORM2)主要在肝中合成,是炎症反应急性期的一个关键蛋白,存在于人、大鼠、小鼠以及其他的哺乳动物中。当机体组织受到伤害、发生炎症或受到感染,酸性糖蛋白的浓度会相应的升高[18]。本研究中,ORM2基因在不同的处理组之间以及不同的日龄中,其表达均发生了改变。60日龄时,ORM2在AR组中下调表达;90日龄时,ORM2在AR组中上调表达。说明饲喂代乳粉能够增强羔羊免疫力和对外界恶劣环境的抵抗力。断奶后,羔羊的抵抗力降低。X.Zhang 等[19]对人类结直肠癌的研究表明,ORM2基因的选择性表达使其成为诊断肠癌的一个潜在的生物标记基因。载脂蛋白A4(APOA4)主要在哺乳动物的小肠中表达,在小鼠和大鼠的肝中也有表达。载脂蛋白合成后分泌到血液中吸附在新生成的乳糜微粒的表面。脂肪在小肠的吸收能够促进APOA4的合成和分泌。本试验中,APOA4在60日龄时表达上调,在90日龄时表达下调。说明60日龄时,脂肪的吸收比较充分。断奶后,脂肪的吸收相对下降,这也说明代乳粉的脂肪含量比后期的母乳要充足,能够满足羔羊的生长需要。在体外试验中,APOA4能够激活卵磷脂-胆固醇脂酰基转移酶和胆固醇转移蛋白[20]。磷酸神经胺受体3(S1PR3)是G蛋白偶联受体EDG受体家族成员之一,可能的功能是调节血管再生和血管内皮细胞[21]。5-羟色胺受体4(HTR4)是G蛋白偶联受体5-羟色胺受体家族成员之一,能够与5-羟色胺结合刺激cAMP的产生。该受体在中枢神经系统和外周神经系统中合成一种糖基化的跨膜转运蛋白,能够调节许多神经传递素的释放。神经胺和5-羟色胺都是机体内神经活性物质,在本试验中,在60和90日龄时,AR组的表达较ER组均上调,说明羔羊的神经活动在加强,神经系统发育比较活跃,代乳粉能促进羔羊神经系统的发育。兴奋性氨基酸转运子2(EAAT2)是蛋白质溶质运载体家族成员之一,能够清除中枢神经细胞树突周围的兴奋性传递素谷氨酸盐。谷氨酸盐的清除有利于特定树突的激活,并能够防止谷氨酸过多的与受体结合造成神经损伤。EAAT2的上调表达能够修补精神分裂症患者的前脉冲抑制[22],有些抗神经药物能够降低EAAT2的表达[23]。在本试验中,无论是在AR组还是在ER组,90日龄时EAAT2的表达都比60日龄时上调,说明在这段时间中,羔羊的神经活动比较活跃,需要更多的EAAT2来清除谷氨酸盐以保证神经功能的正常发挥。MFSD2A在血管中表达行程血脑屏障,该基因的敲除使紧密连接受到破坏,从而增加血脑屏障的通透性[24]。MFSD2A在非小细胞肺癌细胞中严格的低表达,可以作为肺癌细胞抑制子[25]。
4结论
本研究采用Affymetrix芯片筛选了不同的培育方式下羔羊肝组织的差异表达基因,这些差异表达基因主要参与氨基酸、小分子化合物和有机酸代谢的生物过程、酶活性反应过程、免疫反应过程以及氨基酸代谢、脂类代谢、激素合成和信号转导途径。这些代谢途径和信号通路的发现能够为研究相关基因在幼龄反刍动物肝组织中的作用提供理论依据。
参考文献(References):
[1]FODOR S P,READ J L,PIRRUNG M C,et al.Light-directed,spatially addressable parallel chemicalsynthesis[J].Science,1991,251(4995):767-773.
[2]SOUTHERN E M,CASE-GREEN S C,ELDER J K,et al.Arrays of complementary oligonucleotides for analysing the hybridisation behaviour of nucleic acids[J].NucleicAcidsRes, 1994,22(8):1368-1373.
[3]冯永强,阎小君,苏成芝.基因芯片技术[J].国外医学分子生物学分册,2000,22(1):1-5.
FENG Y Q,YAN X J,SU C Z.Gene chip technology[J].JournalofMedicalMolecularBiology,2000,22(1):1-5.(in Chinese)
[4]YAO J,BURTON J L,SAAMA P,et al.Generation of EST and cDNA microarray resources for the study of bovine immunobiology[J].ActaVetScand,2001,42(3):391-405.
[5]HERATH C B,SHIOJIMA S,ISHIWATA H,et al.Pregnancy-associated changes in genome-wide gene expression profiles in the liver of cow throughout pregnancy[J].BiochemBiophysResCommun,2004,313(3):666-680.
[6]EVERTS R E,BAND M R,LIU Z L,et al.A 7872 cDNA microarray and its use in bovine functional genomics[J].VetImmunolImmunopathol,2005,105(3-4):235-245.
[7]RAINARD P,RIOLLET C.Innate immunity of the bovine mammary gland[J].VetRes,2006,37(3):369-400.
[8]JONES K L,KING S S,IQBAL M J.Endophyte-infected tall fescue diet alters gene expression in heifer luteal tissue as revealed by interspecies microarray analysis[J].MolReprodDev,2004,67(2):154-161.
[9]WANG Y H,BYRNE K A,REVERTER A,et al.Transcriptional profiling of skeletal muscle tissue from two breeds of cattle[J].MammGenome,2005,16(3):201-210.
[10]LOOR J J,BIONAZ M,DRACKLEY J K.Systems physiology in dairy cattle:Nutritional genomics and beyond[J].AnnuRevAnimBiosci, 2013,1:365-392.
[11]文钦.基于双生子研究证候差异的甲基化调控[D].成都:成都中医药大学,2011.
WEN Q.The study of syndrome differences in methylation egulation based on twins[D].Chengdu:Chengdu University of Traditional Chinese Medicine,2011.(in Chinese)
[12]屠焰,刁其玉,岳喜新.一种0-3月龄羔羊的代乳品及其制备方法[P].2013-01-30.
TU Y,DIAO Q Y,YUE X X.A kind of milk replacer and its formula for lambs aged 0 to 3 months[P].2013-01-30.(in Chinese)
[13]岳喜新,刁其玉,马春晖,等.早期断奶羔羊代乳粉饲喂水平对营养物质消化代谢及血清生化指标的影响[J].中国农业科学,2011,44(21):4464-4473.
YUE X X,DIAO Q Y,MA C H,et al.Effects of feeding levels of a milk replacer on digestion and metabolism of nutrients and serum biochemical indexes in lambs[J].ScientiaAgriculturaSinica,2011,44(21):4464-4473.(in Chinese)
[14]IRIZARRY R A,HOBBS B,COLLIN F,et al.Exploration,normalization,and summaries of high density oligonucleotide array probe level data[J].Biostatistics, 2003,4(2):249-264.
[15]AUDIC S,CLAVERIE J M.The significance of digital gene expression profiles[J].GenomeRes,1997,7(10):986-995.
[16]BENJAMINI Y,YEKUTIELI D.The control of the false discovery rate in multiple testing under dependency[J].AnnStat,2001,29(4):1165-1188.
[17]高媛媛.奶牛泌乳启动过程乳腺组织基因和蛋白表达研究[D].泰安:山东农业大学,2013.
GAO Y Y.Bovine mammary gene and protein expression profiling during the onset of lactation[D].Tai'an:Shandong Agricultural University,2013.(in Chinese)
[18]FOURNIER T,MEDJOUBI-N N,PORQUET D.Alpha-1-acid glycoprotein[J].BiochimBiophysActa, 2000,1482(1-2):157-171.
[19]ZHANG X,XIAO Z,LIU X,et al.The potential role of ORM2 in the development of colorectal cancer[J].PLoSOne,2012,7(2):e31868.
[20]KIM Y S,GU B H,CHOI B C,et al.Apolipoprotein A-IV as a novel gene associated with polycystic ovary syndrome[J].IntJMolMed,2013,31(3):707-716.
[21]AN S Z,ZHENG Y H,BLEU T.Sphingosine 1-phosphate-induced cell proliferation,survival,and related signaling events mediated by G protein-coupled receptors Edg3 and Edg5[J].JBiolChem,2000,275(1):288-296.
[22]BELLESI M,MELONE M,GUBBINI A,et al.GLT-1 upregulation impairs prepulse inhibition of the startle reflex in adult rats[J].Glia,2009,57(7):703-713.
[23]SCHMITT A,ZINK M,PETROIANU G,et al.Decreased gene expression of glial and neuronal glutamate transporters after chronic antipsychotic treatment in rat brain[J].NeurosciLett, 2003,347(2):81-84.[24]BEN-ZVI A,LACOSTE B,KUR E,et al.Mfsd2a is critical for the formation and function of the blood-brain barrier[J].Nature, 2014,509(7501):507-511.
[25]SPINOLA M,FALVELLA F S,COLOMBO F,et al.MFSD2A is a novel lung tumor suppressor gene modulating cell cycle and matrix attachment[J].MolCancer,2010,9:62.
(编辑郭云雁)
Effect of Different Rearing Systems on Hepatic Gene Expression of Early Weaned Hu Twin Lambs
WANG Hai-chao,ZHANG Nai-feng,CHAI Jian-min,WANG Bo,DIAO Qi-yu*
(KeyLaboratoryofFeedBiotechnologyofMinistryofAgriculture,FeedResearchInstitute,>ChineseAcademyofAgriculturalSciences,Beijing100081,China)
Abstract:This experiment was conducted to study the effect of different rearing systems on hepatic gene expression in twin lambs.Twenty-four pairs of Hu male twin lambs were equally divided into 2 groups.Twenty-four subjects were artificially reared(AR) with milk replacer after 7 days colostrum while 24 others were ewe reared(ER) with mother milk as control.All lambs were weaned at day 60 and then fed with starter till day 90.When the lambs reached 60 and 90 days old,three pairs of twin lambs at each time point were slaughter to collect liver samples.Hepatic gene expression were analyzed via microarray and bioinformatics method.We found many differentially expressed genes(DEGs).They wereOR1E2,S1PR3,KMO,APOA4,ORM2,HTR4,FADS1 in both 60ARvs60ER and 90ARvs90ER,andACO1,HBA1,MFSD2A,CYSJ,LOC785954,FCN,GRB2,LOC100037663,ORM2,RXRG,LOC100602447,SQLE,HSD17B2,CYP4F2,INHBE,EAAT2 in both 60ARvs90AR and 60ERvs90ER,among which 4 unknown genes were identified with the probe ID 14780690,14815720,14845504,14854080.ORM2 was differentially expressed among all the comparisons.Those DEGs involved in the amino acid metabolism,small molecular metabolism,enzyme activities and immune response of GO process and amino acid metabolism,lipid metabolism,hormone biosynthesis and signaling transductions of KEGG pathways.In summary,different rearing systems altered hepatic gene expression.The pathways and functions those DEGs involved in could shed lights on the mechanisms of early cultivation of lambs.
Key words:twin lambs;early weaning;milk replacer;differentially expressed gene;genechip
doi:10.11843/j.issn.0366-6964.2016.04.013
收稿日期:2015-05-05
基金项目:农业部公益性行业(农业)科研专项(201303143);国家肉羊产业技术体系(CARS-39)
作者简介:王海超(1990-),男,河北临漳人,硕士生,主要从事反刍动物营养学研究,E-mail:qiusuoba@163.com *通信作者:刁其玉,研究员,博士生导师,E-mail:diaoqiyu@caas.cn
中图分类号:S826;S815.4
文献标志码:A
文章编号:0366-6964(2016)04-0733-12
