白头翁汤通过保护微血管内皮细胞的完整性及PMNs迁移杀菌功能的影响
2016-07-11王明明
王明明,杨 舒,董 虹,穆 祥
(北京农学院 兽医学(中医药)北京市重点实验室,北京 102206)
白头翁汤通过保护微血管内皮细胞的完整性及PMNs迁移杀菌功能的影响
王明明,杨舒,董虹*,穆祥*
(北京农学院 兽医学(中医药)北京市重点实验室,北京 102206)
摘要:本研究旨在研究白头翁汤(PD)对脂多糖(LPS)诱导内皮细胞损伤的保护作用,从而揭示白头翁汤的药理作用。分别采用水溶性四氮唑(WST-1)、乳酸脱氢酶(LDH)、苏木素伊红(HE)和Hoechst33342染色法检测PD和LPS对大鼠肠黏膜微血管内皮细胞(RIMVECs)增殖、细胞毒性、细胞连接和细胞核变化的影响;建立中性粒细胞(PMNs)跨RIMVECs迁移的Transwel模型,检测PD对LPS损伤的RIMVECs后PMNs细胞内和细胞外细菌数量的影响。结果显示,LPS(1 μg·mL-1)致RIMVECs细胞核萎缩、细胞膜损坏,细胞毒性百分比达53.2%;细胞连接破坏导致细胞脱落,脱落率为39.6%。PD(20 μg·mL-1)对上述损伤有明显的保护作用。在20 μg·mL-1PD作用下,LPS诱导的跨内皮迁移的PMNs细胞内外细菌的存活明显减少(P<0.01)。结果揭示PD可以有效保护LPS损伤的RIMVECs从而增强PMNs的杀菌能力,为临床治疗动物细菌性疾病用药提供理论依据。
关键词:白头翁汤;大鼠肠黏膜微血管内皮细胞;脂多糖;中性粒细胞
微血管内皮细胞(microvascular endothelial cells,MVECs)作为裱衬于血管内部的一层扁平细胞[1],最初被认为只是一种屏障细胞,但随着近年来研究的深入,发现它是各种致病因子的靶点细胞和效应细胞[2]。内皮细胞(endothelial cell,ECs)的完整性对于机体发挥固有免疫具有至关重要的作用。内毒素(lipopolysaccharide,LPS)是革兰阴性菌裂解出来的细胞壁脂多糖,释放到介质中攻击机体免疫屏障。中性粒细胞(polymorph nuclear neutrophils,PMNs)作为固有免疫执行者需要跨越内皮细胞才能达到病灶组织,从而发挥其抗菌作用[3]。因此,对内皮细胞的保护作用是提高免疫调节的途径之一。
目前中药复方有效保护内皮细胞的报道甚多[4-6],但是保护和提高机体免疫机能的方式有待进一步研究。白头翁汤(Pulsatillae decoction,PD)出自张仲景的《伤寒论》,是经典的清热凉血中药复方[7]。近年来,研究发现白头翁汤具有抗菌消炎、愈合结节性溃疡以及促进免疫调节等现代药用价值[8-9]。作为天然中草药组成的复方,低毒性、低残留、低抗药性的特点使其拥有深入研究的意义。
本试验以PD为契机,在细胞水平上深入研究PD的药理作用,通过体外培养的大鼠肠黏膜微血管内皮细胞(rat microvascular endothelial cells,RIMVECs),建立LPS诱导的细胞损伤模型,检测LPS及PD对RIMVECs细胞增殖、毒性及形态变化的影响,并考察PD对跨内皮迁移的PMNs细胞内外杀菌情况的影响,为进一步研究PD治疗细菌性疾病提供理论依据。
1材料与方法
1.1主要仪器与试剂
多功能酶标仪(BIOTEK,型号SYNERGY4);CO2恒温培养箱(SANYO,型号MCO-17AC);奥林巴斯研究显微镜(OLYMPUS,型号IX71);Transwell 通透性支持物(Corning,批号:3421)等。WST-1细胞增殖及细胞毒性检测试剂盒(碧云天,批号:C0035);乳酸脱氢酶细胞毒性检测试剂盒(碧云天,批号C0017);苏木素伊红染色试剂盒(碧云天,批号C0105);LPS(SIGMA,批号L2880);Hoechst 33342(SIGMA,批号B2261);Cell Proliferation Reagent(Roche,批号:11644807001);Percoll (GE Healthcare公司,批号:170891-01-100mL);葡聚糖Dextran T500(Pharmacia公司,批号17032001);大肠杆菌标准株O101(CVCC1525,购自中国兽医药品监察所);白头翁、黄连、黄柏、秦皮购自北京同仁堂药店。
1.2试验材料
将本实验室冻存的第11代RIMVECs复苏后传代,试验所用为13~14代。本试验将白头翁150 g、黄连60 g、黄柏120 g、秦皮120 g参照兽药典制备白头翁汤水煎剂,浓缩成生药浓度为1 g·mL-1,灭菌处理后4 ℃冰箱保存[10]。本试验应用Image J软件分析荧光强度及细胞脱落率。
1.3细胞形态学观察
为了观察LPS对微血管内皮细胞的损伤及PD对其保护情况,本试验通过HE、Hoechst33342染色观察细胞形态及细胞核的变化。将RIMVECs以1×105·mL-1密度接种于24孔板并按照表1进行细胞分组处理,细胞分为对照组、PD组、LPS组、预防组、治疗组。其中对照组为含有2%胎牛血清的DMEM。
试验中HE染色严格按照试剂盒说明书进行,通过Image J软件及计数培养基中脱落细胞数并计算细胞脱落率。试验所用Hoechst33342的终质量浓度为10 μg·mL-1,室温避光染色20 min,PBS清洗3次,在荧光显微镜下观察,并通过Image J软件分析细胞平均光密度。
1.4细胞增殖率及细胞毒性的检测
分别利用WST-1和LDH法检测PD和LPS对RIMVECs增殖、细胞毒性及细胞膜完整性进行评价。RIMVECs生长至70%~80%汇合状态,以1×105·mL-1的密度接种于96孔细胞培养板。将细胞分为对照组、PD组、LPS组、预防组、治疗组,并按照表1进行细胞处理,每组重复三次。
表1细胞分组与处理
Table 1Cell groups and treaments
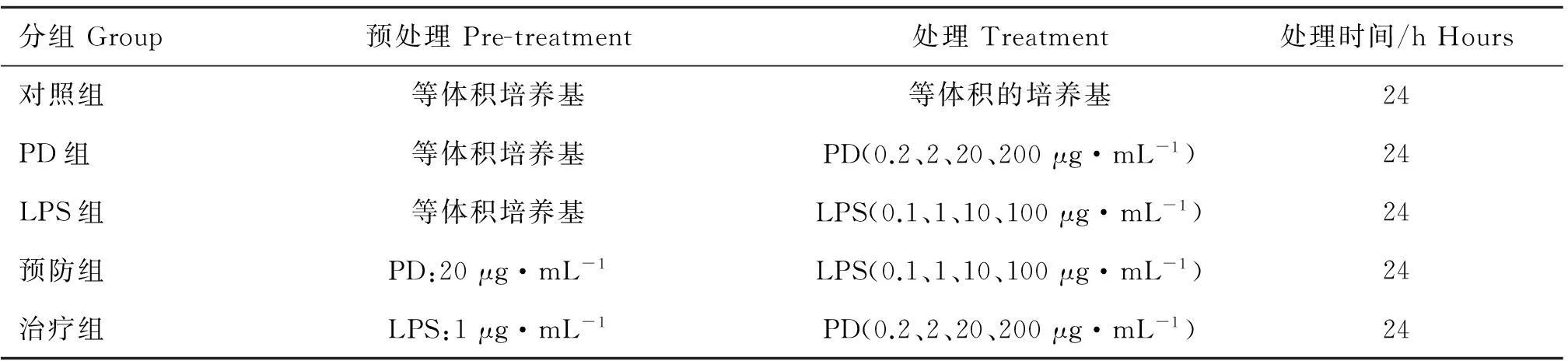
分组Group预处理Pre-treatment处理Treatment处理时间/hHours对照组等体积培养基等体积的培养基24PD组等体积培养基PD(0.2、2、20、200μg·mL-1)24LPS组等体积培养基LPS(0.1、1、10、100μg·mL-1)24预防组PD:20μg·mL-1LPS(0.1、1、10、100μg·mL-1)24治疗组LPS:1μg·mL-1PD(0.2、2、20、200μg·mL-1)24
严格按照WST-1细胞增殖与细胞毒性检测试剂盒说明书,在450 nm波长处测定吸光度。通过公式计算细胞增殖率:增殖率=(样品组-空白对照)/(对照组-空白对照)×100%,其中空白对照为无细胞的培养基。严格按照LDH检测试剂盒说明书,在450 nm波长处测定吸光度。通过公式计算:细胞毒性百分比=(处理样品吸光度-样品对照孔吸光度)/(最大酶活性吸光度-样品对照孔吸光度)×100%。
1.5Transwell体系的建立
利用Transwell通透性支持物,建立跨RIMVECs的PMN迁移Transwell体系。取生长汇合的RIMVECs(3×104·mL-1·well-1)接种于膜孔径为5.0 μm的Transwell小室中,并在下室加入600 μL 2%DMEM,37 ℃的5%CO2培养箱中培养至单层汇合状态。利用Millicell ERS-2系统检测Transwell小室中内皮细胞电阻,通过公式计算:区域面积电阻值(Ω·cm2)= 电阻值×Transwell小室膜面积,确定细胞培养至单层汇合状态。将细胞分为对照组、PD组、LPS组、预防组、治疗组,按照表1进行试剂处理,处理时间为4 h。在小室中加入利用葡聚糖及Percoll梯度离心分离,并用台盼蓝染色调整悬液密度为1×106·mL-1的PMNs,放入37 ℃的5%CO2中静置培养4 h。
1.6跨内皮迁移的中性粒细胞杀菌功能检测[11-12]
庆大霉素保护试验按照文献描述进行。将生长至对数期的大肠杆菌菌株用PBS洗涤并在培养液中重悬,37 ℃培养30 min备用。“1.5”中各组孵育完成后在下室中加入10 μL大肠杆菌(1×103·mL-1)继续培养3 h。收集下室中的培养基并用PBS稀释,取100 μL涂于麦康凯琼脂平板检测细胞外活菌数。加入300 μg·mL-1庆大霉素作用20 min杀死胞外菌,破碎PMNs后取100 μL涂于麦康凯琼脂平板检测细胞内活菌数,37 ℃孵育过夜。
1.7数据处理与分析
试验结果用Graphpad Prism 6统计软件处理数据,所有数据采用均数±标准差表示。*P<0.05、**P<0.01为差异有统计学意义。
2结果
2.1PD及LPS对细胞形态的影响
通过HE染色观察内皮细胞连接的变化,结果发现PD组细胞增多,细胞脱落率呈负值。LPS组细胞形态出现拉伸等状态(如图1C箭头所指)并出现大批量的细胞脱落,脱落率达到39.6%。预防组与治疗组细胞脱落显著低于LPS组(P<0.05,图1)。
细胞损伤时,细胞核或者细胞质内可见浓染致密的颗粒块荧光,甚至可见DNA荧光碎片。本试验通过Hoechst33342对各组细胞核染色,发现LPS组呈现明显致密浓染(图2C),通过Image J软件对图片中细胞荧光分析平均光密度达到0.14 pixel,与对照组相比差异极显著(P<0.01),PD组、预防组、治疗组与对照组相比无统计学意义,提示1 μg·mL-1LPS可造成微血管内皮细胞膜及细胞核损伤,20 μg·mL-1PD可缓解该损伤。
2.2PD对LPS损伤RIMVECs的保护作用
WST可以被活细胞线粒体中的琥珀酸脱氢酶还原生成橙黄色的甲臜,可用来反映细胞活性与增殖。结果表明,LPS(0.1、1、10、100 μg·mL-1)可使内皮细胞的甲臜呈现浓度依赖性减少,细胞增殖率分别为97.2%、53.5%、35.3%、15.1%。PD预防组细胞增殖率极显著高于LPS组 (0.1、1、10、100 μg·mL-1;P<0.01 图3A)。PD治疗组(0.2、2、20、200 μg·mL-1)与1 μg·mL-1LPS相比细胞增殖率均极显著增高(P<0.01 ),当PD质量浓度高于2 μg·mL-1时细胞增殖率高于100%(图3B)。

A、B、C、D、E分别为对照组、PD组、LPS组、预防组、治疗组HE染色图片(100×),F为各组细胞脱落率。与LPS组比较*P<0.05A,B,C,D,E.Figures in the control group,PD group,LPS group,prevention group,treatment group(100×),respectively.F.The rate of cell loss in each gorup.Compared with the LPS group,*P<0.05图1 LPS及PD对RIMVECs细胞连接的影响Fig.1 The impact of LPS and PD on the cell junction of RIMVECs

A、B、C、D、E为对照组、PD组、LPS组、预防组、治疗组Hoechest染色(200×);F为采用Image J软件分析各组平均光密度。与对照组比较**P<0.01A,B,C,D,E.Figures in the control group,PD group,LPS group,prevention group,treatment group (200×),respectively;F represents the average optical density by Image J.Compared with the control group,**P<0.01图2 LPS及PD对RIMVECs细胞核的影响Fig.2 The impact of LPS and PD on the nuclei of RIMVECs
当细胞膜破坏后细胞质中活性比较稳定的LDH会释放出来,因此通过检测培养液中的LDH释放量可以定量分析细胞毒性。结果表明,LPS(1、10、100 μg·mL-1)LDH释放量高于50%,相对应的PD预防组LDH释放量极显著降低(P<0.01 图4A);PD治疗组LDH释放量极显著低于1 μg·mL-1LPS刺激时释放的LDH量(P<0.01 图4B)。
本试验发现PD可以预防LPS损伤微血管内皮细胞,同时可以改善LPS损伤内皮细胞后的细胞增殖。
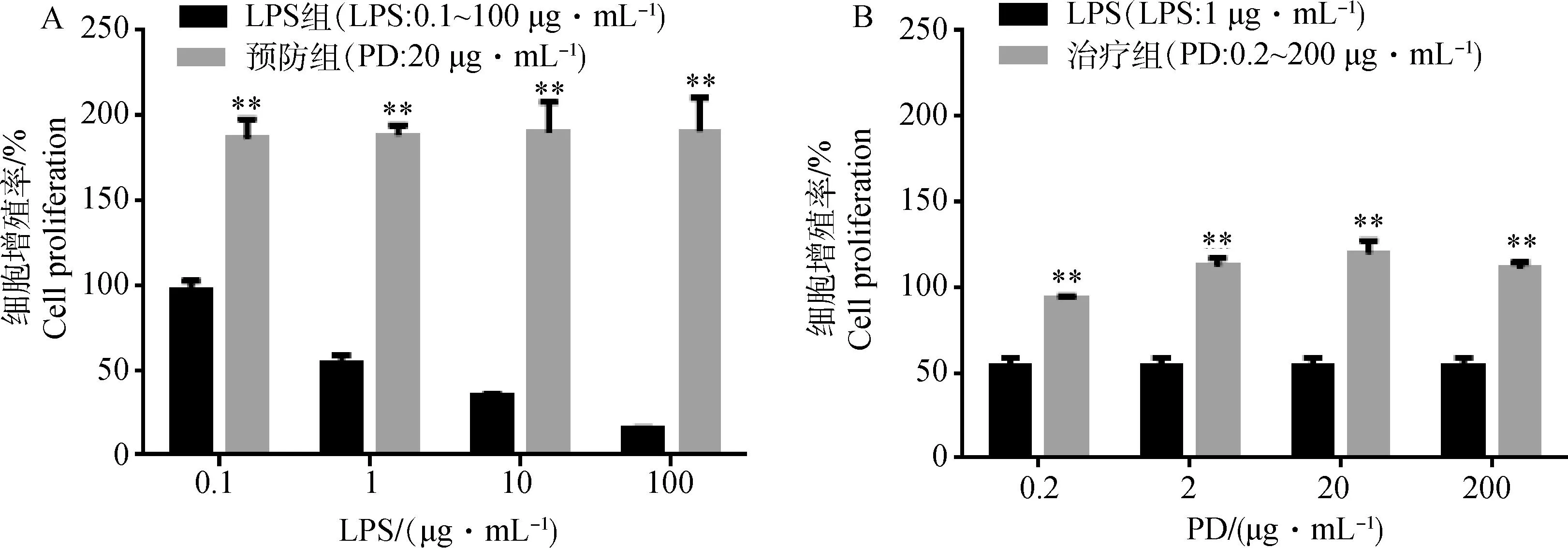
A为不同浓度LPS组、PD预防组细胞增殖情况,预防组与LPS组相比**P<0.01;B为PD治疗组细胞增殖情况,与1 μg·mL-1LPS作用时相比**P<0.01A is the cell proliferation of LPS group and prevention group,compared with the LPS group,**P<0.01;B is the cell proliferation of treatment group,compared with the LPS in 1 μg·mL-1**P<0.01图3 PD对LPS损伤RIMVECs细胞增殖的影响Fig.3 The impact of PD on cell proliferation of LPS-injured RIMVECs
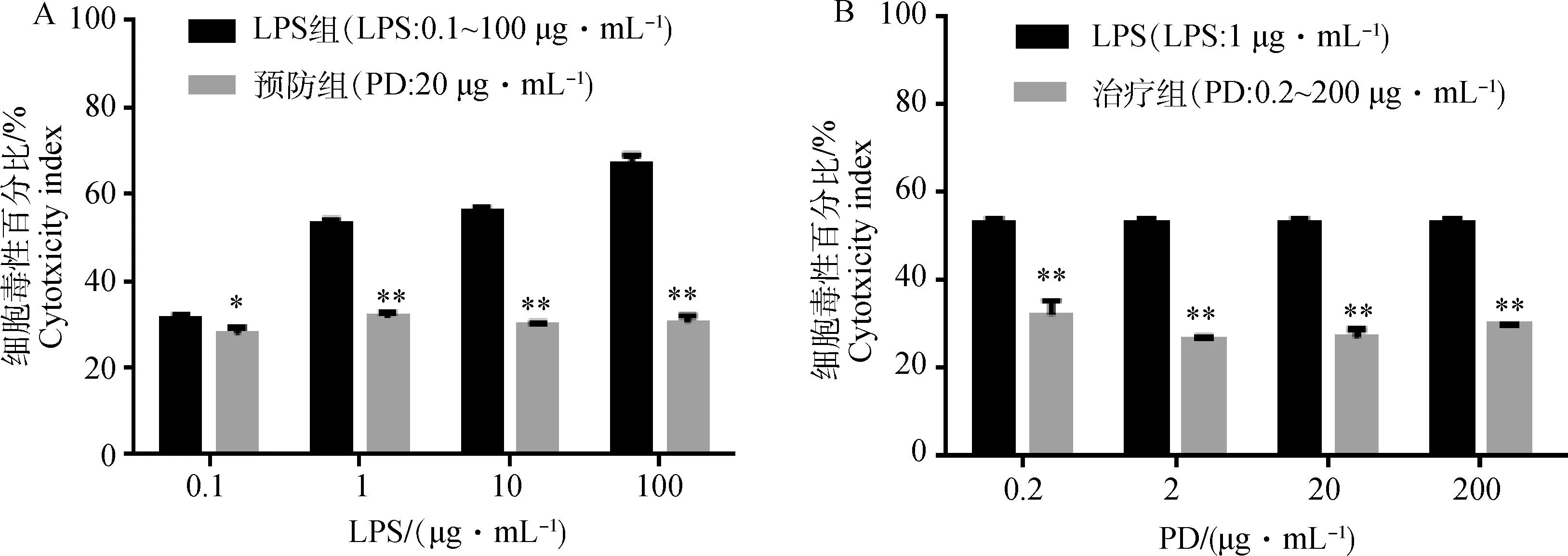
A为LPS组、预防组细胞毒性情况,预防组与LPS组相比*P<0.05,**P<0.01;B为治疗组细胞毒性情况,与1 μg·mL-1LPS作用相比**P<0.01A is the LDH release of LPS group and prevention group,compared with the LPS group *P<0.05,**P<0.01;B is the LDH release of treatment group,compared with the LPS in 1 μg·mL-1**P<0.01图4 PD对LPS损伤RIMVECs LDH释放量的影响Fig.4 The impact of PD on the LDH release of LPS-injured RIMVECs
2.3跨内皮迁移PMNs杀菌能力评价
与LPS损伤RIMVECs后,PMNs穿越不完整RIMVECs的LPS组相比PD预防组与PD治疗组细胞内外细菌量均极显著降低(P<0.01,表2)。提示LPS对RIMVECs造成损伤,而PD对这种损伤有较好的预防及治疗效果,并且可以通过改善RIMVECs以增强PMNs杀菌功能的效果。
表2跨内皮迁移的PMNs杀菌情况
Table 2Transendothelial migration of PMNs sterilization case

分组Group胞内Intracellular胞外Extracelluar对照组46.33±2.52150.66±8.50LPS153.33±8.55185.66±16.04预防组15.33±1.15**26.66±0.57##治疗组37.00±6.55**136.33±7.76##
与LPS组胞内比较**P<0.01。与LPS组胞外比较##P<0.01
Compared with the intracellular of LPS group **P<0.01.Compared with the extracelluar of LPS group ##P<0.01
3讨论
MVECs是构成血液与组织间屏障的重要组成部分,是功能活跃的内分泌细胞[13];作为病原在体内扩散造成全身感染的必经之路,暴露在循环介质中的MVECs易被损伤进而引发多种微血管相关疾病[14]。其中RIMVECs是细菌内毒素的靶细胞,是肠黏膜免疫屏障的重要组成部分,是肠道疾病甚至全身疾病发生发展的病理基础[15]。研究显示LPS会导致RIMVECs形态变形、黏附分子及细胞因子增加、大量炎症介质产生、诱导细胞凋亡等病理表现。所以改善MVECs功能,预防毒素损伤MVECs对研究因MVECs受损而导致的疾病具有重要意义。本试验通过细胞形态染色观察发现,1 μg·mL-1LPS可造成RIMVECs细胞连接破坏,脱落率可达36.2%。PD预防与治疗能够明显改善LPS导致的细胞脱落。对于1 μg·mL-1LPS导致的细胞核皱缩浓染,PD可以通过保护RIMVECs的细胞膜进而降低LPS继续对其细胞核的损伤。
现阶段研究证明,MVECs完整性是组织器官发挥其正常生理功能的必要条件,受损MVECs的增殖修复对维持其完整性至关重要,部分中药可以通过降低MVECs脂质过氧化损伤、调节MVECs活性物质的释放、提高MVECs存活率抑制其凋亡等方式逆转或者改变其相应的病理状态[16]。研究发现丹参麦冬水溶性部位能够明显改善损伤后ECs的增殖,增强细胞生长活力进而达到保护ECs的作用[17]。张磊等研究发现黄芪水煎液能够促进RIMVECs增殖并增强细胞活力,诱导细胞分泌γ-干扰素[18]。PD具有抗菌消炎、燥湿除热、泻火止痢等作用,被广泛应用于治疗动物肠道细菌性疾病。韩捷等通过动物试验观察PD对体液免疫、细胞因子及自由基的影响发现PD具有抗炎杀菌和修复溃疡的作用[19]。胡屹屹等通过体内外试验发现PD可以通过直接抑杀细菌起治疗作用且有抗细菌内毒素的作用[20-21]。探讨PD对RIMVECs细胞增殖率及细胞毒性的影响,发现预防组细胞增殖率明显高于LPS组,且其LDH释放量明显低于LPS组,提示PD的预防作用可以增强RIMVECs的细胞活力,降低LPS所导致的损伤;治疗组较LPS组细胞增殖率显著增高,LDH释放量显著降低,提示PD的治疗作用可以改善LPS损伤RIMVECs后的细胞增殖和损伤。
MVECs不仅是LPS的靶细胞,同时也是一种效应细胞,可以通过分泌功能影响炎症反应。PMNs需要跨越ECs,经历白细胞募集、黏附、游出、通过阿米巴样运动穿过血管壁渗到炎症部位才可以发挥其杀菌功能[22-23]。有研究发现,PMNs溶菌酶的激活与RIMVECs的细胞活性密切相关,PD与LPS作用可以显著增加跨内皮PMNs溶菌酶浓度[24]。本试验通过建立PMNs跨RIMVECs模型,检测PD作用下跨RIMVECs迁移的PMNs杀菌情况。发现PMNs穿越LPS损伤后不完整的RIMVECs杀菌效果显著降低,PD预防与治疗可以明显改善PMNs的杀菌情况。推测RIMVECs结构的完整性对PMNs的激活和发挥杀菌功能至关重要,而PD能够有效降低RIMVECs细胞膜及细胞核的损伤,通过保护RIMVECs完整性,使PMNs穿过完好的RIMVECs并且被激活从而发挥其杀菌功能。综上所述PD不仅有利于细胞增殖,还能够通过有效保护LPS损伤的RIMVECs从而增强PMNs的杀菌能力。本试验在细胞水平上对PD药理作用进行探讨,为兽医临床使用和研究PD防治细菌性疾病提供一定的试验数据。
参考文献(References):
[1]娄晋宁.微血管内皮细胞的培养及其在医学研究中的应用[J].微循环学杂志,2004,14(3):5-8.
LOU J N.Cuture of microvascular endothelial cells and the application in medicine researches[J].ChineseJournalofMicrocirculation,2004,14(3):5-8.(in Chinese)
[2]索占伟,穆祥.从微血管内皮细胞角度浅谈防治细菌内毒素病的新思路[Z].武汉:2006:519-522.
SUO Z W,MU X.New ideas of bacterial endotoxin disease from the perspective of prevention of microvascular endothelial cells[Z].Wuhan:2006:519-522.(in Chinese)
[3]BORREGAARD N.Neutrophils,from marrow to microbes[J].Immunity,2010,33(5):657-670.
[4]高琳琳,王浩.中药保护血管内皮细胞结构和功能的研究进展[J].中国动脉硬化杂志,2006,14(10):907-910.
GAO L L,WANG H.Advances in vascular endothelial cell structure and function of medicine to protect[J].ChineseJournalofArteriosclerosis,2006,14(10):907-910.(in Chinese)
[5]马妍,郭利平.芪参益气滴丸预适应内皮细胞对心肌细胞缺氧损伤的延迟保护作用[J].西部中医药,2015,28(5):11-14.
MA Y,GUO L P.QiShen YiQi dripping pills-induced delayed preconditioning of endothelial cells to hypoxic injury of myocardial cells[J].WesternJournalofTraditionalChineseMedicine,2015,28(5):11-14.(in Chinese)
[6]明松林,何冬梅,王凤英,等.清源生化汤对创伤后脓毒症患者血管内皮细胞的保护作用[J].中医药临床杂志,2015,27(4):536-538.
MING S L,HE D M,WANG F Y,et al.Protective effects of Qingyuan Shenghua Decoction of post-traumatic vascular endothelial cells in patients with sepsis[J].ClinicalJournalofTraditionalChineseMedicine,2015,27(4):536-538.(in Chinese)
[7]朱杰.白头翁汤研究近况[J].中国中医药现代远程教育,2005,3(1):40-42.
ZHU J.Recent situation in research of the Windflower Decoction[J].ChineseMedicineModernDistanceEducationofChina,2005,3(1):40-42.(in Chinese)
[8]孙俊颖,彭新宇,魏光伟,等.白头翁汤的药理作用研究进展[J].广东农业科学,2010(12):112-113.
SUN J Y,PENG X Y,WEI G W,et al.Advances in the pharmacological effects of Pulsatilla soup[J].GuangdongAgriculturalSciences,2010(12):112-113.(in Chinese)
[9]王瑞锋,王雪.白头翁汤的药理作用与临床应用[J].中医学报,2010,25(2):270-271.
WANG R F,WANG X.Analysis on pharmacology and clinical application of pulsatilla decoction[J].ChinaJournalofChineseMedicine,2010,25(2):270-271.(in Chinese)
[10]中国兽药典委员会.中华人民共和国兽药典二○一○年版一部[M].2010:53-54,392.
CCVP.Veterinary Pharmacopoeia of the People’s Republic of China[M].2010:53-54,392.(in Chinese)
[11]STANDISH A J,WEISER J N.Human neutrophils kill Streptococcus pneumoniae via serine proteases[J].JImmunol,2009,183(4):2602-2609.
[12]LEMON J K,WEISER J N.Degradation products of the extracellular pathogen Streptococcus pneumoniae access the cytosol via its pore-forming toxin[J].MBio,2015,6(1):e02110-e02114.
[13]任冬娟.内毒素对血管内皮细胞损伤作用的研究进展[J].中外健康文摘,2011,8(42):223-225.
REN D J.Research endotoxin injury vascular endothelial cells[J].WorldHealthDigest,2011,8(42):223-225.(in Chinese)
[14]张涛,穆祥,黄会岭,等.微血管内皮细胞在中医学研究中的地位探讨[J].中国中医基础医学杂志,2005,11(5):391-393,396.
ZHANG T,MU X,HUANG H L,et al.Discussion about the roles of microvascular endothelial cells in the studies of traditional Chinese medicine[J].ChineseJournalofBasicMedicineinTraditionalChineseMedicine,2005,11(5):391-393,396.(in Chinese)
[15]杨雪静,侯佳惠.姜黄素对内毒素诱导肠黏膜微血管内皮细胞COX-2表达的影响及机制研究[J].中国微生态学杂志,2015,27(8):900-903.
YANG X J,HOU J H.Effect of curcumine on the expression of COX-2 induced by LPS in vascular endothelial cells[J].ChineseJournalofMicroecology,2015,27(8):900-903.(in Chinese)
[16]郭晓辰,张军平.中药抑制血管内皮细胞凋亡的作用机制研究概况[J].中医杂志,2012,53(20):1784-1786.
GUO X C,ZHANG J P.TCM inhibits apoptosis mechanism of action of vascular endothelial overview[J].JournalofTraditionalChineseMedicine,2012,53(20):1784-1786.(in Chinese)
[17]赵宏宇,郑璐玉,张旭,等.丹参麦冬水溶性部位对过氧化氢致血管内皮细胞凋亡的影响[J].现代中医药,2010,30(3):73-76.
ZHAO H Y,ZHENG L Y,ZHANG X,et al.The effect of water-soluble part of radix salviae miltiorrhizae and radix ophiopogonis on vacsular endotheliocyte apoptosis damaged by H2O2[J].ModernTraditionalChineseMedicine,2010,30(3):73-76.(in Chinese)
[18]张磊,孙静,张涛,等.黄芪水煎液诱导大鼠肠黏膜微血管内皮细胞增殖以及分泌IFN-γ的研究[J].动物医学进展,2015,36(3):50-53.
ZHANG L,SUN J,ZHANG T,et al.Study onastragalusaqua induced proliferation and IFN-γ secretion intestinal mucosal micorvascular endothelial cells in rat[J].ProgressinVeterinaryMedicine,2015,36(3):50-53.(in Chinese)
[19]韩捷,梁华龙.白头翁汤治疗溃疡性结肠炎作用机制的实验研究[J].河南中医药学刊,2001,16(3):23-26.
HAN J,LIANG H L.Experimental study of the mechanism of ulcerative colitis Pulsatilla decoction[J].HenanJournalofTraditionalChineseMedicineandPharmacy,2001,16(3):23-26.(in Chinese)
[20]胡屹屹,穆祥,胡元亮.中药方剂白头翁汤抗细菌内毒素的作用研究[J].中国农业大学学报,2011,16(6):132-136.
HU Y Y,MU X,HU Y L.Study on the antiendotoxin action of Pulsatillae Decoction[J].JournalofChinaAgriculturalUniversity,2011,16(6):132-136.(in Chinese)
[21]胡屹屹,穆祥,胡元亮.白头翁汤及其主要成分对LPS诱导内皮细胞分泌NO、E-selectin和IL-8的影响[J].畜牧兽医学报,2012,43(1):145-151.
HU Y Y,MU X,HU Y L.Effects of Pulsatillae Decoction and its main ingredients on LPS-induced NO,E-selectin and IL-8 secretion of endothelial cells[J].ActaVeterinariaetZootechnicaSinica,2012,43(1):145-151.(in Chinese)
[22]SWERLICK R A,LAWLEY T J.Role of microvascular endothelial cells in inflammation[J].JInvestDermatol,1993,100(1):111S-115S.
[23]MARKI A,ESKO J D,PRIES A R,et al.Role of the endothelial surface layer in neutrophil recruitment[J].JLeukocBiol, 2015,98(4):503-515.
[24]刘晓晔,张涛,董虹,等.白头翁汤对大鼠跨内皮迁移的中性粒细胞溶菌酶的影响[J].畜牧兽医学报,2014,45(1):142-146.
LIU X Y,ZHANG T,DONG H,et al.Effects of Pulsatilla Decoction on the lysozyme of transendothelial migration of polymorph nuclear neutrophils in rat[J].ActaVeterinariaetZootechnicaSinica, 2014,45(1):142-146.(in Chinese)
(编辑白永平)
Pulsatillae Decoction Improves the Bactericidal Capacity of Neutrophils by Protection of Integrity of Microvascular Endothelial Cells
WANG Ming-ming,YANG Shu,DONG Hong*,MU Xiang*
(BeijingKeyLaboratoryofTraditionalChineseVeterinaryMedicine,BeijingUniversityofAgriculture,Beijing102206,China)
Abstract:The aims of this paper was to investigate the protective effect of pulsatillae decoction (PD) on endothelial cells injured by lipopolysaccharide (LPS) and to reveal the pharmacological of PD.The cell proliferation and cytotoxicity of the rat microvascular endothelial cells (RIMVECs) were determined by WST-1 ELISA kit and lactate dehydrogenase (LDH) assay.In addition,the RIMVECs damage stimulated by LPS was observed by hematoxylin-eosin (HE) and Hoechst 33342 staining.The transedothlial neutrophils killing was detected by gentamicin protection assay though the build of Transwell.The results showed that LPS (1 μg·mL-1) make the nuclei of RIMVECs shriveled and damage the cell membrane of RIMVECs and lead to cell fall off.The rate of cytotoxicity was 53.2%.The rate of separated cells wass 39.6%.PD(20 μg·mL-1)had the significant proliferative effect for that.LPS induced transendothelial migration of neutrophils can reduce the survival of bacteria in both intracellular and extracellular under the effect of 20 μg·mL-1PD (P<0.01).Results reveal that PD can improve the sterilization function of PMNs by the effective protection of LPS-induced injury of RIMVECs,and might improve the sterilization function of PMNs by protecting the integrity of the RIMVECs to provide a theoretical basis for the dose of clinical treatment of bacterial animal diseases.
Key words:pulsatillae decoction;microvascular endothelial cells;lipopolysaccharide;polymorph nuclear neutrophils
doi:10.11843/j.issn.0366-6964.2016.04.025
收稿日期:2015-10-16
基金项目:国家自然基金项目(31272144;31572558);北京市科委科技计划(Z121100007412004);北京市科技新星(Z141105001814041);北京市自然科学基金(6132007)
作者简介:王明明(1990-),女,辽宁沈阳人,硕士生,主要从事中兽医药及疾病防控方面研究,E-mail:592477872@qq.com *通信作者:穆祥,教授, Tel:010-80799515,E-mail:muxiang1109@sina.com;董虹,副教授,Tel:010-80799480, E-mail:donghong523@163.com
中图分类号:S853.9
文献标志码:A
文章编号:0366-6964(2016)04-0836-08
