猪MC4R基因突变体真核表达载体的构建及功能研究
2016-07-11韩立强郭豫杰鲁维飞褚贝贝杨国宇
韩立强,郭豫杰,鲁维飞,张 欣,褚贝贝,王 江,杨国宇,3*
(1.河南农业大学 农业部动物生化与营养重点实验室,郑州 450002; 2.华中农业大学,教育部动物遗传育种与繁殖重点实验室,武汉 430070; 3.河南省现代畜牧业协同创新中心,郑州 450002)
猪MC4R基因突变体真核表达载体的构建及功能研究
韩立强1,郭豫杰1,鲁维飞1,张欣2,褚贝贝1,王江1,杨国宇1,3*
(1.河南农业大学 农业部动物生化与营养重点实验室,郑州 450002; 2.华中农业大学,教育部动物遗传育种与繁殖重点实验室,武汉 430070; 3.河南省现代畜牧业协同创新中心,郑州 450002)
摘要:为研究MC4R基因不同突变体的功能差异,本研究从猪肌肉组织中克隆得到MC4R基因的编码序列,将克隆片段与pcDNA3.1真核表达载体进行KpnⅠ 和EcoR Ⅰ双酶切,连接形成重组表达载体MC4R1,将载体转染BHK细胞后Western blotting 检测蛋白表达。通过点突变法得到MC4R基因在707/892位点的3个突变载体,将突变载体瞬时转染到BHK细胞,采用免疫荧光对细胞进行标记,通过激光共聚焦显微镜和流式细胞检测荧光表达,结果发现,克隆的MC4R1基因序列长度大约1 000 bp,在707/892位点序列为G/G,将构建的真核表达载体MC4R1转染BHK细胞,经过Western blotting 检测发现MC4R1蛋白正常表达;通过点突变法得到在707/892位点突变的突变载体MC4R2(G/A)、MC4R3(A/G)、MC4R4 (A/A),经过激光共聚焦观察荧光表达后发现,突变受体在细胞膜上均有正常表达,流式检测发现4个突变受体表达的荧光平均强度并没有显著差异(P>0.05)。通过构建MC4R基因突变载体后发现,707/892位点突变对于MC4R受体在细胞膜的表达没有显著影响,其具体机制作用还需深入研究。
关键词:猪;黑素皮质素受体-4;突变体;表达
随着分子生物学技术的飞速发展,分子标记辅助选择和全基因选择育种方式越来越受关注,而对于控制动物性状的功能基因的筛选和深入研究也成为热点,黑素皮质素受体-4 (MC4R)基因是猪育种的重要候选基因[1]。MC4R是下丘脑腹内侧核分泌的一类肽类物质,属于含7个跨膜区的G蛋白偶联受体。MC4R是一个单拷贝基因,仅含有一个外显子,其编码序列长度为996 bp,编码322个氨基酸,是中枢神经系统中黑皮素支路的传导途径,在机体内通过与内源性激动剂α-MSH及拮抗剂Agouti蛋白的相互作用,调控机体的能量代谢和食欲[2-3]。
多项研究发现,MC4R基因的突变与机体的肥胖症、胰岛素水平及脂代谢水平相关。人MC4R基因突变与肥胖症和II型糖尿病发生存在关联[4]。敲除MC4R基因的小鼠出现遗传性肥胖,表现多食、肥胖、胰岛素分泌多等症状[5];有研究发现,猪MC4R基因序列中892位点的错义突变A/G(Asp298Asn)能够导致受体与α-MSH亲和力下降,与猪脂肪沉积(如背膘厚)和生长速度(如测定期平均日增重)具有显著关联[6]。这种效应在多个不同遗传背景的猪群中得以验证,但在其他一些猪群中尚未确证[7],因此它是否为真正的QTN仍处于争论之中。B.Fan等在猪MC4R基因内识别出5个新的SNPs,新发现的SNPs亦与脂肪沉积、平均日增重存在显著关联[8]。这些基因突变特别是其中的707位点的错义突变(Arg236His)对于MC4R受体的功能又具有什么样的作用目前还不清楚。
本研究针对MC4R核酸序列的707/892位点的突变,构建MC4R突变真核表达载体,通过转染细胞后研究突变载体的功能差异,对于揭示MC4R在猪的基因育种方面的机制具有一定的意义。
1材料与方法
1.1材料
Lipofectamine2000(Invitrogen),Star XL扩增 酶、DNA A-Tailing 试剂盒(TaKaRa),DNA提取试剂盒、质粒提取试剂盒(Tigen),DPNⅠ、KpnⅠ、EcoR Ⅰ内切酶(Thermo),pcDNA3.1(+)真核表达载体(实验室自有),DMEM培养基(Hyclone),胎牛血清(杭州四季青),Opti-mem无血清培养基(Gibco),0.25%胰酶(上海吉泰),c-MYC Antibody(9E10)(Santa Cruz),Alexa Fluor®488 Donkey Anti-Mouse IgG (H+L)(Invitrogen),抗荧光封片淬灭液(碧云天),细胞培养板(Corning),二氧化碳培养箱、PCR仪(Thermo),ImageQuantLAS4000生物分子成像仪(GE),激光共聚焦显微镜(Carl Zeiss LSM 5 PASCAL),流式细胞仪(BD FACSCalibur)。
1.2方法
1.2.1猪MC4R基因的克隆采用DNA提取试剂盒从成年大白猪的肌肉组织中提取总DNA,设计引物(表1),引物序列中含有c-Myc标签蛋白的核酸序列及KpnⅠ和EcoR Ⅰ的酶切位点,用高保真Star XL扩增酶进行PCR反应,PCR产物进行琼脂糖凝胶电泳后,切胶回收,将回收核酸片段采用加A试剂盒加polyA尾巴后,连接到pMD18T载体,转化感受态细胞DH5α,进行筛选,获得阳性克隆,送上海生工测序,获得MC4R序列。
1.2.2MC4R基因真核载体的构建将测序正确的MC4R质粒分别进行KpnⅠ、EcoR Ⅰ双酶切,酶切体系为酶各0.5 U,质粒1 μg,Buffer 1 μL,超纯水6 μL,在37 ℃酶切过夜,切胶回收,同时将pcDNA3.1(+)真核表达载体进行同样的双酶切回收,将目的基因的回收片段与载体回收片段在T4 连接酶的作用下进行连接,将连接片段转化感受态细胞后筛选阳性克隆,将阳性克隆扩大培养提取质粒进行酶切验证,将验证正确的质粒测序,获得序列正确的重组载体MC4R1,准备进行细胞转染表达。
表1MC4R基因克隆引物及点突变引物
Table 1Primers for theMC4Rgene clone and mutation
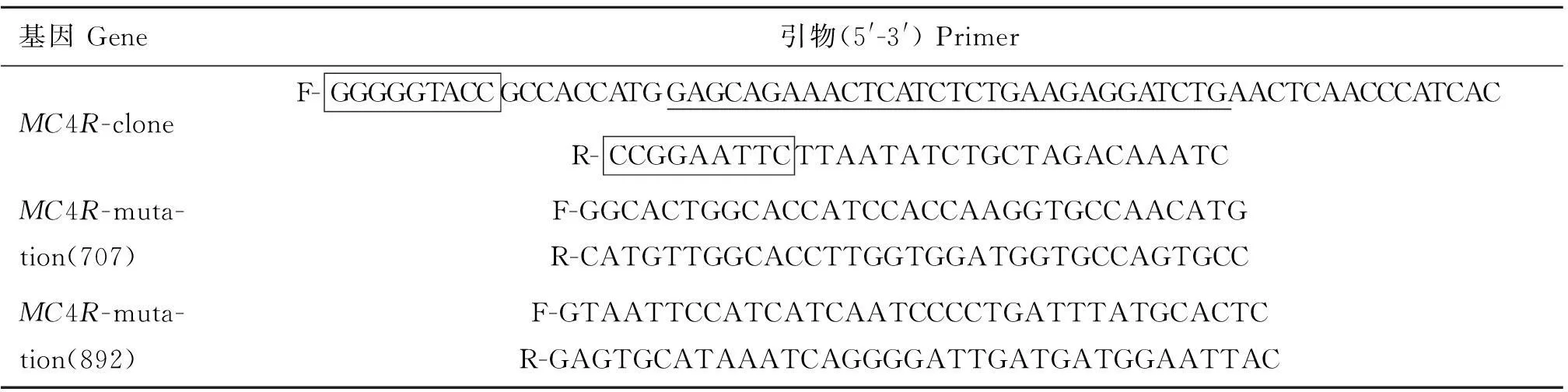
基因Gene引物(5'-3')PrimerMC4R-cloneF-GGGGGTACCGCCACCATGGAGCAGAAACTCATCTCTGAAGAGGATCTGAACTCAACCCATCACR-CCGGAATTCTTAATATCTGCTAGACAAATCMC4R-muta-tion(707)F-GGCACTGGCACCATCCACCAAGGTGCCAACATGR-CATGTTGGCACCTTGGTGGATGGTGCCAGTGCCMC4R-muta-tion(892)F-GTAATTCCATCATCAATCCCCTGATTTATGCACTCR-GAGTGCATAAATCAGGGGATTGATGATGGAATTAC
引物序列中酶切位点用方框表示,c-Myc标签序列用下划线表示
In primer sequences,the boxes represent restriction sites and underlines represent c-Myc tag sequences
1.2.3细胞转染将培养好的BHK细胞经胰酶消化后,按比例分散培养在细胞培养板中,等到细胞达到80%的融合度时,弃去培养基,配置转染试剂(Opti-mem+质粒+Lipofectamine2000),室温孵育20 min后,加入24孔板,转染6 h后,弃去转染试剂,更换新鲜培养基,同时以空载体作为对照组,培养过夜后进行Western blotting 检测。
1.2.4Western blotting 检测MC4R蛋白表达将转染后的细胞板中细胞用PBS洗 3遍,然后每孔加入裂解液150 μL RIPA(1%PMSF),吹打细胞,收集到离心管中,冰浴30 min,12 000 r·min-1离心10 min,取上清加入20%的蛋白上样buffer在100 ℃煮10 min,得到细胞蛋白提取液,进行Western blotting检测蛋白表达,以GAPDH作为内参,ECL显影后在生物分子成像仪内成像分析。
1.2.5MC4R基因4个不同突变体真核载体的构建针对MC4R克隆序列,分别在707、892位点处设计点突变引物(表1),以克隆质粒20倍稀释为模板进行PCR,Star XL 0.4 μL,buffer 4 μL,dNTP 2 μL,上下游引物各0.2 μL,模板1 μL,加水体积到20 μL,PCR循环数为15,同时做阴性对照(加模板不加引物),反应结束后取PCR产物1 μL,加入DpnⅠ酶1 μL,37 ℃酶切过夜,将酶切产物转化DH5α感受态细胞,铺板挑选阳性菌(阴性对照板上不长菌)。将阳性菌送上海生工测序,验证突变效果。将测序突变正确的序列分别进行KpnⅠ、EcoRⅠ双酶切,切胶回收后与pcDNA3.1载体回收片段在T4 连接酶的作用下进行连接,形成不同突变序列的MC4R真核表达载体,将连接片段转化感受态细胞后筛选阳性克隆,将阳性克隆扩大培养提取质粒,测序验证序列的正确性,获得正确的突变序列,准备进行细胞转染表达和免疫荧光观察。
1.2.6MC4R基因不同突变载体的免疫荧光观察在24孔板中加入细胞爬片,接种BHK细胞,细胞培养过夜后,将4种突变载体质粒MC4R1~MC4R4分别转染细胞,24 h后将细胞用PBS洗3次,每次5 min;弃去PBS,4%多聚甲醛固定10 min;PBS洗3次,每次5 min;弃去PBS,对细胞直接用封闭液(90%PBS+10%胎牛血清)封闭1 h;弃封闭液,一抗c-MYC Antibody(9E10)(1∶250)4 ℃过夜,PBS洗3次,加入荧光标记二抗Alexa Fluor®488 Donkey Anti-Mouse IgG (H+L)(1∶500)室温避光孵育1 h;PBS洗3次,在荧光显微镜下检测是否有荧光表达;暗室中将细胞爬片夹出,在载玻片上滴加一滴抗荧光封片淬灭液,将细胞爬片有细胞一侧扣在淬灭液上,爬片周围用封片剂进行封片,晾干放4 ℃,在激光共聚焦显微镜下观察荧光表达。1.2.7流式细胞法检测不同突变载体的荧光表达将4种突变载体质粒MC4R1~MC4R4分别转染细胞,以空载体作为对照,培养48 h后用胰酶消化,将细胞移入1.5 mL离心管中,1 000 r·min-1离心10 min,加入预冷的PBS洗涤1次,离心,1 mL 4%多聚甲醛室温固定20 min,离心洗涤,加入封闭液室温封闭1 h,离心洗涤,加入一抗c-MYC Antibody(9E10),4 °C过夜孵化,离心洗涤细胞,标记荧光二抗Alexa Fluor®488 Donkey Anti-Mouse IgG (H+L),轻轻吹打混匀,室温避光孵育1 h,洗涤细胞,将细胞重新悬浮于500 μL PBS中,轻轻混匀,置流式管中上机检测,试验重复3次,计算阳性细胞数和平均荧光强度数值,利用SPSS软件对各个突变体间的荧光强度差异进行显著性检验。
2结果
2.1MC4R1基因的克隆
以提取的猪肌肉组织DNA作为模板进行PCR,PCR产物进行琼脂糖电泳后发现,在大约1 000 bp处有明显的目的条带(图1),回收后经测序确认所得条带的序列与MC4R1基因标准序列相符,其中在707/892位点的序列为G/G。

图1 MC4R基因的PCR结果Fig.1 PCR amplification result of MC4R gene
2.2MC4R1基因真核载体的构建
将获得的真核表达载体转化感受态细胞后筛选阳性克隆,扩大培养后提取质粒,进行酶切验证,形成大约5 400 bp 的pcDNA3.1载体片段和大约1 000 bp的MC4R1目的基因片段(图2),表明载体构建成功。
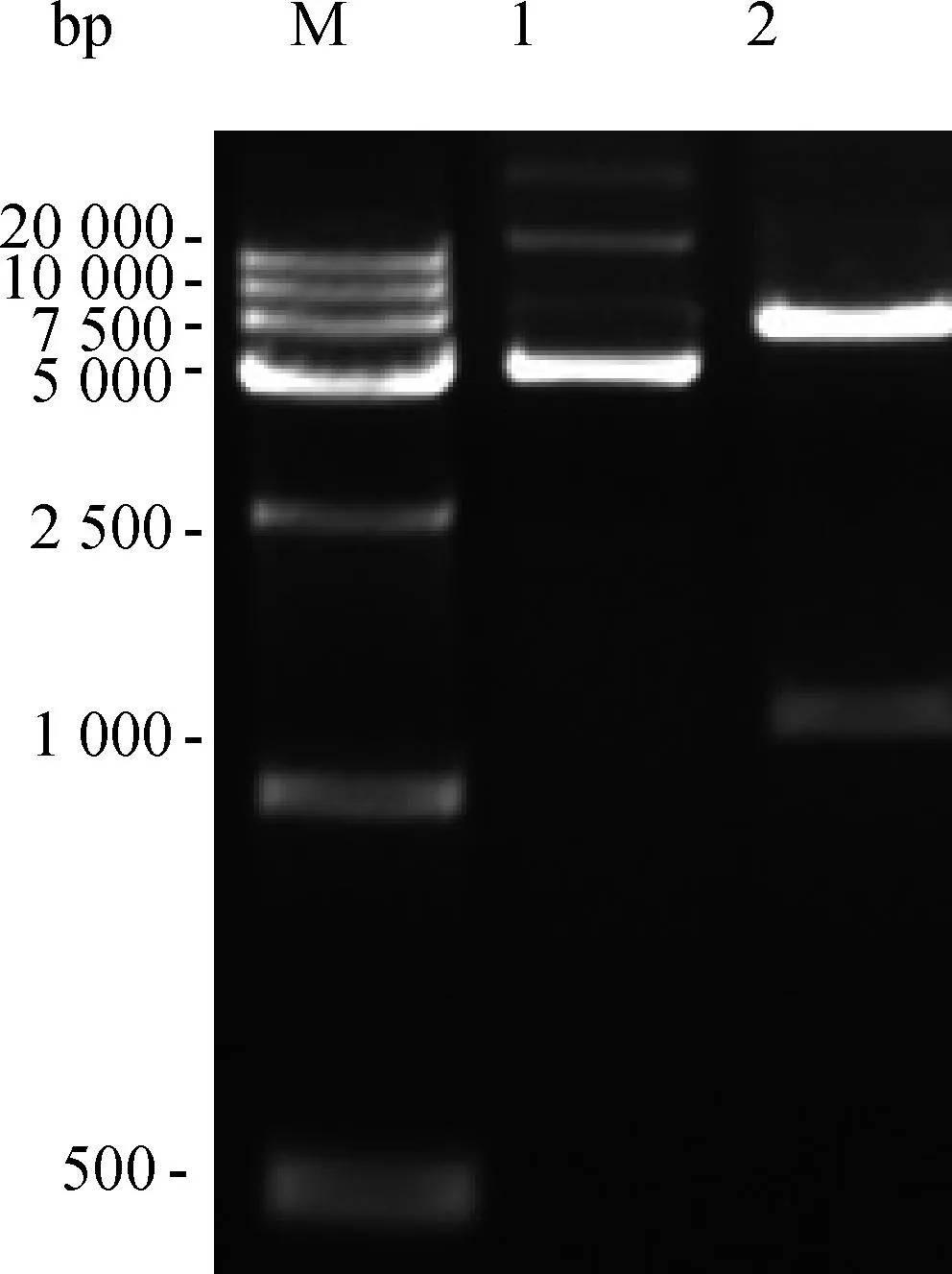
M.DNA相对分子质量标准;1.原质粒;2.质粒双酶切M.Marker;1.MC4R1 vector;2.Digestion of MC4R1 vector by KpnⅠand EcoR Ⅰ图2 MC4R1真核载体质粒双酶切鉴定Fig.2 Double restriction enzyme digestion and identification of MC4R1 eukaryotic expression vector
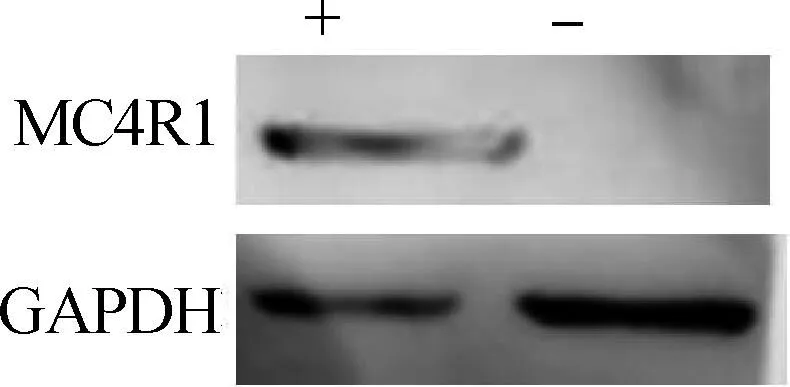
+.MC4R1组;-.对照组+.Group of MC4R1 vector;-.Group of pcDNA3.1图3 MC4R1蛋白表达的Western blotting检测Fig.3 The protein expression of MC4R1 by Western blotting
2.3Western blotting 检测MC4R1蛋白表达
对转染后的细胞提取蛋白进行Western blotting检测,结果发现内参GAPDH在试验组和对照组细胞内都有正常表达,MC4R1蛋白在试验组细胞内正常表达,在对照组细胞(转染pcDNA3.1空载体)内没有检测到MC4R1蛋白的表达(图3),结果表明真核载体MC4R1构建成功。
2.4MC4R基因突变真核载体的构建
将T载体上的MC4R序列经过点突变后,用KpnⅠ、EcoR Ⅰ进行双酶切,获得大约1 000 bp的目的片段和大约2 600 bp的T载体片段(图4),然后分别将目的片段回收后与pcDNA3.1真核表达载体酶切片段进行连接,转化后得到阳性克隆,扩大培养后提取质粒,进行测序验证后获得在707/892位点突变的3个突变载体MC4R2 (G/A)、MC4R3 (A/G)、MC4R4 (A/A)。
2.5MC4R基因不同突变载体的免疫荧光观察
将构建好的MC4R基因4个突变真核载体分别转染BHK细胞后,进行免疫荧光标记,标记后采用激光共聚焦显微镜观察,发现荧光主要在细胞膜上显示(图5),表明此时MC4R受体基因在细胞膜上正常表达。
2.6流式细胞法检测不同突变载体的荧光表达
通过流式细胞仪检测MC4R1~MC4R4载体染后阳性细胞的平均荧光强度(图6),与MC4R1、MC4R2和MC4R4相比,MC4R3的阳性细胞平均荧光强度有所增加,但通过显著性检验后发现4种受体的阳性细胞荧光强度之间无显著性差异(P>0.05)。
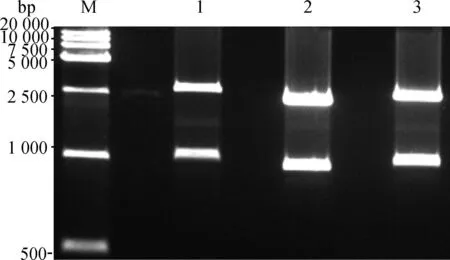
M.DNA相对分子质量标准;1.突变体MC4R2;2.突变体MC4R3;3.突变体MC4R4M.Marker;1.Mutations of MC4R2;2.Mutations of MC4R3;3.Mutations of MC4R4图4 MC4R不同突变体双酶切鉴定图Fig.4 Double restriction enzyme digestion and identification of MC4R mutations by KpnⅠ and EcoR Ⅰ
3讨论
自从I.Gantz在1993年克隆了人的MC4R基因[9],MC4R已经分别从大鼠、小鼠、猪、羊、牛和一些其他的灵长类动物组织中克隆到序列,比对发现氨基酸序列在这些物种间是高度保守的[10]。到目前为止,已经发现有5种黑皮质素受体(MCRs)介导黑皮质素的作用,根据它们的序列被发现的次序,分别命名为MC1R、MC2R、MC3R、MC4R和MC5R[11],MC4R主要在中枢神经系统表达,能够调控能量平衡和摄食[12]。本研究中,通过设计引物对猪MC4R基因进行克隆,经测序获得正确的猪MC4R基因序列,转染细胞后经过Western blotting 检测发现MC4R1蛋白表达正常,表明载体构建成功。

图5 MC4R1~MC4R4的免疫荧光观察Fig.5 Fluorescence observation of MC4R1-MC4R4 vectors
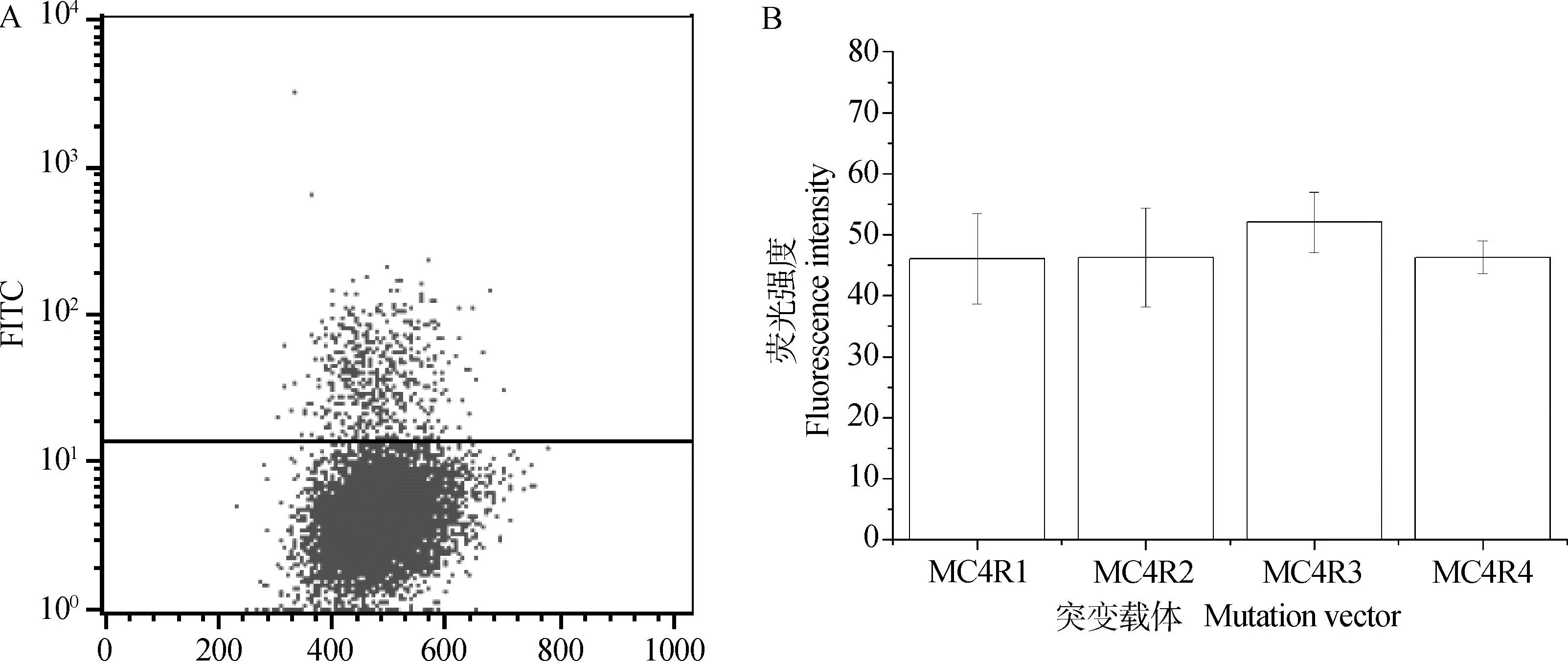
A.阳性细胞;B.平均荧光强度A.Positive cells;B.MFI图6 MC4R1~MC4R4的荧光强度检测Fig.6 Fluorescence intensity of MC4R1-MC4R4 vectors
真核细胞内基因的编码序列发生突变可能会引起基因功能的改变。MC4R作为一种膜蛋白受体,突变基因的蛋白质表达产物可能通过以下几种方式影响受体功能:①受体在细胞表面表达缺陷;②受体与配体亲和力下降;③受体与配体结合后与G蛋白偶联过程异常,无法产生相应cAMP[13-14]。在本研究中,针对猪MC4R基因的主要突变位点,通过点突变的方法获得4个MC4R的错义突变真核表达载体,这4个突变体在707/892位点的基因序列分别为G/G、G/A、A/G、A/A,相对应的氨基酸序列改变为Arg/Asp、Arg/Asn、His/Asp、His/Asn。本研究对这4种突变体在细胞上的表达进行了功能鉴定。MC4R作为一种膜受体,抗体主要对细胞膜上的表达蛋白进行标记,所以当细胞膜显示绿色荧光(图5)时,即表明载体表达出的MC4R蛋白受体在细胞膜上都能够正常表达。通过流式细胞仪检测受体的表达量,发现4种突变体转染后的阳性细胞在细胞膜上的荧光表达值没有差异(图6),表明707/892位点突变没有对细胞表面的受体表达产生缺陷,因此其引起的功能差异可能更倾向于与配体结合及信号转导方面。
其他研究中对人MC4R基因中20个位点进行基因突变,激光共聚焦检测发现,其中很多位点在细胞膜上的表达正常,而在配体偶联和信号传导方面功能异常[15]。MC4R受体作为一种G蛋白偶联受体,与其配体结合能够启动G蛋白偶联的信号系统,活化腺苷酸环化酶,引起细胞内cAMP上升,介导细胞的一系列生理生化活动,而突变MC4R蛋白此能力可能会有所变化。关于猪MC4R突变体的信号转导研究,K.S.Kim等[6]采用I标记法发现猪MC4R在892位点的突变能够减少MC4R受体产生cAMP的功能,而其他研究在293细胞上分析了892位点的突变对于MC4R受体的结合性及与G蛋白偶联产生cAMP的功能影响,发现这两种突变对于MC4R受体的功能没有影响[16],这些相互矛盾的结果还需要后续的研究进行辨别,特别是其中的差异是不是由于在707位点(Arg236His)的突变引起的连锁变化,现在还不得而知。显然,构建707/892位点突变载体来研究这些突变对于MC4R受体与配体的结合及信号转导的影响,对于更加深入的理解猪MC4R基因突变在基因组和遗传方面的功能差异具有一定的科学价值。
致谢:本研究在试验条件方面得到了华中农业大学教育部农业动物遗传育种与繁殖重点实验室的大力支持,在此表示感谢。
参考文献(References):
[1]FAN B,ONTERU S K,GARRICK D J,et al.Genome-wide association study identifies loci for body composition and structural soundness traits in pigs[J].PLoSOne,2011,6(2):e14726.
[2]BARB C R,ROBERTSON A S,BARRETT J B,et al.The role of melanocortin-3 and-4 receptor in regulating appetite,energy homeostasis and neuroendocrine function in the pig[J].JEndocrinol,2004,181(1):39-52.
[3]TAO Y X.The melanocortin-4 receptor:physiology,pharmacology,and pathophysiology[J].EndocrRev,2010,31(4):506-543.
[4]GOVAERTS C,SRINIVASAH S,SHAPIRO A,et al.Obesity-associated mutations in the melanocortin-4 receptor provide novel insights into its function[J].Peptides,2005,26(10):1909-1919.
[5]HUSZAR D,LYNCH C A,FAIRCHILD-HUNTRESS V,et al.Targeted disruption of the melanocortin-4 receptor results in obesity in mice[J].Cell,1997,88(1):131-141.
[6]KIM K S,REECY J M,HSU W H,et al.Functional and phylogenetic analyses of a melanocortin-4 receptor mutation in domestic pigs[J].DomestAnimEndocrinol,2004,26(1):75-86.
[7]PARK H B,CARLBORG O,MARKLUND S,et al.Melanocortin-4 receptor (MC4R) genotypes have no major effect on fatness in a Large White × Wild Boar intercross[J].AnimGenet,2002,33(2):155-157.
[8]FAN B,ONTERU S K,PLASTOW G S,et al.Detailed characterization of the porcineMC4Rgene in relation to fatness and growth[J].AnimGenet,2009,40(4):401-409.
[9]GANTZ I,MIWA H,KONDA Y,et al.Molecular cloning,expression,and gene localization of a fourth melanocortin receptor[J].JBiolChem,1993,268(20):15174-15179.
[10]HUGHES D A,HINNEY A,BRUMM H,et al.Increased constraints onMC4Rduring primate and human evolution[J].HumGenet,2009,124(6):633-647.
[11]SWITONSKI M,MANKOWSKA M,SALAMON S.Family of melanocortin receptor (MCR) genes in mammals-mutations,polymorphisms and phenotypic effects[J].JApplGenet,2013,54(4):461-472.
[12]XI B,CHANDAK G R,SHEN Y,et al.Association between common polymorphism near theMC4Rgene and obesity risk:a systematic review and meta-analysis[J].PLoSOne,2012,7(9):e45731.
[13]TAO Y X.Mutations in melanocortin-4 receptor and human obesity[J].ProgMolBiolTranslSci,2009,88:173-204.
[14]CALTON M A,ERSOY B A,ZHANG S,et al.Association of functionally significant melanocortin-4 but not melanocortin-3 receptor mutations with severe adult obesity in a large North American case-control study[J].HumMolGenet,2009,18(6):1140-1147.
[15]WANG Z Q,TAO Y X.Functional studies on twenty novel naturally occurring melanocortin-4 receptor mutations[J].BiochimBiophysActa,2011,1812(9):1190-1199.
[16]FAN Z C,SARTIN J L,TAO Y X.Pharmacological analyses of two naturally occurring porcine melanocortin-4 receptor mutations in domestic pigs[J].DomestAnimEndocrinol,2008,34(4):383-390.
(编辑郭云雁)
Construction and Function Confirmation of MC4R Gene Eukaryotic Expression Vector with Different Mutations
HAN Li-qiang1,GUO Yu-jie1,LU Wei-fei1,ZHANG Xin2,CHU Bei-bei1,WANG Jiang1,YANG Guo-yu1,3*
(1.KeyLaboratoryofAnimalBiochemistryandNutritionofMinistryofAgriculture,HenanAgriculturalUniversity,Zhengzhou450002,China;2.KeyLaboratoryofAgriculturalAnimalGenetics,BreedingandReproductionofMinistryofEducation,HuazhongAgriculturalUniversity,Wuhan430070,China;3.HenanCollaborativeInnovationCenterofModernAnimalHusbandry,Zhengzhou450002,China)
Abstract:To investigate the function difference of the different Melanocortin-4 receptor (MC4R) gene mutants,the complete coding sequence( CDS) ofMC4Rgene were cloned from pig muscle tissues.The CDS sequence was linked with pcDNA3.1 vector by digested with restriction endonuclease ofKpnⅠ andEcoR Ⅰ and the recombinant eukaryotic expression vectorMC4R1 was constructed.After recombinantMC4R1 plasmid transfected into BHK cells,the protein expression of MC4R1 was confirmed by Western blotting.Simultaneously,3 site-directedMC4RcDNA mutant (707/892 site) vectors were generated.The protein expression of MC4R mutations vector was observed in transiently transfected BHK cell by Laser Scanning Confocal Microscopy and Flow Cytometry ananlysis.The results indicated that the CDS sequence ofMC4R1 gene was about 1 000 bp and the sequence of 707/892 site was G/G.The protein expression of MC4R1 was confirmed in BHK cells using Western blotting.Three site-directed mutant eukaryotic vectorMC4R2,MC4R3,MC4R4 were constructed and the sequence of 707/892 site was G/A,A/G,A/A,respectively.Confocal microscopy showed that every mutant ofMC4Rreceptor were expressed well on the cell surface by the Immunofluorescence.There were no significant difference of the fluorescence intensity between mutants of MC4R receptors(P>0.05)by FCM.The construction and functional research ofMC4Rvector suggest that the mutants of 707/892 site has no significant impact on the expression of MC4R receptor on cell surface.This will provide technological platform for further research in the role ofMC4Rgene.
Key words:pig;MC4R;mutation;expression
doi:10.11843/j.issn.0366-6964.2016.04.006
收稿日期:2015-05-04
基金项目:农业部“引进国际先进农业科学技术”(948)重点项目(2011-G35);国家转基因重大专项(2014ZX0801015B);郑州市科技攻关项目(141PPTGG430)
作者简介:韩立强(1979-),男,河南新乡人,副教授,博士,主要从事动物基因功能的研究,Tel:0371-63558180,E-mail: qlahn2001@126.com *通信作者:杨国宇,教授,博士,主要从事动物生物化学研究,E-mail:haubiochem@163.com
中图分类号:S828;S813.3
文献标志码:A
文章编号:0366-6964(2016)04-0679-07
