副结核分枝杆菌MAP0862蛋白的表达及在间接ELISA中的初步应用
2016-07-11朱良全丁家波常维山
张 振,冯 宇,张 阁,朱良全,蒋 卉,丁家波*,赵 鹏,常维山*
(1.山东农业大学动物科技学院,泰安 271018;2.中国兽医药品监察所,北京 100081)
副结核分枝杆菌MAP0862蛋白的表达及在间接ELISA中的初步应用
张振1,2,冯宇1,张阁2,朱良全2,蒋卉2,丁家波2*,赵鹏1,常维山1*
(1.山东农业大学动物科技学院,泰安 271018;2.中国兽医药品监察所,北京 100081)
摘要:本研究的目的是探索副结核分枝杆菌特异性蛋白MAP0862在牛副结核病血清学诊断中的作用,建立牛副结核病特异性ELISA诊断方法。将通过原核表达获得的副结核特异性蛋白MAP0862纯化并定量后作为包被抗原,经过一系列条件优化后初步建立了牛副结核病间接ELISA诊断方法。使用牛副结核阳性血清、牛布病阳性血清、牛结核阳性血清、卡介苗免疫牛血清、牛大肠杆菌阳性血清以及健康阴性牛血清对该方法的验证表明其具有良好的特异性。使用该方法对300份临床血清进行检测,结果表明该方法与IDEXX副结核检测试剂盒的符合率为94.3%。基于副结核特异性蛋白质MAP0862建立的间接ELISA诊断方法能有效检测牛副结核病。
关键词:牛副结核病;MAP0862蛋白;ELISA
副结核分枝杆菌(Mycobacteriumaviumsubsp.paratuberculosis,MAP)能引起反刍动物以慢性肠炎为特征的副结核病(Johne’s病),该病于1958年和1959年首次报道出现在地中海塞浦路斯的一个牛场中[1],同期我国内蒙古地区也首次报道了一例副结核病牛,该病在随后的几年内迅速蔓延至全国大部分地区[2]。由于该病引起奶牛严重消瘦和生产性能下降,给奶牛生产带来了极大的损失[3],该病仅在美国动物性食品方面的损失每年就可达到2.5亿美元[4]。副结核病不仅关系到畜牧业发展,而且对人类健康也构成威胁,最近有研究推测该菌与人类的克罗恩病相关,然而目前尚无治疗该病的特效治疗药物或方法,因此引起人们越来越多的关注[5]。牛副结核病在我国也相当严重,本实验室与山东奶牛中心连续3年对全国16个省份的28个牧场进行过牛副结核病和布鲁菌病的检测,其中副结核病的群体阳性率高达14.3%。
经典的副结核病诊断采用禽结核菌素进行皮内变态反应试验,检测过程中至少需要2次固定牛,工作量非常大,加之禽结核分枝杆菌与其他分枝杆菌具有较高的同源性,易导致非特异性反应,从而使牛副结核病的确诊变得困难。因此,建立一种简单、高效的副结核病检测方法用于对牛副结核病诊断具有重要的现实意义。
MAP0862为副结核分枝杆菌的特有抗原,在其他分枝杆菌中缺乏,且该蛋白质在副结核分枝杆菌中高水平表达,可引发动物机体体液免疫,具有良好的免疫原性。国内已有对该蛋白质体外表达的研究报道,但未研究其在ELISA方面的应用。本研究旨在对副结核MAP0862基因进行克隆表达,并尝试建立副结核特异的血清学诊断方法。
1材料与方法
1.1材料
1.1.1菌株及载体副结核分枝杆菌P10,购自中国兽医药品监察所微生物保藏中心。原核表达载体pET-32a(+)由本实验室保存。
1.1.2试剂副结核培养基购自BD公司;E.coliBL21(DE3) 、EcoRⅠ、XhoⅠ、T4 DNA Ligase购自TaRaKa公司;超保真2×Master Mix购自NEB公司;基因组提取试剂盒购自Qiagen公司:质粒提取试剂盒购自OMEGA公司;HRP标记的兔抗牛IgG酶标抗体购自Sigma公司。
1.1.3试验血清副结核病阳性牛血清18份、布病阳性牛血清10份、牛结核阳性血清15份、卡介苗免疫牛血清10份、牛阴性血清58份均由本实验室鉴定保存;300份临床牛血清中200份由山东省奶牛中心提供,100份由本实验室保存。
1.2方法
1.2.1菌种复苏无菌开启一支冻存的副结核分枝杆菌P10菌种,用1 mL灭菌生理盐水重悬菌体后接种于两支副结核培养基,置于37 ℃温箱内培养约30 d至长出白色颗粒状菌落。1.2.2引物设计从GenBank调取副结核分枝杆菌K-10 的MAP0862基因序列(检索号:AE016958.1),使用DNAStar软件分析该序列中抗原性最好的一段区域(1 032 bp)并设计一对特异性引物扩增该片段。P1:5′-CCGGAATTCATGCGCTTCGTAAA-CGG-3′(含EcoRⅠ位点);P2:5′-CCGCTCGAG-TTATGGCTTCCTCGTAAA-3′(含XhoⅠ位点)。
1.2.3MAP0862基因扩增使用基因组提取试剂盒提取副结核分枝杆菌P10的基因组作为模板,进行PCR扩增,反应体系为:2×Master Mix 25 μL,上下游引物(10 μmol·L-1)各2.5 μL,基因组2 μL,加灭菌ddH2O至50 μL。反应程序:98 ℃ 30 s;98 ℃ 10 s,54 ℃ 20 s,72 ℃ 20 s(30个循环);72 ℃ 10 min 延伸PCR反应,对PCR产物进行胶回收。
1.2.4重组表达质粒pET-MAP0862的构建与诱导表达使用EcoRⅠ和XhoⅠ分别对回收的PCR产物以及pET-32a(+)载体进行双酶切,使用T4 DNA Ligase对回收后的双酶切产物按一定比例进行过夜连接,将连接产物转化进BL21(DE3)后挑取单菌落摇菌,提取质粒进行双酶切鉴定,挑取酶切鉴定为阳性的质粒送公司测序鉴定。将含阳性重组质粒的菌液按照1∶100比例接种新鲜含氨苄抗性(100 μg·mL-1)的LB培养基中,37 ℃摇菌至OD600 nm=0.6时,加入IPTG至终浓度1 mmol·L-1,37 ℃诱导4 h后离心收集菌体。
1.2.5SDS-PAGE凝胶电泳以及可溶性分析取10 mL菌液超声破碎后13 000×g离心10 min,分别取诱导后的标签蛋白质、全菌蛋白质、全菌超声(40%功率;超声2 s,暂停2 s;总时间10 min)后沉淀以及上清进行SDS-PAGE凝胶电泳,验证目的蛋白质大小以及表达形式。
1.2.6目的蛋白质的纯化按照GE蛋白纯化试剂盒(HisTrap FF crude)纯化包涵体形式蛋白质的说明分别配制Binding Buffer(含20 mmol·L-1咪唑的20 mmol·L-1磷酸盐缓冲液)与含8 mol·L-1尿素的Binding Buffer,含8 mol·L-1尿素的Elution Buffer(含500 mmol·L-1咪唑的20 mmol·L-1磷酸盐溶液)并分别调pH至7.4。用配制好的Binding Buffer将菌体沉淀重悬后进行超声裂解,裂解产物于4 ℃离心机13 000×g离心30 min后弃去上清。用含8 mol·L-1尿素的Binding Buffer将沉淀重悬后冰浴4 h至沉淀完全溶解,使用0.45 μm滤器对蛋白质溶液进行过滤,过滤液按照上述试剂盒说明书纯化目的蛋白质。
1.2.7表达蛋白质的鉴定
1.2.7.1串联质谱(MS/MS)分析:为了对重组蛋白质进行鉴定,将纯化后的重组蛋白质进行12% SDS-PAGE凝胶电泳,考马斯亮蓝染色后切下大小为57 ku的目的条带,送至上海启研生物科技有限公司进行MS/MS鉴定,MS/MS数据采用默认校准。得到的数据通过软件GPS(V3.6)采用MASCOT(V2.3)进行检索。搜索参数如下:数据库为人蛋白质库、胰酶酶切,一个漏切位点,一级质谱的容差为100 ppm,二级质谱的容差为0.6 Da。经过数据库检索后,蛋白质得分大于56分被认为胶内蛋白质与理论序列有可信的匹配(P<0.05)。
1.2.7.2Western blot鉴定:分别取诱导后的标签蛋白质、纯化后的目的蛋白质、诱导后的重组菌超声后裂解物进行SDS-PAGE电泳后,使用伯乐蛋白质转印系统将凝胶上的蛋白质转印至PVDF膜,用5%脱脂奶粉(PBST配制)对PVDF膜进行4 ℃过夜封闭,加入1∶100稀释的牛副结核阳性血清,37 ℃孵育1 h;PBST洗膜3次,每次10 min,加入1∶10 000稀释的HRP标记的兔抗牛单克隆抗体,37 ℃孵育1 h;PBST洗膜3次,每次10 min,按照Vector VIP试剂盒说明书配制显色液后将PVDF膜显色5 min。
1.2.8间接ELISA方法的建立
1.2.8.1使用棋盘法确定最佳抗原包被条件以及最佳血清稀释度:将纯化定量后的抗原按照200、100、50、25 ng·mL-1四个稀释度进行稀释后加入酶标板,每孔100 μL,4 ℃包被过夜后PBST洗板三次;每孔加入100 μL含5%脱脂奶粉的PBST 4 ℃过夜封闭后使用。将阴阳性血清按照1∶25、1∶50、1∶100、1∶200四个稀释度进行稀释后加入酶标板中,每孔100 μL,37 ℃作用30 min,PBST洗板三次;每孔加入100 μL 1∶10 000稀释的HRP标记的兔抗牛IgG酶标抗体,37 ℃作用30 min,洗板后每孔加入100 μL TMB显色液室温避光显色15 min,每孔加入50 μL 1 mol·L-1HCl终止反应,测定OD450 nm数值,以阳性血清与阴性血清的最适OD450 nm比值(P/N)所对应的抗原包被浓度与血清稀释度作为最佳浓度。
1.2.8.2最佳封闭条件的确立:确定最佳抗原包被浓度与血清稀释度后,分别使用含5%脱脂奶粉、5%马血清、5%明胶的PBST溶液作为封闭液,进一步优化该ELISA方法,以背景值最低时的封闭液作为最佳封闭液。
1.2.8.3最佳酶标抗体浓度的确立:按照优化后的上述ELISA条件,将HRP标记的兔抗牛酶标抗体分别进行1∶2 500、1∶5 000、1∶10 000、1∶20 000稀释后进行ELISA反应,选择P/N值最大时的酶标抗体稀释度作为最适工作浓度。
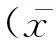
1.2.8.5特异性试验:按照优化后的ELISA方法,取实验室保存的牛副结核阳性血清、牛结核阳性血清、牛布病阳性血清、卡介苗免疫牛血清、牛大肠杆菌阳性血清、牛阴性血清进行检测以验证该方法的特异性。
1.2.8.6敏感性试验:将阳性对照血清进行2倍梯度稀释,使用建立的ELISA方法对稀释后阳性对照血清进行检测,确定阳性对照血清的最高稀释度。
1.2.8.7符合性试验:按照建立的ELISA方法对200份山东省奶牛中心提供的牛血清、100份本实验室保存的牛血清进行检测,将检测结果与IDEXX副结核ELISA试剂盒检测结果进行比对,计算二者符合率。
2结果
2.1质粒鉴定
重组质粒经EcoRⅠ和XhoⅠ双酶切,电泳可见有两条符合预期大小的条带(图1),质粒送公司测序后将结果与NCBI上提供的MAP0862序列进行比对,符合率为100%,表明成功构建了MAP0862重组质粒,标注为pET-MAP0862。
2.2重组蛋白质表达、纯化、鉴定
分别取含有pET32a(+)质粒的大肠杆菌BL21菌体裂解物、纯化后的目的蛋白质与经IPTG诱导后的重组菌菌体裂解物进行SDS-PAGE凝胶电泳,可见纯化后的目的蛋白质与重组菌裂解物均在约57ku处出现目的大小条带(图2)。将目的条带切下经过质谱分析后,将质谱得到的数据提交到数据库进行检索,采用MASCOT算法进行打分,蛋白质最高得分为275,超过得分阈值,表示胶内蛋白质鉴定成功。经过检索,条带内的蛋白质为副结核特异性蛋白MAP0862 (图3) 。
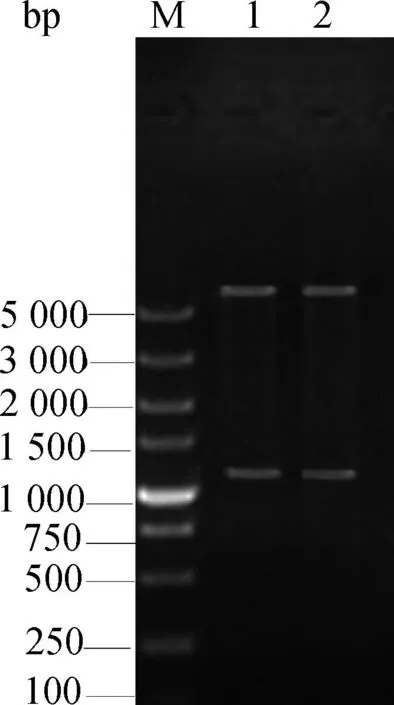
M.DNA相对分子质量标准;1、2.经EcoRⅠ和XhoⅠ双酶切后的重组质粒M.DNA molecular weight marker;1,2.Identification of recombinant plasmid by restriction digestion图1 重组表达质粒pET-MAP0862酶切鉴定Fig.1 Restriction enzyme analysis for the recombinant plasmid pET-MAP0862
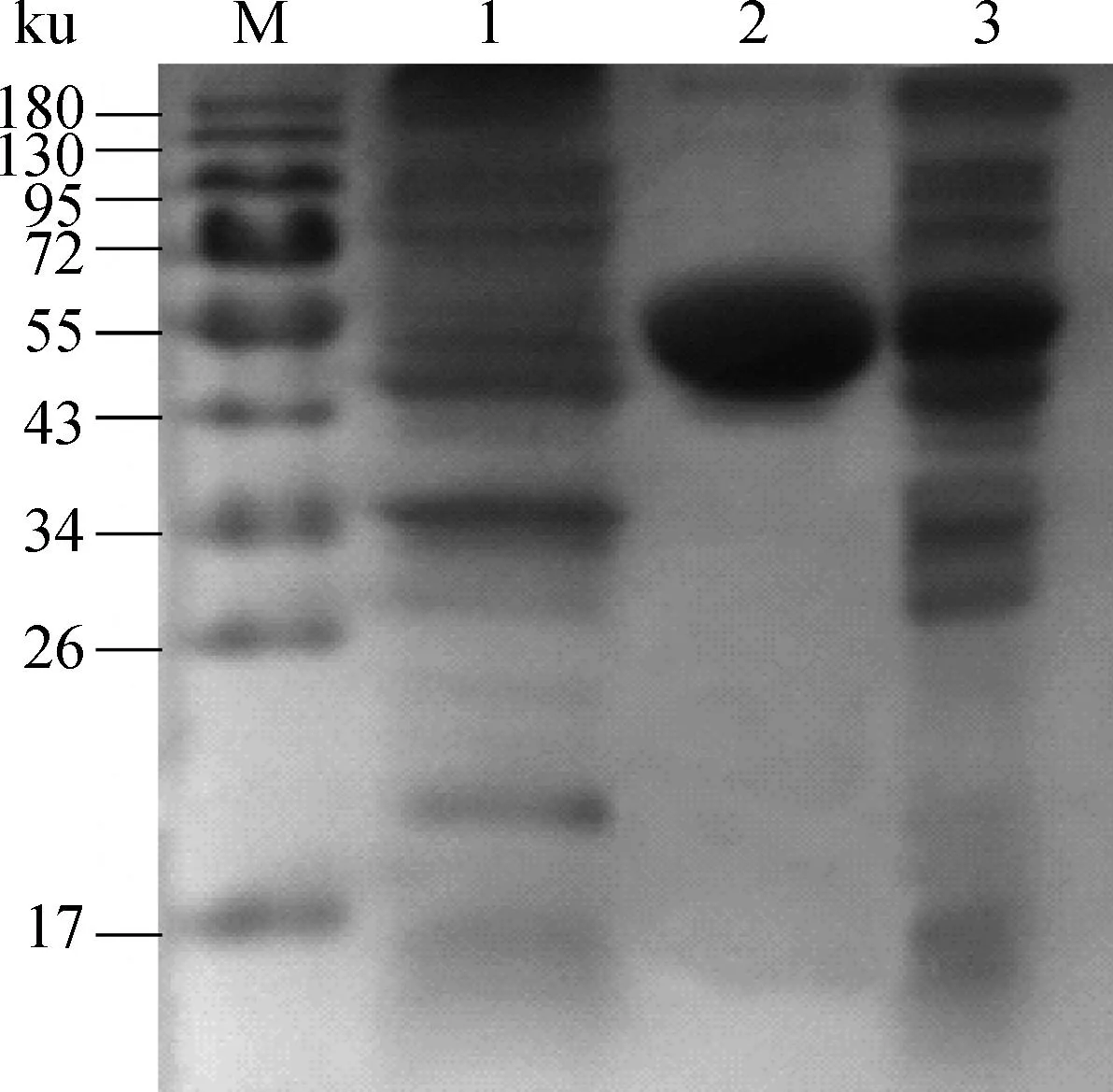
M.蛋白质相对分子质量标准;1:含pET32a(+)质粒的大肠杆菌BL21菌体裂解物;2.纯化后的MAP0862蛋白;3.含pET-MAP0862质粒重组菌超声裂解物M.Protein molecular weight marker;1.Bacteria cracking content of E.coil BL21 with pET-32a;2.Purified recombinant MAP0862;3.Bacteria cracking content of E.coil BL21 with pET-MAP0862图2 重组蛋白质的SDS-PAGE分析Fig.2 SDS-PAGE analysis for the recombinant pET-MAP0862
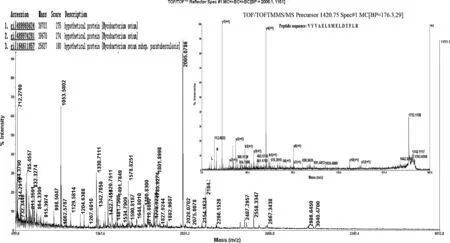
图3 重组蛋白质MAP0862的MS/MS鉴定Fig.3 The tandem mass spectrometry (MS/MS) analysis of MAP0862
2.3Western blot 鉴定
纯化的重组蛋白经SDS-PAGE电泳后转印到PVDF膜上进行Western blot分析,结果在预期的57 ku处出现杂交条带(图4)。
2.4ELISA方法的建立
2.4.1优化后的ELISA条件采用方阵试验确定最佳抗原包被浓度与血清稀释度,分别对三种不同的封闭液对该ELISA方法的背景值影响进行比较,对酶标抗体的最佳稀释度进行确立,同时在此基础上对该ELISA的其他条件进行确立,各优化后的结果见表1。
2.4.2阴阳性血清临界值的确立取实验室保存的58份牛副结核阴性血清使用该ELISA方法测定OD450 nm数值,经计算平均值与s分别为0.224与0.055,即ELISA方法的临界值确定为0.389,当样品OD450 nm数值大于0.389时判定为阳性,小于0.389时判定为阴性。
2.4.3特异性试验结果采用该ELISA方法对实验室保存的不同血清检测结果进行检测,牛结核阳性血清、布病阳性牛血清、卡介苗免疫牛、牛大肠杆菌感染阳性血清的OD450 nm数值均小于临界值,牛副结核阳性血清均检测为阳性,表明该ELISA方法包被的MAP0862蛋白与其他血清均无明显交叉反应,该方法有较好的特异性。
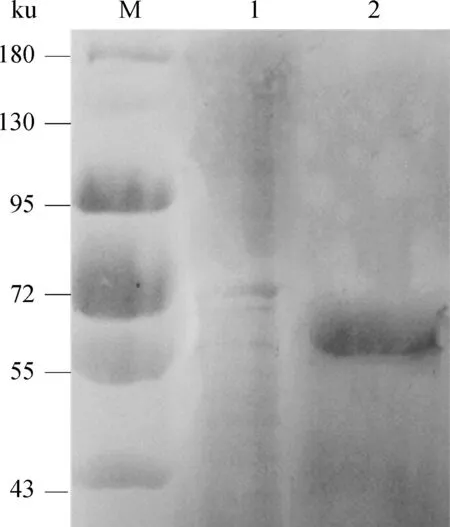
M.蛋白质相对分子质量标准;1.含pET32a(+)质粒的大肠杆菌BL21菌体裂解物;2.纯化后的重组蛋白质M.Protein molecular weight marker;1.Bacteria cracking content of E.coil BL21 with pET32a(+);2.Purified recombinant MAP0862图4 重组蛋白质MAP0862的Western blot分析Fig.4 Western blot analysis of the expressed protein of MAP0862
表1间接ELISA方法的优化结果
Table 1The optimized conditions of the indirect ELISA

重组蛋白质包被条件Coatingwithrecombinantprotein封闭条件Blockingcondition待检血清Sample酶标抗体Enzyme-labelledantibody最佳稀释条件Optimizeddilutionconditon25ng·mL-15%明胶的PBST溶液1∶1001∶10000作用条件Reactioncondition4℃过夜4℃过夜37℃30min37℃30min
2.4.4敏感性试验用建立的ELISA方法对2倍梯度稀释的阳性对照血清进行检测,结果阳性血清稀释32倍后使用优化后的ELISA方法仍能判定为阳性(OD450 nm数值大于临界值0.389),即阳性血清稀释3 200倍后仍能判定为阳性(图5)。
2.4.5符合性试验使用该ELISA方法对于300份牛血清进行检测(结果见表2),经计算二者总符合率为94.3%,阳性符合率为64.5%,阴性符合率为97.7%。
3讨论
副结核分枝杆菌(MAP)是主要引起反刍动物副结核病的病原体,除了感染反刍动物之外,MAP也能感染包括鸟类、兔、狐狸、獾等在内的一些野生动物[6],目前该病在全世界流行,给畜牧业带来了巨大损失[7]。副结核流行病学调查发现,我国奶牛副结核病阳性率与牛场管理水平相关,比较高的牛场基本能达到15%左右[8],与本试验室调查结果基本一致。汪天杰等最近对从澳大利亚出口到我国的6 810头种羊进行副结核检测,结果阳性率为1.53%[9],提示即便是动物疫病控制得比较好的国家,副结核病发生也是比较普遍的。
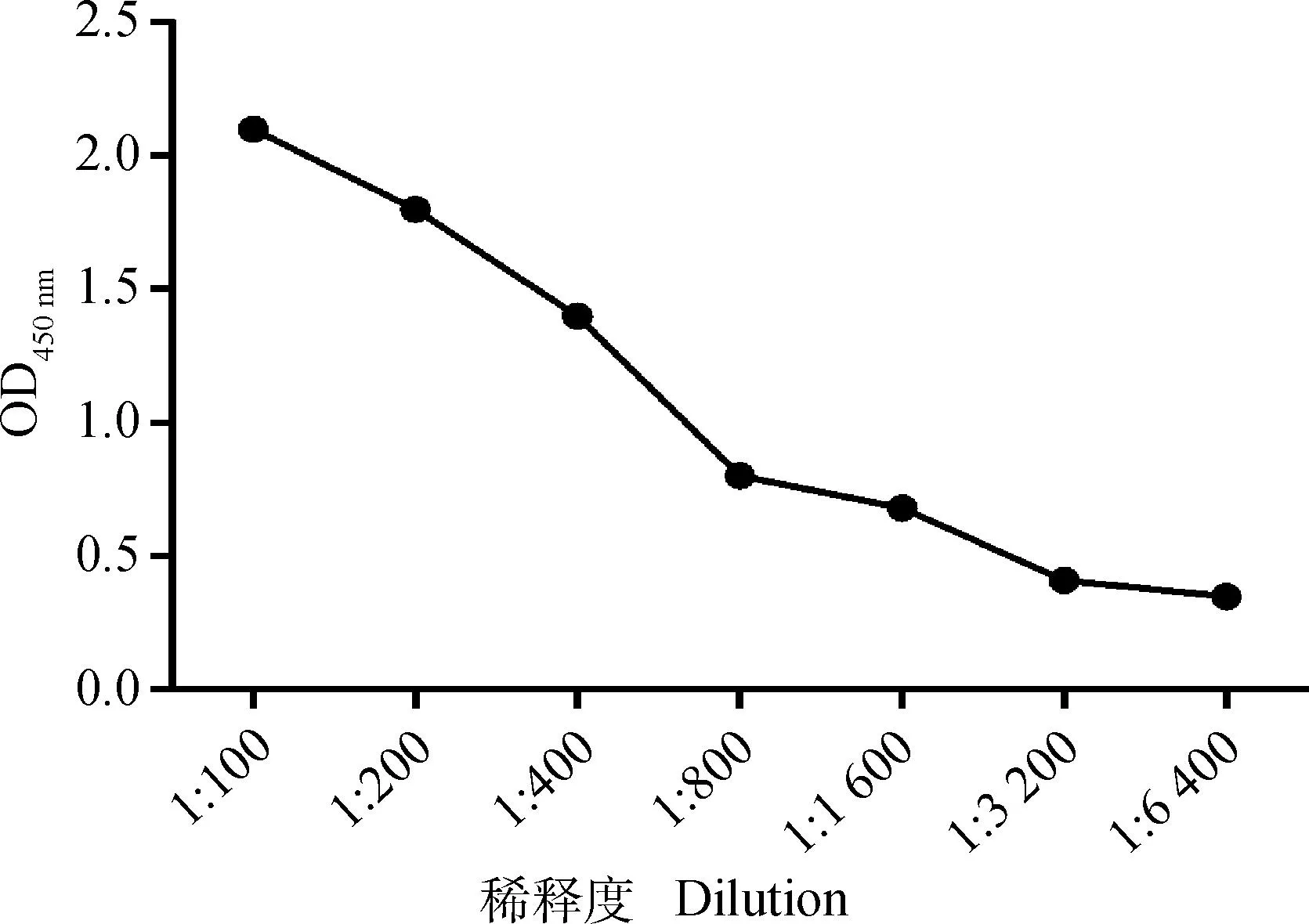
图5 敏感性试验结果Fig.5 Result of sensitivity test
表2MAP0862间接ELISA方法与IDEXX牛副结核检测试剂盒符合率
Table 2The coincidence rate of MAP0862 i-ELISA and IDEXX MAP ELISA kit

IDEXX牛副结核检测试剂盒IDEXXMAPELISAkitPN合计TotalP201131间接ELISAi-ELISAN6263269合计Total26274300
副结核病的诊断方法除了经典的皮肤变态反应外,还有补体结合试验、细菌分离培养、酶联免疫吸附试验等[10]。副结核的分离培养比较困难,需要在培养基中添加提取的草分枝杆菌素作为辅助培养物[11],但即便如此,初代分离副结核也相当困难需要较长的周期。目前使用的基于核酸检测的PCR或荧光定量PCR方法[12]对副结核病原的诊断由于操作复杂很难在生产中得到普及同时会出现假阳性现象。1978年首次采用酶联免疫吸附试验(ELISA)来诊断牛副结核病[13],该方法是目前检测副结核病抗体的最简便方法,其操作方法简单适合在生产中普及。目前已有商品化的进口副结核ELISA检测试剂盒,但是价格较高,很难在生产中得到大规模应用。
本研究中,选取副结核特异性蛋白质MAP0862进行原核表达并进一步纯化定量后作为ELISA包被抗原。重组蛋白质主要以包涵体形式表达,通过对包涵体复性、纯化获得了具有生物活性的重组蛋白质。Western blot鉴定结果表明,牛副结核阳性血清与MAP0862重组蛋白在57 ku处出现特异性反应条带,表明MAP0862蛋白具有良好的反应原性。Western blot结果中仍可见微弱的非特异性杂交带,原因可能是纯化蛋白质中仍掺杂有微量宿主菌蛋白质,与血清中含的大肠杆菌抗体反应所致。研究同时发现,副结核阴性对照血清与牛大肠杆菌感染阳性血清也显示了较高的背景值(OD450 nm约0.2),这可能是由于检测牛血清中存在对His标签的非特异性吸附的抗体,另一方面纯化蛋白质中仍有少量宿主菌(E.coliBL21)蛋白质的残留。
本研究中使用的牛副结核阳性对照血清来源于人工感染副结核牛,对感染牛进行的皮肤变态反应检测、γ-IFN释放试验以及使用IDEXX副结核ELISA试剂盒对血清进行的抗体检测同时判定为副结核阳性;特异性试验中使用的牛副结核阳性血清来自临床分离,对感染牛进行的γ-IFN释放试验以及使用IDEXX副结核ELISA试剂盒对血清的检测均判定为副结核阳性;牛布病阳性血清经试管凝集试验与商品化ELISA试剂盒检测均判定为阳性;牛结核阳性血清和卡介苗免疫牛血清为本实验室人工感染动物制备,并经皮试试验和IFN-γ释放试验验证;牛大肠杆菌阳性血清来自临床分离鉴定并由本实验室保存。用初步建立的MAP0862间接ELISA方法对上述已知背景的样本进行检测,结果表明该方法具有较好的特异性,能有效地区分牛副结核阳性血清与其他干扰血清。对300份临床血清的检测结果与国外进口试剂盒检测结果比较表明二者的总符合率为94.3%,试验结果中存在着阳性符合率低的缺点,分析可能原因一是其中阳性样本较少导致阳性符合率较低,后期需要进一步增加副结核阳性样本以对该方法进行进一步评价。二是牛感染副结核后不同时期MAP0862蛋白表达量不同,导致牛血清中针对该蛋白质的特异性抗体含量不同,对于蛋白质表达量较低时期应用该方法可能不能有效的检测出抗体存在。目前已有的副结核检测方法,并没有一种方法能将感染副结核后不同时期的血清都判定为阳性。针对副结核的检测需要联合使用多种检测方法,同时对于可疑牛场进行连续监测以确定牛场是否存在副结核感染。
4结论
通过原核表达获得副结核特异性蛋白MAP0862,纯化并定量后作为包被抗原,经过一系列条件优化后初步建立了针对副结核的间接ELISA方法。该方法能有效地鉴别副结核阳性血清以及其他干扰血清,使用该方法对临床血清进行检测的结果表明该方法与IDEXX副结核检测试剂盒的符合率为94.3%。基于副结核特异性蛋白MAP0862建立的间接ELISA诊断方法能有效检测牛副结核病。
参考文献(References):
[1]NIELSEN S S,TOFT N.A review of prevalences of paratuberculosis in farmed animals in Europe[J].PrevVetMed,2009,88(1):1-14.
[2]牟巍,蒋菲,何宇,等.副结核分枝杆菌map0862基因的克隆及其在大肠杆菌中的表达[J].中国兽药杂志,2010,44(8):10-12,21.
MU W,JIANG F,HE Y,et al.Cloning and expression ofMycobacteriumaviumsubsp.Paratuberculosisgenemap0862 inE.coli[J].ChineseJournalofVeterinaryDrug,2010,44(8):10-12,21.(in Chinese)
[3]刘思国,王春来,宫强,等.牛分枝杆菌特异性 PCR 检测方法的建立及初步应用[J].中国预防兽医学报,2006,28(1):80-83.
LIU S G,WANG C L,GONG Q,et al.The development and preliminary application of specificity detection of Mycobacterium bovis by PCR based on the gene pncA[J].ChineseJournalofPreventiveVeterinaryMedicine,2006,28(1):80-83.(in Chinese)
[4]王素华,王忠才,李孝军,等.牛副结核分枝杆菌实时荧光定量 PCR 检测方法的建立[J].中国畜牧兽医,2012,39(10):22-26.
WANG S H,WANG Z C,LI X J,et al.Development of Real-time fluorescence quantitative PCR assay for detection of bovineMycobacteriumparatuberculosis[J].ChinaAnimalHusbandry&VeterinaryMedicine,2012,39(10):22-26.(in Chinese)
[5]MANNING E J,COLLINS M T.Mycobacterium avium subsp.paratuberculosis:pathogen,pathogenesis and diagnosis[J].RevSciTech,2001,20(1):133-150.[6]BEARD P M,DANIELS M J,HENDERSON D,et al.Paratuberculosis infection of nonruminant wildlife in Scotland[J].JClinMicrobiol,2001,39(4):1517-1521.[7]DE LISLE G W,YATES G F,MONTGOMERY H.The emergence of Mycobacterium paratuberculosis in farmed deer in New Zealand — a review of 619 cases[J].NZVetJ,2003,51(2):58-62.
[8]谭春萍,张艳雯,黄福标,等.广西部分地区牛病毒性腹泻病毒和副结核分枝杆菌流行情况调查[J].黑龙江畜牧兽医,2015(1):69-70.
TAN C P,ZHANG Y W,HUANG F B,et al.Epidemiological investigation of bovine viral diarrhoea and bovine paratuberculosis in Guang xi province[J].HeilongjiangAnimalScienceandVeterinaryMedicine,2015(1):69-70.(in Chinese)
[9]汪天杰,刘永松,韦兵.澳大利亚进境种羊副结核感染情况调查[J].中国动物检疫,2015,32(2):32-33,85.WANG T J,LIU Y S,WEI B.Survey and analysis on paratuberculosis prevalence in the imported breeding sheep herd from Australia[J].ChinaAnimalHealthInspection,2015,32(2):32-33,85.(in Chinese)
[10]孔繁德,徐淑菲,王景明,等.副结核分枝杆菌诊断技术的研究进展[J].检验检疫科学,2004,14(增刊):57-60.
KONG F D,XU S F,WANG J M,et al.Development of diagnostic techniques of Mycobacterium paratuberculosis[J].InspectionandQuarantineScience,2004,14(Suppl):57-60.(in Chinese)
[11]陈茹,毕英佐,刘志玲,等.四种重要致病性分枝杆菌 DHPLC 检测鉴别方法的建立[J].中国人兽共患病学报,2010,26(1):41-45,52.
CHEN R,BI Y Z,LIU Z L,et al.Establishment of the denaturing high-performance liquid chromatography combined with multiplex nucleic acid amplification method for rapid identification of four important pathogenic mycobacteria[J].ChineseJournalofZoonoses,2010,26(1):41-45,52.(in Chinese)
[12]王春雨,杨莉,刘金华,等.应用TaqMan 荧光定量 PCR 快速检测鹿血中副结核分枝杆菌[J].中国预防兽医学报,2011,33(3):208-210.
WANG C Y,YANG L,LIU J H,et al.TaqMan PCR-based methods for rapid detection ofMycobacteriumaviumsubsp.paratuberculosisin deer blood[J].ChineseJournalPreventiveVeterinaryMedicine,2011,33(3):208-210.(in Chinese)
[13]MILNER A R,LEPPER A W,SYMONDS W N,et al.Analysis by ELISA and Western blotting of antibody reactivities in cattle infected withMycobacteriumparatuberculosisafter absorption of serum with M phlei[J].ResVetSci,1987,42(2):140-144.
(编辑白永平)
Expression of Mycobacterium avium subsp. paratuberculosis MAP0862 and Its Primary Application in Indirect ELISA
ZHANG Zhen1,2,FENG Yu1,ZHANG Ge2,ZHU Liang-quan2,JIANG Hui2,DING Jia-bo2*,ZHAO Peng1,CHANG Wei-shan1*
(1.CollegeofAnimalScienceandVeterinaryMedicine,ShandongAgriculturalUniversity,Tai’an271018,China;2.ChinaInstituteofVeterinaryDrugControl,Beijing100081,China)
Abstract:The objective of the present study was to explore the effect of MAP0862 in sero-diagnosis of Bovine paratuberculosis,and establish a specific ELISA method based on MAP0862.The specific protein obtained by prokaryotic expression was used as coating antigen after purification and quantification,an indirect ELISA was primary established after a series of optimization.The specificity of this method was verified by MAP antiserum,Brucellaantiserum,Bovine tuberculosis (TB) antiserum,BCG antiserum,Escherichiacoliantiserum and negative serum.The detection results of 300 serums showed that the coincidence rate of MAP0862 indiret ELISA with commercial kit was 94.3%.The result indicated that the indirect ELISA method primary established based on MAP0862 can detect Bovine paratuberculosis effectively.
Key words:Bovine paratuberculosis;MAP0862;ELISA
doi:10.11843/j.issn.0366-6964.2016.04.019
收稿日期:2015-07-27
基金项目:现代农业人才支撑计划;北京市科技新星(xx2013099)
作者简介:张振(1990-),男,山东济南人,硕士生,主要从事重要人畜共患病诊断技术和新型疫苗研究,E-mail:sdauzz@163.com *通信作者:常维山,E-mail:wschang@sdau.edu.cn;丁家波,E-mail:dingjiabo@126.com
中图分类号:S855.12
文献标志码:A
文章编号:0366-6964(2016)04-0789-07
