急性痛风性关节炎患者治疗前后外周血单核细胞NLRP3炎性体mRNA表达及血清IL-18水平的研究
2016-07-11丁焕发徐晓辰王尚云刘淑娟兰立强韦涌涛
丁焕发* 徐晓辰王尚云刘淑娟兰立强韦涌涛
(1 青岛市第八人民医院内分泌科,山东 青岛 266100;2 青岛市第八人民医院检验科,山东 青岛 266100)
急性痛风性关节炎患者治疗前后外周血单核细胞NLRP3炎性体mRNA表达及血清IL-18水平的研究
丁焕发1* 徐晓辰1王尚云2刘淑娟1兰立强1韦涌涛2
(1 青岛市第八人民医院内分泌科,山东 青岛 266100;2 青岛市第八人民医院检验科,山东 青岛 266100)
目的 检测急性痛风性关节炎(acute gouty arthritis,AGA)患者治疗前后外周血单核细胞(peripheral blood monocytes,PBMCs)中NLRP3炎性体[NLRP3、凋亡相关斑点样蛋白(ASC)、半胱天冬酶-1(caspase-1)]mRNA表达水平及血清白细胞介素(IL)-18水平的变化,探讨该炎性体及IL-18在AGA发病中可能的作用机制。方法 用RT-PCR法检测100名健康查体者(对照组,C)和100例AGA患者(观察组,T)治疗前(D0)及应用药物治疗后第3天(D3)、第7天(D7)、第14(D14)天NLRP3炎性体mRNA表达水平,同时用ELISA法测定相应IL-18水平。观察组与对照组比较采用独立样本t检验,一般生理指标及血生化指标用独立样本t检验,计数资料采用χ2检验。计量资料用(±s)表示。采用IBM SPSS 19.0软件包对所有数据进行统计学分析。结果 观察组NLRP3 mRNA表达水平D0、D3及D7vs C显著升高,差异有统计学意义(P<0.01),D14 vs C差异无统计学意义(P>0.05);观察组各阶段ASC mRNA表达水平与对照组相比显著升高,差异均有统计学意义,其中D0、D3及D7 vs C(P<0.01)、D14 vs C(P<0.05);观察组caspase-1 mRNA表达水平,D0及D3 vs C显著升高,差异有统计学意义(P<0.01),D7及D14 vs C差异无统计学意义(P>0.05)。观察组D0、D3、D7、D14血清IL-18水平与对照组相比显著升高,差异有统计学意义(均为P<0.01)。结论 NLRP3炎性体及IL-18在AGA患者治疗过程中水平异常,提示它们在AGA发病中参与了炎性反应过程,在炎症机制中可能发挥了重要作用。
凋亡相关斑点样蛋白;半胱天冬酶-1;NLRP3;炎性体;痛风性关节炎
随着社会的发展,人们的生活水平、饮食结构及社交行为方式发生了很大的改变,同时人类寿命也在延长,痛风的患病率逐年上升,急性痛风性关节炎(acute gouty arthritis,AGA)患病率随年龄的增长有逐渐增高的趋势,且常伴有糖尿病、肥胖、心脑血管病、肾脏病等,发病高峰年龄为40岁左右,临床上以男性患者多见,女性约占5%[1],且多为绝经期后妇女。近年来研究发现单核/巨噬细胞系统在急性痛风性关节炎启动、进展及缓解中均发挥了关键作用,其中IL-1β是单钠尿酸盐(monosodium urate,MSU ) 晶体诱导炎症的关键因子,NLRP3炎性体通过促进IL-1β的生成在AGA发作中发挥不可替代的作用[2],其介导的炎性因子的活化不仅涉及IL-1β,还包括IL-18。在AGA患者,血IL-18可能来源于软骨和滑膜细胞以及内皮细胞,在炎性反应中发挥重要作用。本研究即对此进行研究、探讨,以期发现NLRP3炎性体及IL-18在AGA启动、进展及缓解的各个阶段的表达水平及意义,指导AGA的早期防治及优化治疗方案。
1 对象与方法
1.1 研究对象。观察组(T):随机选取符合以下诊断标准和剔除标准的患者100例(男95例,女5例),年龄(47.25±10.99)岁,全部来自本院2014年8月至2016年2月的门诊患者。①急性痛风性关节炎诊断标准:应用美国风湿病协会(ACR)1997年制定的诊断标准。②入选和剔除标准:a.符合ACR诊断标准的急性原发性痛风性关节炎。b.排除心血管、肾脏、血液疾病、肿瘤疾病引起的继发性痛风。c.排除合并感染性疾病患者。d.排除自身免疫性疾病及全身系统疾病患者。e.年龄18~75岁。f.一般情况良好。g.未服用降尿酸药物治疗者。对照组(C):随机选取青岛本地居民健康查体者100例(男95例,女5例),年龄(46.15±11.80)岁,排除高尿酸血症患者。高尿酸血症的诊断标准:是指正常嘌呤饮食状态下,非同日2次空腹血清尿酸水平(37 ℃)男性>420 μmol/L ,绝经前女性>360 μmol/L,绝经后女性的诊断标准同男性。
1.2 治疗方案:在低嘌呤饮食、足量饮水前提下,AGA药物治疗方案:①镇痛:为主要治疗措施。秋水仙碱片,服药疗程14 d:前3 d 0.5毫克/次,3次/天,餐后服;然后0.5毫克/次,2次/天,餐后服,连续用药7 d;后4 d 0.5毫克/次,1次/晚,睡前服。依托考昔片,服药疗程10 d:前3 d 120毫克/次,1次/天,餐后服;3 d后60毫克/次,1 次/天,餐后服,连续用药7 d。②碱化尿液:抑制尿酸在肾脏形成晶体,促进尿酸肾脏排泄。尿pH值维持在6.2~6.8。给予口服枸橼酸钾钠颗粒(逍适柠)2.5克/次,4次/天(三餐后及睡前)。治疗过程中若出现肝、肾功能异常及胃肠道反应则予以排除。
1.3 观测指标:①测定两组的一般生理指标:年龄(Age)、身高(BH)、体质量(BW)、收缩压/舒张压(SBP/DBP)、腰围(WC)、臀围(HC)。计算腰臀比(WHR)及体质量指数(BMI)。BMI=体质量(kg)/身高(m)2。②测定两组的空腹血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、尿酸(UA)、空腹血糖(FPG)、三酰甘油(TG)、总胆固醇(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、C-反应蛋白(CRP)、肌酐(Cr)、尿素氮(BUN)。测定两组全血白细胞总数(WBC)、中性粒细胞数(NEUT)、中性粒细胞百分比(NEUT%)。③测定观察组治疗前(第0天,D0)及治疗后第3天(D3)、第7天(D7)、第14天(D14)PBMCs中NLRP3 mRNA、ASC mRNA及 caspase-1 mRNA。测定相应时间点的空腹血清IL-18水平。同时测定对照组上述指标,与观察组治疗前指标进行比较研究。
1.4 主要检测方法:所有入选者由专人进行一般生理指标测量并记录。实验中血清ALT、AST、UA、FPG、TG、TC、LDL-C、HDL-C、CRP、 Cr、BUN的检测用全自动生化分析仪,IL-18的检测采用ELISA试剂盒。PBMCs中NLRP3、ASC及 caspase-1 mRNA采用RT-PCR检测。血分析采用SYSMEX XT-2000i全自动血液分析仪检测。
1.5 统计学处理:观察组与对照组NLRP3炎性体mRNA比较采用独立样本t检验,一般生理指标、血生化指标及全血分析白细胞数等用独立样本t检验,计数资料采用χ2检验。计量资料用 (±s)表示。采用IBM SPSS 19.0软件包对所有数据进行统计学分析,以P<0.05为有统计学差异。
2 结 果
2.1 一般临床资料及实验室检查指标比较:观察组与对照组比较,两组性别、Age、AST差异均无统计学意义(P>0.05);与对照组相比,观察组BH、BW、BMI、SBP、DBP 、WC、HC、WHR、FPG、UA、ALT、Cr、BUN、TG、TC、LDL-C、HDL-C、C-RP、WBC、NEUT、NEUT%均明显升高,差异有统计学意义(P<0.05~0.01),见表1。
表1 两组一般资料及实验室检查指标水平(±s)

表1 两组一般资料及实验室检查指标水平(±s)
注:*观察组与对照组相比(T vs C)P<0.01,#观察组与对照组相比(T vs C)P<0.05
项目 组别观察组(T) 对照组(C)性别(Sex,Male/Female) 95/5 95/5年龄(Age,Year) 47.25±10.99 46.15±11.80身高(BH,cm) 171.97±5.61* 162.82±6.34体质量(BW,kg) 79.76±11.01* 65.08±9.71体质量指数(BMI,kg/m2) 26.87±3.54* 24.48±2.87收缩压(SBP,mm Hg) 138.96±14.90* 132.61±16.74舒张压(DBP,mm Hg) 88.24±11.22* 83.65±8.95腰围(WC,cm) 96.77±8.29* 87.10±8.90臀围(HC,cm) 104.74±6.56* 101.11±7.65腰臀比(WHR) 0.92±0.05* 0.86±0.05空腹血糖(FPG,mmol/L) 6.48±1.49* 5.99±0.98尿酸(UA,μmol/L) 432.21±127.56* 275.93±69.47丙氨酸转氨酶(ALT,U/L) 29.40±19.37* 20.05±13.18天冬氨酸转氨酶(AST,U/L) 20.72±9.62 19.79±7.27血肌酐(Cr,μmol/L) 83.37±28.59* 61.78±13.35尿素氮(BUN,mmol/L) 5.97±2.36* 4.50±0.87三酰甘油(TG,mmol/L) 2.56±2.19* 1.46±0.85总胆固醇(TC,mmol/L) 5.91±1.35* 5.21±1.17低密度脂蛋白胆固醇(LDL-C,mmol/L) 3.72±0.97* 3.06±0.96高密度脂蛋白胆固醇(HDL-C,mmol/L) 1.31±0.21* 1.45±0.28 C-反应蛋白(CRP,mg/L) 7.36±3.66* 3.55±0.84白细胞总数(WBC,×109/L) 8.80±1.45* 6.24±1.01中性粒细胞(NEUT,×109/L) 7.40±1.57* 4.41±0.93中性粒细胞百分比(NEUT%) 0.84±0.10* 0.70±0.07
2.2 两组NLRP3 mRNA表达水平比较:观察组NLRP3 mRNA表达水平D0、D3及D7vs C显著升高,差异有统计学意义(P<0.01),D14 vs C差异无统计学意义(P>0.05);观察组各阶段ASC mRNA表达水平与对照组相比显著升高,差异均有统计学意义,其中D0、D3及D7 vs C(P<0.01)、D14 vs C(P<0.05);观察组caspase-1 mRNA表达水平,D0及D3vs C显著升高,差异有统计学意义(P<0.01),D7及D14 vs C差异无统计学意义(P>0.05)。见表2。
2.3 两组IL-18水平比较:观察组D0、D3、D7、D14血清IL-18水平与对照组相比显著升高,差异有统计学意义(均为P<0.01)。见表3。
3 讨 论
痛风(Gout)是因嘌呤代谢障碍和(或)尿酸排泄减少、血UA持续升高而导致MSU 晶体析出并沉积于组织或器官引起的一组临床症候群,属于代谢性风湿病[3]。报道显示,国内痛风的患病率目前在1%~3%,2009年山东沿海地区当地居民痛风患病率为1.96%,2007年~2008年美国痛风患病率上升至3.9%[4]。AGA可发生于任何年龄,发病高峰年龄为40岁左右,且常伴有糖尿病、肥胖、心脑血管病、肾脏病等,患病率随年龄的增长有逐渐增高的趋势。本研究中,与对照组相比,观察组BH、BW、BMI、SBP、DBP 、WC、HC、WHR、FPG、UA、ALT、Cr、BUN、TG、TC、LDL-C、HDL-C均明显升高(P<0.01)亦支持上述观点。AGA临床上以男性患者多见,女性约占5%[1],且多为绝经期后妇女。AGA发作时疼痛剧烈,患者异常痛苦,严重影响日常工作和生活。近年来研究发现单核/巨噬细胞系统在AGA启动、进展及缓解中均发挥了关键作用,发作涉及IL-1β、IL-6、IL-18、TNF-α等多种炎性因子,其中IL-1β是MSU晶体诱导炎症的关键因子,IL-18作为一个重要的调节因子,促进及加速炎性反应。
表2 两组NLRP3 mRNA表达水平(±s)
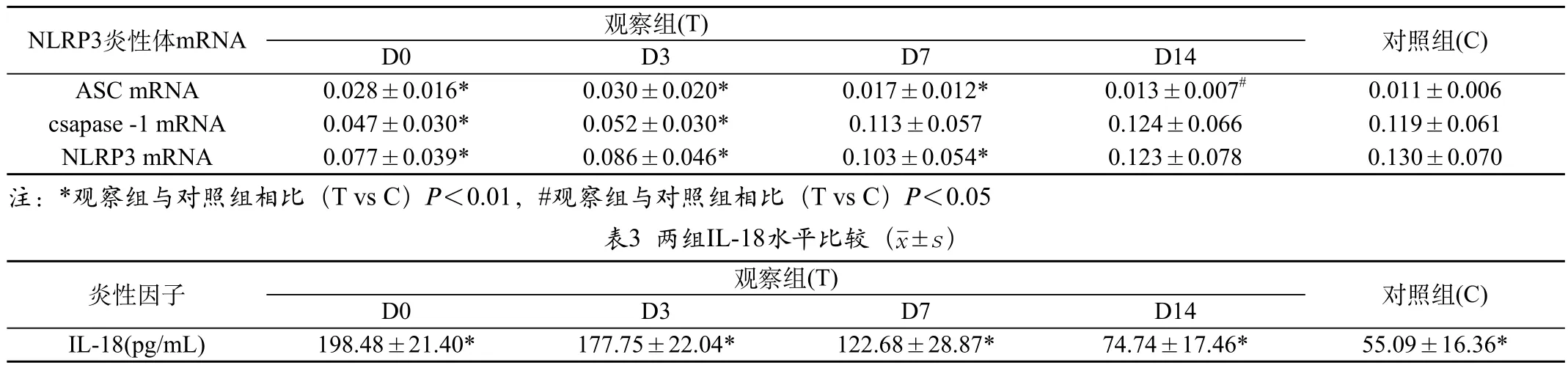
表2 两组NLRP3 mRNA表达水平(±s)
注:*观察组与对照组相比(T vs C)P<0.01,#观察组与对照组相比(T vs C)P<0.05
对照组(C)D0 D3 D7 D14 ASC mRNA 0.028±0.016* 0.030±0.020* 0.017±0.012* 0.013±0.007# 0.011±0.006 csapase -1 mRNA 0.047±0.030* 0.052±0.030* 0.113±0.057 0.124±0.066 0.119±0.061 NLRP3 mRNA 0.077±0.039* 0.086±0.046* 0.103±0.054* 0.123±0.078 0.130±0.070注:*观察组与对照组相比(T vs C)P<0.01,#观察组与对照组相比(T vs C)P<0.05 表3 两组IL-18水平比较(±s)NLRP3炎性体mRNA 观察组(T)对照组(C)D0 D3 D7 D14 IL-18(pg/mL) 198.48±21.40* 177.75±22.04* 122.68±28.87* 74.74±17.46* 55.09±16.36*炎性因子 观察组(T)
NLRP3炎性体,即Nod样受体蛋白3 (nod-like receptor protein 3,NLRP3)炎性体是位于细胞内的一种蛋白质复合体,主要功能为活化半胱氨酸天冬氨酸蛋白酶1(Caspase-1)以间接调控IL- lβ、IL-18[5]、和IL-33等的成熟和分泌,具有调控机体炎性反应的功能。NLRP3炎性体是由核苷酸结合寡聚化结构域样受体(nucleotide-binding oligomerization domain-like receptors,NLRs)家族成员NLRP3 (NLR family,pyrin domain containing 3)、凋亡相关斑点样蛋白(apoptosisassociated speck-like protein containing CARD,ASC)和半胱氨酸天冬氨酸蛋白酶1(cysteine-requiring aspartate protease-1,caspase-1)组成的复合体,是内源性或外源性危险信号的胞质内感受器,是活化caspase-1的分子平台,调控IL-lβ和IL-18等促炎细胞因子的成熟和分泌。IL-lβ是一个经典的促炎性细胞因子,活化的IL-lβ与靶细胞上的IL-1受体结合,激活IL-1信号通路和髓样分化因子(myeloid differentiation factor,MyD88)依赖的NF-κB通路,促进IL-1等促炎因子转录,诱导机体炎性反应。研究证实,IL-lβ是促进多种代谢性疾病发生发展的重要炎性因子,阻断其生物学效应能有效缓解代谢性疾病的进展。NLRP3是模式识别胞内受体Nod样受体蛋白家族的成员,广泛表达于树突细胞、单核细胞和巨噬细胞,具有识别病原体的功能。ASC是NLRP3炎性体的双重衔接蛋白,能够以某种桥梁的形式将NLRP3和caspase-1前体连接起来,最终形成具有酶活性的异二聚体caspase-1。caspase-1作为炎性体的效应蛋白,能够将无活性的IL-18和IL-1β前体剪切为成熟的IL-18和IL-1β,促进其成熟分泌。
目前研究认为,NLRP3炎性体是MSU 导致痛风的核心机制。Martinon等[6]研究显示,NLRP3介导MSU诱导痛风发生发展,其机制可能与MSU诱导K+外流有关,还可能与线粒体来源的活性氧(reactive oxygen species,ROS)释放有关,溶酶体破裂也可能是MSU激活NLRP3炎性小体的机制之一。本研究结果显示,AGA发病时及治疗后第3天,NLRP3 mRNA、ASC mRNA及caspase-1 mRNA表达水平均显著高于对照组(P<0.01),说明在炎症早期,NLRP3炎性体参与了疾病过程。治疗后第7天,患者NLRP3 mRNA、ASC mRNA表达水平仍高于对照组(P<0.01),caspase-1 mRNA表达水平与对照组无明显差异,提示在炎症持续存在期间,NLRP3炎性体持续参与炎症过程,随病程进行,炎症消退过程中,抑制炎症的调控因素可能逐渐出现。治疗第14天NLRP3 mRNA及caspase-1 mRNA表达水平与对照组无明显差异,ASC mRNA表达水平仍高于对照组(P<0.05),较前已明显降低,结果显示AGA炎症消退,趋于正常,ASC表达可能存在其他途径及意义。
AGA的前炎性介质来源于常驻的滑膜细胞和迁移的单核巨噬细胞,而NEUT的侵入和活化是最重要的环节。发病时关节滑液和滑膜中出现的大量NEUT甚至可与急性化脓性关节炎时相当[7]。本研究中,发病时的WBC、NEUT、NEUT%及CRP均显著高于对照组,提示AGA发病时WBC及NEUT在炎症初期就参与了反应。
IL-18是AGA炎性反应过程中的重要炎性因子,其可能主要来源于痛风性关节炎患者的软骨和滑膜细胞及内皮细胞[7]。IL-18发挥生物学效应的活性成分,由单核/巨噬细胞、树突状细胞和Kupffer细胞,以及一些成骨细胞和角质形成细胞分泌,是在NLRP3炎性体介导caspase-1的活化,水解激活IL-18的前体释放出来。作为AGA一个重要的调节因子,IL-18通过促进NEUT的聚集,促进炎性反应,具有促进T细胞增殖的作用,增强TH1细胞和NK细胞的细胞毒活性,是一种多效能炎性细胞因子[8]。IL-18最终作用是产生干扰素-γ,从而加速炎性反应,成熟IL-18对IFN-γ的产生过程和对促溶细胞性NK细胞的活性有重要影响。本研究中,观察组各阶段血清IL-18水平与对照组相比显著升高,差异有统计学意义(均为P<0.01),提示IL-18参与了AGA炎性反应的全过程,在AGA启动、进展及缓解中均发挥了重要作用。
总之,本研究结果表明,NLRP3炎性体及IL-18在AGA患者发病及治疗过程中水平异常,提示它们在AGA发病中参与了炎性反应过程,在炎症机制中可能发挥了重要作用。结果亦提示,NLRP3炎性体及IL-18在炎症过程存在与多种炎性因子的共同作用,相互影响,亦存在相关负向调节,它们在炎症发生、进展及缓解中的负面作用亦可能存在,需要在今后的研究中进一步探讨。
[1] Wallace K,Riedel A,Joseph-Ridge N,et al.In creasing prevalence of gout and hyperuricemia over 10 years among older adults in a managed care population[J].J Rheumatol,2004,31(8):1582-1587.
[2] Sidiropoulos PI,Goulielmos G,Voloudakis GK,et a1.Inflammasomes and rheumatic diseases: evolving concepts[J].Ann Rheum Dis,2008,67(10):1382-1389.
[3] Riehette P,Bardin T.Gout[J].Lancet,2010,375(9711):318-328.
[4] Zhu Y,Pandya BJ,Choi HK.Prevalence of gout and hyperuricemia in the US general population: the National Health and Nutrition Examination Survey 2007-2008[J].Arthritis Rheum,2011,63(10):3136-3141.
[5] Akahoshi T.Pathologicalm echanisms of gouty arthritis[J].Nihon Rinsho,2008,66(4):705-710.
[6] Martinon F,Petrilli V,Mayor A,et al.Gout-associated uric acid crystals activate the NALP3 inflammasome[J].Nature,2006,440(7081):237-241.
[7] 伍沪生.痛风与晶体性关节病[M].北京:人民卫生出版社,2014:62.
[8] Sugimoto T,Ishikawa Y,Yoshimoto T,et a1.Interleukin l8 acts on memory T helper cells type l to induce airway in flammation and hyper-responsiveness in a naive host mouse[J].J Exp Med,2004,l99(4):535-545.
Expression of NLRP3 Inflammasome mRNA in PBMCs and Serum Level of IL-18 of Patients with Acute Gouty Arthritis in the Course of Disease Process
DING Huan-fa1*, XU Xiao-chen1,WANG Shang-yun2, LIU Shu-juan1, LAN Li-qiang1, WEI Yong-tao2
(1 Department of Endocrinology, Qingdao Eighth People's Hospital, Qingdao 266100, China; 2 Laboratory Department, Qingdao Eighth People's Hospital, Qingdao 266100, China)
Objective To study the expression level of NLRP3 (NLR family, pyrin domain containing 3) inflammasome (NLRP3, ASC, caspase-1) mRNA in peripheral blood monocytes (PBMCs) and serum level of interleukin-18 (IL-18) of patients with acute gouty arthritis (AGA) in the course of it, and the roles of them in pathogenesis in AGA. Methods NLRP3 inflammasome mRNA was measured using reverse transcription-polymerase chain reaction (RTPCR) in PBMCs. The expression of NLRP3 inflammasome mRNA in PBMCs was compared between patients with AGA (T, n=100 ) and healthy controls (C, n = 100). T consisted of four stages of disease process¬: pretherapy (D0), 3rd day after medications (D3), 7th day after medications (D7) and 14th day after medications (D14). IL-18 was measured accordingly using Enzyme-linked immunosorbent assay (ELISA) in the two groups. The statistical data were analyzed by IBM SPSS 19.0 software. Result The expression of NLRP3 mRNA in D0, D3 and D7 increased significantly when compared to C(P<0.01). It was no significant difference in D14 when compared to C(P>0.05). The expression of ASC mRNA in AGA increased significantly when compared to healthy controls. D0, D3 and D7 vs C(P<0.01), D14 vs C(P<0.05). The expression of caspase-1 mRNA in D0 and D3 increased significantly when compared to C(P<0.01), while it was in D7 and D14 increased insignificantly when compared to C(P>0.05). Serum level of IL-18 in D0, D3, D7and D14 increased significantly when compared to C (P<0.01). Conclusion Dysregulated expression of the NLRP3 inflammasome and IL-18 level are involved in the inflammatory response and play key roles in the pathogenesis of the process of AGA.
Apoptosis-associated speck- like protein; Caspase-1; NLRP3; Inflamm-asome; Arthritis, gouty
R589.7
B
1671-8194(2016)14-0001-03
青岛市卫生科技发展计划项目,项目编号:2014-WJZD103
E-mail: huanfadings@163.com
