TGF-β3对PLGA支架3-D培养兔髓核细胞影响的体外研究
2016-07-10辛龙徐卫星俞雷钧宋洪浦范顺武王振斌
辛龙,徐卫星,俞雷钧,宋洪浦,范顺武,王振斌
(1.浙江省立同德医院 骨科,浙江 杭州 310012;2.浙江大学附属邵逸夫医院 骨科,浙江 杭州 310016; 3.新疆医科大学第四附属医院 骨科,新疆 乌鲁木齐 830002)
TGF-β3对PLGA支架3-D培养兔髓核细胞影响的体外研究
辛龙1,徐卫星1,俞雷钧1,宋洪浦1,范顺武2,王振斌3Δ
(1.浙江省立同德医院 骨科,浙江 杭州 310012;2.浙江大学附属邵逸夫医院 骨科,浙江 杭州 310016; 3.新疆医科大学第四附属医院 骨科,新疆 乌鲁木齐 830002)
目的 评价转化生长因子β3(transforming growth factor-β,TGF-β3)对兔髓核细胞在聚乳酸-羟基乙酸共聚物(polylactic-co-glycolic acid,PLGA)支架3-D培养的影响。方法 应用粒子沥滤法制备多孔PLGA支架培养兔髓核细胞(1×106/PLGA),分为100 ng/mL TGF-β3/PLGA,500 ng/mL TGF-β3/PLGA,1 μg/mL TGF-β3/PLGA,PLGA对照组。通过MTT分析细胞增殖分化,1,9-二甲基亚甲蓝(DMMB)法检测糖胺多糖(GAG),qPCR检测Ⅱ型胶原(COLⅡ)、Aggrean差异,组织学观察TGF-β3对兔髓核细胞在PLGA支架微孔环境生长形态学改变。 结果 培养7、14、21 d后TGF-β3/PLGA组的髓核细胞活性、GAG产量、COL II及Aggrecan mRNA表达均高于PLGA对照组(P<0.05)。随着TGF-β3浓度递增,细胞活性及基质表达有显著增加(P<0.05)。21 d组织学HE染色显示TGF-β3/PLGA组较PLGA对照组中微孔支架吸附、积聚更多髓核细胞生长。结论 TGF-β3对PLGA三维培养髓核细胞更好提高分化增殖能力,促进细胞基质分泌。TGF-β3/PLGA支架可作为生物学治疗退变椎间盘病变潜在选择方法。
TGF-β3;PLGA支架;兔髓核细胞;3-D培养
脊柱退行性病变所致下腰痛仍是临床常见疾病,对于骨科医生及基础研究者而言,通过逆转椎间盘退行性改变进程来治疗腰腿痛是面临的一项巨大挑战。近年来组织工程技术的迅速发展为椎间盘退变疾病提供了一种新的生物学治疗方法[1-2]。聚乳酸-羟基乙酸共聚物(polylactic-co-glycolic acid,PLGA)作为一种可吸收生物材料,提供合适的体外细胞生长环境,促进细胞黏附,增殖分化形成组织替代物, 进而修复重建已广泛用于组织工程研究[3-7]。实验研究结果表明生长因子可作为一种有效的生物治疗方法,调控细胞基质合成和基因表达,促进细胞增殖分化,组织再生从而修复受损椎间盘组织[8-11]。应用PLGA支架作为转化生长因子β3(transforming growth factor-β,TGF-β3)载体,植入退变椎间盘以刺激形成类软骨样及成纤维细胞,促进椎间盘再生已有研究报道[12]。然而,体外研究TGF-β3对PLGA支架培养椎间盘细胞影响报道并不多。本研究利用可吸收PLGA支架3-D培养兔髓核细胞,评价TGF-β3对细胞生物活性影响,初步探讨生物工程技术治疗椎间盘退变的可行性。
1 材料与方法
1.1 材料
1.1.1 实验动物:健康普通级4周龄新西兰白兔4只,雌雄不限,体质量(2.50±0.50) kg,浙江省医科院动物中心提供。许可证号:SYXK(浙)2014-0051,动物的饲养和实验均得到医院伦理委员会批准。
1.1.2 主要试剂:DMEM-F12培养基、D-Hanks液、Ⅱ型胶原酶、胎牛血清(Gibco公司)、噻唑蓝(MTT)、二甲基亚砜(DMSO)、重组TGF-β3(Sigma-Aldrich公司);Trizol(Invitrogen公司)、逆转录试剂盒(Takala公司)、Ⅱ型胶原免疫组化试剂盒(北京中杉公司)、0.25%胰蛋白酶(上海泽衡生物公司),PLGA(中国纺织科学研究院);HE染色剂(武汉博士德生物公司),硫酸软骨素(Sigma-Aldrich公司);
1.1.3 主要仪器 CO2培养箱(Thermo公司),倒置相差显微镜(CKX41 ,Olympas公司),酶标仪(Spark 20M,TECAN公司),细胞计数仪(BIO-RAD公司),扫描电镜(JSM-IT300,Hitach公司),PCR仪(T100,BIO-RAD公司)。
1.2 方法
1.2.1 兔椎间盘细胞分离培养:1%戊巴比妥钠100 mg/kg静脉注射麻醉处死后,麻醉后无菌条件下获取椎间盘,D-Hanks液冲洗3次,将椎间盘剪碎,Ⅱ型胶原酶和胰酶共同消化1 h。组织消化液浑浊后过滤, 细胞悬液1500 r/min离心2 min,收集细胞接种于培养瓶。37 ℃,5%CO2饱和湿度下,10%新生牛血清DMEM-F12培养基培养。用计数板计数,按1×105/mL接种培养瓶中,每3 d换液,待细胞接近90%汇合时,以1:2传代培养。倒置相差显微镜观察细胞生长、增殖情况及形态特征并记录。
1.2.2 Ⅱ型胶原(COLⅡ)免疫组化染色:细胞爬片PBS洗涤后,用95%乙醇固定20 min,0.3%的过氧化氢处理10 min,以灭活内源性过氧化物酶,10%的血清封闭20 min,Ⅱ型胶原一抗[鼠抗兔抗Ⅱ型胶原单克隆抗体(1:50)],封闭4℃过夜,随后添加二抗[鼠抗鼠IgG多克隆抗体(1:500)]在室温下孵育1 h,DAB显色1 h,封片观察。以正常羊血清代替一抗作为阴性对照。阳性染色呈棕褐色或棕黄色。
1.2.3 PLGA多孔支架制备与椎间盘细胞3-D培养:应用粒子沥滤法制备多孔PLGA支架,颗粒孔径大小约350~500 μm[13]。制成直径10 mm,厚3 mm的圆柱体。70% 乙醇浸泡消毒2 h,蒸馏水换洗乙醇,干燥后密封包装备用。根据O’Brien等[14]方法,先按照说明利用缓冲液稀释TGF-β3至不同浓度,然后将PLGA支架浸泡TGF-β3稀释液中, 4 ℃过夜24 h。最后在负压(0.07~0.08 kPa),-20°条件下冻干,TGF-β3载入PLGA支架微孔。制成3组负载不同浓度的TGF-β3(100 ng/mL、500 ng/mL、1 μg/mL) PLGA支架以培养细胞用。
实验分组如下:100 ng/mL TGF-β3/PLGA,500 ng/mL TGF-β3/PLGA,1 μg/mL TGF-β3/PLGA,PLGA对照组。PLGA支架置于24孔培养板,每个PLGA支架滴加100 μL第2代细胞悬液进行接种(最终浓度为1×106/mL), 3 h后加入900 μL培养液,培养1、7、14、21 d。
1.2.4 MTT摄取:第1、7、14、21天检测各组细胞增殖。每孔加入MTT(5 mg/mL) 100 μL染色, 37 ℃继续孵育4 h, 收集上清液。再加入DMSO 1 mL,振荡10 min充分溶解沉淀物后, 吸取待测液150 μL于96孔培养板,复孔6个,应用酶标仪570 nm波长检测各孔吸光度A值。
1.2.5 糖胺多糖含量测定:第1、7、14、21 天,各组分别取3-D培养上清液离心后置于-80 ℃冰箱中备检。按照Tim等[15]的方法,将培养液收集入YM-50离心超滤管(Milipore) 后5000 g离心30 min,氨基多糖(glycosaminoglycan, GAG)浓度浓缩20倍。分别取20 μL浓缩的培养液与 200 μL 1,9-二甲基亚甲蓝(DMMB)染液混合,复孔5个,酶标仪记录波长525 nm处的吸光度A值。用硫酸软骨素作标准曲线(0~150 μg/mL), 测定每个样本的GAG浓度。
1.2.6 qPCR 测定COL II、Aggrecan含量:于各时间点分别收集各组贴附支架的细胞,以Trizol试剂裂解细胞抽提细胞总RNA, 测定RNA浓度。然后将RNA反转录成cDNA, 以18 S rRNA为内参, 利用cDNA为模板进行荧光定量PCR。反应条件: 95 ℃预变性5 min, 随后95 ℃ 变性30 s, 60 ℃退火30 s, 72 ℃延伸45 s, 共进行45个循环, 再72 ℃延伸10 min。结果用100×2ΔCT(targeted gene)×10m(m=1,2,7)计算目的基因的相对表达量。本实验所有引物由Invitrogen公司设计合成, 内参18S rRNA上下游引物分别为5’-GGA TGG CTG TCT GAC CAA-3’和5’- GGG AGC AGT GAT GTG GAA CAC-3’; 其中COL II的上下游引物分别为5’- GAAGCA CAT CTG GTT TGG AG-3’和5’-TTG GGG TTG AGG GTT TTA CA-3’; Aggrecan的上下游分别为5’-GCA GGG ATA ACG GAC TGA AGT TC-3’和5’-GAT GGT TGA GGG ATG CTC ACA CT-3’。实验结果检测重复4次。
1.2.7 组织学观察:培养第7天后取2个细胞/PLGA复合体, PBS漂洗3次, 3% 戊二醛固定24 h, 扫描电镜下观察细胞在PLGA微孔内部的生长情况。第21天后取出2 个细胞/PLGA复合体,10%甲醛固定24 h。常规脱水、透明、蜡块包埋、切片(厚7 μm)、 HE染色,光镜下进行组织学观察。
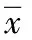
2 结果
2.1 细胞形态学观察 倒置相差显微镜观察,单层培养细胞于48 h后完成贴附伸展。原代细胞多为梭形或多角形,胞质向外伸出多个长短不同的突起,轮廓清晰。中央有明显1~2个类圆形核,见图1。

图1 倒置相差显微镜观察兔髓核细胞原代细胞(×60)Fig.1 The rabbit NPCs by inverted phase contrast microscope(×60)
扫描电镜观察,体外PLGA支架培养7 d,细胞支架复合体内可见大量髓核细胞伸展贴附于PLGA支架孔壁,并见伪足伸出,见图2。

图2 扫描电镜观察PLGA孔隙内附壁生长的兔髓核细胞(×623)Fig.2 The rabbit NPCs attached PLGA scaffolds by scanning electron microscope(×623)
细胞爬片Ⅱ型胶原免疫组化染色阳性,可见细胞核几乎不着色;胞浆染色淡黄色,靠近核周明显,并可见一些细小颗粒沉着,见图3。

图3 兔髓核细胞Ⅱ型胶原免疫组化染色形态表现(×200)Fig.3 Primary nucleus pulposus cells stained with collagen Ⅱ(×200)
2.2 MTT法检测细胞增殖结果 如表1所示,培养后第7、14、21天TGF-β3/PLGA各组A值均高于PLGA对照组, 500 ng/mL、1 μg/mL TGF-β3/PLGA组A值高于100 ng/mL TGF-β3/PLGA组及PLGA对照组,差异有显著的统计学意义(P<0.05)。各组A值随培养时间的延长而增大,说明各组细胞数随时间的增加而增加(P<0.05)。第14、21天同组间A值比较差异无统计学意义。

表1 MTT法检测各组细胞增殖变化
*P<0.05,与同时间点PLGA对照组比较,compared with PLGA control group at the same time point;#P<0.05,与同时间点100 ng/mL TGF-β3/PLGA组比较,compared with 100 ng/mL TGF-β3/PLGA group at the same time point;△P<0.05,同组与第1天比较,compared with the same group on 1stday;▲P<0.05,同组与第7天比较,compared with the same group on 7thday
2.3 DMMB法检测GAG含量 随培养时间的延长各组GAG含量逐渐增加。培养后第7、14、21天TGF-β3/PLGA组较PLGA对照组GAG含量明显增加,500 ng/mL、1 μg/mL TGF-β3/PLGA组高于100ng/mL TGF-β3/PLGA及PLGA对照组,比较有显著差异(P<0.05)。随培养时间延长,第14天GAG含量明显增加,21 d有所降低。比较第14、21天的结果显示各组GAG含量无显著差异。见表2。
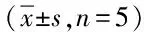
表2 DMMB法检测各组GAG含量变化
*P<0.05,与同时间点PLGA对照组比较,compared with PLGA control group at the same time point;#P<0.05,与同时间点100 ng/mL TGF-β3/PLGA组比较,compared with 100 ng/mL TGF-β3/PLGA group at the same time point;△P<0.05,同组与第1天比较,compared with the same group on 1stday;▲P<0.05,同组与第7天比较,compared with the same group on 7thday
2.4 TGF-β3/PLGA对COL II、Aggrecan基因表达的影响 培养后的第7、14、21天TGF-β3/PLGA组较PLGA对照组COL II及Aggrecan mRNA表达明显增强,500 ng/mL、1 μg/mL TGF-β3/PLGA组高于100 ng/mL TGF-β3/PLGA及PLGA对照组,比较有显著差异(P<0.05)。见表3。
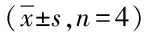
表3 TGF-β3/PLGA对COL II、Aggrecan基因表达的影响
*P<0.05,与同时间点PLGA对照组比较,compared with PLGA control group at the same time point;#P<0.05,与同时间点100 ng/mL TGF-β3/PLGA组比较,compared with 100 ng/mL TGF-β3/PLGA group at the same time point;△P<0.05,同组与第1天比较,compared with the same group on 1stday
2.5 组织学观察 培养21 d后TGF-β3/PLGA细胞支架复合体可见大量苏木素着色的细胞贴附生长于PLGA支架微孔内,数量较多,细胞紧密接触,形成类组织样结构,支架呈透明无着色。 PLGA组贴附细胞较为稀疏沿着支架微孔壁黏附生长。见图4。
3 讨论
退行性椎间盘进行修复,恢复脊柱生理功能仍是脊柱外科医生及研究者面临的难题。一些研究报道利用组织工程方法将细胞-支架复合物植入或多功能干细胞直接注入病变椎间盘, 延缓椎间盘退变的过程已经取得进展[16-19]。然而,选择合适细胞来源、生物载体及有效因子逆转这种椎间盘病理性退变过程仍存在诸多需要解决的问题。生物载体始终是技术关注的焦点,近年来各研究领域中新技术相互渗透,不断发展出一些极具有良好应用前景、新型的生物支架[20-21]。PLGA聚酯化合物具有许多优点,成为椎间盘组织工程的研究重点[7, 22]。PLGA可制备成为一定形状,大小和内孔隙结构的3-D多孔支架,依据不同细胞的生长要求进行调节,因此,近来也广泛应用于体外组织工程再生支架研究[23-24]。一些国内外研究PLGA支架培养软骨细胞在体修复膝关节骨软骨缺损取得较好疗效[5-6,25]。然而,椎间盘细胞的体外培养仍存在细胞分化增殖受限、细胞表型改变,影响逆行的修复效果[26]。因此,本研究选择兔椎间盘髓核细胞与PLGA微孔支架进行3-D培养,并应用生长因子TGF-β3进行体外诱导, 结果发现髓核细胞在第1天比较各组MTT、GAG及ColⅡ含量差异不明显,可能与细胞刚开始贴壁生长有关,还没有显示不同浓度的TGF-β 3影响细胞生长及增殖。而第14天和21天,随着更多细胞贴壁生长和TGF-β3浓度递增,细胞增殖和代谢活动较为稳定,TGF-β3/PLGA组中MTT、GAG及COLⅡ含量均显著增加(P<0.05),说明PLGA多孔支架满足接种髓核细胞的贴附,伸展及繁殖要求。扫描电镜及组织学结果表明细胞较好地均匀分布,贴附、分化增殖于PLGA支架内部的微孔表面,明确细胞与PLGA支架生良好的共存,PLGA支架为维持细胞的体外增殖和代谢活动提供适宜的微环境。因此,TGF-β3/PLGA支架3-D培养兔髓核细胞具备进一步修复的退变椎间盘先决条件。
许多研究报道体外3-D细胞培养,长时间地可持续性增殖后维持原有细胞表型及功能较为困难[6, 27]。生长因子调控、释放,对保持细胞表型及功能具有重要作用,TGF-β3参与椎间盘细胞生长及表型调控,细胞在TGF-β3作用下可更好向正常椎间盘细胞表型分化[11, 28]。本研究使TGF-β3载入PLGA支架,结果表明3-D培养21d时TGF-β3仍可刺激细胞增殖。TGF-β3/PLGA支架组中细胞活性、细胞基质均高于PLGA对照组(P<0.05), 大量活髓核细胞存在支架微孔内较好贴壁与伸展。TGF-β3有效发挥对细胞增殖、分化及代谢的调节作用。近来在体研究表明PLGA具有与其它生物活性分子复合、控释,从而对细胞的生长进行调控[9]。然而,体外对TGF-β3活性可调控性释放,保持TGF-β3较好地分布在细胞附近, 不易流失也仍是体外细胞培养的一个难点。本研究采用冻干法将通过负压、冻干吸附TGF-β3载入PLGA支架微孔,也证实PLGA支架能够较好发挥TGF-β3载体功能,具有良好的细胞、生物因子载体优势。今后研究中有待进一步检测TGF-β3的有效浓度,为将来构建新型复合的PLGA微粒或胶原纤维、凝胶、透明质酸等生物材料,以更加有效控释TGF-β3等生物因子。
综上所述,本实验研究表明PLGA可作为髓核细胞良好的3-D支架载体,细胞附着支架微孔内壁生长良好;TGF-β3载入PLGA支架更好促进椎间盘细胞增殖分化,为椎间盘退行性病变的生物治疗提供一种新的途径。
[1] Bono E, Mathes SH, Franscini N,et al.Tissue engineering--the gateway to regenerative medicine[J].Chimia,2010, 64(11):808-812.
[2]Kandel R, Roberts S, Urban JP.Tissue engineering and the intervertebral disc: the challenges[J].Eur Spine J,2008, 17 Suppl 4:480-491.
[3]Park JS,Yang HN,Woo DG,et al.Multilineage differentiation of human-derived dermal fibroblasts transfected with genes coated on PLGA nanoparticles plus growth factors[J].Biomaterials, 2013, 34(2):582-597.
[4]Uematsu K,Hattori K,Ishimoto Y, et al.Cartilage regeneration using mesenchymal stem cells and a three-dimensional poly-lactic-glycolic acid(PLGA) scaffold[J].Biomaterials, 2005, 26(20):4273-4279.
[5]Wang W,Li B,Yang J,et al.The restoration of full-thickness cartilage defects with BMSCs and TGF-beta 1 loaded PLGA/fibrin gel constructs[J].Biomaterials, 2010, 31(34):8964-8973.
[6]Lu H,Ko YG,Kawazoe N, et al.Culture of bovine articular chondrocytes in funnel-like collagen-PLGA hybrid sponges [J].Biomedical materials(Bristol, England),2011, 6(4):045011.
[7]Pan Z, Ding J.Poly(lactide-co-glycolide) porous scaffolds for tissue engineering and regenerative medicine[J].Interface Focus, 2012, 2(3):366-377.
[8]Paesold G,Nerlich AG, Boos N.Biological treatment strategies for disc degeneration: potentials and shortcomings[J].Eur Spine J,2007, 16(4):447-468.
[9]Yan J,Yang S,Sun H, et al.Effects of releasing recombinant human growth and differentiation factor-5 from poly(lactic-co-glycolic acid) microspheres for repair of the rat degenerated intervertebral disc[J].J Biomater Appl, 2013, 29(1):72-80.
[10]Zhang H,Wang L,Park JB,et al.Intradiscal injection of simvastatin retards progression of intervertebral disc degeneration induced by stab injury[J].Arthritis Res Ther, 2009, 11(6):R172.
[11]Gupta MS,Cooper ES,Nicoll SB.Transforming growth factor-beta 3 stimulates cartilage matrix elaboration by human marrow-derived stromal cells encapsulated in photocrosslinked carboxymethylcellulose hydrogels: potential for nucleus pulposus replacement[J].Tissue Eng Part A, 2011, 17(23-24):2903-2910.
[12]Huang B,Zhuang Y,Li CQ, et al.Regeneration of the intervertebral disc with nucleus pulposus cell-seeded collagen II/hyaluronan/chondroitin-6-sulfate tri-copolymer constructs in a rabbit disc degeneration model[J].Spine, 2011, 36(26):2252-2259.
[13]Oh SH, Kang SG, Lee JH.Degradation behavior of hydrophilized PLGA scaffolds prepared by melt-molding particulate-leaching method: comparison with control hydrophobic one[J].J Mater Sci Mater Med, 2006, 17(2):131-137.
[14]O’Brien FJ, Harley BA, Yannas IV, et al.Influence of freezing rate on pore structure in freeze-dried collagen-GAG scaffolds[J].Biomaterials, 2004, 25(6):1077-1086.
[15]Tim Yoon S, Su Kim K, Li J, et al.The effect of bone morphogenetic protein-2 on rat intervertebral disc cells in vitro[J].Spine, 2003, 28(16):1773-1780.
[16]Chan SC, Gantenbein-Ritte B.Intervertebral disc regeneration or repair with biomaterials and stem cell therapy--feasible or fiction?[J].Swiss Med Wkly, 2012, 142:w13598.
[17]Jin L, Shimmer AL, Li X.The challenge and advancement of annulus fibrosus tissue engineering[J].Eur Spine J,2013, 22(5):1090-1100.
[18]Sharifi S, Bulstra SK, Grijpma DW,et al.Treatment of the degenerated intervertebral disc; closure, repair and regeneration of the annulus fibrosus[J].J Tissue Eng Regen Med,2015,9(10):1120-1132.
[19]Hudson KD,Alimi M, Grunert P, et al.Recent advances in biological therapies for disc degeneration: tissue engineering of the annulus fibrosus, nucleus pulposus and whole intervertebral discs[J].Curr Opin Biotechnol, 2013, 24(5):872-879.
[20]Mahmoud S,Eldeib A,Samy S.The design of 3D scaffold for tissue engineering using automated scaffold design algorithm[J].Australas Phys Eng Sci Med, 2015,38(2):223-238.
[21]Yang X,Li X.Nucleus pulposus tissue engineering: a brief review[J].Eur Spine J,2009, 18(11):1564-1572.
[22]Kim HY, Kim HN, Lee SJ, et al.Effect of pore sizes of PLGA scaffolds on mechanical properties and cell behaviour for nucleus pulposus regeneration in vivo[J].J Tissue Eng Regen Med, 2014.[Epub ahead of print].
[23]Sha’ban M, Kim SH, Idrus RB, et al.Fibrin and poly(lactic-co-glycolic acid) hybrid scaffold promotes early chondrogenesis of articular chondrocytes: an in vitro study[J].J Orthop Surg Res, 2008,3:17.
[24]Yoshioka T, Kawazoe N, Tateishi T, et al.In vitro evaluation of biodegradation of poly(lactic-co-glycolic acid) sponges[J].Biomaterials, 2008, 29(24-25):3438-3443.
[25]Wu G,Cui Y, Ma L, et al.Repairing cartilage defects with bone marrow mesenchymal stem cells induced by CDMP and TGF-beta1[J].Cell Tissue Bank, 2014, 15(1):51-57.
[26]Mern DS, Beierfuss A, Thome C, et al.Enhancing human nucleus pulposus cells for biological treatment approaches of degenerative intervertebral disc diseases: a systematic review[J].J Tissue Eng Regen Med, 2014, 8(12):925-936.
[27]Lichtenberg A, Dumlu G, Walles T, et al.A multifunctional bioreactor for three-dimensional cell(co)-culture[J].Biomaterials, 2005, 26(5):555-562.
[28]Chen YC, Su WY, Yang SH, et al.In situ forming hydrogels composed of oxidized high molecular weight hyaluronic acid and gelatin for nucleus pulposus regeneration[J].Acta biomaterialia, 2013, 9(2): 5181-5193.
(编校:王俨俨)
2016中国生化药物前沿-精准医学·创新药物学术论坛暨《中国生化药物杂志》编委会年会会议通知(第二轮)
由中国药学会生化与生物技术药物专业委员会、北京大学药学院、浙江大学药学院、分子肿瘤学国家重点实验室、天然药物及仿生药物国家重点实验室、医视界共同主办,《中国生化药物杂志》和北京数字时代科技有限公司共同承办的“2016中国生化药物前沿-精准医学·创新药物学术论坛暨《中国生化药物杂志》编委会年会”将于2016年12月8日-10日在北京西藏大厦召开。
一、大会组织
主办单位:
中国药学会生化与生物技术药物专业委员会
北京大学药学院
浙江大学药学院
分子肿瘤学国家重点实验室
天然药物及仿生药物国家重点实验室
医视界
承办单位:
《中国生化药物杂志》
北京数字时代科技有限公司
大会主席:詹启敏
大会副主席(按姓氏笔画排列): 于荣敏 王凤山 李利民 刘昭前 江 明 孙晓波 陈枢青 邱小波
陈晓光 邵荣光 范慧红 药立波 凌沛学 黄 镜 彭小忠 潘景轩
学术顾问:陈志南 杨宝峰
主任委员:詹启敏
副主任委员:周德敏 杨 波
学术委员会委员(按姓氏笔画排列): 于荣敏 王凤山 叶文才 刘昭前 江 明 孙晓波 李为民 李利民
杨 波 杨跃进 邱小波 陈枢青 陈建国 陈晓光 邵荣光 范慧红
周德敏 药立波 凌沛学 黄 镜 彭小忠 潘景轩 魏敏杰
二、大会网站:2016fafbp.cbcpharm.com
三、会议征文
1.征文内容:围绕本次会议主题“精准医学·创新药物”的基础研究、临床应用及前沿综述,具体内容可涵盖生化药物各方面,包括化药、植物药、生物药,从药物分子结构设计等理论研究,植物有效成分提取工艺优化等技术研究,基于生物信息学的分析研究,到临床研究等。
2.征文要求:原创并且在投稿截止前尚未发表的论文,主题明确、层次清晰、论据充分、数据可靠,400~800字中文摘要,摘要按照规定格式(目的、方法、结果和结论)写作;正文4000~8000字。登录www.cbcpharm.com在线投稿/查稿,并注明“会议征文”。
3.所有论文将择优在《中国生化药物杂志》发表。
4.截稿时间:2016年11月25日
四、联系方式
学术联系人:吴 茜 010-84280076-8720;13581939531
学术邮箱:wuxi@cyberzone.cn
会务联系人: 田小娟 010-84280076-8932;13810336853
徐 艳010-84280076-8956:13810335932
会务邮箱:tianxiaojuan@cyberzone.cn
Effect of TGF-β3 on rabbit nucleus pulposus(NP) cells cultured in three-dimensional polylactic-co-glycolic acid scaffoldinvitro
XIN Long1, XU Wei-xing1, YU Lei-jun1, SONG Hong-pu1, FAN Shun-wu2, WANG Zhen-bin3Δ
(1.Department of Orthopaedics, Tongde Hospital of Zhejiang Province, Hangzhou 310012, China; 2.Department of Orthopaedics, The Affiliated Sir Run Run Shaw Hospital, Zhejiang University, Hangzhou 310016, China; 3.Department of Orthopaedics, The Fourth Affiliated Hospital, Xinjiang Medical University, Urumchi 830002, China)
ObjectiveTo evaluate the effect of TGF-β3 on rabbit nucleus pulposus(NP) cells cultured in three-dimensional polylactic-co-glycolic acid (PLGA)scaffoldinvitro.MethodsPLGA scaffolds were fabricated by particulate leaching method and soaked in rabbit NP cells suspension(1×106/scaffold).PLGA-seeded NP cells were devided into 4 groups: 100 ng/mL TGF-β3/PLGA,500 ng/mL TGF-β3/PLGA,1 μg/mL TGF-β3/PLGA,PLGA control group.Cell proliferation activity was measured using MTT assay.The glycosaminoglycan(GAG) analysis were performed by 1,9-dimethylmethylene blue(DMMB) assay.mRNA expression was measured by quantitive PCR at each time point.Histological observation was performed to elucidate the morphological changes of NP cells in PLGA effected by TGF-β3.ResultsHigher cellular proliferation activity, GAG production,Collagen type II, Aggrean expression were observed in TGF-β3 /PLGA-seeded NP cells compared with PLGA control group on day-7,day-14,day-21(P<0.05).Higher dose of TGF-β3 exhibited intense cellular proliferation activity and peri-cellular matrix by increasing trend(P<0.05).Histological observation showed TGF-β3/PLGA developed more significant disc cells cluster than PLGA groups on day-21.ConclusionThe 3D porous PLGA scaffold-seeded cells using TGF-β3 can promotes cell proliferation, and prompt extracellular matrix(ECM) production.It is a potential biotherapy for the treatment of disc degeneration.
TGF-β3; PLGA scaffold; rabbit nucleus pulposus cells; 3D cell culturing
10.3969/j.issn.1005-1678.2016.09.007
浙江省卫计委科学研究基金(2010KYB026)
辛龙,男,博士,主治医师,研究方向:慢性下腰痛发病机制及临床治疗、脊柱退变、脊柱畸形、脊柱创伤、脊柱非融合技术及脊髓损伤,E-mail:xinlonghz@aliyun.com;王振斌,通信作者,男,博士,副主任医师,研究方向:脊髓型颈椎病发病机制及临床治疗、脊柱退变、脊柱畸形、脊柱创伤及脊柱肿瘤,E-mail:wangzb0202@163.com。
R826.64
A
