根系结构对湿地植物根系释氧能力的影响
2016-07-09汤苏晨程康睿
汤苏晨 程康睿


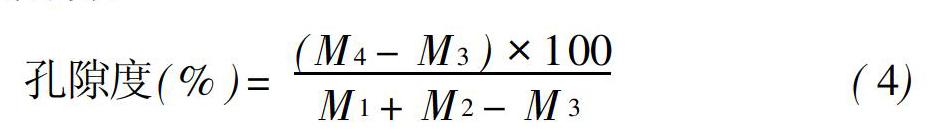
摘要:为了研究湿地植物的根系结构对根系释氧能力(以根系释氧速率和释氧速率对水位变化的敏感性来表征)的影响。采用柠檬酸钛法测定菖蒲、再力花、香蒲、芦苇4 种湿地植物在5种不同水位条件下的根系释氧速率,并采用标准差分析法分析不同湿地植物根系释氧速率对水位变化的敏感性。同时,采用比重瓶法测量湿地植物根系孔隙度,并对植物根部结构进行显微观察。结果表明:4种湿地植物的根系释氧速率从大到小总体上依次表现为香蒲>芦苇>再力花>菖蒲,对水位变化的敏感性从大到小依次表现为香蒲>芦苇>菖蒲>再力花。此外,湿地植物根系释氧能力与植物根系结构关系密切,主要表现为:湿地植物根系通气组织越发达、释氧屏障越不明显,则根系释氧速率越大、对水位变化越敏感。
关键词:人工湿地;根系结构;根系释氧速率;水位;敏感性
中图分类号:Q945 文献标志码:A 文章编号:1672-1683(2016)04-0112-05
Abstract:To study the effects of root structure on the ability of oxygen release from the root systems of plants(expressed by root oxygen release rate and sensibility of root oxygen release rate to dynamic water level),four different wetland plants were used(Acorus calamus Linn,Thalia dealbata,Typha orientalis Presl,Phragmites australis).The root oxygen release rates in five different water levels were measured using titanium citrate buffer.Standard deviation was also used to illustrate the sensibility to dynamic water level of different wetland plants.In addition,root porosity was measured by pycnometer method and root structure was observed by microscope.The results showed that the root oxygen release rate of these wetland plants decreased in the following order as a whole:Typha> Phragmites> Thalia> Acorus.The sensibility of root oxygen release rate to dynamic water level decreased in the following order:Typha> Phragmites> Acorus> Thalia.Moreover,it was found that more developed Aerenchyma and less oxygen barrier may have positive relationship with the ability of root oxygen release.The more sensitive to the release rate of the plant root system,the more sensitive to the change of water level.
Key words:constructed wetland;root structure;root oxygen release rate;water level;sensibility
目前,人工湿地技术被广泛用于处理多种类型的废水,如污水厂尾水[1]、市政污水、分散型农村生活污水[2]等。一些研究表明,供氧条件是影响人工湿地净化能力特别是脱氮能力的关键因素[3-4]。Stein[5]通过研究人工湿[HJ1.96mm]地对于不同浓度COD去除的影响后发现植物具有很高的传输氧的能力,植物根系释氧是湿地土壤中氧的主要来源。另外,由于“根区理论”已被人们广泛接受[6-7],湿地植物的根系释氧(ROL)能够使湿地植物根际溶解氧及其微生物分布发生变化。Justin等[8]提出植物根系结构如通气组织、皮层细胞排列方式等会影响植物根系释氧,从而影响根际微生物的变化;吴振斌[9]发现根系释氧能增加根际微生物酶的活性,为根区解毒,对污水中污染物的去除具有一定的积极意义。因此,维持植物根际溶氧稳定对湿地系统的健康运行有着重要作用。根系释氧方面的研究也越来越受到研究人员的关注[10]。
影响湿地植物根系释氧的因素主要有两类,外因主要包括:①光照强度[11-12]、②营养液氧化还原强度、③有机酸含量、④温度[13]、⑤水位[14]等;内因主要包括:①根系生物量[15]及根系结构[8]、②植物体内氧的浓度[16]、③根部是否存在阻碍根系释氧的屏障[17-18]等。在水位变化情况下,植物根系结构对根系释氧能力有较大影响,Sasikala等[19]以垂直潜流湿地为对象实测了水位起伏对植物根系释氧的影响,发现静水时根系释氧会远远大于水位波动时的数值,从而认为水位波动会引起根系释氧的降低;Caffrey等[15]研究发现水位上升引起的水压增加会破坏通气组织,阻碍植物的根系释氧,此外,植物细胞壁的释氧屏障也会阻碍湿地植物的根系释氧。目前,水位变化情况下根系结构怎样影响植物的根系释氧能力仍然是一个尚待明确的问题。本文针对这一问题,以柠檬酸钛法测定根系释氧速率和释氧速率对水位变化的敏感性,据此来研究湿地植物的根系结构对根系释氧能力的影响,并尝试通过根系孔隙度和微观结构来探讨其中的机理。
1 材料与方法
1.1 植物
挑选4种常见的湿地植物:菖蒲(Acorus calamus)、再力花(Thalia dealbata)、香蒲(Typha orientalis)和芦苇(Phragmites australis)分别培养半年以上,选取长势良好、根重和高度都基本相同且生物群落稳定的湿地植物各一株进行下述试验。选用的植株高度分别为:菖蒲1.16 m、再力花1.09 m、香蒲1.25 m、芦苇1.20 m,空白组不栽种植物。试验时间为2013年4月到2013年6月,每组历时5~7 d。
1.2 水培试验
由于选用的4种湿地植物均生长于浅水或低洼湿地中,其生长环境以水深500 mm以下居多,水培条件下植物根底部至根的第一分叉高度为150±20 mm。试验过程中既要使水位没过植物根部使植物获取足够养分,又应避免水位过高对植物产生破坏性胁迫,干扰后续试验的进行。因此,选择在180、210、240、270和300 mm 5种不同水位条件下进行试验。试验选在天气、温度等条件相似的情况下在恒温恒光强的生化培养箱中进行(图1),培养箱中光强和温度始终保持在1000 lux和25 ℃。每隔一个小时,利用注射器通过取样管取样,采用柠檬酸钛法测定水中的氧含量,每组试验持续6~7 h。董婵[20]发现湿地植物根系释氧与光强有一个2 h左右的滞后时间,因此本试验的湿地植物在试验前先在恒温培养箱中培养2 h,每次试验结束后将湿地植物放回营养液中以便下一水位继续试验。
2 结果与讨论
2.1 4种湿地植物在不同水位下的根系释氧速率
从图2可以看出,每组试验的空白组中柠檬酸钛溶液浓度基本保持不变,可见湿地植物根系所释放的氧气是水体中氧的主要来源。试验组在不同水位条件下Ti3+浓度均随着时间的增加而呈线性下降趋势,因此,在平衡了光强、温度等一系列影响湿地植物根系释氧的外部因素后,湿地植物根系释氧速率保持不变。
整理图2中的数据,由式(2)、式(3)计算得到4种湿地植物在5种不同水位下的根系释氧速率,为了更直观地分析不同水位下各湿地植物的根系释氧速率变化趋势,得到 4种湿地植物的根系释氧速率变化曲线图(图3)。湿地植物的根系释氧速率随着水位的增加都会有相应的变化,其中芦苇和菖蒲随水位的增加呈先增加后减少趋势,在水位为240 mm时有释氧峰值;香蒲的根系释氧速率随水位增加而明显减小;再力花的根系释氧速率变化不显著。总的来说,4种湿地植物根系释氧能力从大到小排列为:香蒲、芦苇、再力花、菖蒲。
为了综合分析植物根系释氧速率对水位变化的敏感性,分别计算4种植物在不同水位条件下根系释氧速率的标准差,见图4。得出4种湿地植物根系释氧速率对水位变化的敏感性依次为:香蒲、芦苇、菖蒲、再力花。
4种湿地植物间较大的根系释氧能力种间差异可能和湿地植物的生长环境有关。香蒲普遍生长在浅水池塘或湖泊中,根部深入泥内,长期处于缺氧或无氧环境之下,其根部的各项生理生化活动都需要植株向下输氧,
且其根系发达,所需氧气量较根系小的植物更大,故其释氧速率也较大,且随着水位的升降变化也较大。再力花之所以在水深0.6 m的水域至岸边均能较好生长,且水没基部也可生长良好,对水位变化的敏感性较低,可能与其特殊的根系结构也有很大的关系。而芦苇香蒲出现释氧峰值是因为芦苇和菖蒲适宜生长在200 mm以上的水深环境中,在水位较低的条件下,植物自身的生理特性得不到满足,从而影响了植物的生长,最终影响了释氧能力;而当水位继续增加,水压压迫植物通气组织,使通气组织的氧气运输能力降低,导致了根系释氧能力的下降, 最终导致芦苇和菖蒲在水位为240 mm时有释氧峰值的现象。
因此,得出植物根系结构对植物释氧能力存在较大的影响。由于在野外环境下湿地的水位波动是普遍现象,因此在构建人工湿地时,应根据湿地实际情况选用适宜的湿地植物。如果湿地水位变化较大,则应栽种再力花、菖蒲等对水位变化较不敏感的湿地植物,以维持植物根区氧含量的相对稳定,使湿地系统处于健康、稳定的状态。
2.2 4种湿地植物根系结构的分析
湿地植物根系孔隙度能较好地表征湿地植物根部通气组织的发达程度,从而反应湿地植物的根系释氧状况[21]。图5反映了4种湿地植物根系的孔隙度大小,可以看出芦苇的根系孔隙度最大,香蒲次之,而菖蒲和再力花的根系孔隙度较低,低于40%。因此,4种湿地植物根系释氧速率可能与根系孔隙度存在着一定的正相关关系,即孔隙度越大,根系释氧速率越大。同时,由于湿地植物根部通气组织中有大量储存空气的气腔、气道,其孔隙度越大,水位上升产生的的机械应力增加使通气组织中储存的空气排出越多,植物的根系释氧对水位变化越敏感。
通气组织(Aerenchyma)是湿地植物中的一种能贮存和输导气体的薄壁组织。在湿地植物的根茎叶结构的发育过程中,部分细胞程序性死亡,形成相互贯通的气道、气腔,储藏着大量空气,有利于光合作用、呼吸作用过程中气体的交换,同时也有效地抵抗了水生环境中所受到的机械应力。通过光学显微镜分别观察4种湿地植物的结构,见图6。从显微结构可以看出4种湿地植物的内部结构差异较大,且不同的结构直接影响着根系释氧速率对水位变化的敏感性。
菖蒲的外表皮细胞较厚,外表皮厚度约为20 μm,内部皮层薄壁细胞排列连续,在靠近外表皮区域形成一些直径约10 μm的气穴。其表皮层的厚壁组织细胞间孔隙非常小,几乎不透光,形成了一层明显的释氧屏障,因此菖蒲的根系释氧速率较低。由于释氧屏障的存在,菖蒲根系释氧速率对水位变化的敏感性也较低。
再力花外表皮厚约20 μm,皮层细胞排列不规则且外表皮与厚壁组织细胞间存在一层明显的空隙,形成一个三明治结构的释氧屏障。这层空隙不仅能阻碍再力花地上部分产生的氧气向根外释放,还一定程度上缓冲了水位上升对再力花根部通气组织产生的机械应力,使水位变化对再力花根系释氧速率几乎无影响。
香蒲虽然外表皮细胞较多、外表皮较厚,达30 μm左右,但植物外表皮细胞与皮层薄壁组织几乎无区别,并且有很多横向溶生性通气组织,有利于地上部分释放的氧气向根外释放。由于没有明显的释氧屏障,故其根系释氧速率对水位变化较敏感。
芦苇的通气组织为蜂窝状扩大型,有连续的细胞排列,通气组织比较发达,且植物外表皮细胞较少、外表皮较薄,没有明显的释氧屏障。所以地上部分产生的氧气能很快地经过根部组织向外排出,其根系释氧速率对水位变化也比较敏感。
3 结论
(1)4种湿地植物在相同环境下根系释氧速率及对水位变化的敏感性存在很大的种间差异。4种湿地植物根系释氧速率从大到小依次为:香蒲>芦苇>再力花>菖蒲,对水位变化的敏感性也各不相同,其中香蒲对于水位变化的敏感性最大,再力花对于水位变化最不敏感。
(2)湿地植物根系释氧速率与通气组织发达程度呈正相关关系,通气组织越发达,植物根系释氧速率越大,并且根系释氧速率对水位变化的敏感性也越大。另外,根系释氧能力与湿地植物根部细胞排列有关,外表皮组织与皮层薄壁组织间的释氧屏障越不明显,根系释氧速率越大,其对水位的变化越敏感。
参考文献(References):
[1] 高翔,黄津辉,张忠广,等.人工湿地处理污水处理厂尾水中试研究[J].南水北调与水利科技,2014,12(1):54-58.(GAO Xiang,HUANG Jin-hui,ZHANG Guang-zhong,et al.Research on the pilot scale experiment of tail water from a wastewater treatment plant treated by constructed wetlands[J].South-to-North Water Transfers and Water Science & Technology,2014,12(1):54-58(in Chinese))
[2] 李怀正,叶建锋,王晟,等.垂直潜流人工湿地技术在上海市农村污水处理中的应用和发展[J].环境污染与防治,2008,30(8):84-89.(LI Huai-zheng,YE Jian-feng,WANG Sheng,et al.Vertical subsurface flow constructed wetland wastewater treatment technologies in rural areas of Shanghai in the application and development.Environmental Pollution&Control,2008,30( 8):84- 89( in Chinese))
[3] 胡浩云,张学英.浅谈人工湿地对面源污染中氮素的去除效果[J].南水北调与水利科技,2011,9(3):142-144.(HU Hao-yun,ZHANG Xue-ying.Discussion of nitrogen removal efficiency from non-point pollution by artificial wetland[J].South-to-North Water Transfers and Water Science & Technology,2011,9(3):142-144(in Chinese))
[4] Kuschk P,Wiessner A,Kappelmeyer U,et al.Annual cycle of nitrogen removal by a pilot-scale subsurface horizontal flow in a constructed wetland under moderate climate[J].Water Research,2003,37(17):4236-4242.
[5] Stein O B,Biederman J A,Hook P B,et al.Performance data from model constructed wetlands for wastewater treatment[C].Engineering Approaches to Ecosystem Restoration:Proceedings of the 1998 Wetlands Engineering and River Restoration Conference.1998:22-27.
[6] Huang J,Wang S H,Yan L,et al.Plant photosynthesis and its influence on removal efficiencies in constructed wetlands[J].Ecological Engineering,2010,36(8):1037-1043.
[7] Calhound A,King G M.Regulation of root-associated methanotrophy by oxygen availability in the rhizosphere of two aquatic macrophytes[J].Applied and environmental microbiology,1997,63(8):3051-3058.
[8] Justin S,Armstrong W.The anatomical characteristics of roots and plant response to soil flooding[J].New Phytologist,1987,106:465–495.
[9] 吴振斌,贺锋,程旺元,等.极谱法测定无氧介质中根系氧气输导[J].植物生理学报,2000,26(3):177-180.(WU Zhen-bin,HE Feng,CHENG Wang-yuan,et al.Studies on oxygen transportation of roots in anaerobic media with polarography[J].Plant Physiol J,2000,26(3):177-180.(in Chinese))
[10] 刘志宽.湿地植物根系泌氧及其对滇池N、P营养物去除的影响研究[D].太原理工大学,2010.(LIU Zhi-kuan.Research on ROL of wetland plants and its impact on removal of N、P nutrient in Dianchi[D].Taiyuan University of Technology,2010.(in Chinese))
[11] Connell E L,Colmer T D,Walker D I.Radial oxygen loss from intact roots of Halophila ovalis as a function of distance behind the root tip and shoot illumination[J].Aquatic Botany,1999,63(3):219-228.
[12] Dong C,Zhu W,Zhao Y Q,et al.Diurnal fluctuations in root oxygen release rate and dissolved oxygen budget in wetland mesocosm[J].Desalination,2011,272(1):254-258.
[13] Colmer,T D.Long-distance transport of gases in plants:a perspective on internal aeration and radial oxygen loss from roots[J].Plant Cell Environ.,2003,26(1):17-36.
[14] 程康睿,朱伟,董婵,等.水力条件对芦苇湿地系统DO质量浓度的影响[J].水资源保护,2014,30(3):76-80.(CHENG Kang-rui,ZHU Wei,DONG Chan,et al.Effects of different hydraulic conditions on DO concentration in Phragmites australis wetland[J].Water Resources Protection,2014,30(3):76-80.(in Chinese))
[15] Caffrey J M,Kemp W M.Seasonal and spatial patterns of oxygen production,respiration and root-rhizome release in Potamogeton perfoliatus L.and Zostera marina L[J].Aquatic Botany,1991,40(2):109-128.
[16] Laskov C,Horn O,Hupfer M.Environmental factors regulating the radial oxygen loss from roots of Myriophyllum spicatum and Potamogeton crispus[J].Aquatic Botany,2006,84(4):333-340.
[17]杨朝东,张霞,刘国锋,等.植物根中质外体屏障结构和生理功能研究进展[J].植物研究,2013,33(1):114-119.(YANG Chao-dong,ZHANG Xia,LI Guo-feng,et al.Progress on the structure and physiological functions of apoplastic barriers in root[J].Bulletin of Botanical Research,2013,33(1):114-119.(in Chinese))
[18] 邓泓,叶志鸿,黄铭洪.湿地植物根系泌氧的特征[J].华东师范大学学报:自然科学版,2008,(6):69-76.(DENG Hong,YE Zhi-hong,HUANG Ming-hong.Characteristics of radial oxygen loss from root of wetland plants[J].Journal of East China Normal University:Natural Science,2008,(6):69-76.(in Chinese))
[19] Sasikala S,Tanaka N,Wah H S Y W,et al.Effects of water level fluctuation on radial oxygen loss,root porosity,and nitrogen removal in subsurface vertical flow wetland mesocosms[J].Ecological Engineering,2009,35(3):410-417.
[20] 董婵.人工湿地植物释氧规律及对污染物去除的影响[D].河海大学,2011.(DONG Chan.Variations in oxygen release from roots of plants and the effect on pollutants removal in constructed wetlands[D].Hohai University,2011.(in Chinese))
[21] 杨俊兴,任红艳,郭庆军,等.湿地植物通气组织和渗氧对其重金属吸收和耐性研究进展[J].土壤,2014,46(3):394-401.(YANG Jun-xing,REN Hong-yan,GUO Qing-jun,et al.Effects of aerenchyma and radial oxygen loss of wetland plants on their heavy metal uptake and tolerance:a review[J].Soils,2014,46(3):394-401.(in Chinese))
