抗肿瘤化合物E7在不同种属肝微粒体酶中的体外代谢研究
2016-07-09汤明海王海蓉王春艳叶昊宇
汤明海 王海蓉 王春艳 叶昊宇


[摘要]采用商品化的人、Beagle犬、食蟹猴、SD大鼠的肝微粒体酶,考察E7在4个种属肝微粒体中的代谢稳定性,比较代谢的种属差异。采用选择性化学抑制剂,测定不同抑制剂对E7代谢速率的影响,分析预测大鼠肝微粒中参与E7代谢的主要亚酶。实验结果显示E7在人、犬、食蟹猴和大鼠4个种属的肝微粒体中体外代谢半衰期T1/2分别为5775,6930,1690,3013 min;体外固有清除率分别为0004 8,0004 0,0016 4,0009 2 mL·min-1·mg-1。推测E7在人和犬肝微粒体中代谢速率相近,均比较慢;在猴和大鼠肝微粒体中代谢速率相近,均比较快;代谢速率存在明显的种属差异。CYP2E1,CYP2A6, CYP1A2和CYP2D6均可能参与代谢E7,而多态性的CYP3A4对其的代谢贡献较小。
[关键词]E7;肝微粒体;代谢稳定性;酶表型
[Abstract]To investigate the metabolic stability of E7 in liver microsomes of human, Beagle dog, Cynomolgus monkey and SD rats, and compare the metabolic differences between different species Selective chemical inhibitors were used to determine the effects of different inhibitors on E7 metabolic rate, and predict the main enzymes involved in E7 metabolism in rat liver microsomes The experimental results showed that the in vitro halflives (T1/2) of E7 in liver microsomes of human, dog, monkey and rats were 5775, 6930, 1690,3013 min respectively Their intrinsic clearance rate was 0004 8, 0004 0, 0016 4 and 0009 2 mL·min-1·mg-1 respectively Hence, it could be speculated that the metabolic rate of E7 was similarly slow in human and dog liver microsomes; while it was similarly fast in monkey and rat liver microsomes There was significant difference in metabolic rate of E7 between different species The results showed that CYP2E1, CYP2A6, CYP1A2 and CYP2D6 might participate in metabolism of E7, while the contribution of polymorphic CYP3A4 was small
[Key words]E7; liver microsomes; metabolic stability; metabolic phenotype
doi:10.4268/cjcmm20160927
E7是本實验室基于抗肿瘤化合物MPC6827开发的香豆素类化合物,结构见图1,企图在一定程度上保留其抗肿瘤活性的同时,又降低其细胞毒性作用[12]。香豆素类化合物是一类具有苯并α吡喃酮母核的天然产物的总称,是自然界中重要的一类芳香族化合物,广泛分布于动植物中[34],具有抗HIV、抗癌、降压、抗心律失常、抗骨质疏松、镇痛、平喘及抗菌等多种生物活性,且呈浓度效应关系[1,5],其中抗肿瘤作用是一个研究热点[1];植物中提取的天然产物大多毒副作用较低,香豆素类化合物具有相对分子质量小、合成相对简单、溶解度好、生物利用度高等[2]优点。在此基础上,以构效关系为指导,合成目标化合物E7。
实验室前期药理学体外细胞筛选结果表明,该化合物对不同肿瘤细胞B16,A549等均呈现良好的抗肿瘤效果,有进一步开发的可能性。体外代谢方法具有试验简便、周期短等特点,被广泛应用于早期阶段的药物研发。类似于体内实验存在的种属差异,体外代谢实验中不同CYP同工酶能介导不同的代谢反应,因而CYP酶介导的代谢反应和生成的代谢产物种类或量也存在着种属差异[67]。为了全面了解E7在不同种属肝微粒体中的代谢特性,给后续药物开发的体内实验动物选用提供支持,选择了容易获得的啮齿类动物和跟人更接近的大动物[8]的肝微粒体来进行E7体外代谢研究,内容包括①探究E7在不同种属肝微粒中的代谢稳定性;②采用选择性化学抑制剂方法预测E7的代谢表型。
1材料
超高效液相色谱(UPLC)系统:包括溶剂系统(Waters Quaternary Solvent Manager)、进样系统(Waters Sample Manager FTN)、 色谱柱(Waters Acquity UPLCTM BEH C18色谱柱,21 mm×100 mm,17 μm);数据处理软件(Waters MassLynx V41 Software),购自美国Waters公司;三重四极杆质谱(MS):Waters xevo TQD,美国Waters公司;Thermo Heraeus Fresco 17低温冷冻离心机(Thermo Scientific 公司);230VUK涡旋混合器(Labnet International公司);BT125D电子天平(北京赛多利斯仪器有限公司);Milli Q超纯水系统(美国 Merck Millipore公司)。
E7是四川大学生物治疗国家重点实验室以香豆素为基础合成的抗肿瘤药物小分子,经UV,1H和13CNMR,HRMS分析鉴定其结构,通过RPHPLC测定,其纯度大于98%;内标1201A由四川大学生物治疗国家重点实验室合成,经UV,1H,13CNMR,HRMS分析鉴定其结构,纯度大于98%;α萘黄酮(ANF,东京化成工业株式会社);盐酸噻氯匹定(TCP,中国食品药品检定研究院);奎尼丁(QND,TCI上海化成工业发展有限公司);二乙基二硫代氨基甲酸钠(DDTC)、磺胺苯吡唑(SUL)购于美国Sigma;酮康唑(KCZ,Dr Ehrenstorfer公司);甲醇为色谱纯;水为娃哈哈纯净水;其余试剂为分析纯。人肝微粒体(HLM)、SD大鼠肝微粒体(RLM)、Beagle犬肝微粒体(DLM)、猴肝微粒体(MoLM):20 g·L-1,购自武汉普莱特生物医药技术有限公司,于-80 ℃冷冻保存;NADPH发生系统(A液、B液)购自武汉普莱特生物医药技术有限公司,于-80 ℃冷冻保存。
2方法
21储备液和工作液的配制
E7储备液的配制:精密称定E7 1000 mg,使用甲醇作为溶剂定容至10 mL棕色量瓶中,混匀,即得质量浓度为1 g·L-1的E7贮备液,密封,4 ℃冰箱保存备用。工作时,使用甲醇稀释贮备液制成不同梯度浓度的工作液。
内标溶液的配制:精密称定1201A 1000 mg,使用甲醇作为溶剂定容至10 mL棕色量瓶中,混匀,即得质量浓度为1 g·L-1的1201A贮备液,密封,4 ℃冰箱保存。工作时,精密量取贮备液,用甲醇稀释为30 μg·L-1的溶液,密封,4 ℃冰箱保存待用。
22UPLCMS/MS条件
液相条件:Waters Acquity UPLCTM BEH C18色谱柱(21 mm×100 mm,17 μm);柱温 30 ℃;流动相为01%甲酸水(A)甲醇(B),梯度洗脱,0~25 min,60%~90%B;进样体积5 μL。
质谱条件:电喷雾离子化(ESI)方式,检测离子为正离子;毛细管电压3 kV,离子源温度150 ℃,脱溶剂气温度450 ℃,脱溶剂气流量700 L·h-1,锥孔气流量45 L·h-1。以上条件下,采用多级反应监测(MRM)测定E7和内标,其对应的监测离子对和碰撞能量分别是E7(29810→26812, 30 eV),内标(28716→13814,25 eV)。
23E7在肝微粒體体外代谢孵育模型中的代谢稳定性
231代谢稳定性孵育模型参照文献[9]每个孵育体系总体积为2095 μL,体系包括01 mol的PBS缓冲液(pH 74)188 μL,NADPH发生系统12 μL。其中NADPH发生系统由10 μL的Solution A和2 μL的Solution B临用时冰浴上混合制得。冰浴上将2 μL 100 μmol的E7加入孵育体系中,在37 ℃水浴中预热5 min;然后冰浴上分别加入75 μL不同种属的肝微粒体酶,轻轻混匀,置于37 ℃水浴中孵育, 孵育时间为0,5,10,20,30 min。待反应完毕后加入400 μL内标质量浓度为30 μg·L-1的甲醇溶液(4 ℃)终止反应, 平行实验3次,考察E7化合物在不同酶源中的代谢稳定性。
232体外半衰期将孵育0 min E7的浓度作为100%,其他孵育时间点的浓度转换为百分剩余量,将各时间点的百分剩余量的自然对数对孵育时间作线性回归,求算得斜率k,根据公式,T1/2 =-0693/k可以计算得到体外半衰期。肝微粒体中的清除率(CL, mL·min-1·mg-1)=0693×孵育液(mL)/[T1/2(min)×肝微粒体(mg)][6]。
24E7在CYP450酶中的代谢表型研究
代谢表型指特定代谢酶对目标化合物代谢相对贡献的测算,以确定参与药物代谢的主要酶,为预测个体差异和药物间相互作用提供依据。
241代谢表型研究体系根据文献[10],本实验选用的选择性化学抑制剂如下:1 μmol α萘黄酮(αnaphthoflavone,CYP1A2);50 μmol盐酸噻氯匹定(ticlopidine,CYP2C19);10 μmol奎尼丁(quinidine,CYP2D6);100 μmol二乙基二硫代氨基甲酸钠(clomethiazole,CYP2E1);1 μmol酮康唑(ketoconazole,CYP3A4);20 μmol磺胺苯吡唑(sulphaphenazole,CYP2C9)。首先根据231项下温孵系统选择代谢表型反应时间、酶蛋白浓度及底物浓度。
设定E7的孵育浓度为1 μmol,孵育时间为30 min,大鼠肝微粒酶的质量浓度为075 g·L-1。以231项下孵育体系,冰浴上加1 μL浓度为200 μmol的E7溶液,1 μL各选择性化学抑制剂,在37 ℃水浴中预热5 min,然后冰浴上加入75 μL的肝微粒体酶,轻轻混匀。37 ℃水浴中孵育30 min,反应完毕后加入400 μL内标质量浓度为30 μg·L-1的甲醇溶液(4 ℃)终止反应,每个样品平行3次。
另设定未发生反应样品为阴性对照组(不加NADPH发生系统和抑制剂,只加入等量甲醇);设定完全发生反应为阳性对照组(加入NADPH发生系统,但不加抑制剂,只加入等量甲醇)。采用UPLCMS/MS检测E7原形剩余含量,考察不同选择性抑制剂对E7代谢的影响。
242数据处理用待测物的消除速率表示待测物在微粒体孵育体系中的代谢速率;抑制率=1-加入抑制剂样品代谢速率/阳性对照样品代谢速率×100%=1-(阴性对照组浓度-实验组浓度)/(阴性对照组浓度-阳性对照组浓度)×100%。
用计算机程序Excel for Windows (微软公司)和SPSS statistics 170软件数据处理系统进行数据处理和制图。
汤明海等:抗肿瘤化合物E7在不同种属肝微粒体酶中的体外代谢研究25方法学考察[11]
251专属性取PBS缓冲液188 μL,加入75 μL高温灭活的肝微粒体,10 μL的A液和2 μL的B液,记作“孵育体系I”。取“孵育体系I”,加入400 μL甲醇溶液后,按23项下后续的样品处理方法处理进样,即得空白对照样品A。另取“孵育体系I”,然后加入400 μL含内标的甲醇溶液(质量浓度为30 μg·L-1),加入2 μL质量浓度为10 mg·L-1的E7溶液,按23项下后续的样品处理方法处理进样,得对照样品B(E7终浓度为100 μg·L-1)。
252线性关系E7对照品工作液配制:精密量取E7对照品贮备液,用甲醇一次稀释得质量浓度分别为25,5,10,20,40,80,125 mg·L-1的系列对照品工作液。于“孵育体系I”中分别加入2 μL上述系列浓度的对照品工作液涡旋混匀,按23项下方法处理,制得E7理论质量浓度分别为25,50,100,200,400,800,1 250 μg·L-1的系列对照品溶液,按22项下条件进样分析。分别以待测物E7的浓度为横坐标,以样品与内标物的峰面积比值为纵坐标,采用加权最小二乘法进行回归计算,求得直线回归方程,即为样品的工作曲线。
253准确度按照252项下方法,制得质量浓度为50,200,1 000 μg·L-1的低、中、高质控样品进行准确度实验,同法处理后进样分析,计算各浓度质控样品的回收率;每组样品均平行操作5份。
254精密度精密度与准确度采用同样的低、中、高浓度质控样品,用质控样品的日内和日间RSD表示。日内每隔2 h处理一组低、中、高浓度样品,共处理5组,计算日内精密度。日间精密度连续3 d测定3个分析批次,每个浓度测定5个样品来计算日间精密度。
255基质效应按照252项下方法,制得质量浓度为50,200,1 000 μg·L-1的低、中、高质控样品,每组样品平行5份;将测定所得的峰面积A与相同浓度的质控对照品溶液直接进样测定所得到的峰面积B进行比较,即可考查基质效应。基质效应可表示为A/B×100%,基质抑制率=(1-A/B)×100%,此值应小于15%。
3结果
31方法学验证
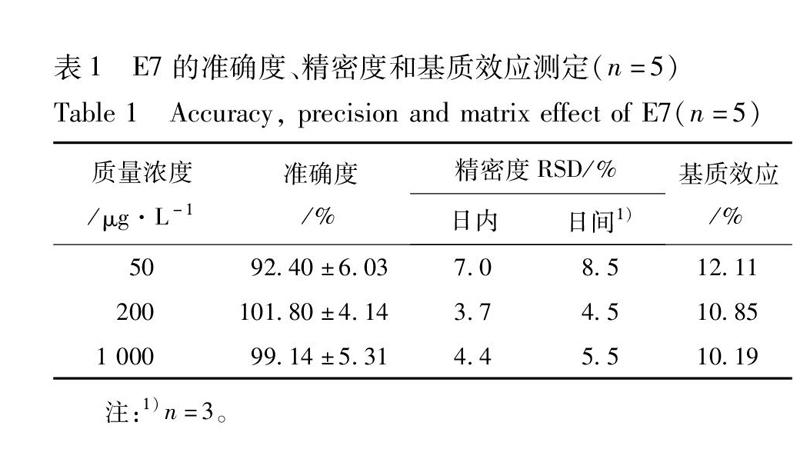
E7和内标的保留时间分别为190,098 min,达到基线分离,且没有受到空白基质的干扰,说明其专属性良好。分别以待测物E7的浓度为横坐标,以样品与内标物的峰面积比值为纵坐标,采用加权最小二乘法进行回归计算,求得直线回归方程,y=0002 3x+0047 7, R2=0994 4,且各濃度的测定值与真实值偏差均小于15%,表明在25~1 250,E7浓度与响应值呈良好的线性关系,符合要求。低、中、高质控样品的回收率分别(9240 ± 603)%,(10180 ± 414)%,(9914 ± 531)%。实验结果表明该浓度范围内回收率较高,准确度符合要求,测定结果准确、可信。日内、日间精密度的RSD都小于9%,符合要求。基质抑制率小于13%,基本不会对测定产生影响。方法学验证的结果表明,该方法特异性、准确度、精密度和基质效应等均符合本实验的要求,见表1。
32E7在不同种属肝微粒体中的代谢稳定性
分别考察了E7在人、犬、猴、大鼠肝微粒体中的代谢稳定性,E7在4个种属的肝微粒体中均有较明显代谢,孵育时间与底物剩余百分比的孵育曲线见图2。E7在人、犬、猴、大鼠肝微粒体酶中均发生代谢,20 min内代谢较快;孵育20~30 min,剩余底物的量变化较小,趋于稳定。
33体外半衰期与固有清除率
在人、犬、猴、大鼠肝微粒体中,以底物剩余百分比的自然对数与孵育时间作线性回归,大鼠肝微粒体中的线性回归方程为y=-0023x+4410,R2=0877;犬肝微粒体中的线性回归方程为y=-0010x+4566,R2=0885;猴肝微粒体中的线性回归方程为y=-0041x+4410,R2=0880;人肝微粒体中的线性回归方程为y=-0012x+4475,R2=0732。由各线性曲线的斜率计算体外代谢半衰期与固有清除率,结果见表2。
34E7在大鼠肝微粒体中的代谢表型
E7的CYP代谢是由多酶介导的,抑制剂二乙基二硫代氨基甲酸钠(CYP2E1特异性抑制剂),毛果芸香碱(CYP2A6特异性抑制剂),α萘黄酮(CYP1A2特异性抑制剂)和奎尼丁(CYP2D6特异性抑制剂)是参与其代谢的主要同工酶,代谢抑制率分别是7824%,7265%,6828%,6003%,与不加化学抑制剂的空白对照组相比代谢酶活性有均显著性差异(P<001),表明CYP2E1,CYP2A6,CYP1A2,CYP2D6可能参与代谢E7,见表3。表3各抑制剂对大鼠肝微粒中E7代谢的影响
4讨论
本文首次建立了香豆素类抗肿瘤化合物E7的UPLCMS/MS测定方法,该方法专属性强、灵敏度高、准确度高、重复性好。E7在人、犬、食蟹猴和大鼠等4个不同种属的肝微粒体中体外代谢半衰期T1/2分别为5775,6930,1690,3013 min;体外固有清除率分别为0004 8,0004 0,0016 4,0009 2 L·min·g-1,推测E7在人和犬肝微粒体中代谢速率相近,均比较慢;在猴和大鼠肝微粒体中代谢速率相近,均比较快;表明其代谢速率存在明显的种属差异。本实验的结果有助于药物开发人员在后续研究中选择最相关的动物(犬)进行E7的体内药物代谢研究,进而预测E7在人体的代谢情况[8]。而猴和大鼠,因为E7在其中的代谢性质跟人差异比较大,并不能准确预测E7在人体的代谢情况,在后续的实验中将不作考虑。 CYP2E1,CYP2A6, CYP1A2和CYP2D6均可能参与代谢E7,而多态性的CYP3A4对其的代谢贡献较小。相对于药物间相互作用,E7由多种代谢酶代谢,这将大大降低因体内某一种酶被诱导或抑制而导致严重不良反应的风险;同时,多态性的代谢酶对其代谢贡献小,也就降低因CYP基因多态性而引起个体差异的几率,故针对药物间相互作用,E7表现出理想的代谢表型特性。
[参考文献]
[1]Sirisoma N, Pervin A, Zhang H, et al. Discovery of N(4methoxyphenyl) N,2dimethylquinazolin4amine, a potent apoptosis inducer and efficacious anticancer agent with high blood brain barrier penetration[J]. J Med Chem, 2009, 52:2341.
[2]Kasibhatla S, Baichwal V, Cai S X, et al. MPC6827:a smallmolecule inhibitor of microtubule formation that is not a substrate for multidrug resistance pumps[J]. Cancer Res, 2007, 67(12):5865.
[3]郝光,王振国,付文艳,等. 香豆素类化合物抗肿瘤作用研究进展[J]. 中国中药杂志, 2008, 33(18):2016.
[4]孔令雷,胡金凤,陈乃宏. 香豆素类化合物药理和毒理作用的研究进展[J]. 中国药理学通报,2012, 28(2):165.
[5]楊秀伟,徐波,冉福香,等. 11种香豆素类化合物对人膀胱癌细胞系EJ细胞株生长抑制活性的筛选[J]. 中西医结合学报,2007, 5(1):56.
[6]焦士勇,艾常虹,李爱芳,等. 补骨脂酚的体外肝微粒体代谢及代谢减毒作用的种属比较[J]. 中国药理学通报,2011, 27(2):216.
[7]庄笑梅,林庆辉,李春正,等. 罗通定在人、比格犬和大鼠肝微粒体代谢转化的体外比较研究[J]. 中国药理学通报,2009, 25(9):1147.
[8]Martignoni M, Groothuis M M, Kanter R. Species differences between mouse, rat, dog, monkey andhuman CYPmediated drug metabolism, inhibition and induction[J]. Drug Metab Toxicol, 2006, 2(6):875.
[9]Cohen L H, Remley M J, Raunig D, et al. In vitro drug interactions of cytochrome p450:an evaluation of fluorogenic to conventional substrates[J]. Drug Metab Dispos, 2003, 31:1005.
[10]刘治军,傅得兴,汤光. FDA药物相互作用研究指南(草案)2006版解读[J]. 国际药学研究杂志, 2008, 35(1):50.
[11]张剑萍,郭澄. 生物样品分析中的方法学验证[J]. 中国药房, 2008, 19(31):2469.
[责任编辑曹阳阳]
