扶正化瘀胶囊对二甲基亚硝胺诱导的肝纤维化大鼠血
2016-07-09高国瑗郑希元彭渊陶艳艳刘平杨涛刘成海
高国瑗 郑希元 彭渊 陶艳艳 刘平 杨涛 刘成海

[摘要]探讨扶正化瘀胶囊(Fuzheng Huayu capsules,FHC)对二甲基亚硝胺(dimethylnitrosamine,DMN)诱导的肝纤维化模型大鼠血清代谢组学的影响。应用液质联用技术分别建立对照组、模型组和FHC组的大鼠血清代谢图谱,并定量分析各组内源性代谢物——氨基酸和胆汁酸水平。实验结果表明,FHC组大鼠的血清代谢指纹谱与模型组存在显著差异,采用主成分分析(PCA)和偏最小二乘法(PLSDA)初步鉴定了潜在5种溶血磷脂胆碱类生物标记物。再通过定量分析各组大鼠血清氨基酸和胆汁酸的水平,发现FHC治疗4周后血清中失调的14种氨基酸和5种胆汁酸水平明显有回归正常水平的趋势。由此可见,FHC抗肝纤维化作用机制可能涉及到溶血磷脂胆碱类、氨基酸和胆汁酸的代谢过程。
[关键词]扶正化瘀;肝纤维化;代谢组学;液质联用;生物标记物
[Abstract]To investigate the effect of Fuzheng Huayu capsule(FHC) on serum metabolomics in rats with liver fibrosis induced by dimethylnitrosamine(DMN) The metabolic profiles of rat serum of normal group, model group, and FHC group were established by liquid chromatographymass spectrometry technology Furthermore, the levels of endogenous metabolites such as amino acids and bile acids were measured in each group The results showed that there were significant differences in the serum metabolic fingerprints between the FHC group and the model group Moreover, 5 potential lysophosphatidylcholines biomarkers were identified by using principal component analysis(PCA) and partial least squares discriminant analysis (PLSDA) Quantitative analysis of amino acids and bile acids in serum of rats showed that 14 kinds of amino acids and 5 kinds of bile acids returned to normal levels after four weeks of FHC treatment In conclusion, the antihepatic fibrosis mechanisms of FHC may be related to the metabolic process of lysophosphatidylcholines, amino acids and bile acids
[Key words]Fuzheng Huayu capsules; liver fibrosis; metabolomics; UPLCMS/MS; biomarker
doi:10.4268/cjcmm20160925
扶正化瘀膠囊(Fuzheng Huayu capsules,FHC)是国家食品药品监督管理局(CFDA)批准的抗肝纤维化中药产品,由虫草菌丝、丹参、桃仁、五味子、松黄粉及绞股蓝组成,针对慢性乙肝、肝炎后肝硬化正气(肝、脾、肾)虚损、血瘀阻络、湿热内留这一中医基本证候病机特点。该方可改善肝炎后肝硬化患者肝功能、调整异常免疫功能和降低血清肝纤维化标志物水平等,对乙肝肝纤维化的组织学逆转率达52%,且肝组织炎症活动度也有明显改善[1]。其作用机制包括抗脂质过氧化损伤、保护肝细胞炎性坏死与凋亡、调节转化生长因子(TGF)β1/Smads 信号通路与抑制肝星状细胞(HSC)活化、调节胞外基质代谢和抑制肝血管新生等[2]。通过血清成分分析发现一些潜在抗肝纤维化的活性成分[3],并发现这些成分在肝纤维化大鼠的药代动力学与组织分布存在明显的差异[4]。课题组在最近研究中采用液质联用技术发现临床肝硬化腹水的患者血清中3种磷脂胆碱类的潜在标志物,并且还发现血清中氨基酸和胆汁酸代谢均有显著变化[5]。FHC(片)作为临床常用的抗肝纤维化中药,在治疗肝纤维化的过程中对血清代谢组学是否会产生影响还不得而知。本文拟建立二甲基亚硝胺诱导的肝纤维化大鼠模型,采用液质联用技术考察FHC治疗后的肝纤维化大鼠代谢组学的变化特征,重点对前期临床发现的血清代谢组学特征物进行研究,阐明FHC对肝纤维化大鼠代谢组学的影响,为从代谢组学角度阐明扶正化瘀方的作用机制奠定基础。
1材料
ACQUITYTM超高效液相色谱仪SYNAPT G2高分辨率飞行时间质谱仪、ACQUITY UPLCQuattro Premier XE超高效液相色谱三重四级杆质谱联用仪及MassLynxTM 41工作站软件(美国 Waters 公司);病理分析系统(德国Leica公司),包括自动脱水机(ASP300)、轮转切片机(RM2035)、包埋机(EG1160)、浸蜡机(HI1210)、烤片机(HI1220);5415R台式高速冷冻离心机(德国 Eppendorf 公司);BP211D 电子天平(德国Sartorius公司);SB5200D超声清洗仪(宁波新芝生物科技股份有限公司);VX200涡旋振荡器(美国 Labnet Inernational公司);PURELAB classic UVF 纯水仪(英国ELGA公司)。
FHC(批号110202,规格03 g)由上海现代中医药股份有限公司提供;二甲基亚硝胺(dimethylnitrosamine,DMN)购自东京化成工业株式会社;血清肝功能试剂盒,包括丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、白蛋白(ALB),均购自南京建成生物工程研究所;苯丙氨酸(Phe)、色氨酸(Trp)、酪氨酸(Tyr)、甲硫氨酸(Met)、缬氨酸(Val)、丙氨酸(Ala)、苏氨酸(Thr)、丝氨酸(Ser)、赖氨酸(Lys)、精氨酸(Arg)、天门冬酰胺(Asn)、谷氨酰胺(Gln)、亮氨酸(Lue)、异亮氨酸(Ile)、谷氨酸(Glu)、组氨酸(His)、脯氨酸(Pro)、胆酸(CA)、去氧胆酸(DCA)、鹅去氧胆酸(CDCA)、猪去氧胆酸(HDCA)、甘氨胆酸(GCA)、牛磺胆酸(TCA)、牛磺去氧胆酸(TDCA)、牛磺鹅去氧胆酸(TCDCA)、牛磺猪去氧胆酸(THDCA)等均购自中国医药集团上海化学试剂公司;色谱纯乙腈和甲醇购自Fisher 公司;實验用水为自制超纯水(Millipore 制备);其他分析纯试剂均购自中国医药集团上海化学试剂公司。
Wister大鼠30只,雄性,体重(180±20) g,SPF级,购自上海斯莱克实验动物有限公司,合格证号SCXK(沪)20070005,饲养于上海中医药大学实验动物中心,自由饮食饮水。
2方法
21模型制备与给药
所有大鼠适应环境1周后,按体重分层,随机分为对照(Control)、模型(Model)和FHC 3组,每组10只。模型组与FHC组腹腔注射DMN,剂量10 μg·kg-1,每周连续3 d ,连续4周,首次注射剂量为正常剂量2/3[6]。造模第3周,FHC组给予扶正化瘀胶囊40 g·kg-1(相当于60 kg成人体重剂量),每周连续7 d,连续4周。对照组大鼠给予等体积双蒸水灌胃,剂量为2 mL·kg-1。
22样品的采集与处理
分别于DMN造模前、造模后和给药4周后(最后一次给药后24 h),经大鼠眼底静脉丛采全血2 mL,于4 ℃冰箱静置2 h,再以4 000 r·min-1离心10 min,分离血清,-80 ℃保存;最后一次取血后,各组大鼠脱颈椎处死,并打开腹腔,摘取肝脏,取最大叶03 cm×08 cm×10 cm大小的肝组织2块,用于普通病理。
23肝功能与肝纤维组织病理学观察
血清肝功能指标ALT,AST和ALB的活性采用相关试剂盒检测。肝组织经40 g·L-1甲醛溶液固定之后,予梯度酒精脱水,石蜡包埋, 分别进行苏木精伊红染色(HE染色)和天狼猩红染色,光镜下观察肝组织炎症和纤维化程度。
高国瑗等:扶正化瘀胶囊对二甲基亚硝胺诱导的肝纤维化大鼠血清代谢组学的影响24代谢组学数据采集
241血清样品制备精密吸取100 μL大鼠血清,加入乙腈甲醇(1∶1)混合溶液400 μL,涡旋振荡1 min,4 ℃离心15 min(20 000×g),得到上清液A。上清A用乙腈甲醇溶液稀释后,用于UPLCMS样本分析和氨基酸轮廓分析。取上清A 300 μL并氮气吹干(35 ℃)。残渣用100 μL的初始流动相复溶,涡旋振荡1 min,4 ℃再离心10 min(20 000×g),吸取上清液B,用于UPLCMS胆汁酸轮廓分析。
242代谢指纹谱的色谱质谱条件色谱条件:WatersACQUITYTM UPLC系统,配以ACQUITY UPLC HSS T3色谱柱(21 mm×150 mm, 18 μm);流动相水(A)乙腈(B),梯度洗脱,0~6 min,90%~40%A,6~10 min,40%~20%A,10~16 min,20%~10%A,16~165 min,10%~90%A,流速03 mL·min-1;柱温30 ℃;进样体积5 μL。
质谱条件:MALDO SYNAPTTM G2 高分辨质谱仪(Waters,美国),电喷雾离子化(ESI)源。正离子全扫描模式时,毛细管电压35 kV;锥孔电压35 V;离子源温度120 ℃;脱溶剂温度300 ℃;脱溶剂气流速800 L·h-1(N2);锥孔气流50 L·h-1。负离子全扫描模式时,毛细管电压28 kV;锥孔电压45 V,其他条件同正离子模式;N2(纯度999%)和氩气(纯度99999%)分别用作锥孔气及碰撞气。质谱范围m/z 100~1 000;扫描时间02 s。
243氨基酸和胆汁酸的定量分析氨基酸定量分析参照文献[7]。色谱条件:WatersACQUITYTM UPLC系统,色谱柱为TSKGEL AMIDE80(50 mm×20 mm, 3 μm);流动相为乙腈(A)5 mmol·L-1醋酸铵(01%甲酸,B),梯度洗脱,0~3 min,70%A,3~55 min,70%~50%A,55~80 min,50%A,流速015 mL·min-1;柱温45 ℃;进样体积5 μL。质谱条件:ESI源;正离子检测;离子源温度20 ℃;脱溶剂温度300 ℃;脱溶剂气(N2);流速600 L·h-1;锥孔气(N2);流速50 L·h-1;碰撞气为氩气(Ar);碰撞能15 eV。
胆汁酸定量分析参照文献[8]。色谱条件:WatersACQUITYTM UPLC系统,色谱柱为ACQUITY UPLC BEH 柱 (10 mm × 100 mm,17 μm);流动相甲醇(A)5 mmol·L-1醋酸铵(01%甲酸,B),梯度洗脱,0~1 min,55%A,1~26 min,55%~62%A,26~114 min,62%~80%A,流速03 mL·min-1;柱温45 ℃;进样体积为5 μL。质谱条件:ESI源;负离子检测;离子源温度120 ℃;脱溶剂温度300 ℃;脱溶剂气(N2)流速700 L·h-1;锥孔气(N2)流速50 L·h-1;碰撞气为氩气(Ar);碰撞能20~35 eV。
氨基酸和胆汁酸的定量方法学验证依据美国FDA生物样品分析指导原则实施,分别进行校正曲线、精密度、稳定性、加样回收率、基质效应等方法学验证研究,其结果均在可接受范围。
25数据采集与处理
采用SPSS 180软件中OneWay ANOVA对药理数据进行分析,所有数据用±s表示,两两比较用t检验,结果以P<005表示有显著性差异。血清代谢组学数据采用MassLynxTM 41工作软件、SIMCAP(version 120,Umetrics,Umea,瑞典)中主成分分析(PCA)进行数据处理。
3结果与分析
31生化及病理实验
311FHC对肝纤维化大鼠肝功能的影响与对照组相比,模型组血清ALT和AST水平显著性上升(P<001),ALB水平显著性下降(P<001)。经FHC给药后,血清ALT和AST水平显著性下降(P<001),血清ALB水平有一定差异(P=007),结果见表1。
312FHC对肝纤维化大鼠肝组织病理的影响光镜下HE染色显示,正常大鼠肝小叶结构清晰,肝细胞索由中央静脉向四周呈放射状排列,可见少许窦旁细胞,汇管区可见极少量纤维结缔组织。造模4周结束时模型大鼠肝脏可见大面积出血坏死,并见大量肿胀坏死的肝细胞,同时有大量淋巴细胞、单核细胞等炎性细胞浸润,肝窦扭曲变形;汇管区明显
表1扶正化瘀胶囊对二甲基亚硝胺诱导肝纤维化大鼠血清肝功能水平的影响
Table 1Effects of FHC on serum ALT,AST and ALB in rats simulated by DMN
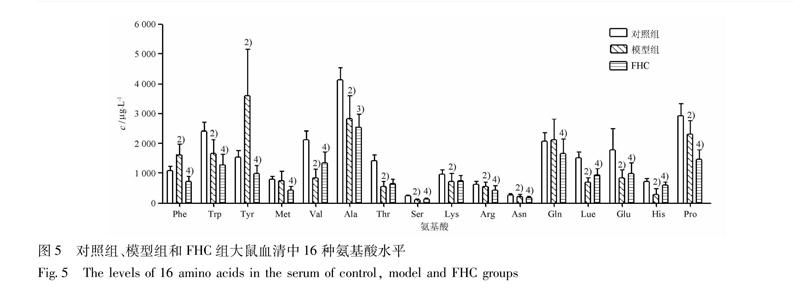
组别ALT/U·L-1AST/U·L-1ALB/g·L-1对照101±33255±54373±25模型520±1232)615±1242)286±182)FHC184±484)338±834)297±24注:与对照组相比1)P<005,2)P<001; 与模型组相比3)P<005,4)P<001(图5,6同)。
增宽,广泛增生的纤维组织形成间隔,将肝小叶分割包绕成大小不等的假小叶;经FHC给药后,大鼠肝脏的肝细胞变性、坏死,肝内出血、纤维增生都有不同程度的改善。天狼猩红染色显示正常大鼠肝脏内仅在汇管区和中央静脉壁见到少量胶原纤维。模型大鼠肝脏纤维组织弥漫性增生严重,大多数形成较厚的完全间隔,向肝小叶组织内伸展,分割包绕肝组织,形成假小叶;经FHC给药后,大鼠肝脏弥漫性纤维组织增生程度减轻,纤维间隔菲薄,见图1。
A和D为对照组,B和E为模型组,C和F为 FHC组;A,B,C为HE染色,D,E,F为肝组织天狼星红染色。
图1肝组织HE 染色(×200)和肝组织天狼星红染色(×100)
Fig1HE staining in hepatic tissue(×200) and sirius red staining in hepatic tissue(×100)
32血清代谢组学
321各组大鼠血清样品总离子流色谱图为了筛选大鼠血清的代谢组学特征,样品采用UPLCG2高分辨质谱分析。连续给药4周后,对照组、模型组与FHC组大鼠血清样品总离子色谱图见图2。
322主成分分析将所有样本的UPLCMS/MS数据进行PCA和PLSDA分析,结果见图3,4。结果显示,主成分积分值集中分布于椭圆形散点图的3个区域,对照组分布在右下方,模型组分布在正上方,FHC组分布在左下方。FHC组与对照组、模型组均存在一定距离,说明药物在代谢过程中对血清中化学成分的影响比较显著。给药后,FHC组各点有向对照组样本点接近的趋势。
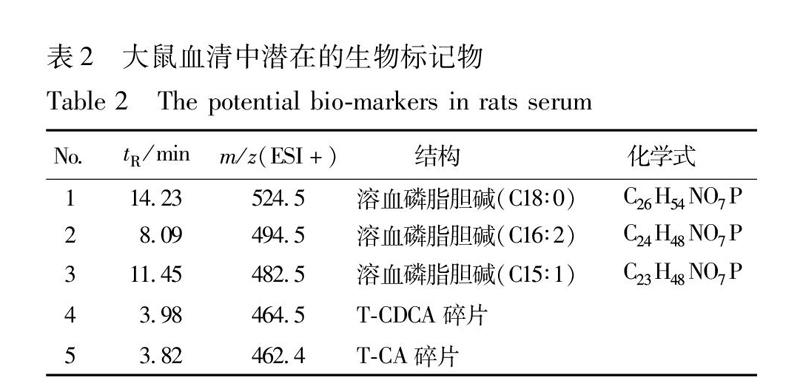
为了找出发生显著变化(P<005)的生物标志物,对模型组与对照组及模型组与各给药组进行PLSDA分析,并得到代谢物载荷图,结果见图3,4。对照组和模型组能够很好的分开,说明2组之间血清中的化学成分发生明显改变。模型组大鼠经FHC给药后,有向对照组回归的趋势,且3组样本间存在明显的差异物质。通过寻找明显差异的化学成分,对差异物质的化学结构进行确定(通过精确相对分子质量,对照品及其二级碎片比对),初步鉴定了其中5个差异性物质,即潜在生物标记物,分别为溶血磷脂胆碱(C18∶0),溶血磷脂胆碱(C16∶2),溶血磷脂胆碱(C15∶1),TCDCA碎片,TCA碎片,结果见表2。
323氨基酸代谢轮廓分析连续给药4周后,对照组、模型组和FHC组大鼠血清中氨基酸水平见图5。与对照组比较,模型组的芳香族氨基酸苯丙氨酸和酪氨酸的血清水平升高非常显著(P<001);而色氨酸、缬氨酸、丙氨酸、苏氨酸、丝氨酸、赖氨酸、精氨酸、天门冬酰胺、亮氨酸、谷氨酸、脯氨酸和组氨酸等12种氨基酸下降非常显著(P<001);甲硫氨酸和谷氨酰胺含量无显著性差异。经FHC治疗4周
324胆汁酸代谢轮廓分析连续给药4周后,对照组、模型组和FHC组大鼠血清中胆汁酸水平见图6。实验结果表明,二甲基亚硝胺诱导的肝纤维化模型大鼠血清中牛磺猪去氧胆酸、牛磺胆酸、牛磺鹅去氧胆酸、猪去氧胆酸和胆酸的水平非常显著高于对照组(P<001),牛磺去氧胆酸水平也显著性上升(P<005);且鹅去氧胆酸水平呈非常显著性下降(P<001),甘氨胆酸含量也呈显著性下降(P<005);去氧胆酸则无显著性差异。经FHC治疗4周后,与模型组大鼠比较,牛磺猪去氧胆酸、牛磺胆酸、牛磺鹅去氧胆酸、猪去氧胆酸、胆酸等5种胆汁酸水平下降非常显著(P<001),呈回归正常水平的趋势。
4讨论
代谢组学是继基因组学、蛋白组学之后发展起来的一门新学科,是通过考察生物体系受刺激或扰动后,其代谢产物的变化或其随时间的变化,是研究生物体系的一门科学[9]。代谢组学与中医治疗疾病的整体观念相一致,在疾病诊断及药物研发等方面已有广泛应用[1011]。代谢组学在肝脏相关研究中已有所应用,如关于逍遥散对大鼠肝纤维化保护作用的机制研究[12],以及疏肝健脾方防治肝纤维化的可能作用机制研究[13]。本研究首次采用液质联用技术,考察了FHC对二甲基亚硝胺诱导的肝纤维化大鼠血清代谢组学的影響,结合主成分分析法,发现FHC治疗后,代谢指纹谱图与模型组大鼠存在显著差异,并且鉴定出溶血磷脂胆碱(C18∶0),溶血磷脂胆碱(C16∶2),溶血磷脂胆碱(C15∶1),TCDCA碎片,TCA碎片等5种潜在生物标记物,可用于定性表征FHC的治疗作用。此外,肝脏是机体物质代谢的中枢器官,富含与氨基酸分解代谢有关的酶,是氨基酸代谢的重要场所之一,在氨基酸的新陈代谢及蛋白质的合成与分解中发挥了重要的作用。当肝细胞功能障碍时,氨基酸代谢受到影响[14]。本研究发现DMN诱导大鼠肝纤维化后,除甲硫氨酸和谷氨酰胺含量无显著性差异,血清中有另外16种内源氨基酸水平发生显著改变。而FHC治疗后内源氨基酸水平有显著回归正常水平的趋势,这印证肝功能指标和肝纤维化病理切片的数据,提示FHC纠正了肝纤维化导致的血清氨基酸水平的紊乱。同样的现象在胆汁酸代谢中也被发现。胆汁酸是在肝细胞内由胆固醇转变而来,是肝脏清除体内胆固醇的主要方式,因此,胆汁酸代谢变化可直接反映肝功能的状态[15]。FHC的治疗使肝纤维化大鼠中的牛磺猪去氧胆酸、牛磺胆酸、牛磺鹅去氧胆酸、猪去氧胆酸、胆酸等5种紊乱的胆汁酸水平向正常水平回归趋势。总而言之,FHC对二甲基亚硝胺诱导的肝纤维化大鼠血清代谢物质紊乱有明显的恢复作用,其抗肝纤维化作用机制可能涉及到溶血磷脂胆碱类、氨基酸和胆汁酸的代谢过程,这为将来从这些代谢途径阐明FHC的抗纤维化作用奠定了基础。
[参考文献]
[1]刘平,胡义扬,刘成,等. 扶正化瘀胶囊干预慢性乙型肝炎肝纤维化作用的多中心临床研究[J]. 中西医结合学报, 2003, 1(2): 89.
[2]Liu C, Hu Y, Xu L, et al. Effect of Fuzheng Huayu formula and its actions against liver fibrosis [J]. Chin Med, 2009, 4(6):1.
[3]沈丹萍,杨莉,陶艳艳,等. 分析扶正化瘀方中五味子的入血成分[J]. 中国中药杂志,2011,36(7): 854.
[4]Yang T, Liu S, Zheng T H, et al. Comparative pharmacokinetics and tissue distribution profiles of lignan components in normal and hepatic fibrosis rats after oral administration of Fuzheng Huayu recipe [J]. J Ethnopharmacol,2015, 166: 305.
[5]Yang T, Zheng X Y, Xing F, et al. Serum metabolomic characteristics of patients with liver cirrhotic ascites [J]. Integr Med Int, 2014, 1:135.
[6]王丽娜,刘成海,陈园,等. 一种改良的二甲基亚硝胺纤维化模型诱导方法及其病理特点[J]. 中国实验动物学报,2007,15(2): 90.
[7]Xu Y, Yang L, Yang F, et al. Metabolic profiling of fifteen amino acids in serum of chemicalinduced liver injured rats by hydrophilic interaction liquid chromatography coupled with tandem mass spectrometry [J]. Metabolomics, 2011, 8:475.
[8]Yang L, Xiong A, He Y, et al. Bile acids metabonomic study on the CCl4 and alphanaphthylisothiocyanateinduced animal models: quantitative analysis of 22 bile acids by ultraperformance liquid chromatographymass spectrometry [J]. Chem Res Toxicol, 2008, 21(12):2280.
[9]Preeti B, Stephanie M, Moon K H, et al. PlantMetabolomics. org: a web portal for plant metabolomics experiments[J]. Plant Physiol,2010, 152:1807.
[10]侯丽娟,许清玉,段树鹏,等. 尿液代谢组学诊断乙肝患者的抑郁症状[J]. 上海交通大学学报,2014,34(11):1647.
[11]Stewart J D, Bolt H M. Metabolomics: biomarkers of diease and drug toxicity [J]. Arch Toxicol, 2011, 85:3.
[12]張宁,方衡,王雪,等. 逍遥散对实验性肝纤维化大鼠模型干预作用的代谢组学研究[J]. 药物分析杂志,2014,4:588.
[13]高家荣,陈金锋,姜辉,等. 疏肝健脾方对四氯化碳诱导的肝纤维化大鼠肝脏代谢组学的影响[J]. 中医杂志,2015(11):961.
[14]秦环龙. 肝功能不全时氨基酸代谢变化与支链氨基酸的治疗作用[J]. 肠外与肠内营养,2004,11(4): 249.
[15]曹学民. 血清总胆汁酸测定在肝脏疾病中的临床意义[J]. 中国实验诊断学,2011(1):151.
[责任编辑曹阳阳]
