基于网络药理学方法探讨通塞脉片治疗动脉粥样硬化的作用机制
2016-07-09李娜张新庄王俨如曹亮丁岗王振中萧伟徐筱杰
李娜 张新庄 王俨如 曹亮 丁岗 王振中 萧伟 徐筱杰


[摘要]該研究利用网络药理学方法探索通塞脉片治疗动脉粥样硬化的药效物质和分子作用机制。经分子对接、分子靶蛋白网络分析发现,通塞脉片中有97个分子可与动脉粥样硬化相关靶蛋白产生较好的相互作用(对接得分大于等于7),其中37个分子可作用于2个以上靶点,且具有较高的介数,推测这37个分子可能是通塞脉片治疗动脉粥样硬化的主要活性成分群。同时,所预测活性成分中含有较多的黄酮类和皂苷类化合物,提示该2类成分应在药效物质基础和质量标准研究中重点关注。靶点网络特征分析显示,通塞脉片主要活性成分可通过与Toll 样受体(TLR1,TLR2)、基质金属蛋白酶(MMP1,MMP2,MMP3,MMP9)、血管紧张素转化酶(ACE)、白三烯A4 水解酶(LTA4H)、5脂氧酶(5LOX)、过氧化物酶体增殖物激活受体(PPARα,PPARγ)等22个主要靶蛋白作用,起到调节炎症、增加斑块稳定性、保护内皮细胞、参与血脂调节及抗凝等作用,从而参与对动脉粥样硬化病理过程不同环节的调控,最终实现对动脉粥样硬化的治疗。该研究揭示了通塞脉片治疗动脉粥样硬化的主要药效物质及其可能的分子作用机制,印证了通塞脉片多成分、多靶点、整体调节的作用特点,为后续系统进行通塞脉片药效物质基础和作用机制实验研究提供了理论依据。
[关键词]中药;通塞脉片;网络药理学;分子对接;动脉粥样硬化
[Abstract]Network pharmacology method was adopted in this study to explore the active compounds and mechanism of Tongsaimai tablets for atherosclerosis In molecular docking and moleculartarget protein network analysis, 97 molecules in Tongsaimai tablets showed good interaction with the atherosclerosisrelated target protein (docking score≥7), and 37 molecules of them could act on more than 2 targets (≥2) with higher betweenness, suggesting that these 37 molecules might be the main active compounds group in Tongsaimai tablets for atherosclerosis treatment Furthermore, the predicted active compounds contained more flavonoids and saponins, reminding more attention should be paid on flavonoids and saponins in study of effective compounds and quality standards of Tongsaimai tablets Targets network analysis showed that, the active compounds of Tongsaimai tablets could regulate inflammation, stabilize plaque, protect vascular endothelial cell, regulate blood lipid and inhibit blood coagulation through acting on the main 22 target proteins, such as Tolllike receptors (TLR1, TLR2), matrix metalloproteinase (MMP1, MMP2, MMP3, MMP9), angiotensin converting enzyme (ACE), leukotriene A4 hydrolase (LTA4H), 5lipoxidase (5LOX), peroxisome proliferatorsactivated receptors (PPARα, PPARγ) These active compounds can participate in regulating different pathologic stages of atherosclerosis and thus treat atherosclerosis finally This study revealed the main active compounds and possible mechanism of Tongsaimai tablets for treatment of atherosclerosis and meanwhile, verified the characteristics of multicomponents, multitargets and integral regulation for Tongsaimai tablets, providing theoretical references for the following systematic laboratory experiments on effective compounds and action mechanism of Tongsaimai Tablet
[Key words]traditional Chinese medicine; Tongsaimai tablet; network pharmacology; molecular docking; atherosclerosis
doi:10.4268/cjcmm20160922
动脉粥样硬化(atherosclerosis,AS)是一种可由高胆固醇血症、高血压、糖尿病、吸烟等多种危险因素诱发的慢性疾病[12], 其特征性病理过程包括脂质代谢紊乱、血管内皮细胞受损及炎性细胞浸润、斑块破裂和血栓形成等,是导致多种心脑血管疾病发生的重要病理基础[3]。动脉粥样硬化性心血管疾病的发病率呈逐年上升趋势,尽管在预防和治疗方面取得了较好的进展,但其仍是世界范围内导致死亡的主要原因[45]。因而,对动脉粥样硬化的治疗一直是医药学界研究的重点。通塞脉片是在古方四妙勇安汤(《验方新编》)基础上研制而成的中成药,由黄芪、党参、当归、金银花、玄参、石斛、牛膝、甘草8味中药组成,具有活血祛瘀、益气养阴、通调脉络之功效,临床上对动脉粥样硬化、脑梗死等显示了较好的治疗作用[69]。药理学研究亦表明,通塞脉片可通过抗炎、清除自由基、保护内皮细胞等对大鼠实验性动脉粥样硬化起到改善或治疗作用[1013]。化学成分研究显示,通塞脉片各组方药材的研究较为深入,但全方尚未见有系统研究的报道。质量标准研究表明阿魏酸(ferulic acid)、甘草酸(glycyrrhizic acid)、绿原酸(chlorogenic acid)、齐墩果酸(oleanolic acid)、黄芪甲苷(astragoloside IV)、哈巴苷(harpagide)及哈巴俄苷(harpagoside)等可作为通塞脉片的质控成分[1416]。通塞脉片抗动脉粥样硬化的作用机制目前也有一些探索[11,1719],但缺乏系统性。中药复方研究的复杂性使得系统研究并揭示通塞脉片药效物质基础和分子作用机制存在一定困难。
网络药理学提供了一种从系统水平研究中药复方潜在活性成分和作用靶点的新策略,特别适宜于反映及阐释中药多成分多靶点的作用关系,与中药能从整体水平调控机体,发挥治疗作用的观点相吻合,网络药理学研究理念已被引入中药领域,并得到认可和应用[2023]。为此,本研究尝试采用网络药理学方法分析通塞脉片治疗动脉粥样硬化的药效物质基础和可能的分子作用机制,以期为深入开展通塞脉片基础实验研究及临床合理应用提供理论依据。
1材料与方法
11分子对接文献分析显示,动脉粥样硬化是一种慢性血管疾病,血管内皮细胞损伤、脂质沉积为其始动因素。炎症、巨噬细胞浸润、胞外基质水解、氧化应激、细胞凋亡等相互交织参与其形成过程,并逐渐演变为不稳定斑块。最终以不稳定斑块为基础形成血栓,导致严重的心脑血管临床事件,如心绞痛、心肌梗塞、猝死及中风等[1,2426]。基于此,笔者经文献调研初步获得了195个靶蛋白[1,2741],并经RCSB数据库进一步筛选,最终选取了30个含有原配体的靶蛋白晶体复合物(表1)。同时,依据通塞脉片的处方组成,从江苏康缘药业股份有限公司创建的中医药网络药理学智能信息平台(traditional Chinese medicine network pharmacology intelligent information platform,TCMN)数据库[42]中检索得到755个小分子化合物结构。在确定以上靶点和成分信息的基础上,根据靶点的uniprot和化合物的TCMC编号获得成分与靶点的分子对接得分。分子对接的具体参数如下:在以AutoDock 40为内核的DOVIS 20平台上进行分子对接,以原配体为活性中心,盒子大小为40 ×40 ×40 ,格点间隔为0375 ,分子构象搜索采用拉马克遗传算法(LGA),初始种群数为150,平移步长为02 nm,旋转步长为50°,突变率为002,交叉率为08,局部搜索频率为006,其余为默认值。
12网络构建根据分子对接结果,在得分高于原配体的基础上,选取对接得分大于等于7的分子靶蛋白数据对导入Cytoscape 321构建分子靶蛋白网络,并通过network analyzer插件分析网络特征,预测通塞脉片的可能活性成分和潜在靶蛋白。
2结果
21分子对接在分子计算中,分子与靶蛋白的相互作用情况可用对接得分来评估,得分越高则两者相互作用的可能性越大。通塞脉片的分子对接结果显示,有97个分子与靶蛋白的对接得分大于等于7,其中部分化合物抗动脉粥样硬化的作用已有文献报道。例如,格桑曲珍等研究显示甘草酸(glycyrrhizinic acid,TCMC0156B)能有效抑制载脂蛋白E基因敲除小鼠动脉粥样硬化的发展,对脂质代谢及动脉粥样硬化斑块具有调节和降低作用[43];张明发等从抗高血脂、抗炎、抗氧化、抗血小板聚集等方面綜述表明了甘草酸、甘草次酸(glycyrrhetinic acid,TCMC053CB[44]以及熊果酸(ursonic acid,TCMC01013)、齐墩果酸(oleanolic acid,TCMC00BED)等的抗动脉粥样硬化作用[45]。据此推测,这97个分子可能是通塞脉片治疗动脉粥样硬化的活性成分。
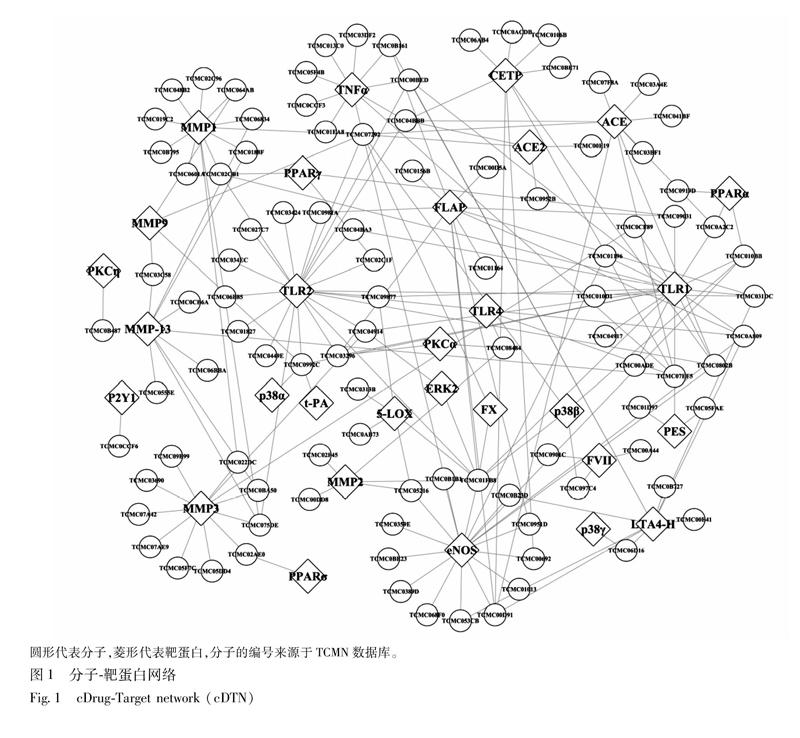
22网络分析分子对接结果表明,97个分子并非均单纯靶向单一蛋白,而是部分分子可同时作用多个蛋白或多个分子可作用一个蛋白,进而在活性分子与靶蛋白之间构成一个复杂的关系网络。网络节点度(degree)和介数(betweenness, BW)是网络分析中的2个重要参数,常用于刻画网络节点的重要程度[46]。因此,为了进一步分析这个复杂关系网络中活性分子以及靶蛋白的差异性,本研究针对由97个分子与30个靶蛋白的相互关系所构建的“分子靶蛋白网络”(图1)进行了网络特征分析,发现有37个分子可作用于2个以上的靶点(网络节点度≥2),且具有较高的介数(表2),提示这些分子的变化会对通塞脉片抗动脉粥样硬化的分子靶蛋白网络稳定性和完整性产生较大影响,从而改变其抗动脉粥样硬化的疗效,推测这37个分子可能是通塞脉片的主要活性成分群。另一方面,对蛋白节点网络特征分析,发现有22个靶蛋白分别可与2个以上(网络节点度≥2)的分子发生作用(表3),推测这22个靶蛋白可能与通塞脉片治疗AS的作用机制密切相关。
3讨论
本文利用网络药理学方法探讨通塞脉片抗动脉粥样硬化的药效物质基础和分子作用机制,经分子对接、分子靶蛋白网络分析发现,loniflavone等97个分子可能是通塞脉片治疗动脉粥样硬化的活性成分,其中37个分子可作用于2个以上的靶点,且具有较高的介数,推测可能是通塞脉片治疗动脉粥样硬化的主要活性成分群(表2)。
进一步分析发现,通塞脉片的预测活性成分中含有较多的黄酮类和皂苷类化合物。文献研究显示,在通塞脉片的组成药材中,黄芪总黄酮、怀牛膝总皂苷、甘草总黄酮等均对动物实验性动脉粥样硬化有较好的防治作用[4749]。另外,皂苷类化合物如甘草酸、甘草次酸、熊果酸、齐墩果酸等亦显示有抗动脉粥样硬化作用[4345],与预测一致,提示黄酮类和皂苷类成分可能是通塞脉片治疗动脉粥样硬化的重要成分群,在后续药效物质基础和质量标准研究中可重点加以关注和控制。
动脉粥样硬化是一种慢性炎症疾病,Toll 样受体(TLRs)与炎症密切相关,研究发现TLR1,TLR2在人和鼠动脉粥样硬化病变的内皮细胞和巨噬细胞中均有表达[50];TLR1,TLR2的阻断或缺失可降低动脉粥样硬化的发生率[39]。靶点网络特征分析显示(表3),loniflavone 等21个化合物与TLR2有较好的作用;oleanolic acid等18个化合物与TLR1有较好的作用,提示调节炎症反应可能是通塞脉片防治动脉粥样硬化的主要途径之一。基质金属蛋白酶(MMPs)是一族可消化细胞外基质的重要蛋白酶类,MMPs含量和活性的升高,可致细胞外基质迅速降解、纤维帽变薄,继而致使斑块易于破裂而引发临床事件,其中MMP1,MMP2,MMP3,MMP9等已证实与纤维帽形成、斑块稳定性等密切相关[5153]。通塞脉片中有29个化合物可与MMP1,MMP2,MMP3,MMP9产生较好的作用,且每个MMP亚型均有4个以上化合物与之作用,提示稳定斑块可能是通塞脉片治疗动脉粥样硬化,预防进一步心脑血管事件发生的又一重要途径。血管紧张素转化酶(ACE)可将血管紧张素Ⅰ(AngⅠ)转换为血管紧张素Ⅱ(AngⅡ),后者具有促动脉粥样硬化斑块形成作用;血管紧张素转化酶2(ACE2)为ACE同系物,可水解AngⅡ生成Ang(17);Ang(17)具有舒张血管、保护内皮细胞等作用,可抑制动脉粥样硬化病变[28]。通塞脉片中有9个化合物可对ACE产生较好的作用,有4个化合物可对ACE2产生较好的作用,表明通塞脉片即可通过抑制ACE,降低其对动脉粥样硬化的促进作用,又可增强ACE2活性,加强其对动脉粥样硬化病变的改善作用。此外,通塞脉片中还有39个化合物可与其他如FLAP,CETP,5LOX,PPARα,PPARγ,PGES等13个与脂质代谢、炎症等密切相关的靶点发生较好的作用。已有药理研究结果显示,通塞脉片可通过降低AngⅡ水平,降低NO含量及NOS活力,抑制MMP2,MMP9的表达,改善动脉粥样硬化病变[10,1719],与部分预测结果相吻合。
通塞脉片呈现出多成分、多靶点、整体调节的作用特点,其主要活性成分群可通过调节炎症(如TLR1,TLR2,5LOX,FLAP,LTA4H,TNFα,PPARα,PPARγ),增加斑块稳定性(如MMP1,MMP2,MMP3,MMP9,MMP13),保护内皮细胞(如ACE2,eNOS),参与血脂调节、脂代谢(如CETP,PPARα,PPARγ)及抗凝(如FX)等作用参与对动脉粥样硬化病理过程不同环节的调控,进而影响动脉粥样硬化的形成与发展。这从分子水平上揭示了通塞脉片治疗动脉粥样硬化的药效作用机制,本研究为后续系统开展通塞脉片治疗动脉粥样硬化的药效物质基础和分子作用机制的实验研究提供了理论依据。
[参考文献]
[1]Patel S, Celermajer D S, Bao S. Atherosclerosis——underlying inflammatory mechanisms and clinical implications[J]. Int Biochem Cell Biol, 2008, 40(4): 576.
[2]周桂桐, 杨玥. 动脉粥样硬化易损斑块稳定性的研究综述[J]. 中华中医药学刊, 2009, 27(12): 2483.
[3]王蕾. 动脉粥样硬化治疗研究新进展[J]. 现代医药卫生, 2013, 29(20): 3085.
[4]Bekkering S, Joosten L A, van der Meer J W, et al. The epigenetic memory of monocytes and macrophages as a novel drug target in atherosclerosis[J]. Clin Ther, 2015, 37(4): 914.
[5]袁水玲. 动脉粥样硬化药物治疗研究进展[J]. 现代医药卫生, 2014, 30(5): 708.
[6]陈荣明, 杨能华, 吴亚利, 等. 通塞脉片对大鼠缺血后肢侧支循环建立的影响[J]. 南京中医药大学学报, 2009, 25(6): 434.
[7]伊红丽, 杜志刚. 通塞脉片治疗脑梗死颈动脉粥样硬化斑块对照观察[J]. 辽宁中医杂志, 2007, 34(11): 1595.
[8]曹树平, 陳荣明. 通塞脉片治疗急性脑梗死气虚血瘀证80例[J]. 南京中医药大学学报, 2004, 20(2): 116.
[9]顾锡镇. 通塞脉片治疗急性缺血性中风30例[J]. 南京中医药大学学报, 2004, 20(2): 83.
[10]姜淼, 卞慧敏, 仇锦春, 等. 通塞脉片对动脉粥样硬化模型大鼠的影响[J]. 新中医, 2007, 39(12): 102.
[11]殷書梅, 王宓, 林新艳, 等. 通塞脉片对动脉粥样硬化大鼠NFκB、MCP1表达的影响[J]. 中药药理与临床, 2010, 26(3): 46.
[12]朱青, 胡晨, 蒋凤荣, 等. 通塞脉片对动脉粥样硬化大鼠CD40及CD40L表达的影响[J]. 中华中医药杂志, 2011, 26(1): 160.
[13]杨雨微, 胡晨, 卞慧敏, 等. 通塞脉片对大鼠实验性动脉粥样硬化模型血管内皮细胞的影响[J]. 中成药, 2010, 32(3): 371.
[14]张莉, 狄留庆, 赵晓莉, 等. 高效液相色谱法测定通塞脉片中黄芪甲苷的含量[J]. 南京中医药大学学报, 2003, 19(2): 94.
[15]张妤琳, 龚丽, 郭青. 通塞脉片质量标准研究[J]. 中成药, 2013, 35(7): 1568.
[16]陈锦容. 通塞脉片中阿魏酸的含量测定[J]. 海峡药学, 2009, 21(8): 60.
[17]修媛娟, 胡晨, 蒋凤荣, 等. 通塞脉片对动脉粥样硬化大鼠MMP9/TIMP1的影响[J]. 南京中医药大学学报, 2010, 26(3): 208.
[18]朱青, 张启春, 赵越, 等. 5种中药复方对局灶性脑缺血大鼠的影响及作用机制比较[J]. 中草药, 2011, 42(6): 1149.
[19]赵健, 伊红丽. 通塞脉片对动脉粥样硬化斑块稳定性影响的实验研究[J]. 新中医, 2008, 40(9): 96.
[20]柯志鹏, 张新庄,丁玥, 等. 利用网络药理学方法研究芪桂痛风片的药效物质基础与分子作用机制[J]. 中国中药杂志, 2015, 40(14): 2837.
[21]吴磊宏, 高秀梅, 王林丽, 等. 附子多成分作用靶点预测及网络药理学研究[J]. 中国中药杂志, 2011, 36(21): 2907.
[22]赵琴琴, 李翔, 曾美玲, 等. 网络药理学方法研究红花注射液主要活性成分对脑血管疾病网络的调控作用[J]. 中国药学杂志, 2015, 50(16): 1402.
[23]王俨如, 张新庄,李娜, 等. 基于网络药理学方法探讨双鱼颗粒治疗上呼吸道感染的作用机制[J]. 中国新药杂志, 2015, 24(11): 1222.
[24]Wong B W, Meredith A, Lin D, et al. The biological role of inflammation in atherosclerosis[J]. Can J Cardiol, 2012, 28(6): 631.
[25]王浩然, 于春江. 动脉粥样硬化发生机制及治疗药物的研究进展[J]. 首都医科大学学报, 2010, 31(6): 828.
[26]Munteanu A, Zingg J M. Cellular, molecular and clinical aspects of vitamin E on atherosclerosis prevention[J]. Mol Aspects Med, 2007, 28(5/6): 538.
[27]Radmark O, Samuelsson B. 5lipoxygenase: regulation and possible involvement in atherosclerosis[J]. Prostaglandins Other Lipid Mediat, 2007, 83(3): 162.
[28]Wang Y, Tikellis C, Thomas M C, et al. Angiotensin converting enzyme 2 and atherosclerosis[J]. Atherosclerosis, 2013, 226(1): 3.
[29]Viola J, Soehnlein O. Atherosclerosis——a matter of unresolved inflammation[J]. Semin Immunol, 2015, 27(3): 184.
[30]Little P J, Chait A, Bobik A. Cellular and cytokinebased inflammatory processes as novel therapeutic targets for the prevention and treatment of atherosclerosis[J]. Pharmacol Ther, 2011, 131(3): 255.
[31]Oestvang J, Johansen B. Phospholipase A2: a key regulator of inflammatory signalling and a connector to fibrosis development in atherosclerosis[J]. Biochim Biophys Acta, 2006, 1761(11): 1309.
[32]Tsompanidi E M, Brinkmeier M S, Fotiadou E H, et al. HDL biogenesis and functions: role of HDL quality and quantity in atherosclerosis[J]. Atherosclerosis, 2010, 208(1): 3.
[33]de Goma E M, de Goma R L,Rader D J. Beyond highdensity lipoprotein cholesterol levels: evaluating highdensity lipoprotein function as influenced by novel therapeutic approaches[J]. J Am Coll Cardiol, 2008, 51(23): 2199.
[34]NegreSalvayre A, Dousset N, Ferretti G, et al. Antioxidant and cytoprotective properties of highdensity lipoproteins in vascular cells[J]. Free Radic Biol Med, 2006, 41(7): 1031.
[35]Aviram M, Rosenblat M. Paraoxonases 1, 2, and 3, oxidative stress, and macrophage foam cell formation during atherosclerosis development[J]. Free Radic Biol Med, 2004, 37(9): 1304.
[36]Gross B S, Fruchart JC, Staels B. Peroxisome proliferatoractivated receptor β/δ: a novel target for the reduction of atherosclerosis[J]. Drug Discov Today, 2005, 2(3): 237.
[37]Bits′ Iu V, Dosenko V, Medvedev V V. Role of apoptosis in the pathogenesis of atherosclerosis[J]. Fiziol Zh, 2000, 46(5): 83.
[38]Tokumura A, Sumida T, Toujima M, et al. Plateletactivating factor (PAF)like oxidized phospholipids: relevance to atherosclerosis[J]. Biofactors, 2000, 13(1/4): 29.
[39]Cole J E, Kassiteridi C, Monaco C. Tolllike receptors in atherosclerosis: a "Pandora′s box" of advances and controversies[J]. Trends Pharmacol Sci, 2013, 34(11): 629.
[40]Jamkhande P G, Chandak P G, Dhawale S C, et al. Therapeutic approaches to drug targets in atherosclerosis[J]. Saudi Pharm J, 2014, 22(3): 179.
[41]de Nigris F, Lerman A, Ignarro L J, et al. Oxidationsensitive mechanisms, vascular apoptosis and atherosclerosis[J]. Trends Mol Med, 2003, 9(8): 351.
[42]Ding W X, Gu J Y, Cao L, et al. Traditional Chinese herbs as chemical resource library for drug discovery of antiinfective and antiinflammatory[J]. J Ethnopharmacol, 2014, 155(1): 589.
[43]格桑曲珍, 馬俐, 谢光辉, 等. 甘草酸对载脂蛋白E基因敲除小鼠脂质代谢及动脉粥样硬化斑块的影响[J]. 中国动脉硬化杂志, 2015, 23(2): 116.
[44]张明发, 沈雅琴. 甘草抗动脉粥样硬化和抗血栓形成研究进展[J]. 西北药学杂志, 2011, 26(3): 222.
[45]张明发, 沈雅琴. 齐墩果酸和熊果酸的抗动脉粥样硬化作用[J]. 上海医药, 2014, 35(23): 73.
[46]Zhang X Z, Gu J Y, Cao L, et al. Network pharmacology study on the mechanism of traditional Chinese medicine for upper respiratory tract infection[J]. Mol Biosyst, 2014, 10(10): 2517.
[47]汪德清, 丁保国, Neil T G, 等. 黄芪总黄酮对动脉粥样硬化早期形成的影响[J]. 中国药理学通报, 2003, 19(6): 637.
[48]邹小明,丁志山. 怀牛膝总皂苷对大鼠血管平滑肌细胞内bFGF和ICAM1表达的影响[J]. 中华中医药学刊, 2013, 31(11): 2489.
[49]吴玉婷, 孙云, 刘国栋. 甘草总黄酮对高脂血症模型小鼠的干预作用[J]. 黑龙江医药, 2013, 26(5): 774.
[50]武海阔, 陈浩, 王军. Toll样受体在大血管病变中作用[J]. 辽宁中医药大学学报, 2014, 16(1): 95.
[51]胡国晶, 路娇扬, 王双. Toll样受体与动脉粥样硬化易损斑块的关系[J]. 中国动脉硬化杂志, 2012, 20(5): 477.
[52]石健, 侯静波. 基质金属蛋白酶与动脉粥样硬化关系研究新进展[J]. 国际心血管病杂志, 2013, 40(1): 25.
[53]郭爱桃, 韦立新, 石怀银, 等. 基质金属蛋白酶1与冠状动脉粥样硬化斑块破裂的关系[J]. 中华病理学杂志, 2000, 29(4): 21.
[责任编辑马超一]
