青花菜肉桂酰辅酶A还原酶基因的克隆与表达特征分析
2016-07-09李小艳裴徐梨荆赞革唐征
李小艳 裴徐梨 荆赞革 唐征


摘 要 为研究肉桂酰辅酶A还原酶在青花菜生长发育中的作用,采用RT-PCR技术克隆青花菜BoCCR基因全长cDNA序列,并利用qRT-PCR检测其在不同器官中的表达模式。结果表明:BoCCR基因开放阅读框为987 bp,推导编码328个氨基酸。预测蛋白分子量为36.86 ku,PI值为6.04。该蛋白亲水性氨基酸多于疏水性氨基酸,为亲水性蛋白。高级结构预测表明青花菜BoCCR蛋白具有完整的二级结构,三级结构的α-螺旋主要位于外部,β-折叠位于内部。分子进化分析显示CCR蛋白在植物进化过程中,各属形成单独的分枝,可以区分其亲缘关系。荧光定量技术检测到青花菜的BoCCR基因在花蕾发育早期表达最高,推测该基因可能与青花菜花粉发育相关。
关键词 青花菜;肉桂酰辅酶A还原酶;基因克隆;表达分析
中图分类号 Q78 文献标识码 A
青花菜(Brassica oleracea var. italica)是一种以绿色或紫色花球作为主要食用器官的世界性蔬菜,其营养十分丰富。一直以来,水果和蔬菜的消费都与健康具有相关性,而富含抗癌物质芥子油苷的青花菜被认为是重要的保健蔬菜之一,受到了越来越多消费者的喜爱。
木质素是植物体内的第二大有机物质,总量仅次于纤维素,在植物生长发育中具有重要的生物学功能[1]。木质素主要位于植物特化细胞的次生细胞壁上,其不仅能够通过细胞壁的木质化过程,提高细胞壁的机械强度,还对病原菌侵害和逆境胁迫具有抵御作用[2]。植物花粉的发育与花粉壁具有密切联系[3]。花粉壁结构复杂,而木质素是其重要的组成部分,因此木质素代谢可能对植物的花粉发育产生一定的影响。
肉桂酰輔酶A还原酶(Cinnamoyl-CoA reductase,CCR)是木质素生物合成过程中的第1个关键酶。其能够还原3种羟基肉桂酸的CoA酯,生成相应的肉桂醛,然后催化木质素单体合成[4]。CCR基因家族是一个小的多基因家族,存在2个以上的基因拷贝,而在水稻中仅发现1个基因拷贝[5]。近年来CCR基因已经在水稻[6]、棉花[7]、小麦[8]等模式植物以及美洲南瓜[9]、茶树[10]、马尾松[11]等非模式植物中成功克隆,但研究多集中在植物性状改良方面,而关于CCR基因在花粉发育过程中的作用报道极少。
本研究利用RT-PCR技术,从青花菜高代自交系‘WN12-95B中成功克隆到肉桂酰辅酶A还原酶基因。通过生物信息学的方法对其基因及氨基酸序列进行分析,同时通过qRT-PCR技术检测了青花菜BoCCR基因的表达特性,为深入了解该基因在青花菜花粉发育过程中的作用提供一定的理论基础。
1 材料与方法
1.1 材料
试验材料(青花菜高代自交系‘WN12-95B)由温州科技职业学院(温州市农科院)提供,常规田间管理。于始花期取根、茎、叶、嫩荚、不同发育阶段的花蕾(<2 mm,2~4 mm,>4 mm)用于肉桂酰辅酶A还原酶基因的时空表达特征分析。
植物总RNA提取试剂盒、第一链反转录试剂盒、Taq酶、荧光染料SYBR GreenⅠ、DNA Marker 2 000等购于大连TaKaRa公司;所用引物由南京金斯瑞有限公司合成。
1.2 方法
1.2.1 总RNA的提取及目标基因的克隆 青花菜RNA的提取采用植物总RNA提取试剂盒,过程按照试剂盒说明书进行。得到的总RNA使用PrimeScriptTM 1st Strand cDNA Synthesis Kit反转录合成cDNA第一链。根据本实验室转录组测序数据中肉桂酰辅酶A还原酶基因序列设计全长PCR扩增引物(5′-GGCGTCAATGGCTGAAAAG-3′;5′- TGCTTATTACTTTGGAAGATCACC-3′)。扩增程序为94 ℃ 5 min;94 ℃ 30 s,55 ℃ 50 s,72 ℃ 1 min,32个循环;72 ℃延伸10 min,4 ℃保存[12]。
1.2.2 BoCCR基因序列的生物信息学分析 将BoCCR基因序列在NCBI的BLASTp(http://www.ncbi.nlm.nih.gov/blast/)中进行同源性比对并利用ORF FINDER程序预测BoCCR基因的开放阅读框。运用Signal P和pI/MW分析BoCCR蛋白的信号肽、切割位点以及分子量和等电点。系统进化树的构建使用MEGA 5.0进行。DNAMAN用于蛋白的疏水性/亲水性分析。Predict Protein软件(http://www.predictprotein.org)用于构建蛋白质二级和三级结构模型。
1.2.3 BoCCR基因的表达特征分析 采用荧光定量PCR技术对青花菜BoCCR基因在不同组织以及不同发育时期花蕾的表达特征进行分析。反应过程在BIO-RAD IQ5 Real-time PCR System上完成。BoCCR表达特征分析引物为:5′-CGGTGTAATATC
CTTGTTGAG-3′和5′-GTTGTGAAGTGAATGAGAG
TT-3′。BoActin基因(引物序列:5′-GACAACTTAC
AACTCCATCAT-3′和5′-CTCATACGGTCAGCGAT
A-3′)为内参基因。反应条件为:94 ℃ 30 s;94 ℃ 10 s,58 ℃ 20 s,40个循环[12]。每个反应体系重复3次。相对表达量采用2-ΔΔCT法计算,ΔCT=CT,目标基因-CT, actin[13]。
2 结果与分析
2.1 青花菜BoCCR基因的克隆与序列结构分析
以青花菜cDNA为模板,经PCR扩增后克隆得到1条BoCCR基因条带(图1),该基因的开放阅读框为987 bp,推导编码328个氨基酸(图2),GenBank登录号为:KX518606。Signal P蛋白信号肽分析显示BoCCR基因无信号肽序列。该蛋白的分子量为36.86 ku,等电点为6.04。
2.2 青花菜BoCCR基因序列的同源比对
青花菜BoCCR蛋白序列同源性比对结果显示该蛋白与芸薹属植物(甘蓝、油菜、白菜)的氨基酸序列同源性极高。其次与拟南芥、荠菜、玉山筷子芥、野草莓、油棕、海枣、无油樟也具有较高的氨基酸序列同源性。结构域分析表明青花菜CCR蛋白属于NADB_Rossmann超基因家族,含有NADP结合区域和酶活性区域两个结构域,其中NADP结构域为植物CCR蛋白的保守结构。
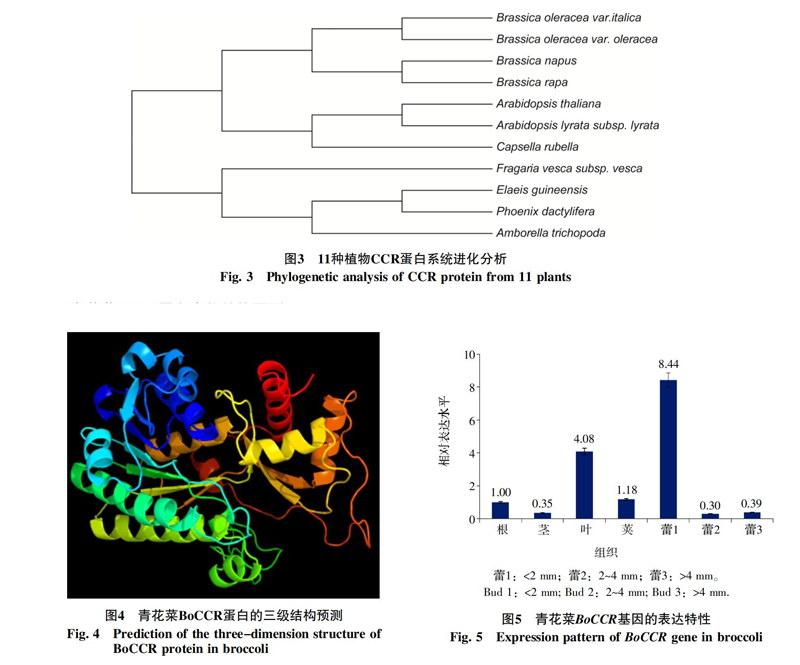
2.3 青花菜BoCCR蛋白的系统进化分析
为了深入研究青花菜BoCCR蛋白与其他植物之间的进化关系,采用MEGA 5.0成功构建系统进化树,结果如图3。CCR 蛋白在进化的过程中, 可以明显区分植物亲缘关系。分化较早的无油樟最先分为一支,其次棕榈科植物海枣和油棕形成一个单独的分支,草莓与其他植物亲缘关系较远,也单独位于一个分枝;分化较晚的十字花科植物中,芸薹属的青花菜、甘蓝、油菜、白菜聚为一支,其他十字花科植物聚为另一支,分子进化结果与植物学的传统分类基本一致。
2.4 青花菜BoCCR蛋白的亲水性和疏水性分析
青花菜BoCCR蛋白的亲水性和疏水性预测结果显示其亲水性最大位点为第282位精氨酸(Arg),最大值为2.38;最小位点为第161位丝氨酸(Ser),最小值为-2.08;疏水性最大值为2.68,位点出现在第238位的亮氨酸(Leu),其次最大位点出现在第128 位的丙氨酸(Ala)。青花菜BoCCR蛋白的亲水性氨基酸多于疏水性氨基酸,故推测其为亲水性蛋白。
2.5 青花菜CCR蛋白高级结构预测
蛋白质的二级和三级结构均属高级结构,其预测对于了解蛋白质的生物功能具有重要作用。采用Predict Protein在线软件预测青花菜CCR蛋白的高级结构,结果显示该蛋白的二级结构包括α-螺旋(38%)、β-转角(15%)和不规则卷曲(8%)。三级结构预测显示CCR蛋白由10个α-螺旋和7个β-折叠组成,α-螺旋主要位于外部,β-折叠在内部(图4)。
2.6 青花菜BoCCR基因的表达特征分析
青花菜BoCCR基因在不同组织及不同发育时期花蕾的相对表达量分析结果表明,BoCCR在所有组织中均有表达,其中花蕾的表达量最高,其次为叶片,茎的表达量较低。BoCCR基因在花蕾发育早期(<2 mm)表达量特别高,为叶片中表达量的2倍,之后表达量急剧下降,发育中期(2~4 mm)表达量最低,后期(>4 mm)表达量略有增加(图5)。
3 讨论
木质素是一种重要的次生代谢产物,在高等植物的生长发育过程中具有重要作用[14]。木质素的合成是一个复杂的过程,其中涉及到许多酶的相互作用。CCR是木质素合成途径的第一个限速酶[15],可调控木质素合成过程中的碳流。迄今为止,CCR基因已经在杨树、小麦、亚麻、桉树等作物中成功克隆,本试验获得了青花菜BoCCR基因,推导编码328个氨基酸,结构域分析表明其属于NADB_Rossmann超基因家族成员。BoCCR蛋白不存在信号肽,为非分泌型蛋白,与前人研究相符,表明其在细胞质中合成。
蛋白质的保守结构域预测可为深入了解蛋白质作用机理提供有效途径。通过BLASTp的结果发现青花菜BoCCR蛋白存在一个还原酶保守结构域,其能够有效的结合辅因子NADPH,是CCR的催化位点。同时比对通过BLAST得到的不同物种的氨基酸序列,发现同属植物之间的CCR蛋白分子结构差异不大,推测同属的CCR基因家族在物种进化过程中相对保守,与前人结果相符。
本研究通过系统进化树的构建,揭示了CCR蛋白的进化过程。海枣和油棕同属于棕榈科植物,为单子叶植物,在进化过程中较低等,首先被分出;其次为无油樟,它是双子叶植物中最原始的一种,与其他双子叶植物没有明显的亲缘关系[16];蔷薇科的草莓较上面3种植物高等,但与其他科属植物亲缘关系较远,也位于一个单独的分支;十字花科植物为高等植物,其染色体与低等植物相比经历了多次全基因组复制事件,位于一个大的类群;而芸薹属植物的染色体又额外经历了三倍化现象[17],与十字花科植物位于不同的分支。植物CCR蛋白的进化与进化相符, 各属分别形成一个分枝, 呈现明显的种属特性。
分析青花菜BoCCR基因在不同组织中的相对表达量,结果可以看出BoCCR基因在根、茎、叶、花蕾、荚中均表达,在发育早期花蕾(<2 mm)中的表达量明显高于其他组织,为叶片中的2倍。这种高表达特性可能与木质素是花粉壁的主要组成成分有关。在小孢子发育初期,孢子壁随着木质素沉积而迅速加厚和转化。该基因随着花蕾发育表达丰度降低。推测原因其可能是随着花粉的发育,花粉壁发育所需合成木质素也逐渐降低,但具体作用机理有待进一步研究。本研究对青花菜BoCCR基因的克隆对今后研究BoCCR基因在花粉发育过程中的作用奠定一定的基础。
参考文献
[1] Zhong R Q, Morrison W H, Himmelsbach D S, et al. Essential role of caffeoyl coenzyme a O-methyltransferase in lignin biosynthesis in woody poplar plants[J]. Plant Physiol, 2000, 124: 563-578.
[2] 李潞滨, 刘 蕾, 何聪芬, 等. 木质素生物合成关键酶基因的研究进展[J]. 分子植物育种, 2007, S1: 45-51.
[3] 马伯军, 刘程捷, 陈析丰, 等. 花粉壁发育相关基因的研究进展[J]. 浙江师范大学学报(自然科学版), 2013(4): 438-443.
[4] 李 高, 杨 杞, 张 烨, 等. 檸条锦鸡儿肉桂酰辅酶A还原酶基因克隆和分析[J]. 中国生物工程杂志, 2014, 34(1): 50-56.
[5] 李 波, 梁 穎, 柴友荣. 植物肉桂酰辅酶A还原酶(CCR)基因的研究进展[J]. 分子植物育种, 2006, S1: 55-65.
[6] 白 勇, 巩 威, 刘天昀, 等. 水稻肉桂酰辅酶A还原酶基因的克隆与表达分析[J]. 科学通报, 2003, 16: 1 780-1 784.
[7] 秦 超. 棉花肉桂酰辅酶A还原酶基因(GhCCR4)的遗传转化和功能分析[D]. 乌鲁木齐: 新疆农业大学, 2009.
[8] 蔺占兵. 小麦肉桂酰辅酶A还原酶(CCR)基因的分离和功能分析[D]. 北京: 中国科学院研究生院(植物研究所), 2003.
[9] 陈 刚. 美洲南瓜CCR基因与种皮发育和抗白粉病相关性研究及其功能分析[D]. 兰州: 甘肃农业大学, 2013.
[10] 陈林波, 宋维希, 李晓霞, 等. 茶树 ‘紫娟 肉桂酰辅酶A还原酶基因(CCR)克隆及序列分析[J]. 西北农业学报, 2016(1): 80-85.
[11] 陈碧华. 马尾松肉桂酰辅酶A还原酶基因(CCR)克隆及分析(英文)[J]. 林业科学, 2009(12): 46-53.
[12] 裴徐梨, 荆赞革, 唐 征, 等. 青花菜脂质转移蛋白基因的克隆与表达特征分析[J]. 分子植物育种, 2015, 13(3): 615-621.
[13] Pfaffl M W. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Research, 2001, 29: 2 002-2 007.
[14] 杨硕知. 木质素生物合成途径中关键酶肉桂酰辅酶A还原酶研究进展综述[J]. 安徽农学通报, 2010(12): 44-45.
[15] Lacombe E, Hawkins S, van Doorsselaere J, et al. Cinnamoyl CoA reductase, the first committed enzyme of the lignin branch biosynthetic pathway: cloning, expression and phylogenetic relationships[J]. Plant Journal, 1997, 11(3): 429-441.
[16] 路安民, 汤彦承. 被子植物起源研究中几种观点的思考[J]. 植物分类学报, 2005(5): 420-430.
[17] Taylor J S, Raes J. Duplication and divergence: the evolution of new genes and old ideas[J]. Annu Rev Genet, 2004, 38: 615-43.
