外源IBA对裸花紫珠插穗营养物质含量及抗氧化酶活性的影响
2016-07-09李晨晨周再知张金浩梁坤南马华明黄桂华
李晨晨 周再知 张金浩 梁坤南 马华明 黄桂华
摘 要 以药用植物裸花紫珠(Callicarpa nudiflora)一年生半木質化枝条为材料,使用吲哚丁酸(IBA,1 500 mg/L)处理插穗,以清水为对照,每隔6 d取样1次,测定生根过程中插穗基部可溶性糖、淀粉、可溶性蛋白含量及吲哚乙酸氧化酶(IAAO)、多酚氧化酶(PPO)、过氧化物酶(POD)活性的动态变化。结果表明,扦插后0~12 d,1 500 mg/L IBA处理增加了插穗内可溶性蛋白含量,降低了淀粉含量,可溶性糖含量先降后升,IAAO、POD、PPO活性增加;扦插后12~30 d,淀粉及可溶性糖含量逐渐降低,可溶性蛋白含量先升后降,但仍都高于对照,IAAO和PPO活性逐渐下降,POD活性先降后增;扦插30 d后,可溶性糖、蛋白、淀粉含量逐步趋于稳定,IAAO活性趋于稳定,而PPO和POD活性逐渐降低。总之,较高浓度的可溶性糖、可溶性蛋白,低浓度的淀粉,较高的IAAO、POD和PPO活性有利于裸花紫珠插穗不定根形成和发育。
关键词 扦插繁殖;营养物质;抗氧化酶活性;IBA处理
中图分类号 S567 文献标识码 A
裸花紫珠(Callicarpa nudiflora Hook. et Arn.)为马鞭草科(Verbenaceae)紫珠属(Callicarpa)植物,国内主要分布在福建、广东、广西、海南等省区[1]。全株可入药,具有抗菌、止血、消炎、解毒、收敛等功效,药用价值高、应用范围广[2]。近年来,种植面积不断扩大,对苗木的需求不断增大。由于裸花紫珠采种期短且种子不宜储藏、发芽率较低的缘故[3],扦插繁殖成为主要的繁殖手段。
外源激素类物质被广泛用于植物的扦插繁殖,特别是IAA和IBA,对不定根的诱导和发生起调控作用[4-5]。一些研究表明,扦插生根过程中,插穗内的营养物质含量及抗氧化酶活性与不定根形成密切相关。茅林春等[6]研究发现,经IBA处理后的梅(Prunus mume Sieb)插穗在不定根发生和生长过程中,可溶性糖含量和生根率呈显著的正相关,而淀粉含量和生根率呈显著的负相关。赵云龙等[7]对糙叶杜鹃(Rhododendron scabrifoliu)扦插研究发现,外源激素可显著的促进插穗内可溶性糖的增加,有利于插穗不定根的形成。外源激素类物质对插穗内过氧化物酶(POD)、多酚氧化酶(PPO)和吲哚乙酸氧化酶(IAAO)活性产生显著影响[8-10]。魏海蓉等[11]对甜樱桃(Prunus avium)矮化砧‘吉塞拉 6号研究发现,外源IBA处理能够提高生根率,其主要原因是提高了PPO、POD活性,降低了IAAO活性。
外源IBA处理可显著提高裸花紫珠扦插生根率[12]。 周再知等[13]采用4种IBA浓度处理裸花紫珠插穗,确定了1 500 mg/L IBA浓度下生根效果最佳,揭示了此浓度下,插穗内源激素IAA、ABA、GA和ZR含量随生根进程的变化规律。对扦插过程中,插穗营养物质含量和相关氧化酶活性的变化规律尚不明确。本研究的目的是探究外源IBA(1 500 mg/L)处理下,裸花紫珠扦插生根过程中,插穗的可溶性糖、淀粉及可溶性蛋白含量以及POD、PPO和IAAO活性的变化规律,进一步揭示其不定根的形成机理,为裸花紫珠的扦插繁殖提供理论依据。
1 材料与方法
1.1 材料
从海南五指山采集野生裸花紫珠的种子,播种育苗。2年生时,选用生长健壮、无病虫害的当年生半木质化枝条。截取中部,制成长度9~11 cm,具2~3个芽眼,上端为平口、保留两侧半片叶,下端斜切接近马蹄形的插穗。
1.2 方法
1.2.1 试验设计 采用单因素完全随机区组设计,设置2个IBA浓度(0和1 500 mg/L)处理,每个区组重复3次,每处理小区插穗100条。以泥炭 ∶ 蛭石 ∶ 河沙=2 ∶ 1 ∶ 1的体积比配置混合扦插基质。扦插前2 d,将其装入长540 mm×宽280 mm×深110 mm规格50穴苗盘内,并用0.5%的高锰酸钾进行淋灌消毒。将制备好的插穗每50条扎成1捆,用质量百分比为0.1%的高锰酸钾溶液消毒1~2 min,取出用蒸馏水冲洗干净。在IBA不同处理浓度溶液及清水中速蘸15 s,而后竖直插于上述穴盘中,深度3~4 cm。扦插后,浇水、覆盖薄膜,每隔3 d交替喷洒质量百分比为0.1%的高锰酸钾溶液和50%多菌灵可湿性粉剂500倍液消毒。20 d以后,仍按此浓度交替消毒,7 d 1次。保持扦插环境温度在21~33 ℃之间,相对湿度在70%以上。
1.2.2 测定项目与方法 扦插后,每隔6 d,取样1次,总共取样8次。每个重复随机抽取10~12条插穗,迅速用蒸馏水将基部冲洗干净,滤纸擦干,然后置于冰盒内,带回实验室。迅速剥取穗条基部2~3 cm韧皮部,剪碎、混匀,经过液氮冷冻处理后,保存于-20 ℃的超低温冰箱中。采用蒽酮比色法测定可溶性糖和淀粉含量;考马斯亮蓝G-250染色法测定可溶性蛋白含量;吲哚乙酸氧化酶(IAAO)活性和过氧化物酶(POD)活性的测定,参照植物生理学实验指导[14];采用邻苯二酚比色法测定多酚氧化酶(PPO)活性,参照植物生理学实验技术[15]。各测定项目材料均以鲜重(FW)计量。
2 结果与分析
2.1 裸花紫珠插穗生根过程中营养物质含量的变化
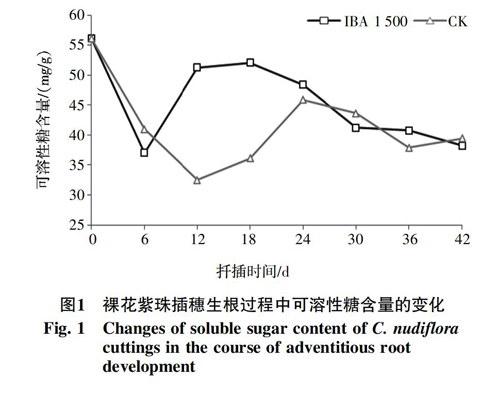
2.1.1 可溶性糖含量的变化 图1表明,IBA(1 500 mg/L)处理下插穗基部可溶性糖含量,呈现出“下降-上升-下降”的趋势。扦插后逐渐下降,第6天时降到谷值,降幅34.1%,6~12 d快速上升,12~18 d上升速度减缓,在第18天时达到峰值,增幅为40.7%。对照在扦插第6天后,插穗的可溶性糖含量持续下降,第12天时达到谷值,12~18 d上升较为缓慢,18~24 d上升速度加快,第24天时,达到峰值,增幅为41.0%。峰值之后,IBA处理的可溶性糖含量持续下降,第30天后,趋于平稳,而对照处理则延迟到第36天以后。第42天时,两者的可溶性糖含量均维持在40.0 mg/g(以鲜重计,以下类同)左右。
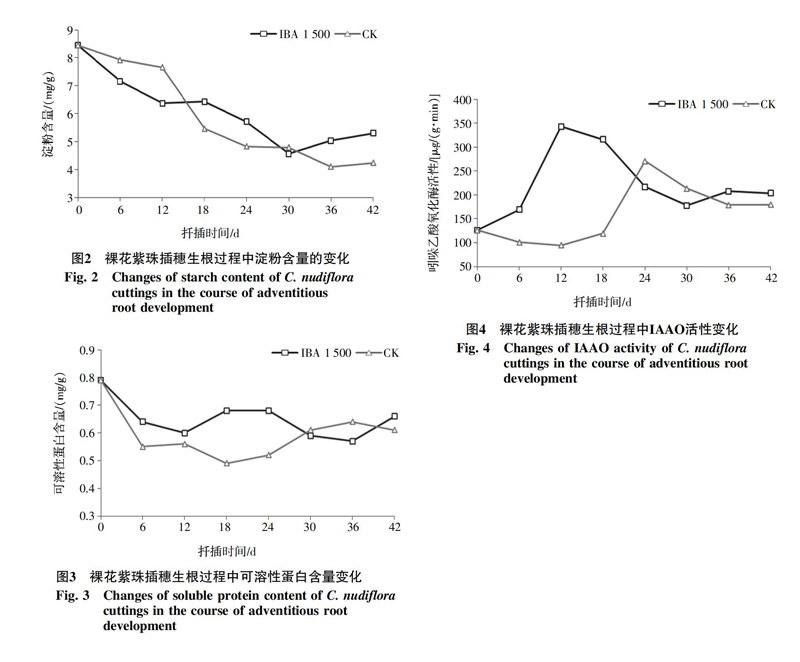
2.1.2 淀粉含量的变化 由图2可知,插穗的淀粉含量總体上均呈现平稳下降的趋势,不同阶段下降幅度有所不同。IBA(1 500 mg/L)处理插穗在扦插后0~12 d内淀粉含量大幅度下降,12~18 d时淀粉含量保持平稳,几乎不变,接下来的第18~30天又快速下降,第30天时淀粉含量达到了最低值,之后开始缓慢上升。而对照插穗在0~12 d缓慢下降,而第12~24天则急剧下降,12~18 d时淀粉含量下降速率最大,降幅为28.6%,24~30 d时其含量趋于恒定,第30~36天出现小幅度的下降,之后也开始有所回升。
2.1.3 可溶性蛋白含量的变化 从图3可以看出,扦插后的30 d内,IBA(1 500 mg/L)处理插穗的可溶性蛋白的含量始终高于对照。扦插后12 d,IBA(1 500 mg/L)处理插穗的可溶性蛋白含量大幅下降,第12天后开始回升,第18天时达到峰值,而后持续下降,在第36天时达谷值,降幅16.2%,之后又大幅度上升。而对照插穗在第12天后持续下降,在第18天时达到谷值,之后进入上升期,在第36天时达到峰值,然后又开始下降。
2.2 裸花紫珠插穗生根过程中抗氧化酶活性的变化
2.2.1 吲哚乙酸氧化酶(IAAO)活性变化 从图4可以看出,IBA(1 500 mg/L)处理和对照插穗内IAAO酶活性大体上都呈现出先上升后下降最后趋于稳定的变化趋势。IBA(1 500 mg/L)处理插穗的IAAO活性在扦插0~12 d急剧上升,升幅达172.5%,第12天后又大幅度下降,到第30天时出现低谷,降幅达48.1%,之后逐渐趋于平稳。对照处理插穗IAAO活性在扦插0~12 d出现小幅度降低的趋势,12~18 d开始缓慢上升,18~24 d急剧上升并到达峰值,升幅126.9%,24 d之后逐渐降低,其降低的幅度越来越小,在第36天后趋于平稳。
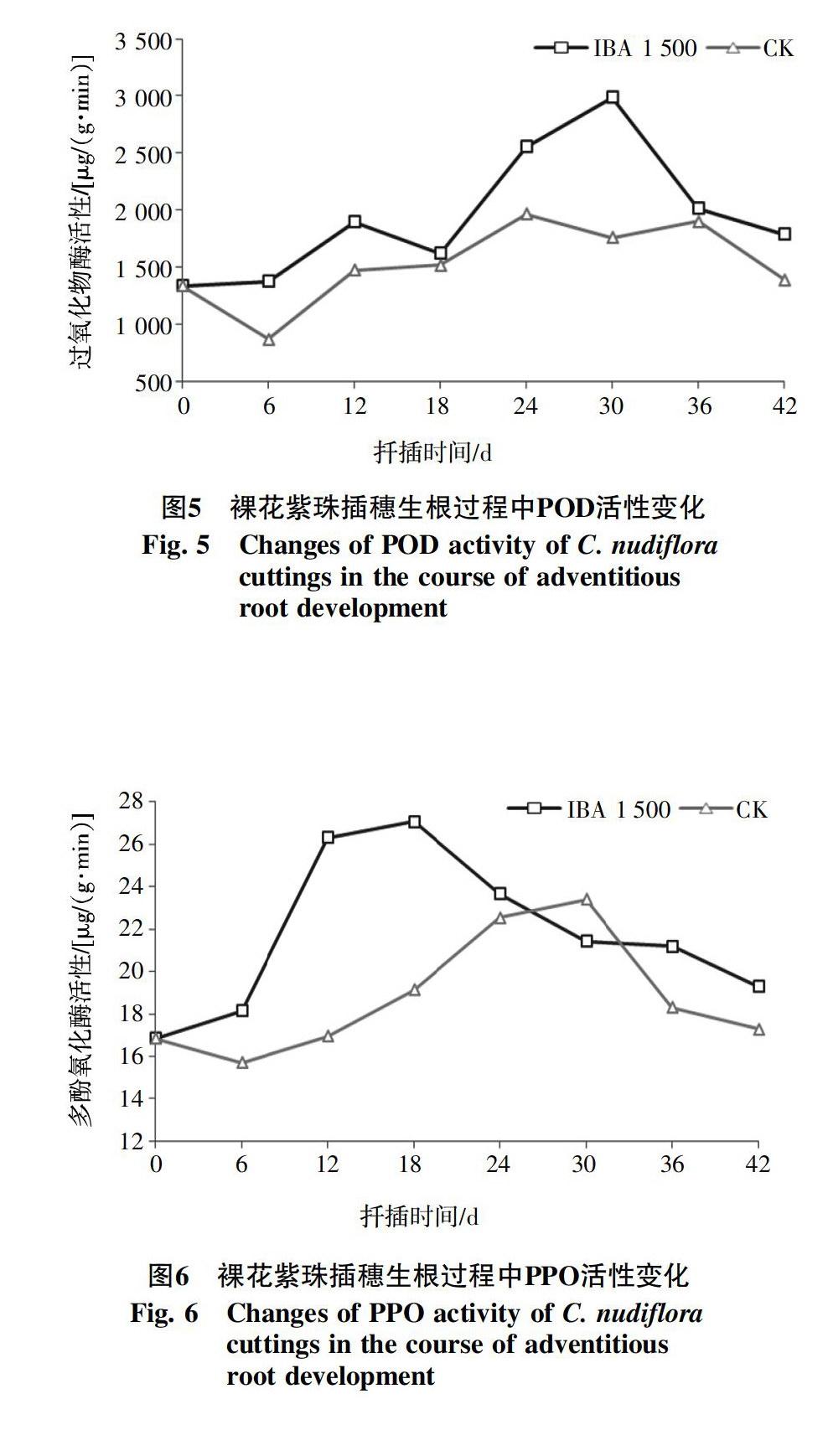
2.2.2 过氧化物酶(POD)活性的变化 POD活性与扦插生根的关系密切,被一致认为是植物生根的标志性物质之一。IBA(1 500 mg/L)处理和对照插穗内POD活性随扦插时间总体上呈先升高后降低的变化趋势,在插穗生根的不同阶段差别明显(图5)。整个扦插生根监测过程中,IBA(1 500 mg/L)处理插穗内的POD活性一直都高于对照处理,说明较高水平的POD活性可能会促进插穗生根。IBA(1 500 mg/L)处理插穗的POD活性在扦插后的6 d内变化不大,第6~12天时快速升高并于第12天时达到第1个峰值,增幅42.1%,12~18 d逐渐降低,第18天后又开始大幅度的升高,第30天时形成第2个峰值,此时也是整条变化曲线的最高点,比扦插前增加了124.1%,之后再次降低,到第42天时,已接近扦插前POD活性的水平。对照在扦插后6 d,POD活性急剧降低,在第24天活性到达最高值,之后其活性缓缓下降,但是变化幅度十分微小,第36天时POD活性到达第2个峰值,两个峰值大小接近,36~42 d活性大幅降低。
2.2.3 多酚氧化酶(PPO)活性的变化 扦插过程中插穗内PPO活性变化见图6。扦插前,插穗内PPO活性比较低,扦插后6 d内两个处理PPO活性变化幅度都不大,但是IBA(1 500 mg/L)处理表现出升高趋势,而对照则相反。IBA(1 500 mg/L)处理插穗的PPO活性在第6~12天急剧升高,第18天达到最大值,增幅60.8%,且比对照早12 d。之后PPO活性大幅度降低,第30天下降幅度变小至观测结束。对照的PPO活性在第6~24天之间升高,且升高的幅度是逐渐变大的,第30天达到最大值,增幅39.0%,第30天之后持续下降,第42天所测的PPO活性水平与扦插时基本一致。
3 讨论
3.1 扦插生根过程中营养物质含量的变化
魏海蓉等[11]用外源激素IBA(1 000 mg/L)处理甜樱桃矮化砧‘吉塞拉6号(Gisela 6,Prunus cerasus × P. canescens)发现其插穗内可溶性糖含量随生根进程呈现“升高-降低”的变化规律。而本研究发现,裸花紫珠插穗内可溶性糖含量随生根进程呈现“下降-上升-下降”的变化规律。结合周再知等[13]对裸花紫珠扦插不定根形成阶段的划分,即扦插后0~12 d为皮内根原基诱导分化、愈伤组织形成期阶段,12~30 d为不定根形成及发生阶段,30 d以后为不定根伸长及发育阶段,IBA(1 500 mg/L)处理的裸花紫珠插穗在不定根诱导分化期的前期(1~6 d),插穗内的可溶性糖含量大幅度下降,这可能是由于插穗基部呼吸作用增强、愈伤组织和根原始体形成消耗大量的能量和养分,及可溶性糖的消耗速度远大于形成速度所致。在不定根诱导分化期的后期(6~12 d),可溶性糖含量快速回升,而对照依然在下降,这可能是外源IBA处理加快了插穗内淀粉水解成可溶性糖的缘故。在不定根的形成阶段(12~30 d),插穗的可溶性糖逐渐降低,可能与生根过程中快速消耗大量能量有关;期间,尽管能量物质依然在快速水解,但是水解速度小于可溶性糖的消耗速度,这与多数人的研究结果一致[16-18]。
淀粉作为植物体内能量的储藏形式,在植物生长的特殊阶段可以转化为可溶性糖,是插穗生根过程中主要的能量来源[19]。本研究发现,裸花紫珠在扦插生根过程中,淀粉含量呈逐渐下降的趋势,主要是因为生根过程中消耗了大量的能量。IBA处理插穗在扦插后0~12 d内,淀粉含量大幅度下降,远远大于对照的下降速度,这可能与IBA处理可以增强插穗内某些糖类水解酶的活性,加强对淀粉的水解有关[20]。在不定的形成阶段(12~30 d),IBA处理插穗内淀粉含量下降速度减缓,而对照开始出现大幅度下降,可能是因为IBA处理的插穗在不定根形成的过程中,地上部分已经长出部分新叶,通过光合作用,合成少量的淀粉和糖类,从而减缓了淀粉的水解速度,而对照的地上部分新叶形成和生长则相对迟缓。当插穗进入不定根伸长阶段(30 d后),插穗根系生长较完全、新叶完全长出,插穗逐渐恢复光合能力,同化产物得以积累和运输,多余的糖分转化为淀粉,导致淀粉含量的升高。
可溶性蛋白是插穗总氮含量的主要组成部分且可以激活与生根有关的基因[21]。氮素类化合物不仅与根原始体形成有关,而且还能促进根和地上部分的生长[22]。虽然可溶性蛋白质只占总体蛋白质的一小部分,但是机体所能吸收的主要是可溶性蛋白,它在生命体活动中发挥着运输协调、免疫保护、传导神经活动等重要功能[23]。在裸花紫珠的生根过程中,其插穗内可溶性蛋白含量表现为“下降-上升-下降-上升”的变化趋势,结合生根进程来看,前期的可溶性蛋白的大幅度降低主要是因为在不定根诱导阶段,可能是可溶性蛋白大量转化为细胞分裂和分化过程中所需要功能蛋白,为不定根的形成做准备,而后出现短期的上升可能是因为随着根原基形成,插穗吸收能力增强且短期内消耗较小,可溶性蛋白合成较多的缘故。待不定根进入伸长期时,根部分生区需要大量的进行分裂分化,可溶性蛋白消耗大,导致含量下降,当插穗地上部分长出新叶后,光合能力逐渐恢复,光合产物增多,可溶性蛋白逐渐积累。
3.2 扦插生根过程中抗氧化酶活性的变化
IAAO是分解IAA的专一性酶,该酶利用氧气来氧化IAA,并且与不定根的形成有关[24-26]。研究表明,难生根的树种插穗内IAAO活性较低,对不定根的诱导及形成作用不明显,而易生根的树种插穗内IAAO活性高,可降低插穗IAA浓度,有利于诱导不定根的形成[27-28]。本研究发现 IAAO活性呈现出先上升后下降的趋势。在裸花紫珠插穗不定根诱导阶段(0~12 d),外源激素IBA处理大幅度提高了IAAO活性。裸花紫珠插穗的IAA含量在扦插6~12 d时,大幅下降[13],这可能与高活性的IAAO有关。在不定根的形成阶段(12~30 d),IAAO活性逐渐下降。IAAO活性的下降,致使插穗内IAA含量升高,有利于不定根的表达,促进根的伸长生长,这与王小玲等[29]用1 000 mg/L IBA处理四倍体刺槐(tetraploid Robinia pseudoacacia)硬枝进行扦插的研究结果一致,但是扈红军等[30]对欧榛(Corylus avellana)扦插研究表明,不定根表达期内,IAAO活性高有益于促进根的伸长。不同树种在扦插生根过程中IAAO活性及其作用不同,比较复杂。
POD是一种存在于植物體内的含Fe卟啉辅基的酶,参与多种生理生化过程。POD活性与扦插生根密切相关,被普遍认为是植物生根的标志性物质之一。本试验发现,经IBA处理的插穗生根过程中,POD活性呈现“上升-下降-上升-下降”的趋势。且出现了两个高度不同峰值,这与多数有关扦插生根过程中POD活性会有两个高峰的结果一致[30-33]。第1个峰值出现在诱导期内,它的升高主要与抑制伤呼吸有关,伤呼吸产生大量的活性氧类物质(ROS),如O2-等,机体会产生大量的防御酶,例如超氧化物歧化酶,它能够将O2-歧化为H2O2和O2,再由POD氧化为H2O和O2,从而避免活性氧所造成的膜系统的损害[23]。POD活性的升高可以氧化插穗内过多的内源IAA,有利于诱导根原基发育。对于第二峰值出现在不定根的表达时期,扈红军等[30]认为该峰值的出现也与不定根的表达有关,高活性的POD有利于不定根的表达。在根的伸长和发育期,POD活性下降,促使插穗内IAA含量增加,有利于根的伸长和发育。
PPO是普遍存在植物体内的一种含铜的氧化酶,它可以将酚类化合物和吲哚乙酸催化成一种“IAA-酚酸化合物”,这种复合物具有促进不定根分化及形成的作用[34]。本试验结果表明,IBA处理显著提高了裸花紫珠插穗内PPO的活性。扦插后,PPO活性先升高, 之后随不定根的形成和伸长, 活性逐渐降低。这与赵云龙等[7]对糙叶杜鹃(Rhododendron scabrifoliu)、扈红军等[35]对榛子(Corylus heterophylla)扦插研究结论一致。多数研究表明,易生根植物体内PPO活性较高,PPO可以把高浓度的酚类物质转化为促根物质,进而促进了不定根的分化及形成[36-37]。裸花紫珠为较易生根的植物,在不定根的诱导分化阶段,IBA(1 500 mg/L)处理的插穗内PPO活性明显升高,可能与PPO促成酚类物质转化有关。
植物的扦插生根机理复杂,一种物质含量的变化可能导致其他一种或多种物质含量的变化,以及与之相关的抗氧化酶活性的变化,弄清它们之间内在的联系,还需从激素信号转导、次生代谢、基因调控等方面深入研究。
参考文献
[1] 广东省植物研究所. 海南植物志[M]. 北京: 科学出版社, 1964.
[2] 张绮玲, 庞玉新, 杨 全, 等. 裸花紫珠的本草考证[J]. 广东药学院学报, 2014, 30(5): 667-671.
[3]黄秋银, 蓝祖栽, 潘春柳, 等. 裸花紫珠种子萌发影响因素研究[J]. 安徽农业科学, 2009, 37(25): 12 006-12 007.
[4] Singh B, Yadav R, Bhatt B P. Effects of mother tree ages, different rooting mediums, light conditions and auxin treatments on rooting behaviour of Dalbergia sissoo branch cuttings[J]. Journal of Forestry Research, 2011, 22(1): 53-57.
[5] Ahkami A H, Melzer M, Ghaffari M R, et al. Distribution of indole-3-acetic acid in Petunia hybrida shoot tip cuttings and relationship between auxin transport, carbohydrate metabolism and adventitious root formation[J]. Planta, 2013, 238(3): 499-517.
