牙龈卟啉单胞菌脂多糖对人脐静脉内皮细胞表达趋化因子RANTES和分形素的影响
2016-07-08漆晓玲赵蕾陈珊珊孟姝吴亚菲口腔疾病研究国家重点实验室华西口腔医院四川大学成都6004重庆医科大学附属口腔医院牙周病科重庆4047口腔疾病研究国家重点实验室华西口腔医院牙周病科四川大学成都6004
漆晓玲 赵蕾 陈珊珊 孟姝 吴亚菲.口腔疾病研究国家重点实验室 华西口腔医院(四川大学),成都 6004;2.重庆医科大学附属口腔医院牙周病科,重庆 4047;.口腔疾病研究国家重点实验室 华西口腔医院牙周病科(四川大学),成都 6004
·口腔微生物毒力因子专栏·
牙龈卟啉单胞菌脂多糖对人脐静脉内皮细胞表达趋化因子RANTES和分形素的影响
漆晓玲1,2赵蕾3陈珊珊1孟姝3吴亚菲3
1.口腔疾病研究国家重点实验室 华西口腔医院(四川大学),成都 610041;2.重庆医科大学附属口腔医院牙周病科,重庆 401147;3.口腔疾病研究国家重点实验室 华西口腔医院牙周病科(四川大学),成都 610041
[摘要]目的 观察牙龈卟啉单胞菌脂多糖(Pg-LPS)对人脐静脉内皮细胞(HUVEC)表达调节活化正常T细胞表达和分泌的趋化因子(RANTES)和分形素的影响。方法 应用不同质量浓度(200、500、1 000 ng·mL-1)的Pg-LPS分别处理HUVEC 1、6、12、24 h,利用实时荧光定量聚合酶链反应(RT-PCR)及酶联免疫吸附(ELISA)法检测RANTES及分形素mRNA及蛋白质的表达变化。结果 在Pg-LPS与HUVEC共同培养 1、6和12 h时,除培养时间为12 h、Pg-LPS质量浓度为200 ng·mL-1组的RANTES mRNA和1 h、200 ng·mL-1组RANTES蛋白表达与对照组无明显差异外,其余各实验组RANTES蛋白和mRNA表达量及分形素mRNA表达量均高于对照组,差异有统计学意义(P<0.05);6 h时,二者mRNA表达量达到峰值,分别为对照组的4.88倍和6.20倍;刺激6 h后,RANTES蛋白和mRNA表达量及分形素的mRNA表达量均降低,24 h时,仅Pg-LPS质量浓度为500 ng·mL-1组与对照组相比有统计学差异(P<0.05);分形素蛋白的表达量则仅在Pg-LPS浓度为1 000 ng·mL-1刺激6、12 h时与对照组相比有统计学差异(P<0.05)。结论 Pg-LPS感染具有上调HUVEC表达趋化因子RANTES和分形素的作用,可能在牙周炎促进动脉粥样硬化发生、发展的过程中起一定作用。
[关键词]动脉粥样硬化; 牙周炎; 趋化因子; 牙龈卟啉单胞菌; 脂多糖
牙周炎与动脉粥样硬化(atherosclerosis,AS)及心血管疾病(cardiovascular disease,CVD)密切相关,是CVD的独立危险因素之一。血循环中的单核细胞趋化进入血管壁的过程是AS形成和发展中的关键环节之一,与单核细胞趋化功能相关的CC类及CX3C类趋化因子在这一过程中起重要作用。调节活化正常T细胞表达和分泌的趋化因子(regulated upon activation normal T-cell expressed and secreted,RANTES)是一种CC类趋化因子。目前CX3C类趋化因子亚家族只发现了不规则趋化因子,又称分形素(fractalkine)这一个成员。研究证明,RANTES和分形素均参与了AS的炎症反应过程,具有促进炎症反应及AS形成的作用[1-4]。
牙龈卟啉单胞菌是牙周炎主要致病菌,脂多糖(lipopolysacchearide,LPS)是其重要的毒力因子之一。本课题组前期研究[5]表明:牙龈卟啉单胞菌可侵入人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC),并对其细胞功能产生一定影响;进一步研究[6]显示:牙龈卟啉单胞菌及其毒力因子LPS可促进单核细胞表面趋化因子受体的表达上调。另有研究[7]也表明,牙龈卟啉单胞菌能黏附并侵入血管内皮细胞,其毒力因子LPS还可以通过上调黏附分子、趋化因子及趋化因子受体等从而促进白细胞的活化,参与AS病损的形成。但牙龈卟啉单胞菌的LPS能否通过影响血管内皮细胞趋化因子RANTES和分形素的表达,从而调节单核细胞向血管内皮趋化迁移的作用,目前国内外研究还较少。本研究通过观察不同质量浓度牙龈卟啉单胞菌LPS对HUVEC表达趋化因子RANTES和分形素的影响,探索其在CVD中的可能致病机制,为牙周炎与CVD的相关关系提供依据。
1 材料和方法
1.1 实验细胞株
HUVEC细胞株EA-hy926,由上海斯信生物科技有限公司提供。
1.2 试剂和仪器
牙龈卟啉单胞菌的LPS(Invivogen公司,美国);胎牛血清,DMEM-高糖培养基(Gibco公司,美国);TrizolTMReagent(Invitrogen公司,美国);人RANTES及分形素酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(上海源叶生物科技有限公司提供);RNA逆转录试剂盒(TaKaRa公司,日本)。恒温培养箱(Thermo公司,美国),超净工作台(Biological Safety Cabinets,Thermo公司,美国),水平摇床(SYC-2101型,Crystal公司,美国),酶标仪(Thermo公司,美国),高速冷冻离心机(Hermle公司,德国),高通量聚合酶链反应(polymerase chain reaction,PCR)仪(BIO-RAD公司,美国),ABI7300型荧光定量PCR仪(Applied Biosystems公司,美国)。1.3 细胞培养
用含15%胎牛血清的DMEM培养基复苏细胞,置于含10%胎牛血清的DMEM培养基中,在37 ℃和5%CO2环境中常规培养,每2 d传代1次(去除培养基中血清,PBS清洗3次,加入胰酶消化),镜下观察细胞形态。
1.4 细胞毒性实验
将对数生长期的HUVEC接种于96孔板,密度为每毫升5×104个,每孔0.2 mL。培养24 h后,每孔加入不同质量浓度的LPS,使孔内LPS终质量浓度分别为0(对照组)、10、50、100、200、500、1 000、2 000、5 000 ng·mL-1,每个不同的质量浓度设置4个复孔,空白组仅加入DMEM培养基0.2 mL,余孔加入等体积的PBS液。培养24 h后,吸出待测孔的培养基,更换新鲜培养基0.2 mL,每孔中加入MTT 液20 μL,置于培养箱中3.5~4 h后终止培养,吸弃上清液,每孔中加入DMSO液200 μL,置于培养箱中30 min后水平摇床低速震荡10 min,待结晶充分溶解后,利用ELISA检测仪测定出490 nm波长的相应吸光度A值,计算细胞存活率。细胞存活率=(实验组A值-空白组A值)/(对照组A值-空白组A值)。
1.5 LPS感染HUVEC模型
选取不同质量浓度的LPS与HUVEC共培养,使其终质量浓度为0、200、500、1 000 ng·mL-1。分别于培养后1、6、12、24 h收集细胞上清液,Trizol法裂解细胞以提取细胞总RNA。
1.6 RANTES及分形素mRNA表达
采用实时荧光定量PCR(real time quantitative-PCR,RT-PCR)检测RANTES及分形素mRNA的表达。提取总RNA,逆转录合成cDNA,然后进行RTPCR反应,采用β-actin作为内参基因。各基因的引物序列如下。β-actin,F:5’-CCACGAAACTACCTTCAA-CTCC-3’,R:5’-GTGATCTCCTTCTGCATCCTGT-3’;RANTES,F:5’-CATCCTCATTGCTACTGCCCTCT-3’,R:5’-GCCACTGGTGTAGAAATACTCCTTG-3’;分形素,F:5’-TTCTGCCATCTGACTGTCCTGC-3’,R:5’-TGCCTGGTTCTGTTGATAGTGGAT-3’。
1.7 RANTES及分形素蛋白的表达
采用ELISA法测定细胞上清液中RANTES及分形素蛋白的表达,根据试剂盒所示步骤进行操作。RANTES最低检测质量浓度为70 pg·mL-1,分形素最低检测质量浓度为20 pg·mL-1。
1.8 统计学方法
所有数据为3次重复实验结果,采用SPSS17.0统计软件进行统计分析。统计方法采用方差分析法,两两比较采用LSD检验,检验水准为双侧α=0.05。
2 结果
2.1 细胞毒性实验结果
应用不同质量浓度LPS刺激HUVEC细胞24 h后的MTT实验结果见图1。10、50、100、200、500、1 000 ng·mL-1LPS组细胞存活率均在95%以上,与对照组相比差异无统计学意义(P>0.05)。2 000、5 000 ng·mL-1LPS刺激后,细胞存活率较对照组明显降低,差异有统计学意义(P<0.05)。根据MTT实验结果,筛选出后续实验中LPS刺激的质量浓度为0、200、500、1 000 ng·mL-1。
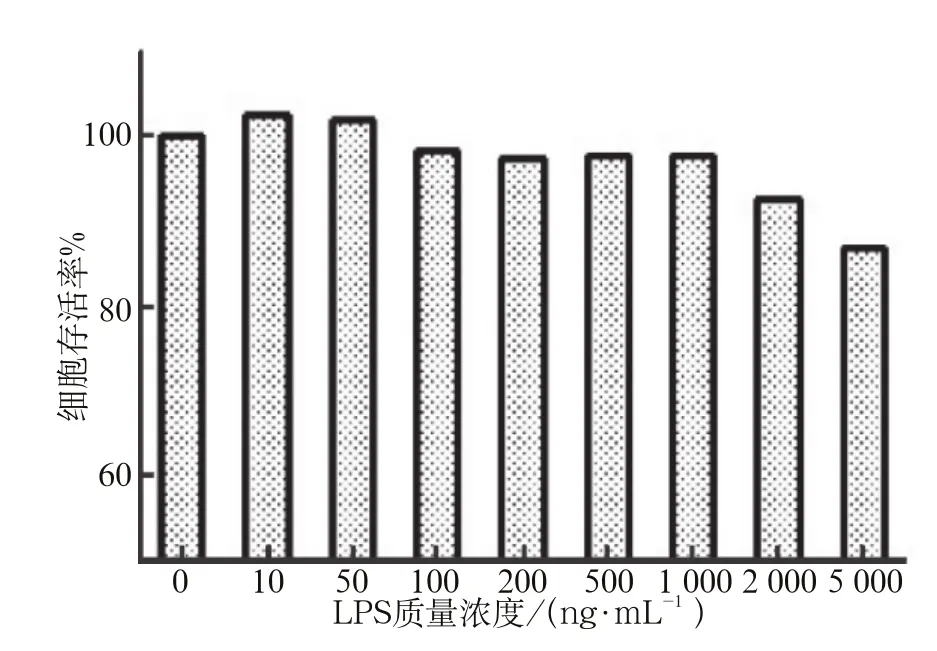
图 1 不同质量浓度LPS作用下HUVEC存活率 Fig 1 The survival rate of HUVEC under different concentrations of LPS
2.2 RANTES及分形素的mRNA表达
2.2.1 RANTES mRNA的表达 不同质量浓度LPS刺激HUVEC细胞后RANTES mRNA的表达变化见表1。在刺激的12 h内,RANTES mRNA相对表达量随着LPS质量浓度增高呈增加趋势,除12 h时200 ng·mL-1组外,其余实验组与对照组的差异均有统计学意义(P<0.05)。6 h时1 000 ng·mL-1组RANTES mRNA相对表达量达到峰值,为对照组的4.88倍。6 h后,各实验组RANTES mRNA的表达量较之前呈下降趋势,24 h时,各实验组RANTES mRNA表达量均略微高于对照组,仅500 ng·mL-1组与对照组的差异有统计学意义(P<0.05)。同一时间点各实验组间比较显示:1、6、12 h时,1 000 ng·mL-1组RANTES mRNA相对表达量均高于200 ng·mL-1及500 ng·mL-1组,差异有统计学意义(P<0.05)。
表 1 LPS刺激HUVEC后RANTES mRNA的相对表达量Tab 1 RANTES mRNA expression levels of HUVEC stimulated by LPS±s
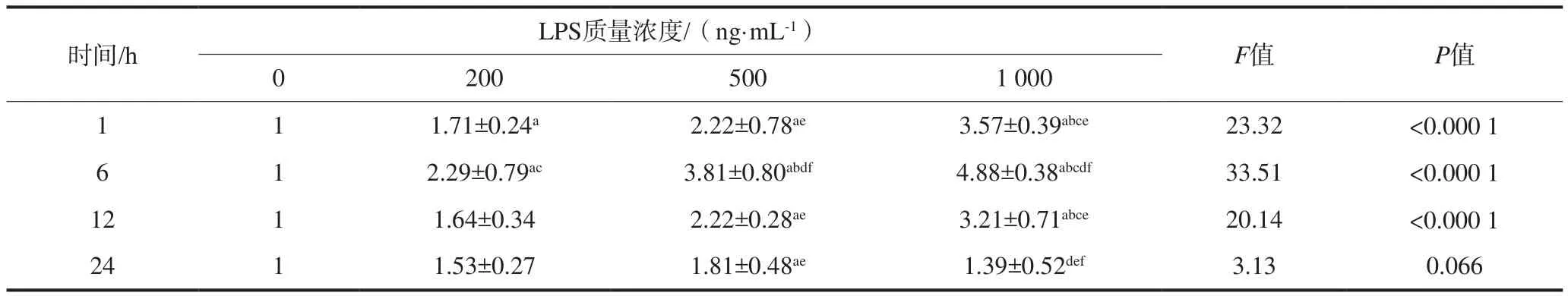
表 1 LPS刺激HUVEC后RANTES mRNA的相对表达量Tab 1 RANTES mRNA expression levels of HUVEC stimulated by LPS±s
注:a:与相同时间点对照组相比,P<0.05;b:与相同时间点2 00 ng·mL-1组相比,P<0.05;c:与相同时间点500 ng·mL-1组相比,P<0.05;d:与相同质量浓度1 h组相比,P<0.05;e:与相同质量浓度6 h组相比,P<0.05;f:与相同质量浓度12 h组相比,P<0.05。
时间/h LPS质量浓度/(ng·mL-1) F值 P值0 200 500 1 000 1 1.71±0.24a2.22±0.78ae3.57±0.39abce23.32 <0.000 1 6 1 2.29±0.79ac3.81±0.80abdf4.88±0.38abcdf33.51 <0.000 1 1 12 1 1.64±0.34 2.22±0.28ae3.21±0.71abce20.14 <0.000 1 24 1 1.53±0.27 1.81±0.48ae1.39±0.52def3.13 0.066
2.2.2 分形素mRNA的表达 LPS刺激HUVEC细胞后分形素mRNA的表达变化见表2。在刺激的12 h内,分形素mRNA相对表达量随LPS质量浓度增高呈增加趋势,各实验组与对照组相比均有统计学差异(P<0.05)。6 h时1 000 ng·mL-1组分形素mRNA表达量达到峰值,为对照组的6.20倍。6 h后,各实验组分形素mRNA表达量较之前下降,24 h时,各实验组分形素mRNA表达量均略微高于对照组,仅500 ng·mL-1组与对照组差异有统计学意义(P<0.05)。同一时间点各实验组间比较显示:1、6、12 h时,随着LPS质量浓度增加,分形素mRNA相对表达量相应增高, 各组间差异均有统计学意义(P<0.05)。
表 2 LPS刺激HUVEC后分形素mRNA的相对表达量Tab 2 Fractalkine mRNA expression levels of HUVEC stimulated by LPS ±s
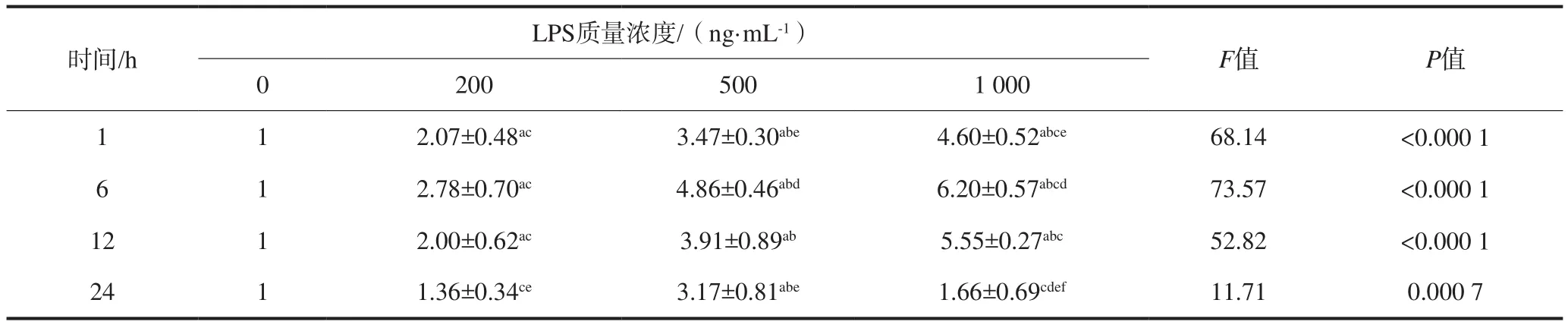
表 2 LPS刺激HUVEC后分形素mRNA的相对表达量Tab 2 Fractalkine mRNA expression levels of HUVEC stimulated by LPS ±s
注:a:与相同时间点对照组相比,P<0.05;b:与相同时间点2 00 ng·mL-1组相比,P<0.05;c:与相同时间点500 ng·mL-1组相比,P<0.05;d:与相同质量浓度1 h组相比,P<0.05;e:与相同质量浓度6 h组相比,P<0.05;f:与相同质量浓度12 h组相比,P<0.05。
LPS质量浓度/(ng·mL-1)时间/h F值 P值0 200 500 1 000 1 2.07±0.48ac3.47±0.30abe4.60±0.52abce68.14 <0.000 1 6 1 2.78±0.70ac4.86±0.46abd6.20±0.57abcd73.57 <0.000 1 1 12 1 2.00±0.62ac3.91±0.89ab5.55±0.27abc52.82 <0.000 1 24 1 1.36±0.34ce3.17±0.81abe1.66±0.69cdef11.71 0.000 7
2.3 细胞上清液中RANTES和分形素蛋白质量浓度2.3.1 RANTES蛋白质量浓度 不同质量浓度LPS刺激HUVEC细胞后RANTES蛋白的表达变化见表3。在刺激的12 h内,细胞上清液中RANTES质量浓度随LPS刺激浓度增高呈增加趋势,除1 h时200 ng·mL-1组外,其余各实验组与对照组相比均具有统计学差异(P<0.05)。刺激6 h后,各实验组的细胞上清液中RANTES质量浓度较之前呈下降趋势;24 h时,各实验组RANTES质量浓度均略微高于对照组,仅500 ng·mL-1组与对照组的差异有统计学意义(P<0.05)。同一时间点各实验组间比较显示:1、6、12 h时,随着LPS质量浓度增加,RANTES表达量相应增高,1 000 ng·mL-1组和200、500 ng·mL-1组的差异均有统计学意义(P<0.05)。
表 3 LPS刺激HUVEC后细胞上清液中RANTES的质量浓度变化Tab 3 RANTES protein levels in the supernatant of HUVEC stimulated by LPS pg·mL-1,±s

表 3 LPS刺激HUVEC后细胞上清液中RANTES的质量浓度变化Tab 3 RANTES protein levels in the supernatant of HUVEC stimulated by LPS pg·mL-1,±s
注:a:与相同时间点对照组相比,P<0.05;b:与相同时间点2 00 ng·mL-1组相比,P<0.05;c:与相同时间点500 ng·mL-1组相比,P<0.05;d:与相同质量浓度1 h组相比,P<0.05;e:与相同质量浓度6 h组相比,P<0.05;f:与相同质量浓度12 h组相比,P<0.05。
LPS质量浓度/(ng·mL-1)时间/h F值 P值0 200 500 1 000 1 1 227.50±71.12 1 309.39±51.47cef1 471.59±34.02abe1 629.47±34.40abce50.63 <0.000 1 6 1 201.05±44.50 1 566.81±51.21acdf1 698.93±36.56abdf1 826.73±40.31abcdf154.1 <0.000 1 12 1 252.21±20.48 1 413.77±51.31ade1 489.81±33.10ae1 633.71±34.00abce76.19 <0.000 1 24 1 265.21±31.75 1 339.70±34.43ce1 440.99±46.50abe1 344.83±41.15cdef13.74 0.000 3
2.3.2 分形素蛋白质量浓度 不同质量浓度LPS刺激HUVEC细胞后分形素蛋白的表达变化见表4。不同质量浓度LPS刺激后细胞上清液中分形素质量浓度与对照组相比较没有明显的变化,仅刺激6、12 h时1 000 ng·mL-1组与其他各组的差异具有统计学意义(P<0.05)。
表 4 LPS刺激HUVEC后细胞上清液中分形素的质量浓度变化Tab 4 Fractalkine protein levels in the supernatant of HUVEC stimulated by LPS pg·mL-1,±s
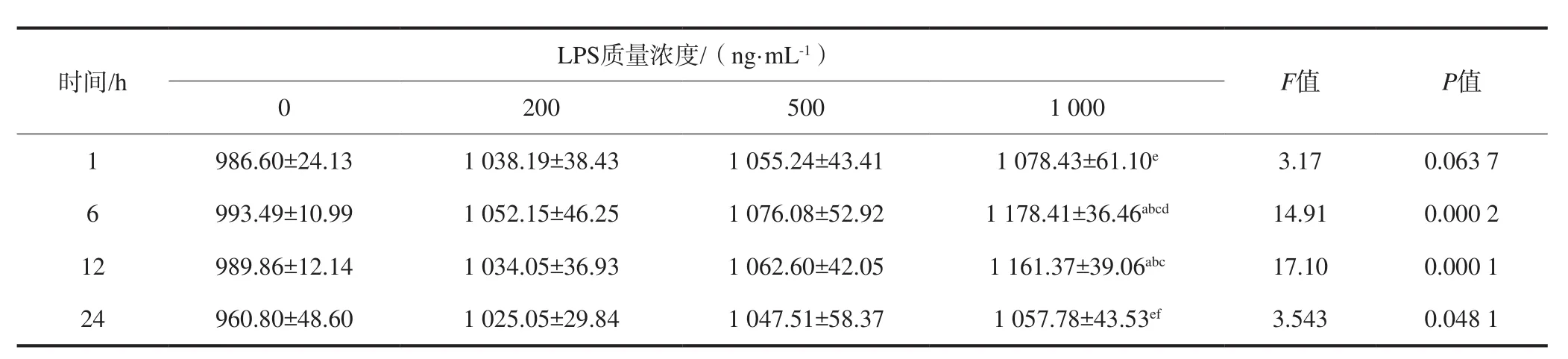
表 4 LPS刺激HUVEC后细胞上清液中分形素的质量浓度变化Tab 4 Fractalkine protein levels in the supernatant of HUVEC stimulated by LPS pg·mL-1,±s
注:a:与相同时间点对照组相比,P<0.05;b:与相同时间点2 00 ng·mL-1组相比,P<0.05;c:与相同时间点500 ng·mL-1组相比,P<0.05;d:与相同质量浓度1 h组相比,P<0.05;e:与相同质量浓度6 h组相比,P<0.05;f:与相同质量浓度12 h组相比,P<0.05。
LPS质量浓度/(ng·mL-1)时间/h F值 P值0 200 500 1 000 986.60±24.13 1 038.19±38.43 1 055.24±43.41 1 078.43±61.10e3.17 0.063 7 6 993.49±10.99 1 052.15±46.25 1 076.08±52.92 1 178.41±36.46abcd14.91 0.000 2 12 989.86±12.14 1 034.05±36.93 1 062.60±42.05 1 161.37±39.06abc17.10 0.000 1 24 960.80±48.60 1 025.05±29.84 1 047.51±58.37 1 057.78±43.53ef3.543 0.048 1 1
3 讨论
牙周炎和心血管疾病联系密切。牙周炎症能导致血液中的重要冠心病相关生物标志物浓度升高,而经过牙周治疗后其浓度下降[8-9]。研究[10]显示,牙周炎临床指标与动脉瓣膜狭窄,颈动脉粥样硬化,内皮细胞功能障碍等有关,牙周治疗可以改善内皮细胞功能。牙龈卟啉单胞菌是目前公认的引起牙周炎的主要致病菌之一,LPS是其最重要的毒力因子之一。研究[11]表明,亚临床内毒素血症使AS和CVD的发生风险增加3倍。目前为止,尚未见文献报道牙龈卟啉单胞菌LPS引起亚临床脓毒血症的浓度范围参考值。以往在体外研究中,牙龈卟啉单胞菌LPS的质量浓度多选择为1~5 000 ng·mL-1[12-13]。结合本研究细胞毒性实验结果,后续实验中LPS刺激质量浓度选择为0、200、500、1 000 ng·mL-1。
AS是CVD的基本病变,动脉壁上形成粥样硬化斑块是AS的主要特点,斑块中含有大量炎症细胞,其中单核细胞约占80%左右。单核细胞通过对血管内皮细胞的趋化作用而进入血管壁变成巨噬细胞,进一步吞噬脂质后变为泡沫细胞,成为粥样硬化斑块的主要组成成分。其中趋化因子在单核细胞黏附、侵入血管内皮以及AS的形成和发展中起重要作用。趋化因子家族主要分为四大类:C、CC、CXC、CX3C,其中具有单核细胞趋化功能的是CC类和CX3C类趋化因子。
RANTES是CC类趋化因子亚家族中的一员,其受体为CCR1、CCR3和CCR5,具有典型的趋化效应,与G蛋白偶联受体结合后可引起短暂的钙离子内流,导致受体极化和细胞迁移,增加细胞表面细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)、CD43、CD44及CD45等的表达,诱导白细胞向炎症部位浸润[14]。趋化因子RANTES可促进炎症反应,参与AS发生发展过程。流行病学调查[15]显示,RANTES受体CCR5的基因多态性与心血管疾病的发生有关。研究人员在AS病变中检测到RANTES存在[16]。用多肽拮抗剂抑制RANTES受体后可以抑制白细胞浸润,AS病变形成及发展[1]。动物实验[2]显示,血清RANTES浓度与粥样斑块不稳定性呈正相关。另外Gamonal等[17]研究表明,牙周炎患者局部炎症位点龈沟液(gingival crevicular fluid,GCF)中可检测到趋化因子RANTES的存在,但在牙周健康者的龈沟液中无法检测到。Johnson等[18]发现牙周炎患者牙龈组织中RANTES表达增加,且与牙周袋的探诊深度有一定的关系。这些研究结果提示,牙周炎引起的RANTES表达水平变化可能是牙周炎与CVD相关的桥梁分子之一。本研究的结果显示,200、500、1 000 ng·mL-1的LPS均能影响HUVEC RANTES蛋白和mRNA表达,且在12 h内,RANTES蛋白和mRNA表达量随LPS刺激的质量浓度增高呈增加趋势,在6 h时的表达量最高。这提示LPS可能通过上调RANTES的表达影响单核细胞对血管内皮细胞的趋化功能,进而影响AS形成。Bodet等[19]利用不同的牙龈卟啉单胞菌(ATCC33277、ATCC53977、W83)感染人全血,结果发现,牙龈卟啉单胞菌可呈浓度依赖性促进RANTES表达,且ATCC53977的刺激作用更强,这与本研究结果一致。
分形素是趋化因子CX3C亚家族目前的唯一成员,具有膜结合型和分泌型两种形式,是一种兼具黏附功能的趋化因子,不仅能够诱导单核细胞的定向迁移,还能介导单核细胞与血管内皮细胞的紧密黏附。研究[20]发现,分形素及其受体参与AS形成及去稳定化的过程。Rius等[3]研究表明,吸烟可以增加人动脉内皮细胞分形素的表达,促进单核细胞对其的黏附。Stolla等[4]研究发现,分形素在人动脉粥样硬化斑块的早、晚期都可检测到,并且可促进单核细胞的趋化作用。Park等[21]研究表明,100 ng·mL-1的LPS刺激鼠肾小球膜细胞4h后,分形素的mRNA表达量是空白对照组的2.2倍。Hosokawa等[22]研究发现,在正常的人牙龈组织中未检测到分形素表达,而炎性牙龈组织中可检测到其表达,且主要表达于血管内皮细胞;进一步用1 000 ng·mL-1的牙龈卟啉单胞菌LPS刺激HUVEC,结果表明,LPS可上调分形素的mRNA表达,8 h时表达量最高。本研究结果表明,200、500、1 000 ng·mL-1的Pg-LPS均能影响人脐静脉内皮细胞分形素的mRNA表达,且在12 h内,分形素的mRNA表达量随LPS质量浓度增高呈增加趋势,6 h时的表达量最高。这一结果类似Hosokawa 等[22]的研究结果。但是本研究中LPS对分形素蛋白水平表达的影响并不明显,这可能是由于分形素具有膜结合型和分泌型两种形式,而本实验利用ELISA法测量细胞上清液中分形素质量浓度仅能测得其分泌形式,测量结果可能欠缺对膜结合型分形素表达变化的分析。本课题组后续实验将通过流式细胞术和Western-blot进一步分析LPS对HUVEC表面膜结合型分形素表达的影响。
[参考文献]
[1] Braunersreuther V, Steffens S, Arnaud C, et al. A novel RANTES antagonist prevents progression of established atherosclerotic lesions in mice[J]. Arterioscler Thromb Vasc Biol, 2008, 28(6):1090-1096.
[2] Lv YB, Jing J, Li JM, et al. Assessment of RANTES levels as the indicators of plaque vulnerability in rabbit models of atherosclerosis[J]. Pathol Res Pract, 2014, 210(12):1031-1037.
[3] Rius C, Company C, Piqueras L, et al. Critical role of fractalkine (CX3CL1) in cigarette smoke-induced mononuclear cell adhesion to the arterial endothelium[J]. Thorax, 2013, 68(2):177-186.
[4] Stolla M, Pelisek J, von Brühl ML, et al. Fractalkine is expressed in early and advanced atherosclerotic lesions and supports monocyte recruitment via CX3CR1[J]. PLoS ONE, 2012, 7(8):e43572.
[5] 邓辉, 吴亚菲, 丁一, 等. 四种牙周致病菌侵入血管内皮细胞能力的体外研究[J]. 中华口腔医学杂志, 2010, 45(4): 203-206. Deng H, Wu YF, Ding Y, et al. Invasion of four common periodontal pathogens into vascular endothelial cells in vitro [J]. Chin J Stomatol, 2010, 45(4):203-206.
[6] 黄玮, 赵蕾, 贾岳, 等. 牙龈卟啉单胞菌脂多糖对单核细胞THP-1表达CC类趋化因子受体2的影响[J]. 中华口腔医学杂志, 2013, 48(7):393-397. Huang W, Zhao L, Jia Y, et al. Effect of Porphyromonas gingivalis lipopolysacchearide on the expression of CC chemokine receptor 2 in monocytes[J]. Chin J Stomatol, 2013, 48(7):393-397.
[7] Hashizume T, Kurita-Ochiai T, Yamamoto M. Porphyromonas gingivalis stimulates monocyte adhesion to human umbilical vein endothelial cells[J]. FEMS Immunol Med Microbiol, 2011, 62(1):57-65.
[8] Paraskevas S, Huizinga JD, Loos BG. A systematic review and meta-analyses on C-reactive protein in relation to periodontitis[J]. J Clin Periodontol, 2008, 35(4):277-290.
[9] 邓林凯, 李春洁, 李茜, 等. 牙周治疗对心血管疾病危险因素控制效果的系统评价[J]. 华西口腔医学杂志, 2013, 31(5):463-467. Deng LK, Li CJ, Li Q, et al. Periodontal treatment for cardiovascular risk factors: a systematic review[J]. West China J Stomatol, 2013, 31(5):463-467.
[10] Hayashi C, Gudino CV, Gibson FC 3rd, et al. Review: pathogen-induced inflammation at sites distant from oral infection: bacterial persistence and induction of cell-specific innate immune inflammatory pathways[J]. Mol Oral Microbiol, 2010, 25(5):305-316.
[11] Wiedermann CJ, Kiechl S, Dunzendorfer S, et al. Association of endotoxemia with carotid atherosclerosis and cardiovascular disease: prospective results from the Bruneck Study[J]. J Am Coll Cardiol, 1999, 34(7):1975-1981.
[12] Honda T, Oda T, Yoshie H, et al. Effects of Porphyromonas gingivalis antigens and proinflammatory cytokines on human coronary artery endothelial cells[J]. Oral Microbiol Immunol, 2005, 20(2):82-88.
[13] Tarozzo G, Campanella M, Ghiani M, et al. Expression of fractalkine and its receptor, CX3CR1, in response to ischaemiareperfusion brain injury in the rat[J]. Eur J Neurosci, 2002, 15(10):1663-1668.
[14] Marino AP, Silva AA, Santos PV, et al. CC-chemokine receptors:a potential therapeutic target for Trypanosoma cruzi-elicited myocarditis[J]. Mem Inst Oswaldo Cruz, 2005, 100(Suppl 1):93-96.
[15] Balistreri CR, Candore G, Caruso M, et al. Role of polymorphisms of CC-chemokine receptor-5 gene in acute myocardial infarction and biological implications for longevity [J]. Haematologica, 2008, 93(4):637-638.
[16] Veillard NR, Steffens S, Burger F, et al. Differential expression patterns of proinflammatory and antiinflammatory mediators during atherogenesis in mice[J]. Arterioscler Thromb Vasc Biol, 2004, 24(12):2339-2344.
[17] Gamonal J, Bascones A, Jorge O, et al. Chemokine RANTES in gingival crevicular fluid of adult patients with periodontitis[J]. J Clin Periodontol, 2000, 27(9):675-681.
[18] Johnson RB, Wood N, Serio FG. Interleukin-11 and IL-17 and the pathogenesis of periodontal disease[J]. J Periodontol, 2004, 75(1):37-43.
[19] Bodet C, Chandad F, Grenier D. Porphyromonas gingivalisinduced inflammatory mediator profile in an ex vivo human whole blood model[J]. Clin Exp Immunol, 2006, 143(1): 50-57.
[20] Damås JK, Boullier A, Waehre T, et al. Expression of fractalkine (CX3CL1) and its receptor, CX3CR1, is elevated in coronary artery disease and is reduced during statin therapy [J]. Arterioscler Thromb Vasc Biol, 2005, 25(12):2567-2572.
[21] Park J, Song KH, Ha H. Lipopolysaccharide increases monocyte binding to mesangial cells through fractalkine and its receptor[J]. Transplant Proc, 2012, 44(4):1029-1031.
[22] Hosokawa Y, Nakanishi T, Yamaguchi D, et al. Expression of fractalkine (CX3CL1) and its receptor, CX3CR1, in periodontal diseased tissue[J]. Clin Exp Immunol, 2005, 139(3): 506-512.
(本文编辑 吴爱华)
[中图分类号]R 780.2
[文献标志码]A [doi] 10.7518/hxkq.2016.02.018
[收稿日期]2015-09-30; [修回日期] 2015-11-21
[基金项目]国家自然科学基金(30973323,81371150)
[作者简介]漆晓玲,硕士,E-mail: 815655244@qq.com
[通信作者]吴亚菲,教授,博士,E-mail:yafeiwu@tom.com
Effects of Porphyromonas gingivalis lipopolysaccharide on the expression of RANTES and fractalkine in human um-bilical vein endothelial cells
Qi Xiaoling1,2, Zhao Lei3, Chen Shanshan1, Meng Shu3, Wu Yafei3. (1. State Key Laboratory of Oral Diseases, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China; 2. Dept. of Periodontics, Stomatological Hospital of Chongqing Medical University, Chongqing 401147, China; 3. State Key Laboratory of Oral Diseases, Dept. of Periodontics, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China)
Supported by: Natural Science Foundation of China (30973323, 81371150). Correspondence: Wu Yafei, E-mail: yafeiwu@ tom.com.
[Abstract]Objective A study was conducted to investigate the effects of Porphyromonas gingivalis lipopolysaccharide (Pg-LPS) on the expression of regulated upon activation normal T-cell expressed and secreted (RANTES) and fractalkine in human umbilical vein endothelial cells (HUVECs). Methods HUVECs were incubated with different concentrations of Pg-LPS (200, 500, and 1 000 ng·mL¯1) for 1, 6, 12, and 24 h, respectively. Then real time quantitative polymerase chain reaction (RT-PCR) and enzyme-linked immunosorbent method (ELISA) were adopted to detect the protein levels and mRNA levels of RANTES and fractalkine. Results The RANTES protein levels and mRNA levels, as well as fractalkine mRNA levels, were significantly higher in all experimental groups of 1, 6, and 12 h than in the control group (P<0.05), except the expression of RANTES mRNA in 200 ng·mL¯1group of 12 h and RANTES protein in 200 ng·mL¯1group of 1 h. The expression levels of RANTES mRNA and fractalkine mRNA were highest in 1 000 ng·mL¯1group of 6 h and were 4.88- and 6.20-fold higher, respectively, than those in the control group. The expression levels of RANTES protein, mRNA, and frac-talkine mRNA decreased 6 h after stimulation, and were significantly higher than those in the control group (P<0.05) in the 500 ng·mL¯1group of 24 h. There was a significant difference between the expression of fractalkine mRNA in 1 000 ng·mL¯1group of 6 and 12 h than in the control group (P<0.05). Conclusion Pg-LPS infection might up-regulate the expression of RANTES and fractalkine in HUVEC, and such expression is important in the development of atherosclerosis.
[Key words]atherosclerosis; periodontitis; chemokines; Porphyromonas gingivalis; lipopolysacchearide
