鹿瓜多肽注射液对家兔长节段单椎体压缩性骨折VEGF及PMMA颗粒诱导骨溶解的影响*
2016-07-08冯艳琴江雪莲王文杰郭晓玲穆敬平湖北省十堰市太和医院湖北医药学院附属医院湖北十堰442000
冯艳琴 江雪莲 王文杰 张 毅 郭晓玲 王 璇 穆敬平(湖北省十堰市太和医院湖北医药学院附属医院,湖北十堰442000)
鹿瓜多肽注射液对家兔长节段单椎体压缩性骨折VEGF及PMMA颗粒诱导骨溶解的影响*
冯艳琴江雪莲王文杰张毅郭晓玲王璇穆敬平△
(湖北省十堰市太和医院湖北医药学院附属医院,湖北十堰442000)
【摘要】目的观察鹿瓜多肽注射液对家兔长节段单椎体压缩性骨折合并骨溶解治疗过程中血管内皮生长因子(VEGF)表达及PMMA颗粒诱导骨溶解抑制作用的影响。方法健康兔50只,将其中40只随机分为模型对照组、鹿瓜多肽A、B、C组,采用手术方法建立家兔长节段单椎体压缩性骨折基础上于骨折周围组织注入PMMA颗粒以造成骨折合并骨溶解动物模型,另10只不做造模型处理设为空白对照组。术后10 d鹿瓜多肽A、B、C 3组于骨折局部肌肉注射鹿瓜多肽注射液治疗4周,空白对照组及模型对照组肌肉注射等体积0.9%氯化钠注射液。兔疫组化染色及图像分析法测定兔L1节骨折椎体VEGF及VEGF mRNA阳性表达,ELISA法检测血清PGE2、IL-1及IL-8水平,影像学检测骨折椎体骨密度,HE染色病理检测兔L1骨折椎体骨溶解病理改变情况。结果鹿瓜多肽B、C组在治疗4周后,其VEGF、VEGFmRNA在兔L1节骨折椎体中的阳性表达及骨密度均明显增强,PGE2、IL-1、IL-8水平及病检兔L1节骨折椎体骨溶解明显降低,与本组治疗前及模型对照组比较,差异有统计学意义(P<0.05)。鹿瓜多肽A组无明显变化,B、C组两组间比较,差异无统计学意义(P>0.05)。结论鹿瓜多肽注射液可促进兔长节段单椎体压缩性骨折合并骨溶解愈合过程中VEGF及VEGFmRNA阳性表达,增加L1节骨折椎体局部组织血液供应,促使L1节骨折椎体周围组织血管内皮新生,降低PGE2、IL-1及IL-8水平以减轻炎症反应,调节兔L1节骨折椎体组织细胞代谢及平衡,抑制骨溶解而增加骨密度,对骨折椎体骨痂形成及维持成骨及破骨过程的平衡稳定具有明显的促进作用。
【关键词】长节段单椎体压缩性骨折鹿瓜多肽注射液兔L1节骨折椎体血管内皮生长因子骨溶解
长节段单椎体压缩性骨折(LSVCF)在人工关节置换术或者内固定治疗时常并发无菌性炎症并导致关节松动,并间接造成骨折部位骨溶解,而骨溶解是关节磨损微粒无菌性炎症主要诱因[1]。在骨科手术中主要的磨损微粒有骨水泥颗粒-PMMA、聚乙烯颗粒-UHMPE及钛合金微粒等,特别是PMMA这类磨损颗粒可明显刺激骨折周围组织,造成大量炎性细胞聚集,这些炎性细胞可分泌大量的炎症因子如PGE2、白介素-1(IL-1)及白介素-8(IL-8)等,并进一步刺激活化破骨细胞而导致骨质的吸收[2]。由于骨折椎体成骨细胞分化能力下降,破骨细胞骨吸收能力升高等多种因素协同作用,骨生成与骨吸收的动态平衡失衡,进而促进骨折椎体周围骨溶解[3]。本研究通过建立家兔长节段单椎体压缩性骨折L1节骨折椎体合并骨溶解(体内注射PMMA颗粒造成L1节骨折椎体骨溶解动物模型)模型,观察鹿瓜多肽注射液在PMMA颗粒诱导长节段单椎体压缩性L1节骨折椎体骨溶解及破骨细胞形成及功能中的相互作用,旨在挖掘祖国中医药治疗长节段单椎体压缩性骨折合并骨溶解的优势,为临床治疗骨折提供安全可靠的药物。现报告如下。
1 材料与方法
1.1实验动物SPF级健康家兔50只,兔龄180 d,体质量1.6~2.0 kg,随机数字表编号随机分为空白对照组、模型对照组、鹿瓜多肽A组、鹿瓜多肽B组,鹿瓜多肽C组,每组10只。动物饲养及实验要求:应保证动物福利,尽量减少动物用量,手术麻醉动物时注意保温,本实验研究动物处置方法符合动物伦理学标准[4]。动物房温度18~25℃,湿度在50%~75%之间,每2小时交替光照。动物应分笼饲养,喂普通成型饲料并自由饮水,术后每日观察动物进食及饮水量,称质量,及时清理动物粪便。
1.2仪器及药品SP-Max 3500FL型多功能荧光酶标仪(厂家:上海冉超光电科技有限公司。型号:SPMax 3500FL型);PMMA颗粒(I-海倍尔康生物医学科技有限公司,规格:R=0.2~0.5 μm);兔血管内皮生长因子(VEGF)共调节趋化因子1(VCC1)ELISA试剂盒及兔mRNA提取试剂及反转录试剂(厂家:上海酶联生物科技有限公司。产品货号分别为:mi028454、 mi028457)。鹿瓜多肽注射液(厂家:哈尔滨誉衡药业股份有限公司。批号:字H23020001);
1.3造模参照文献[5],家兔经腹腔注射10%水合氯醛麻醉(0.3 g/kg),腹部向下卧位固定于兔手术台,用医用棉花蘸取硫化钠溶液(80%)涂抹在兔手术区递去兔毛,碘伏消毒完毕后于靠近家兔左侧脊柱旁椎体L1~L3水平处纵行切开皮肤,分离皮下组织、深筋膜及脊间肌肉和韧带,暴露腹膜后间隙。再钝性分离椎前肌肉及韧带,在靠近L1~L2椎间盘处用钢丝剪从椎体侧前方剪断L1椎体前缘,用2.5 mm的钻头在L1椎体中部一侧平行钻两个孔对穿椎体,孔间距为10 mm,人为造成L1椎体中部平面皮质损伤,动物苏醒后自由觅食运动及体质量相当于加载的后应力,此应力可集中在L1椎体平面造成动物长节段单椎体压缩性骨折病变[6]。然后取100 mL PMMA颗粒(30 g/L)悬液注射在L1椎体周围处,1号线间断缝合深筋膜、皮下组织,关闭综合皮肤,再次消毒处理。术后注意预防感染,可肌肉注射庆大霉素4万u(8万u/支,每日1次,注射7 d),动物交替光照促使动物运动及进食可以加剧长节段单椎体压缩性骨折病变模型效果,术后可得长节段单椎体压缩性骨折合并骨溶解动物模型,本实验模型成功率为100%。空白对照组仅腹腔注射麻醉及手术区硫化钠溶液递毛,本组不开胸手术作为空白对照。
1.4给药在椎体压缩骨折合并骨溶解术后10 d,鹿瓜多肽A组在L1节骨折椎体局部肌肉注射鹿瓜多肽注射液0.5 mL/(kg·d)、鹿瓜多肽B组注射2 mL/(kg·d),鹿瓜多肽C组注射4 mL/(kg·d),空白对照组及模型对照组注射等量0.9%氯化钠注射液,5组动物均连续注射治疗4周。
1.5检测指标及方法1)参照文献[7],造模型成功并于治疗4周后取家兔耳缘静脉血暂存,ELISA分析PGE2、IL-1及IL-8水平。方法:造模型成功并治疗4周后取家兔耳缘静脉血静置60 min,3000 r/min离心20 min,取上清液加入EP管,在-20℃低温冰箱保存待查。检测时加样板每孔分别加入样品、样品稀释液、标准品各100 μL,37℃温育30 min后加入酶标偶合液、底物、终止液50 μL等,450 nm波长读取其OD值即可。L1节骨折椎体检测项目:取家兔L1节骨折椎体,采用双抗体两步夹心酶联免疫吸附法测定不同组家兔VEGF、蛋白表达的光密度(OD)值。取材及检测方法:5组家兔均于治疗4周后处死并迅速分离出L1节骨折椎体后滤纸吸干,并分别编号置于-30℃冰冻待查。检测时将标本研磨,5000转离心20 min,取上清液(待测样本),将标准品、待测样本加入到预先包被的VEGF单克隆抗体透明酶标包被板中,37℃温育30 min,洗涤后再加入酶标工作液,再于37℃下温育30 min后洗涤除去未结合的成分,依次加入底物A、B,底物在辣根过氧化物酶催化下转化为蓝色产物,在酸的作用下变成黄色,颜色的深浅与样品VEGF浓度呈正比,用SP-Max 3500 FL型多功能荧光酶标仪于450 nm波长下测定VEGF的OD值。VEGF-mRNA的测定方法参照文献[8],5组家兔L1节骨折椎体标本进行RNA提取,采用反转录-聚合酶链反应(RT-PCR)测定其VEGF-mRNA表达水平。2)兔L1骨折椎体HE染色病理检测方法:参照Warashina等[9]实验步骤,治疗4周后取兔L1骨折椎体,固定,脱钙、脱水、石蜡包埋,石蜡切片4.5m,分别进行HE染色检测兔L1骨折椎体骨溶解病理改变情况。
1.6统计学处理应用SPSS 19.0统计学软件分析。计量资料以(±s)表示,两组间的均数检验采用多因素方差分析,两两比较采用LSD-t检验。计数资料以率表示,组间构成比差异检验采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1各组HE染色病理检测情况模型对照组在治疗4周后,L1骨折椎体骨吸收明显增加,骨小梁结构紊乱,骨破坏溶解面积增多,与空白对照组比较差异有统计学意义(P<0.05)。鹿瓜多肽B、C两组在4周治疗后,L1骨折椎体骨吸收明显减少,骨破坏溶解面积降低,与本组治疗前及模型对照组比较,差异有统计学意义(P<0.05)。鹿瓜多肽A组治疗前后差别不大(P>0.05)。鹿瓜多肽B、C组两组间比较差别不大(P>0.05)。
2.2各组治疗前后VEGF、VEGF mRNA表达比较见表1。空白对照组兔VEGF、VEGF mRNA在L1节骨折椎体上有一定的表达,但治疗前后无明显变化(P>0.05)。模型对照组VEGF、VEGF mRNA表达在L1节骨折椎体表达明显增强,与空白对照组比较差异有统计学意义(P<0.05),提示L1节骨折椎体损伤可刺激机体增强VEGF分泌。鹿瓜多肽B组及鹿瓜多肽C组在4周治疗后VEGF、VEGF mRNA表达明显增强,与本组治疗前及模型对照组比较差异有统计学意义(P<0.05)。鹿瓜多肽A组治疗前后差别不大(P>0.05)。鹿瓜多肽B、C组两组间比较差别不大(P>0.05)。
2.3各组治疗前后PGE2及骨密度比较见表2。空白对照组PGE2及骨密度治疗前后保持在正常水平,且治疗前后无明显变化(P>0.05)。模型对照组PGE2明显升高,骨密度在造模后明显降低,骨膜溶解,与空白对照组比较差异有统计学意义(P<0.05)。鹿瓜多肽B组、鹿瓜多肽C治疗4周后,PGE2降低程度较大,骨膜溶解好转,骨密度明显升高,与本组治疗前及模型对照组比较差异有统计学意义(P<0.05);鹿瓜多肽A组治疗前后差别不大(P>0.05)。鹿瓜多肽B、C组两组间比较差别不大(P>0.05)。
表1 各组治疗前后VEGF、VEGF mRNA表达比较(分,±s)
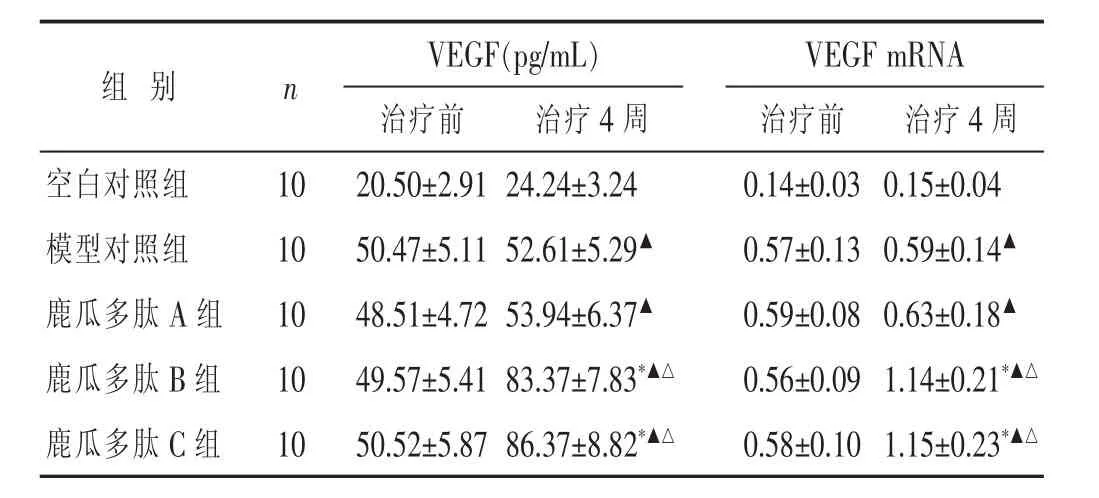
表1 各组治疗前后VEGF、VEGF mRNA表达比较(分,±s)
与本组治疗前比较,* P<0.05;与空白对照组比较,▲ P<0.05;与模型对照组比较,△ P<0.05。下同。
VEGF(pg/mL)VEGF mRNA治疗前 治疗4周 治疗前 治疗4周空白对照组10 20.50±2.91 24.24±3.24 0.14±0.03 0.15±0.04组别 n模型对照组10鹿瓜多肽A组10 50.47±5.11 52.61±5.29▲ 48.51±4.72 53.94±6.37▲ 0.57±0.13 0.59±0.14▲ 0.59±0.08 0.63±0.18▲ 鹿瓜多肽B组10 49.57±5.41 83.37±7.83*▲△ 0.56±0.09 1.14±0.21*▲△ 鹿瓜多肽C组10 50.52±5.87 86.37±8.82*▲△ 0.58±0.10 1.15±0.23*▲△
表2 各组治疗前后PGE2及骨密度比较(±s)
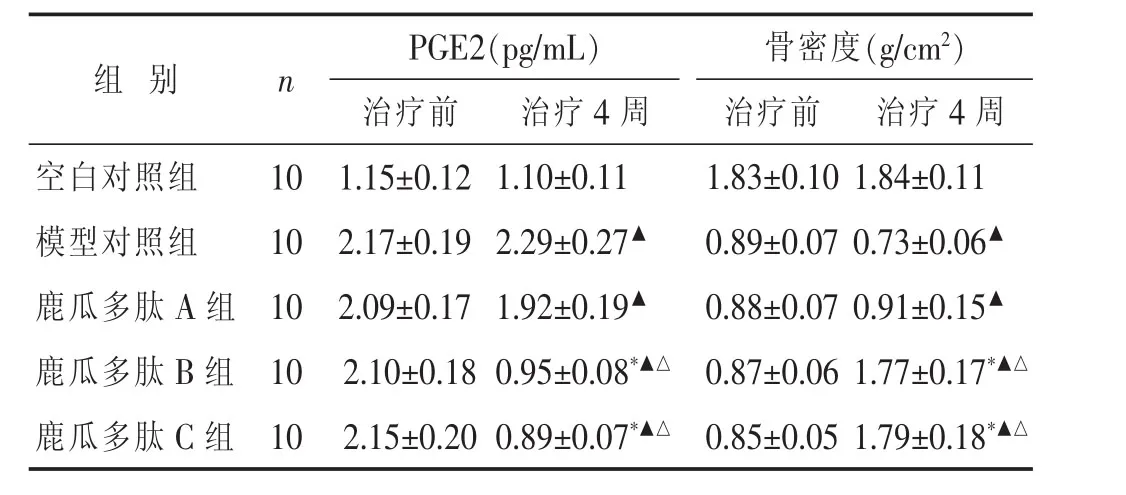
表2 各组治疗前后PGE2及骨密度比较(±s)
组别 n PGE2(pg/mL) 骨密度(g/cm2 )治疗前 治疗4周 治疗前 治疗4周空白对照组10 1.15±0.12 1.10±0.11 1.83±0.10 1.84±0.11模型对照组10鹿瓜多肽A组10 2.17±0.19 2.29±0.27▲ 2.09±0.17 1.92±0.19▲ 0.89±0.07 0.73±0.06▲ 0.88±0.07 0.91±0.15▲ 鹿瓜多肽B组10 2.10±0.18 0.95±0.08*▲△ 0.87±0.06 1.77±0.17*▲△ 鹿瓜多肽C组10 2.15±0.20 0.89±0.07*▲△ 0.85±0.05 1.79±0.18*▲△
2.4各组治疗前后IL-1、IL-8水平比较见表3。空白对照组兔IL-1、IL-8治疗前后无明显变化(P > 0.05)。模型对照组IL-1、IL-8明显增强,与空白对照组比较,差异有统计学意义(P<0.05),提示损伤可刺激机体增强IL-1、IL-8分泌。鹿瓜多肽B组及鹿瓜多肽C组在4周治疗后IL-1、IL-8明显降低,与本组治疗前及模型对照组比较差异有统计学意义(P<0.05)。鹿瓜多肽A组治疗前后无明显变化(P>0.05)。鹿瓜多肽B、C组两组间比较差别不大(P>0.05)。
表3 各组治疗前后IL-1及IL-8水平比较(pg/mL,±s)
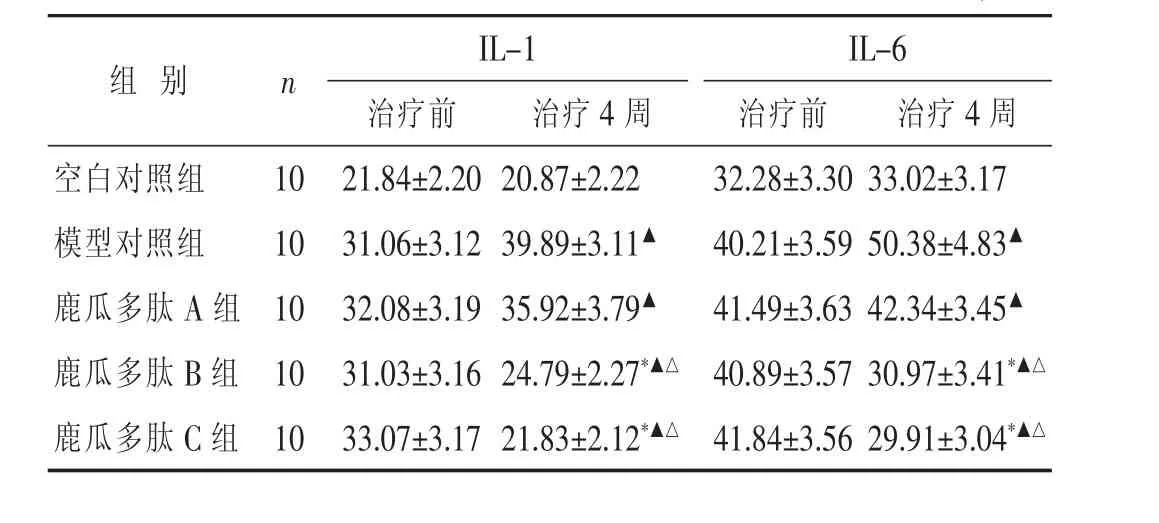
表3 各组治疗前后IL-1及IL-8水平比较(pg/mL,±s)
IL-1IL-6治疗前 治疗4周 治疗前 治疗4周空白对照组10 21.84±2.20 20.87±2.22 32.28±3.30 33.02±3.17组别 n模型对照组10鹿瓜多肽A组10 31.06±3.12 39.89±3.11▲ 32.08±3.19 35.92±3.79▲ 40.21±3.59 50.38±4.83▲ 41.49±3.63 42.34±3.45▲ 鹿瓜多肽B组10 31.03±3.16 24.79±2.27*▲△ 40.89±3.57 30.97±3.41*▲△ 鹿瓜多肽C组10 33.07±3.17 21.83±2.12*▲△ 41.84±3.56 29.91±3.04*▲△
3 讨 论
鹿瓜多肽注射液是从鹿科动物梅花鹿的骨骼和葫芦科植物甜瓜的干燥成熟种子中提取的多肽注射液类生物活性因子合成的一种复方灭菌注射液,富含骨形态发生蛋白(BMP)、成纤维细胞生长因子(FGF)等多种骨诱导多肽类因子,其甜瓜籽提取物中有多种游离氨基酸和有机钙、磷。鹿瓜多肽注射液中含有的骨诱导多肽类生物因子可调节骨代谢,刺激成骨细胞增殖,促进新骨形成,能有效刺激软骨和成骨细胞的分化及增长、促进骨痂形成及骨折修复愈合[10]。鹿瓜多肽注射液中的甜瓜籽提取物还可降低骨折局部毛细血管通透性,减少炎性浸润及渗出,调节钙磷代谢,增加骨钙沉积;防止骨质疏松以及抗炎镇痛抗风湿等作用[11]。长节段单椎体压缩性骨折以腰椎L1~L5多见,以50岁以上的绝经老年妇女好发,出现骨折多因脊柱椎体骨质疏松,脊柱椎体终板损伤,椎间盘退行性变,流行病学调查显示其发生率达26%以上[12]。
本研究结果示,模型对照组兔在造模成功后,其VEGF、VEGF mRNA阳性表达均有不同程度提高,说明椎体长节段单椎体压缩性骨折创伤可在一定程度上刺激机体VEGF的及VEGF mRNA表达水平。其PGE2、IL-1及IL-8均明显增高,说明椎体长节段单椎体压缩性骨折时植入PMMA这类磨损颗粒可明显刺激骨折周围组织,造成大量炎性细胞聚集,这些炎性细胞可分泌大量的炎症因子如PGE2、IL-l及IL-8等,并进一步刺激活化破骨细胞而导致骨吸收。近年来研究发现VEGF具有增加微、小静脉血管的通透性、促使血管内皮细胞分裂增殖及诱导血管再生等作用[13]。VEG其结构和功能与原发现的血管通透性因子(VPF)一致,故称为VEGF/VPF[14],它是一种高度特异性的促血管生长因子[15],可促进多种血管活性物质合成、血管内皮细胞增殖迁移及再生,参与骨折部位动脉侧支循环形成的调节[16],故VEGF在临床上常作为血管内皮功能的重要指标之一。本研究中,在肌肉注射鹿瓜多肽注射液治疗4周后,鹿瓜多肽B、C组VEGF及mRNA阳性表达较模型对照组进一步明显增强,提示鹿瓜多肽注射液具有促进椎体损伤时VEGF的分秘的作用,这与彭昊等[17]研究鹿瓜多肽注射液诱导缺骨折愈合过程中血管内皮生长因子表达,促进骨折局部组织血管再生,促进受损血管内皮修复的功能一致。鹿瓜多肽中甜瓜籽提取物能降低骨折局部毛细血管通透性,减少炎性因子IL-l、IL-8、PGE2等浸润及渗出,恢复局部血运,抑制机体PGE2的合成与释放而达到止痛作用。在促进骨折早期愈合过程中,甜瓜籽提取物与BMPs、FGF等骨诱导多肽生物因子可促进骨原性生长因子合成,为骨细胞合成BMPs、FGF等骨源性生物因子提供原料,具有明显的协同作用[18],可促进骨源性生物因子的合成及钙磷代谢,维持骨容量,增加骨钙含量,增强骨密度。同时,鹿瓜多肽B、C两组静脉血PGE2、IL-1及IL-8水平明显降低,这是由于椎体长节段单椎体压缩性骨折时植入PMMA这类磨损颗粒后可刺激巨噬细胞产生多种炎性因子,如IL-l、IL-8及PGE2等,IL-l、IL-8及PGE2等炎性因子在诱导细胞增殖形成及骨吸收等方面起着明显的诱导作用[19]。破骨细胞是造成骨吸收溶解的重要细胞,PMMA磨损颗粒促使破骨细胞的分化与增殖,直接产生大量促炎性递质和蛋白水解酶类,尤其是IL-l、IL-8、PGE2等,使破骨细胞前体细胞向破骨细胞的分化增值,并最终导致植入PMMA磨损颗粒骨折椎体溶解。在经过鹿瓜多肽治疗4周后,鹿瓜多肽B、C两组静脉血PGE2、IL-1及IL-8水平明显降低,提示鹿瓜多肽注射液可能阻止PMMA磨损颗粒造成的炎性浸润,抑制PMMA这类磨损颗粒刺激巨噬细胞产生,降低炎性因子多种炎性因子IL-l、IL-8、PGE2等的分泌与合成,进而抑制破骨细胞的分化与增殖,减少骨吸收及溶解。
综上所述,鹿瓜多肽注射液可促进兔长节段单椎体压缩性骨折合并骨溶解愈合过程中VEGF及VEGF mRNA阳性表达,增加L1节骨折椎体局部组织血液供应,促使L1节骨折椎体周围组织血管内皮新生,降低PGE2、IL-1及IL-8水平以减轻炎症反应,调节兔L1节骨折椎体组织细胞代谢及平衡,抑制骨溶解而增加骨密度,对骨折椎体骨痂形成及维持成骨及破骨过程的平衡稳定具有明显的促进作用。
参考文献
[1]陈雷,李长德,于洋,等.鹿瓜多肽注射液对PMMA颗粒诱导的小鼠颅骨骨溶解抑制作用的实验研究[J].黑龙江医药科学,2014,37(2):102-103.
[2]KwanTat S,Padrines M,Theoleyre S,et al. IL -8,RANKL,TNF-α l-Pha/ILlinterrelations in boneresorption pathophysiology[J].Cytokine Growth Factor Rev,2004,15(1):49-60.
[3]季锋.关节置换术后假体周围粒子与假体松动的研究进展[J].中国医药导报,2012,9(8):10-12.
[4]贾自力,张萍萍.漫议动物福利与动物卫生[J].中国动物检疫,2015,10(5):45-49.
[5]张淑娴,郭新全,邱玉金,等.兔长节段单椎体压缩性骨折动物模型制备的初步探讨[J].动物医学进展,2013,34(7):131-134 .
[6]陈劲松,赵卫东,林欣,等.长节段单椎体压缩性骨折动物模型的建立[J].中国临床解剖学杂志,2007,25(l):88-89.
[7]李章华,王志林,周月容,等.鹿瓜多肽注射液对骨折愈合过程中生长因子表达的影响[J].中国骨与关节损伤杂志,2007,22(l1):919-920.
[8]Ozmen S,Ayhan S,Demir Y,et al. Impact of gradual blood flow increase on ischemia-reperfusion injury in the rat cremaster microcirculationmodel[J]. J Plast Reconstr Aesthet Surg,2008,61(8):939-948.
[9]Warashina H,Sakano S. Biological reaction to alumina,zirconia,ti -tanium and polyethy lene particles implanted onto murine calvaria[J]. Biomaterials,2003,24(l):3655-3661.
[10]赵海峰.鹿瓜多肽注射液与骨肽注射液治疗四肢骨干骨折的临床对比研究[J].医学信息,2012,25(5):126-127.
[11]雷桂平.通督补肾活血方联合鹿瓜多肽注射液治疗强直性脊柱炎32例[J].中医药导报,2011,17(11):96-97.
[12]安珍,杨定焯,张祖君,等.骨质疏松性脊椎压缩性骨折流行病学调查分析[J].中国骨质疏松杂志,2002,8(1):8283-8284.
[13]孙立光,欧阳慧,郝钊,等.骨瓜提取物注射液应用于四肢骨折术后患者的临床价值[J].现代中西医结合杂志,2014,23(25):2776-2778.
[14]孙熘瑛,徐鹏霄.血管内皮生长因子的研究和应用进展[J].解剖科学进展,2003,9(4):361-363.
[15]王骏,励建安,金挺剑,等.日负荷对新西兰兔血管内皮生长因子表达的影响[J].中国康复医学杂志,2005,2O(3):165-167.
[16]Ca-Szabo G,Ragass-San JD,Turumella V,et al. Changes in nRNA and protein levels of proteoglycans of the anulus fibrosus and nucleus pulposus during intervertebral disc degeneration[J]. Spine,2002,27(20):2212-2221.
[17]彭昊,汪品,李章华,等.鹿瓜多肽注射液促进骨折愈合过程中血管内皮生长因子表达的机制[J].中国临床康复,2006,7(37):81-82.
[18]杨垒.鹿瓜多肽注射液的临床应用综述[J].当代医学,2009,15(10):165-166.
[19]邵振兴,蒋青.假体周围骨质溶解细胞分子生物学研究[J].国际骨科学杂志,2007,28(3):170-173.
The Effects of Cervus and Cucumis Polypeptide Injection on VEGF and PMMA Particles Induced Osteol-ysis of Long segmental Single Vertebral Compression Fractures
FENG Yanqin,JIANG Xuelian,WANG Wenjie,et al.
Taihe Hospital of Shiyan,Hubei,Shiyan 442000,China.
【Abstract】Objective:To observe the effects of cervus and cucumis polypeptide injection on VEGF and PMMA particles induced osteolysis of long segmental single vertebral compression fractures. Methods:Among 50 healthy rabbits,40 were randomly divided into the model control group,and cervus and cucumis polypeptide A,B,C group. The surgical method was used to make animal model of long segmental single vertebral compression fractures with osteolysis,and the surrounding tissue was injected with PMMA particles. The rest 10 rabbits were designed as the blank control group. 4 weeks after operation,group A,B,and C took the local muscle injection,and the control group were treated with the same volume of physiological saline. The rabbit plague immunohistochemical staining and image analysis method was used to determine VEGF and VEGFmRNA expression of the rabbit L1 vertebral fractures;ELISA was used to detect levels of serum PGE2,IL-1 and IL-8 and image was used to detect fracture vertebral bone mineral density and HE staining pathological detection of rabbit L1 vertebral osteolysis pathological changes. Results:4 weeks after treatment,in group B and C,the VEGF and VEGF mRNA in rabbit L1 fracture vertebral positive expression and bone density were significantly enhanced,and PGE2,IL-1,IL-8L1 level and pathological examination of rabbit L1 section fracture vertebral osteolysis was significantly reduced. Compared with the treatment group and the model control group,the difference was statistically significant(P<0.05). There was no significant change in group A. C and B groups were compared,without statistical significance (P>0.05). Conclusion:Cervus and cucumis polypeptide injection can promote the positive expression of EGFand VEGFmRNA in the agglutination of long segmental single vertebral compression fracture associated with osteolysis in rabbit,increase blood supply of L1 vertebral fracture local tissue,promote L1 joint fracture and vertebral surrounding tissue vascular endothelial newborn,reduce the level of PGE2,IL-1 and IL-8 to reduce inflammatory reaction,regulate L1 joint fracture and vertebral body tissue metabolism and balance,inhibit osteolysis to increase bone density,with a promoting effect on vertebral fracture callus formation,maintaining the balance and the stability of the bone forming and breaking process.
【Key words】Long segmental single vertebral compression fractures;Cervus and cucumis polypeptide injection;Rabbit L1 vertebral fractures;Vascular endothelial growth factor;Bone mineral density;Osteolysis
中图分类号:R285.5
文献标志码:A
文章编号:1004-745X(2016)02-0208-05
doi:10.3969/j.issn.1004-745X.2016.02.007
*基金项目:湖北省科技厅项目(2013cfc037)
通信作者△(电子邮箱:951777718@qq.com)
收稿日期(2015-08-21)
