MOF作模板制备多孔Au/CuxO催化剂及其CO氧化性能
2016-07-07刘朋飞张所瀛杨祝红陆小华南京工业大学化学化工学院材料化学工程国家重点实验室江苏南京210009
刘朋飞,张所瀛,杨祝红,陆小华(南京工业大学化学化工学院,材料化学工程国家重点实验室,江苏 南京 210009)
MOF作模板制备多孔Au/CuxO催化剂及其CO氧化性能
刘朋飞,张所瀛,杨祝红,陆小华
(南京工业大学化学化工学院,材料化学工程国家重点实验室,江苏 南京 210009)
摘要:采用MOF材料作模板,通过在Cu-BTC材料表面预先负载贵金属Au再热解的方法,成功制备了具有正八面体结构的新型多孔Au/CuxO负载型催化剂。通过降低热解环境中的O2浓度,调节氧化时间,实现了Au/Cu-BTC氧化产物组分的调节,分别制得了Au/Cu2O、Au/Cu2O-CuO、Au/CuO复合催化材料。将其用于CO催化氧化,发现所有Au/CuxO催化剂都表现出比Cu-BTC和Au/Cu-BTC更优异的催化性能,其中由于拥有较高的比表面积、Cu2O含量以及更好的Au的分散性,Au/Cu2O的CO氧化活性最佳,180℃即能实现CO的完全转化。
关键词:金属-有机骨架材料;催化剂;纳米结构;多孔材料;Cu-BTC;Au/Cu2O
2016-01-03收到初稿,2016-01-27收到修改稿。
联系人:杨祝红。第一作者:刘朋飞(1989—),男,硕士研究生。
Received date: 2016-01-03.
Foundation item: supported by the National Natural Science Foundation of China (21136001), the National Basic Research Program of China (2013CB733503) and the Project of Priority Academic Program Development of Jiangsu Higher Education Institutions (PAPD).
引 言
多孔金属氧化物材料的物理化学性质往往与其结构、组分息息相关[1-3]。传统的多孔金属氧化物制备方法如水热法、热氧化法、溶胶凝胶法等一般只能制备如线状、棒状、球状等低维度或低曲率的简单结构[4-6],对于高维度或高曲率的复杂结构如正方体、正八面体等很难制得[7]。
金属-有机骨架材料(metal-organic frameworks,MOFs)是由金属离子和有机配体通过配位自组装所形成的具有周期性网状结构的多孔材料,由于其优异的物化性质,近20年来被广泛用于气体分离、多相催化、传感、药物传输等领域的研究[8-13]。近几年来,由于其结构的可设计性以及较为温和的热性质,MOFs又被广泛当作模板材料进行多孔金属氧化物复杂结构的构筑和调控,获得了一系列具备特殊结构和性能的多孔材料[7, 14-18]。如Lou等[7, 15]通过热处理普鲁士蓝微盒,制备得到了立方体中空Fe2O3并用作电极材料,发现其具有极高的电池容量,并展现出良好的循环性能,之后又将普鲁士蓝微盒与多种金属弱酸进行反应,从而制备了一系列Fe2O3复合材料(包括Fe2O3/SnO2、Fe2O3/SiO2、Fe2O3/GeO2、Fe2O3/Al2O3、Fe2O3/B2O3)。Huang 等[14, 17]通过热解ZIF-67和HKUST-1制备得到了多孔正十二面体Co3O4和正八面体的CuO并将其用作锂离子电池的电极材料,表现出了良好的活性和稳定性。在本课题组前期的研究过程中,Zhang等[18]利用Cu-BTC MOFs作模板制备了正方体、截角正方体、多面体、正八面体、棒状和线状系列多孔CuO/Cu2O复合材料并将其用于CO氧化反应中,展现了优异的催化活性。
本文在课题组前期研究的基础上,充分利用MOFs组分调节的优势,通过预先在Cu-BTC (H3BTC为均苯三甲酸)材料上负载贵金属Au再氧化的方法,制备得到了具有正八面体结构的新型多孔Au/CuxO催化剂材料(CuxO表示不同组成的铜氧化物)。通过对氧化温度的控制,调节复合材料中Cu2O和CuO的含量,从而得到了Au/Cu2O、Au/Cu2O-CuO、Au/CuO系列复合材料,并将其用于CO氧化反应体系中,以期获得性能最优的多孔Au/CuxO催化剂。
1 实验材料和方法
1.1材料
硝酸铜[Cu(NO3)2·3H2O,纯度>99.5%,上海新宝精细化工厂],均苯三甲酸(C8H6O4,纯度>99%,国药集团化学试剂有限公司),氯金酸(AuCl3·HCl·4H2O,Au含量大于47.8%,上海试剂厂),N,N-二甲基甲酰胺(DMF,纯度>99.5%,国药集团化学试剂有限公司),无水乙醇(CH3CH2OH,纯度>99.7%,无锡市亚盛化工有限公司),去离子水(自制,电阻大于16 MΩ)。
1.2制备方法
1.2.1Cu-BTC的制备称取2 g Cu(NO3)2·3H2O 和1 g均苯三甲酸置于干燥的烧杯中,分别量取15 ml DMF,乙醇和去离子水溶液加入烧杯,将混合物搅拌10 min,使其充分混合溶解。之后将混合溶液倒入100 ml聚四氟乙烯内衬中,装入水热釜,将其置于80℃烘箱中反应20 h。反应结束后冷却至室温,倒掉上层清液,用DMF对底层沉淀物进行浸渍,待上层液体澄清后倒掉液体再用DMF浸渍,重复3次后,用二氯甲烷溶液浸渍3 d,一天更新一次溶剂。最后,倒掉上层溶剂,将沉淀置于真空干燥箱中,80℃干燥12 h,即可得到Cu-BTC。
1.2.2Au/Cu-BTC的制备Au的负载采用传统的沉积沉淀(deposition-precipitation,DP)法[19]。首先将过量的尿素(1.89 g)溶解在75 ml的HAuCl4溶液中(0.512 mmol·L−1)。然后加入5 ml的无水乙醇得到HAuCl4的混合溶液。再称取1.5 g 1.2.1节中制备的Cu-BTC加入混合溶液中,将此溶液在避光条件下,80℃加热回流2 h。冷却过滤后,用乙醇和去离子水的混合溶液洗涤数次。得到的固体产物在70℃下干燥24 h。然后将烘干后的固体产物放在管式炉中,通入H2/N2混合气(H2含量10%,流量40 ml·min−1),150℃下还原2 h,最终得到样品Au/Cu-BTC。ICP-AES结果表明制备的所有样品中Au负载量为0.5%(质量分数)。
1.2.3Au/CuxO的制备称取0.4 g 1.2.2节中制得的Au/Cu-BTC样品放入管式炉中,通入O2/He混合气(O2体积分数为2%,流量40 ml·min−1)30 min排出管内的空气,再在该气氛下300℃分别热解1、3和6 h,得到样品Au/Cu2O、Au/Cu2O-CuO、Au/CuO。
1.3分析测试仪器
催化剂的物相鉴定采用粉末X射线衍射仪(PXRD,Bruker-D8Advance);催化剂比表面积和孔结构信息采用麦克公司的TristarⅡ3020M在−196℃条件下通过N2吸脱曲线测试得到(所有样品在测试之前都需在100℃条件下脱气10 h,比表面积和孔结构信息通过仪器自带的分析软件获得);催化剂的形貌表征采用日立S-4800场发射扫描隧道显微镜(FESEM);催化剂的微观形貌、颗粒尺寸由FEI Tecnai G2 F20场发射透射电子显微镜(STEM)进行表征。程序升温固定床反应器采用天津先权科技有限公司的TP-5000,升温速率为10℃·min−1。
1.4CO氧化实验
称取50 mg催化剂装入TP-500固定床的石英套管中。通入体积分数分别为1%、2%和97%的CO、O2、He的混合气,总流量为20 ml·min−1。从室温开始,每次升温10℃稳定10 min后,采集尾气、分析尾气组成,计算CO转化效率。温度由通过放置在催化床层内部的热电偶温控系统控制。尾气分析采用装有热导检测器(TCD)的HP-6890气相色谱仪分析。
2 实验结果与讨论
2.1Cu-BTC和Au/Cu-BTC材料形貌与结构表征
由FESEM图和XRD图对比(图1、图2)可以发现,采用本文的配方可以制备得到具有正八面体规则形貌的Cu-BTC材料。沉积沉淀法进行Au担载后,Cu-BTC的结构和形貌不受影响,仍然保持完整的正八面体结构,但与标准XRD谱图对比却很难发现Au衍射特征峰的存在,这一方面是因为本文中Au的担载量较低(质量分数0.5%),另一方面可能是由于沉积沉淀法担载的Au纳米颗粒尺寸较小[19],导致其特征衍射峰无法被辨识或检测。通过对比担载前后的FESEM图可以发现,相比于原先Cu-BTC光滑的表面,负载后Cu-BTC的表面明显增加了许多纳米颗粒,这也预示了Au担载的成功。

图1 Cu-BTC和Au/Cu-BTC的FESEM图Fig.1 FESEM images of Cu-BTC and Au/Cu-BTC
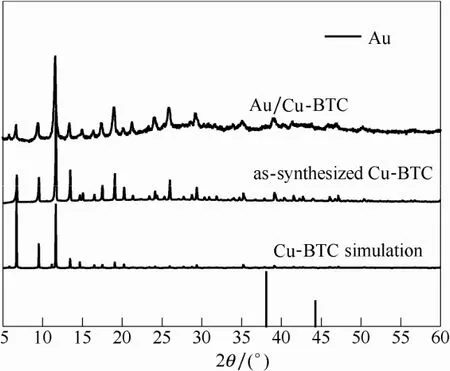
图2 Cu-BTC和Au/Cu-BTC的XRD谱图Fig.2 XRD pattern of samples
2.2Au/CuxO复合材料表征结构分析
2.2.1氧化条件对产物的影响将MOFs放入氧化环境中进行热处理即可获得金属氧化物,文献中通常都采用空气氧化法[14, 18, 20],由于空气中氧气含量较高,反应剧烈,一方面不利于对氧化产物的组分进行调控,另一方面剧烈的反应不利于MOFs结构的稳定。因此本文通过降低氧气浓度,采用O2体积分数为2%的O2/He混合气进行Cu-BTC的氧化。通过产物XRD谱图(图3)的对比可以发现,通过控制氧化时间可以有效调节产物的组分,氧化1 h后产物以Cu2O为主,氧化3 h得到Cu2O/CuO复合材料,当反应延长至6 h产物变为CuO。值得注意的是,Au/Cu-BTC产物中无法探测到的Au的特征峰,在氧化产物中清晰可见,而且随着反应时间的延长,相对峰强度也越来越强,如Au在2θ=44.3°处的特征峰,在1 h的氧化产物中还并不明显(图3),但随着反应的时间延长,特征峰强度明显增加(图3),这可能是由于Au颗粒在受热条件下逐渐发生了团聚所致。由此可见,通过Au/Cu-BTC氧化环境和氧化时间的控制可以分别制得Au/Cu2O、Au/Cu2O-CuO、Au/CuO负载型催化材料。

图3 Au/CuxO的XRD谱图Fig.3 XRD pattern of Au/CuxO samples
通过FESEM对氧化产物的形貌进行表征,如图4所示,氧化产物继承了Cu-BTC材料的正八面体结构。随着反应时间的延长,正八面体的结构会发生一定的收缩和扭曲,但整体还是呈现正八面体形貌。相比于文献报道的在空气中热处理1 h,Cu-BTC的结构就会发生严重的坍塌[18, 21],本文采用的弱氧化环境,在反应6 h后,仍能保证大部分产物结构具有正八面体的特征。由此可见,低氧浓度氧化法不仅可以有效调节产物的组成还可以保证产物形貌的稳定。

图4 Au/CuxO复合材料的FESEM图Fig.4 FESEM images of products from oxidation of Au/Cu-BTC for different time
2.2.2产物多孔结构的表征通过TEM表征Au/CuxO复合材料的内部结构,如图5所示。由于本文所获得产物颗粒较大(近10 µm),因此TEM的电子束很难完全穿透材料内部,观察其内部结构[图5(a)]。同时又由于高倍TEM的强电子束容易造成颗粒的团聚,导致结构的坍塌,因此很难通过TEM观察到完整的正八面体多孔结构。但通过局部的放大,如图5(b)所示,可以明显分辨出正八面体的内部空腔,说明了产物多孔结构的存在。与此同时,图5(c)证明了表面负载颗粒的存在,通过高分辨透射电镜(HRTEM)对晶格数据进行测量,发现复合材料多元组分的晶格距离分别为0.238、0.213和0.279 nm与Au的[111]面、CuO的[110]面以及Cu2O的[200]面的数据相对应,证明了Au/Cu2O-CuO复合材料的成功制备。

图5 Au/Cu2O-CuO的TEM图Fig.5 TEM images of Au/Cu2O-CuO
通过对氧化1和3 h后产物中Au颗粒的尺寸进行统计分析,如图6所示,可以发现,随着反应时间的延长,Au颗粒发生了明显的团聚,其平均尺寸从4.52 nm增加到了12.15 nm,这结果与图3中Au 的XRD特征峰随氧化时间的延长逐渐增强的结果相一致。
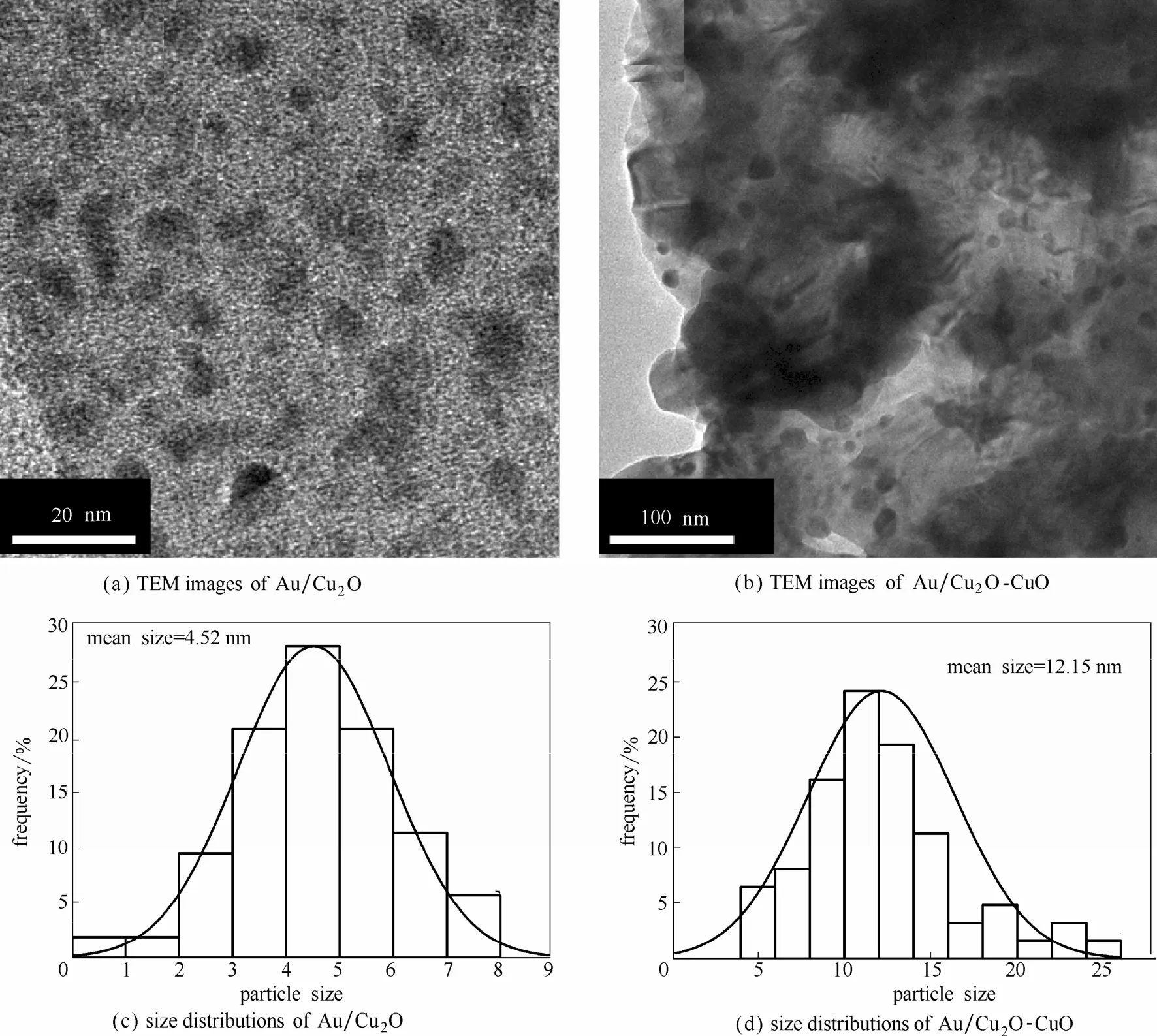
图6 氧化产物中Au颗粒的粒径分布Fig.6 TEM images and size distributions of Au nanoparticle on different products
N2吸脱附曲线表征结果与TEM分析结果一致,如图7所示。所有Au/CuxO负载型催化剂的吸脱附曲线都有明显的滞后环,表明了产物中多孔结构的存在。通过比表面积和孔性质的对比(表1),可以发现,Au/Cu2O虽然相比于Cu-BTC比表面积和孔容发生了骤降,但相比于传统的铜氧化物其比表面积仍具有一定的优势[6, 18]。随着反应时间的增加,产物的比表面积、孔容持续下降,分别从22.59、0.10 cm3·g−1下降至最终的4.90、0.02 cm3·g−1,平均孔径反而先升后降从17.61 nm变为14.67 nm。推测其原因:在反应伊始,由于配位键的断裂和配体分子的去除,MOFs的有序微孔结构迅速消失,比表面积骤降。随着氧化反应的持续进行,表面的Cu原子优先发生氧化反应,内部的Cu原子不断从内部扩散至表面与氧气反应,致使内部的空腔结构逐渐增大,平均孔径增加[14, 23]。随着反应时间的进一步延长,Cu原子被充分氧化,内部结晶度较差的CuO又重新扩散到材料表面进行重结晶,过度的重结晶过程势必造成孔结构的坍塌、内部空腔的破坏,最终留下较为稳定的十几纳米的孔道结构。
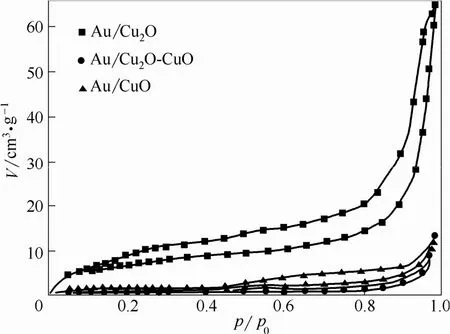
图7 不同产物的N2吸脱附曲线Fig.7 Nitrogen adsorption-desorption isotherms at 77 K ofdifferent products

表1 Au/CuxO复合材料的比表面积、孔容、孔径Table 1 Special surface area, pore volume and pore size of Au/CuxO composites
2.3CO催化性能表征
通过CO氧化实验评价所制备的各种复合材料的催化性能,结果如图8所示。Cu-BTC中由于具有一定的配位不饱和金属位,因此其拥有一定的CO氧化活性[24-25]。通过贵金属Au的负载得到Au/Cu-BTC催化剂并不能显著提高其Cu-BTC的催化活性,这可能与Au的CO催化机理有关。由文献可知[26-27],Au可以活化其晶界周围载体中的晶格氧,产生氧空穴从而使催化剂具有极佳的CO氧化活性,但配位化合物并不能产生氧空穴,致使Au/Cu-BTC的催化活性并不能显著提升。相比而言,通过氧化处理后得到的样品Au/CuxO明显具有更为优异的CO氧化性能。如图8(a)~(c)所示,在240℃前都能实现CO的全部转化,且催化活性Au/Cu2O>Au/Cu2O-CuO>Au/CuO,其中Au/Cu2O的活性最高,90℃即开始发生转化,180℃达到100%,其性能明显优于文献已报道的商用CuO及其他铜的氧化物[18,28]。分析其原因:一方面由于Au/Cu2O具有更高的比表面积,反应过程中,催化剂表面能吸附更多的O2分子提供更充足的氧环境[18];另一方面,由2.2.2节的分析可知,Au/Cu2O中的活性组分Au纳米颗粒,具有更小的尺寸和更好的分散性;与此同时,Cu2O也被证实相比于CuO具有更强的捕获和释放表面晶格氧的能力[18, 29-30]。Au/Cu2OCuO与Au/CuO的对比也表明,在比表面积接近的情况下,Cu2O的存在可以显著提高催化材料的CO氧化性能。因此,Au/Cu2O具备了最佳的CO催化性能,Au/Cu2O-CuO次之,Au/CuO相对最弱。

图8 不同催化剂的CO催化氧化活性Fig.8 Catalytic activity of catalysts for CO oxidation
3 结 论
本文利用Cu-BTC材料作模板通过预先负载贵金属Au再热处理的方法,成功制得了具有高CO氧化活性、组分可调的Au/CuxO负载型催化剂。将Au/Cu-BTC复合材料置于O2体积分数2%的O2/He混合气中进行氧化,通过控制氧化时间,分别制备得到了Au/Cu2O、Au/Cu2O-CuO、Au/CuO复合材料。实验结果显示,所有的复合催化剂都具有多孔的正八面体结构。CO催化氧化测试结果表明由于活性载体的作用,Au/CuxO催化剂相比于Cu-BTC 和Au/Cu-BTC明显具有更为优异的催化性能,其中Au/Cu2O由于具有较高的比表面积、Cu2O含量和较好的Au的分散性而展现了最佳的CO氧化活性。与此同时,值得注意的是本文采用的MOF作模板制备负载型催化剂的方法具有很好的拓展性,可以根据需求通过改变MOF和贵金属种类获得各种各样的负载型催化剂,为新型催化剂的开发和制备提供了新的思路。
References
[1]CHEN X, MAO S S. Titanium dioxide nanomaterials: synthesis, properties, modifications, and applications [J]. Chem. Rev., 2007, 107(7): 2891-2959.
[2]CHEN Z, JIAO Z, PAN D, et al. Recent advances in manganese oxide nanocrystals: fabrication, characterization, and microstructure [J]. Chem. Rev., 2012, 112(7): 3833-3855.
[3]ZHANG Q, ZHANG K, XU D, et al. CuO nanostructures: synthesis, characterization, growth mechanisms, fundamental properties, and applications [J]. Prog. Mater. Sci., 2014, 60: 208-337.
[4]LIU B, ZENG H C. Mesoscale organization of CuO nanoribbons: formation of “dandelions” [J]. J. Am. Chem. Soc., 2004, 126(26): 8124-8125.
[5]AHMAD T, CHOPRA R, RAMANUJACHARY K V, et al. Canted antiferromagnetism in copper oxide nanoparticles synthesized by the reverse-micellar route [J]. Solid State Sciences, 2005, 7(7): 891-895.
[6]YU H G, YU J G, LIU S W, et al. Template-free hydrothermal synthesis of CuO/Cu2O composite hollow microspheres [J]. Chem. Mater., 2007, 19(17): 4327-4334.
[7]ZHANG L, WU H B, MADHAVI S, et al. Formation of Fe2O3microboxes with hierarchical shell structures from metal-organic frameworks and their lithium storage properties [J]. J. Am. Chem. Soc., 2012, 134(42): 17388-17391.
[8]张所瀛, 刘红, 刘朋飞, 等. 金属有机骨架材料在 CO2/CH4吸附分离中的研究进展[J]. 化工学报, 2014, 65(5):1563-1570. DOI: 10.3969/j.issn.0438-1157.2014.05.002. ZHANG S Y, LIU H, LIU P F, et al. Progress of adsorption-based CO2/CH4separation by metal organic frameworks [J]. CIESC Journal, 2014, 65(5): 1563-1570. DOI: 10.3969/j.issn.0438-1157.2014.05.002.
[9]阳庆元, 刘大欢, 仲崇立. 金属-有机骨架材料的计算化学研究[J].化工学报, 2009, 60(4):805-819. YANG Q Y, LIU D H, ZHONG C L. Computational study of metal-organic frameworks [J]. CIESC Journal, 2009, 60(4): 805-819.
[10]CZAJA A U, TRUKHAN N, MULLER U. Industrial applications of metal-organic frameworks [J]. Chem. Soc. Rev., 2009, 38(5): 1284-1293.
[11]HORCAJADA P, GREF R, BAATI T, et al. Metal-organic frameworks in biomedicine [J]. Chem. Rev., 2012, 112(2): 1232-1268.
[12]KRENO L E, LEONG K, FARHA O K, et al. Metal-organic framework materials as chemical sensors [J]. Chem. Rev., 2012, 112(2): 1105-1125.
[13]LI J R, SCULLEY J, ZHOU H C. Metal-organic frameworks for separations [J]. Chem. Rev., 2012, 112(2): 869-932.
[14]WU R B, QIAN X K, YU F, et al. MOF-templated formation of porous CuO hollow octahedra for lithium-ion battery anode materials [J]. Journal of Materials Chemistry A, 2013, 1(37): 11126-11129.
[15]ZHANG L, WU H B, LOU X W. Metal-organic-frameworks-derived general formation of hollow structures with high complexity [J]. J. Am. Chem. Soc., 2013, 135(29): 10664-10672.
[16]HU L, CHEN Q. Hollow/porous nanostructures derived from nanoscale metal-organic frameworks towards high performance anodes for lithium-ion batteries [J]. Nanoscale, 2014, 6(3):1236-1257.
[17]WU R B, QIAN X K, RUI X H, et al. Zeolitic imidazolate framework 67-derived high symmetric porous Co3O4hollow dodecahedra with highly enhanced lithium storage capability [J]. Small, 2014, 10(10): 1932-1938.
[18]ZHANG S Y, LIU H, SUN C C, et al. CuO/Cu2O porous composites: shape and composition controllable fabrication inherited from metal organic frameworks and further application in CO oxidation [J]. Journal of Materials Chemistry A, 2015, 3(10): 5294-5298.
[19]LIU H, ZHANG S Y, LIU Y Y, et al. Well-dispersed and size-controlled supported metal oxide nanoparticles derived from MOF composites and further application in catalysis [J]. Small, 2015, 11(26): 3130-3134.
[20]HU L, HUANG Y, ZHANG F, et al. CuO/Cu2O composite hollow polyhedrons fabricated from metal-organic framework templates for lithium-ion battery anodes with a long cycling life [J]. Nanoscale, 2013, 5(10): 4186-4190.
[21]ZHANG F, CHEN C, XIAO W M, et al. CuO/CeO2catalysts with well-dispersed active sites prepared from Cu3(BTC)2metal-organic framework precursor for preferential CO oxidation [J]. Catal. Commun., 2012, 26: 25-29.
[22]ROWSELL J L, YAGHI O M. Effects of functionalization, catenation, and variation of the metal oxide and organic linking units on the low-pressure hydrogen adsorption properties of metal-organic frameworks [J]. J. Am. Chem. Soc., 2006, 128(4): 1304-1315.
[23]ZHANG S Y, LIU H, LIU P F, et al. A template-free method for stable CuO hollow microspheres fabricated from a metal organic framework (HKUST-1) [J]. Nanoscale, 2015, 7(21): 9411-9415.
[24]YE J Y, LIU C J. Cu3(BTC)2: CO oxidation over MOF based catalysts [J]. Chem. Commun., 2011, 47(7): 2167-2169.
[25]QIU W G, YU W, LI C Q, et al. Effect of activation temperature on catalytic performance of CuBTC for CO oxidation [J]. Chinese J. Catal., 2012, 33(4): 986-992.
[26]ISHIDA T, NAGAOKA M, AKITA T, et al. Deposition of gold clusters on porous coordination polymers by solid grinding and their catalytic activity in aerobic oxidation of alcohols [J]. Chem.-Eur. J., 2008, 14(28): 8456-8460.
[27]HARUTA M. When gold is not noble: catalysis by nanoparticles [J]. Chem. Rec., 2003, 3(2): 75-87.
[28]HUANG H, ZHANG L, WU K, et al. Hetero-metal cation control of CuO nanostructures and their high catalytic performance for CO oxidation[J]. Nanoscale, 2012, 4(24): 7832-7841.
[29]JERNIGAN G G, SOMORJAI G A. Carbon monoxide oxidation over three different oxidation states of copper: metallic copper, copper (Ⅰ) oxide, and copper (Ⅱ) oxide—a surface science and kinetic study [J]. J. Catal., 1994, 147(2): 567-577.
[30]HUANG T J, TSAI D H. CO oxidation behavior of copper and copper oxides [J]. Catal. Lett., 2003, 87(3/4): 173-178.
MOF-templated preparation of porous Au/CuxO catalysts with octahedral structures for CO oxidation
LIU Pengfei, ZHANG Suoying, YANG Zhuhong, LU Xiaohua
(State Key Laboratory of Materials-Oriented Chemical Engineering, School of Chemistry and Chemical Engineering, Nanjing Tech University, Nanjing 210009, Jiangsu, China)
Abstract:More recently, metal-organic frameworks (MOFs), as a excellent sacrificial template, have been widely used to fabricate a variety of porous metal oxides with special structures and performances. To take full advantage of MOFs in composition regulation, herein a novel method to prepare porous Au/CuxO composites with octahedral structures inherited from MOFs was introduced. Au/Cu-BTC was firstly prepared by the traditional deposition-precipitation method. Subsequently, pyrolysis of Au/Cu-BTC was conducted in 2% (volume fraction) O2balanced with helium. By varying the time of heating, Au/CuxO composites including Au/Cu2O, Au/Cu2O-CuO and Au/CuO were successfully achieved. When tested in CO oxidation, these supported catalysts exhibited much better catalytic performances than Cu-BTC and Au/Cu-BTC due to the more active support of metal oxides. Thus, Au/Cu2O showed the best catalytic activity since the high surface area, Cu2O content and better dispersion of Au.
Key words:metal-organic frameworks; catalyst; nanostructure; porous material; Cu-BTC; Au/Cu2O
中图分类号:O 643; TQ 426
文献标志码:A
文章编号:0438—1157(2016)06—2325—07
DOI:10.11949/j.issn.0438-1157.20160002
基金项目:国家自然科学基金项目(21136001);国家重点基础研究发展计划项目(2013CB733503);江苏高校优势学科建设工程资助项目。
Corresponding author:YANG Zhuhong, zhhyang@njtech.edu.cn
