运用分子标记辅助构建海带核心种质资源
2016-07-06崔翠菊刘延岭李晓捷罗世菊武瑞娜王利芹张壮志山东东方海洋科技股份有限公司国家海藻与海参工程技术研究中心山东省海藻遗传育种与栽培技术重点实验室山东烟台64003江西财经大学江西南昌33003
崔翠菊, 李 言, 刘延岭, 李晓捷, 罗世菊, 武瑞娜, 王利芹, 张壮志,孙 娟, 田 鑫(. 山东东方海洋科技股份有限公司, 国家海藻与海参工程技术研究中心, 山东省海藻遗传育种与栽培技术重点实验室, 山东 烟台 64003; . 江西财经大学, 江西 南昌33003)
运用分子标记辅助构建海带核心种质资源
崔翠菊1, 李 言1, 刘延岭1, 李晓捷1, 罗世菊1, 武瑞娜1, 王利芹1, 张壮志1,孙 娟1, 田 鑫2
(1. 山东东方海洋科技股份有限公司, 国家海藻与海参工程技术研究中心, 山东省海藻遗传育种与栽培技术重点实验室, 山东 烟台 264003; 2. 江西财经大学, 江西 南昌330013)
海带(Saccharina japonica)是一种具有重要经济和生态价值的大型海藻, 配子体是其种质资源保存的形式, 也是海带杂交育种、育苗的材料。为有效管理和评价海带种质资源, 初步构建了海带核心种质资源, 利用RAPD标记技术对海带“早厚成一号”的28份配子体进行了遗传学评价。采用UPGMA聚类法, 根据遗传相似性系数进行分组, 采用简单比例法进行取样(25%、35%、50%、65%)分析, 计算不同取样比例时的遗传多样性参数, 结合样本的生长状态和雌、雄比例, 综合评价遗传多样性的各种参数, 取样比例为50%时构建的核心种质库相对合理。本研究为海带品种(系)的核心种质的筛选和遗传学评价打下基础。
海带(Saccharina japonica); RAPD分子标记; 核心种质; 遗传多样性
[Fund programs: National Supporting Program of Science and Technology of China (2012BAD55G01); National High Technology Research and Development Program (863 Program) of China (2012AA10A406), and Municipal Science and Technology Research and Development Project of Yantai (2013LGS002)]
海带(Saccharina japonica)是一种大型褐藻, 属于褐藻门(Phaeophyta), 褐藻纲(Phaeophyceae), 海带目(Laminariales), 海带科(Laminariaceae), 海带属(Saccharina), 在医药、化工、食品等领域用途广泛。目前, 我国已形成山东、福建为主产区的养殖基地,年产约90万吨, 其配子体是种质保存和人工育种、育苗的对象[1]。我国是开展海带遗传选育最早的国家。自20世纪50年代末以来, 先后有20余个优良品种(系)应用于生产, 大大促进了海带栽培业和相关产业的发展。开展海带自交纯化、定向选择, 先后培育出海带“远杂10号”、“901”海带[2-3]、“荣福”海带[4]、“东方2号”[5]、“东方3号”[6]和“东方6号”[7]等, 这些海带品种均是利用配子体直接杂交或杂交后定向选育得到的海带品种。
分离雌、雄配子体用于其种质保存, 不仅可保持海带目标性状的均质性、特异性和重复性, 也为海带种质遗传评价提供材料基础。目前, 我国海带种质收集、保存和评价体系已建立, 也开发了各种分子标记技术体系, 用于海带种质的遗传评价[8-12]。但尚未建立将分子标记应用于筛选海带核心种质的技术方法。Frankel等[13-14]提出如何处理海量的种质资源与有效地评价利用优异资源这一矛盾提出了核心种质(core collection)的概念, 即以最小的资源份数最大限度地代表该物种的遗传多样性。有利于作物种质的保存、评价与利用。因此, 迫切需要开展该方面的研究与应用, 这可提高海带种质资源的保存效率, 便于种质库的管理、种质创新等深层次研究。
目前, 核心种质的筛选工作主要应用在农作物和果树等陆地植物, 如小麦、水稻、大豆、玉米、高梁、桃树、大白菜和山药等物种中开展了相应的核心种质和初级核心种质的筛选[15-21]。但海带与陆地作物不同, 因为农作物是纯系, 其核心种质是相对物种而言, 由不同的农家种组成。而海带本身是经过多代杂交或自交选育而来, 遗传相对复杂, 不是纯系, 是一些性状表现相对一致的群体, 海带保存的种质材料为配子体, 由于海带配子体是采用低温液相保存, 存在杂菌污染或生长状态不好种质, 这就需要在保存过程去掉, 因此, 在每个品种(系)配子体采集时, 都多选择几个不同个体的种海带在当年进行配子体的分离、培养和保存, 导致保存的种质可能有重复, 长期保存会费时、费力、费钱。所以海带核心种质需要在品种的层面上进行筛选。
在进行陆地作物核心种质筛选时多选用SSR和RAPD标记, 但SSR在品种内多态率太低, 不适用,新型的分子标记SNP虽然有数量上的优势, 但目前若要大批量检测应用还存在技术和经费的限制。除此之外, 在电泳检测的高通量标记体系中, 只有AFLP和RAPD标记, 但AFLP标记的酶切和检测体系都比较繁琐, 且对基因组样品的要求很高, 综合考虑, 只有RAPD标记体系比较易操作且多态性高。
本研究以海带“早厚成一号”为材料, 将其保存的28份配子体进行核心种质筛选, 尝试构建核心种质库, 利用RAPD标记技术, 进行遗传学评价, 探讨海带核心种质构建的可行性, 为其他海带种质保存和筛选提供参考, 为高效、合理构建海带核心种质资源提供技术参考。
1 材料和方法
1.1 材料
选取海带“早厚成一号”的28个种质(配子体)为材料。保存条件: 温度10℃左右, 光照强度10 μmol/(m2·s)以下, 培养液为煮沸消毒海水, 营养盐: NaNO3-N 10mg/L, KH2PO4-P 1 mg/L。培养液2周更换1次。
1.2 DNA提取
取0.1 g湿重的配子体材料, 用消毒海水反复多次冲洗, 筛绢过滤, 尽可能的吸干水分, 采用植物基因组DNA提取试剂盒(天根公司, 中国)提取基因组DNA, 用紫外分光光度计和琼脂糖凝胶电泳检测所提DNA的浓度和纯度。DNA浓度统一稀释为40 ng/μL以方便后续使用。–20℃保存备用。
1.3 RAPD引物的选择和PCR反应参数
从候选的100条引物中筛选出16条能够获得清晰条带、重复性好的引物, 筛选出的引物见表1。RAPDPCR反应总体积为该体系(20 μL)为: 1×PCR buffer,1.0 mmol/L Mg2+, 0.2 mmol/L dNTPs, 2.0 μmol/L 引物,40 ng 模板DNA, 0.25 U Taq DNA 聚合酶(promega)。
扩增PCR程序为: 95℃预变性5 min; 95℃变性30 s, 37℃退火1min, 72℃延伸2 min, 共40个循环;最后72℃延伸10 min。取5 μL扩增产物在1.5%琼脂糖凝胶电泳检测。Tanon 2500凝胶成像仪拍照记录电泳结果。
1.4 数据分析
电泳图谱的每一条带为一个标记, 代表一个引物的结合位点。依据DNA电泳分子质量标准(Markers)计算出各PCR产物片段的大小(近似值),以显性标记计数, 若有条带出现记做1, 若无条带出现记做0。相同引物不同胶板间以DNA电泳分子质量标准、特征带和公共带对应, 找到相应大小的对应条带。应用excel建立各引物的0、1数据库。各引物的条带多态性比例计算方法: 多态位点比例P=(多态位点数/位点总数)×100%; 多态信息含量(PIC,polymorphic information content), PICi=1–P其中:Pij表示引物i的第j个带型出现的频率[14]。利用popgene32软件对28份材料遗传参数进行多样性分析, 用NTSYS2.10软件的Qualitative data程序计算各样品间的遗传距离和遗传相似性系数, 用其中SAHN程序和UPGMA方法进行聚类分析, 用Dcenter和Eigen程序进行主坐标分析。
1.5 取样策略
根据不同的相似性系数, 采用逐步UPGMA聚类取样法构建早厚成品系的初级核心种质库, 聚类取样时2个相近个体的取舍遵从以下原则: 既优先保留生长状态良好, 藻体干净的个体。因海带配子体有雌雄之分, 所以在进行样品的取舍时还应综合考虑雌雄比例。比较每次聚类所得的核心种质与原库在平均Nei’s多样性指数、平均Shannon信息指数、平均等位基因数、平均有效等位基因数等指标评价各核心种质库的质量。
2 结果
2.1 RAPD扩增结果多态性分析
16个RAPD引物对28个海带配子体进行种质资源分析, 各引物的扩增条带数、多态性条带数和百分率统计见表1。
不同引物扩增出的条带数和多态性条带数见表1, 用所选的16条RAPD引物对28个配子体进行扩增, 共得到319条可靠、清晰和重复性高的条带。319条带中有301条是多态性条带, 平均多态性比率为91.65%, 每个引物平均多态位点数为18.81, 除了引物S2110, 其他引物在28个早厚成品系配子体中得到的多态性均较高, 平均多态条带率78.57%~100%。PIC(polymorphic information content, 多态性信息含量)数值除了引物S2110为0.685, 其余引物的PIC值均在0.883~0.944之间, 表明所用引物多态性均较高。

表1 RAPD引物扩增多态性信息表Tab. 1 Polymorphic information of RAPD primers
2.2 遗传多样性分析
根据16条RAPD引物扩增所得结果进行遗传多样性分析表明, 平均Shannon’s信息指数(I)为0.4405,平均Nei’s基因多样性指数(H)为0.2868, 平均有效等位基因数(Ne)为1.4271, 平均等位基因数(Na)为1.9718, 均表明28份海带种质多样性很丰富。遗传相似性系数变化范围在0.608 2~0.824 5之间, 表明28份材料在DNA分子水平上变异幅度较大。根据RAPD标记数据计算个体间的遗传相似系数矩阵,采用UPGMA法构建遗传关系聚类图(图1)。28个个体被聚为2个类群, 其中第1个类群只有19号个体,表明它与其他的个体间亲缘关系较远。第2个类群包括6个亚类, 有27个个体。主坐标分析是基于遗传相似系数进行的。因此, 主坐标分析图中各个品种种质间的位置关系反应了其在遗传上的相似性。通过RAPD标记对28个个体进行主坐标分析, 主坐标散点图见图2。比较图1、2可知, 对28份材料所进行的聚类分析和主坐标分析的结果基本上是一致的。
2.3 核心种质库构建
根据聚类结果和主坐标分析可知, 该28个种质材料的遗传相似度较高, 但也有差异。海带“早厚成一号”是通过自交选育得到的性状优良、遗传稳定的海带品种。采集种质时选取的均为性状优良的个体, 所以这些种质材料在遗传上相似度较高。根据聚类结果, 若以0.733为最低相似系数, 可将28个个体分为7个类群(图1)。分别以取样比例为25%、35%、50%、65%进行初级核心种质的筛选, 并对各比例下得到的种质进行遗传多样性的评价(表2)。根据表2中的数据, 考虑到雌、雄配子体数量的比例, 综合评价遗传多样性的各种参数, 取样比例为50%时构建的核心种质库相对合理。
3 讨论
海带的生活史表现为异型世代交替, 即由大型的孢子体世代与微小的配子体世代互相交替而组成。配子体作为海带种质保存形式, 可长期保持种质的均质性的特异性, 利用配子体进行保种和育苗,既可以长期保持其优良性状和纯度, 也在很大程度上避免大田孢子体逐代选种和混采混育导致的种质退化和混杂问题。每个海带品种(系)在进行配子体采集时, 为保证种质保存的成功率和全面性, 通常会选择多个不同个体的种海带进行配子体的分离、培养和保存, 这就导致保存的种质材料可能存在重复,不能有效地进行管理和利用。因此, 对同一品种保存的配子体进行遗传学评价, 从中筛选出核心种质,提高种质保存的效率和实用性。
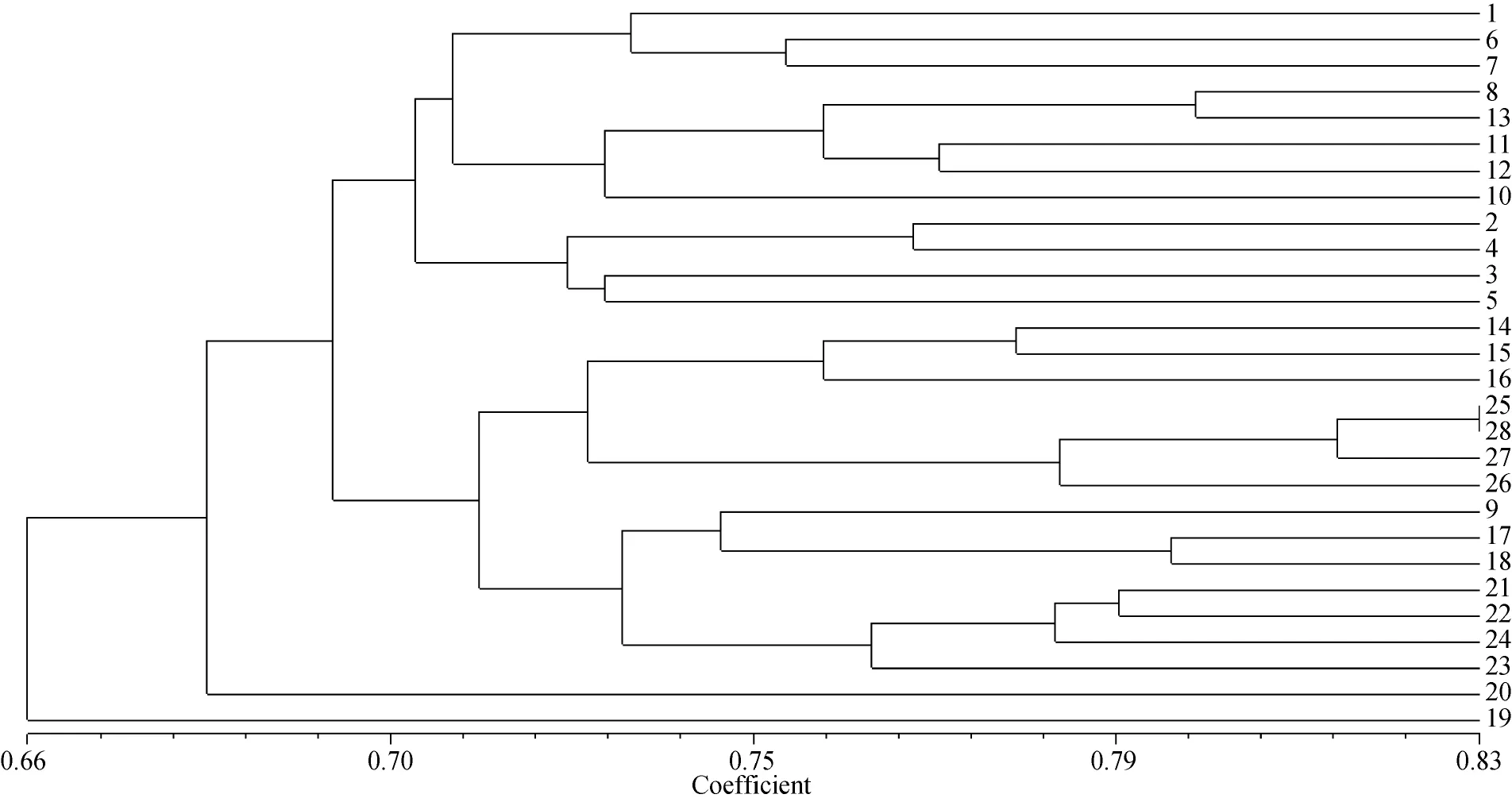
图1 28个早厚成配子体间基于RAPD遗传相似性系数的UPGMA聚类图Fig. 1 The UPGMA cluster diagram of the 28 “Zaohoucheng” gametophytes based on RAPD genetic similarity coefficient
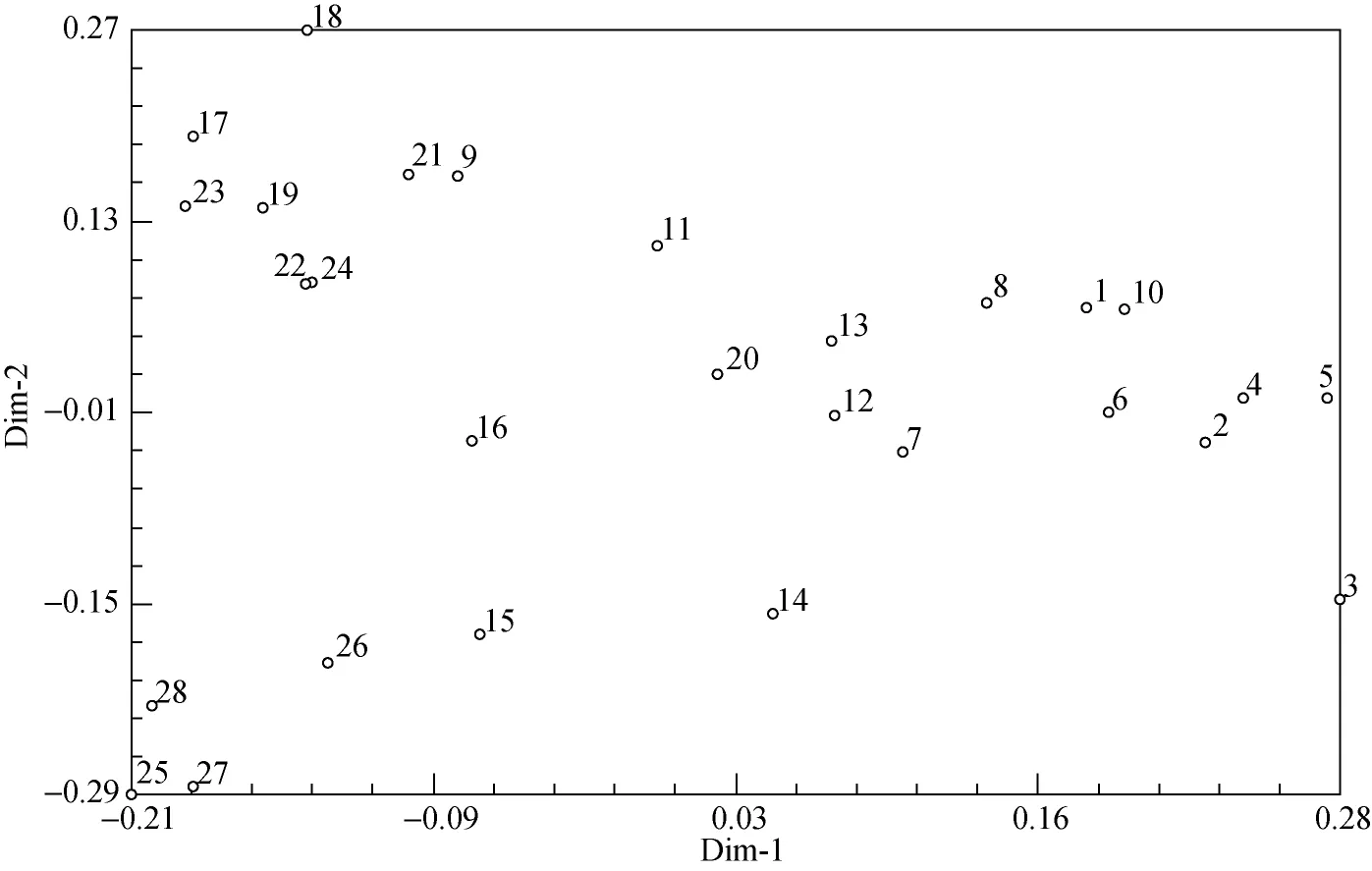
图2 主坐标分析散点图Fig. 2 Scatter diagram of principal coordinates analysis

表2 不同取样比例获得的核心种质与原始种质(100%)的遗传多样性参数Tab.2 The genetic diversity parameters of different sampling rates for core collection and original collection (100%)
目前, 陆地植物方面, 国内外主要依据表型性状数据和分子标记数据。表型性状的数据与种质资源应用直接相关且容易获取, 但一些数量性状易受当地气候环境的影响, 存在不稳定性, 难以真实地反应出种质资源的遗传多样性。分子标记不受物种生长环境和生长时期的影响, 多态性高、信息量大且稳定, 适用于遗传多样性评价和核心种质取样[22]。目前多采用表型性状和分子标记两种数据相结合进行构建, 并根据分子标记数据进行取样。齐永文等利用20对SSR引物上的分子标记数据和15个表型性状资料, 开展了甘蔗细茎野生种的核心种质构建[22]。刘遵春等整合农艺性状和分子标记数据构建新疆野苹果核心种质, 所构建的42 份新疆野苹果核心种质保留了300 份原始种质93%以上的农艺性状, 很好地代表了原始种质的遗传多样性[23]。但在经济海藻中尚未见有报道。本研究的材料为大型的经济海藻, 本研究中, 在采集海带种质时因为孢子体存在表型的差异, 而且缺乏系统的养殖检测结果, 因此, 难以直接与配子体进行关联评价, 只能采用分子标记数据来进行海带核心种质的评价, 用于核心种质筛选的参考依据。在我们用SSR标记对海带“早厚成一号”群体的遗传多样性分析发现, 所采用的SSR标记在群体中的多态性呈现率很低, 难以区分其群体。目前,虽有一定量的SNP分子标记, 但若要大批量应用还存在技术和经费的限制。除此之外, 在电泳检测的高通量标记体系中, 只有AFLP和RAPD标记, 但AFLP标记的酶切和检测体系都比较繁琐, 且对基因组样品的要求很高, 综合考虑, 我们选用比较易操作且多态性高的RAPD标记体系, 用筛选后的16条多态性高, 扩增清晰的引物进行遗传学评价时发现,RAPD标记在海带“早厚成一号”群体中的多态性较高, 通过聚类分组和不同取样比例, 综合考虑雌雄配子体数量的比例, 在取样比例为50%时筛选到的核心种质相对合理, 可以达到预期效果。
另外, 在遗传学评价策略方面, 对核心种质其亲缘关系相近的材料的取舍也影响实验结果。我们以群体的遗传相似性系数, 采用UPGMA聚类法进行分组, 采用简单比例法进行取样, 计算不同取样比例时的遗传多样性参数, 结合样本的生长状态和雌雄比例, 进行取样。初步结果表明, 该方法可以获得海带核心种质材料, 对简化海带核心种质材料的程序、优化原有海带核心种质材料有积极意义。目前, 可用于进行海带核心种质筛选的分子标记种类和数量有限, 随着技术的进步, 若能将大量的SNP标记体系用于核心种质的筛选, 将会大大提高检测效率。今后还需要确立相关的标记评价体系, 检验其在海带核心种质评价中的具体效果, 如提高种质筛选效率、简化种质保存步骤等。
[1] 曾呈奎, 王素娟, 刘思俭, 等. 海藻栽培学[M]. 上海:上海科学技术出版社, 1985: 55-121. Zeng Chengkui, Wang Sujuan, Liu Sijian, et al. Seaweed cultivation [M]. Shanghai: Shanghai science and technology press, 1985: 55-121.
[2] 张全胜, 刘升平, 曲善村, 等. “901”海带新品种培育的研究[J]. 海洋湖沼通报, 2001, (2): 46-53. Zhang Quansheng, Liu Shengping, Qu Shancun, et al. Studies on rearing new variety of kelp “901” [J]. Transactions of oceanology and limnology, 2001, (2):46-53.
[3] Zhang Q S, Tang X X, Cong Y Z, et al. Breeding of an elite Laminaria variety 90-1 through inter-specific gametophyte crossing [J]. Journal of Applied Phycology,2007, 19: 303-311.
[4] Zhang J, Liu Y, Yu D, et al. Study on high-temperature-resistant and high-yield laminaria variety “Rongfu” [J]. Journal of Applied Phycology, 2011, 23:165-171.
[5] Li X J, Cong Y Z, Yang G P, et al. Trait evaluation and trial cultivation of Dongfang No. 2, the hybrid of a male gametophyte clone of Laminaria longissima (Laminariales, Phaeophyta) and a female one of L. japonica [J]. Journal of Applied Phycology, 2007, 19:139-151.
[6] Li X J, Liu J L, Cong Y Z, et al. Breeding and trial cultivatipn of Dongfang No.3, a hybrid of Laminaria gametophyte clones with a more than intraspecific less than interspecific relationship [J]. Aquaculture, 2008,280: 76-80.
[7] Li X J, Zhang Z Z, Qu S C, et al. Breeding of an intraspecific kelp hybrid Dongfang no. 6 (Saccharina japonica, Phaeophyceae, Laminariales) for suitable processing products and evaluation of its culture performance [J]. Journal of Applied Phycology, 2016,28(1): 439-447.
[8] 张全胜, 石媛嫄, 丛义周, 等. 我国引种海带和栽培品种(系)来源配子体克隆的AFLP分析[J]. 中国海洋大学学报, 2008, 38(3): 429-435. Zhang Quansheng, Shi Yuanyuan, Cong Yizhou, et al. AFLP Analysis of the Gametophyte Clones Derived from Introduced Laminaria (Phaeophyta) and Cultured Varieties of China [J]. Periodical of Ocean University of China, 2008, 38(3): 429-435.
[9] Wang X L, Yang Y X, Cong Y Z, et al. DNA finger-printing of selected Laminaria (Phaeophyta) gametophytes by RAPD markers [J]. Aquaculture, 2004, 238:143-153.
[10] Wang X L, Liu C L, Li X J, et al. Assessment of genetic diversities of selected Laminaria (Laminariales, Phaeophyta) gametophytes by inter-simple sequence repeat analysis [J]. Journal of Integrative Plant Biology, 2005,47 (6): 753-758.
[11] Li X J, Yang G P, Shi Y Y, et al. Prediction of the heterosis of Laminaria hybrids with the genetic distance between their parental gametophyte clones [J]. Journal of Applied Phycology, 2008, 20(6): 1097-1102.
[12] 石媛嫄, 杨官品, 廖梅杰, 等. 海带和长海带配子体无性繁殖系微卫星DNA多态性比较分析 [J]. 中国海洋大学学报, 2008, 38(1): 303-308. Shi Yuanyuan, Yang Guanpin, Liao Meijie, et al, Comparative study on the Microsatellite DNA Polymorphism of the Gametophytes of L.japonica and L.longissima [J]. Periodical of Ocean University of China, 2008, 38(1): 303-308.
[13] Frankel O H. Genetic perspectives of germplasm conservation[C]// In: Arber W, Illmensee K, Peacock W J,Starlinger P (eds). Genetic Manipulation: Impact on Man and Society. Cambridge: Cambridge University Press, 1984: 161-170.
[14] Frankel O H, Brown A H D. Plant genetic resources today: a critical appraisal[C]// In: Holden J H W, Williams J T (eds). Crop Genetic Resources: Conservation and Evaluation. London: George Allen and Unwin,1984: 249-257.
[15] Marcelo F O, Randall L N, Isaias O G, et al. Establishing a soybean germplasm core collection [J]. Field crops research, 2010, 119: 277-289.
[16] Meenakshi S, Shawna B M, Henry J T. Development of a core collection of Triticum and Aegilops species for improvement of wheat for activity against chronic diseases [J]. Agriculture & Food Security, 2013, 2: 4.
[17] 沈志军, 马瑞娟, 俞明亮, 等. 国家果树种质南京桃资源圃初级核心种质构建[J]. 园艺 学报, 2013,40(1): 125-134. Sheng Zhijun, Ma Ruijuan, Yu Mingliang, et al. Establishment of peach primary core collection based on accessions conserved in national fruit germplasm repository of Nanjing [J]. Acta Horticulturae Sinica, 2013,40(1): 125-134.
[18] 李丽, 何伟明, 马连平, 等. 用EST-SSR分子标记技术构建大白菜核心种质及其指纹图谱库[J]. 基因组学与应用生物学, 2009, 28: 76-88. Li Li, He Weiming, Ma Lianping, et al. Construction Chinese cabbage (Brassica rapa L.) core collection and its EST-SSR fingerprint database by EST-SSR molecular markers [J]. Genomics and Applied Biology,2009, 28: 76-88.
[19] 陈冰嬬, 李继洪, 王阳, 等. 高梁种质资源研究进展[J]. 西北农林科技大学学报(自然科学版), 2013,41(1): 64-77. Chen Bingru, Li Jihong, Wang Yang, et al. Advances in germplasm resources of sorghum (Sorghum bicolor (L.)Moench) [J]. Journal of Northwest A &F University (Nat. Sci. Ed.), 2013, 41(1): 64-77.
[20] 刘向宇, 霍秀文, 魏娜, 等. 山药种质资源的ISSR遗传多样性分析及初级核心种质库的构建[J]. 园艺学报, 2014, 41(S): 2669. Liu Xiangyu, Huo Xiuwen, Wei Na, et al. Genetic diversity ISSR analysis and establishment of primary core collection in Yam germplasm resources [J]. Acta Horticulturae Sinica, 2014, 41(S): 2669.
[21] Flavia F T, Reinaldo L G, Paulo E P, et al. Evaluation of maize core collection for drought tolerance [J]. Crop Breeding and Applied Biotechnology, 2010, 10: 312-320.
[22] 齐永文, 樊丽娜, 罗青文, 等. 甘蔗细茎野生种核心种质构建[J]. 作物学报, 2013, 39(4): 649-656. Qi Yongwen, Fan Lina, Luo Qingwen, et al. Establishment of Saccharum spontaneum L. core collections [J]. Acta Agronomica Sinica, 2013, 39(4): 649-656.
[23] 刘遵春, 刘大亮, 崔美, 等. 整合农艺性状和分子标记数据构建新疆野苹果核心种质[J]. 园艺学报, 2012,39(6): 1045-1054. Liu Zunchun, Liu Daliang, Cui Mei, et al. Combing agronomic traits and molecular marker data for constructing malus sieversii core collection [J]. Acta Horticulturae Sinica, 2012, 39(6): 1045-1054.
(本文编辑: 康亦兼)
Establishment of core collection for Saccharina japonica using molecular markers
CUI Cui-ju1, LI Yan1, LIU Yan-ling1, LI Xiao-jie1, LUO Shi-ju1, WU Rui-na1,WANG Li-qin1, ZHANG Zhuang-zhi1, SUN Juan1, TIAN Xin2
(1. Shandong Oriental Ocean Sci-tech Co. Ltd, National Algae and Sea cucumber Project Technology Research Centre, Algae Genetic Breeding and Cultivation Technology Key Laboratory of Shandong Province,Yantai 264003, China; 2. Jiangxi University of Finance and Economics, Nanchang 330013, China)
Mar., 19, 2015
Saccharina japonica; RAPD molecular markers; core germplasm; genetic diversity
Kelp is a large alga with an important economic and ecological value. The gametophytes are the preserved materials for kelp germplasm resources, which are also used for kelp crossbreeding and seedling. For an effective management and evaluation of kelp germplasm resources, a core collection of germplasm was screened. Genetic evaluation of 28 gametophytes of “Zaohoucheng” variety was conducted by RAPD molecular marker technology, using the UPGMA clustering method, based on the genetic similarity coefficient of grouping, simple percentage sampling (25%, 35%, 50%, and 35%), and analysis and calculation of genetic diversity parameters of different sampling rates, combined with the growth status and proportion of males and females. The core collection at the sampling rate of 50% was relatively reasonable. These results laid the foundation for screening and genetic evaluation of core germplasm of kelp varieties (or lines).
S917.3
A
1000-3096(2016)01-0018-07
10.11759/hykx20150319001
2015-03-19;
2015-05-14
国家科技支撑计划项目(2012BAD55G01); 国家高技术研究发展计划(863计划)项目(2012AA10A406); 烟台市科技发展计划项目(2013LGS002)
崔翠菊(1984-), 女, 山东济宁人, 工程师, 博士, 主要从事海藻分子生物学和遗传育种研究, 电话: 0535-6929510, Email:cuicuiju@163.com
