采用组织芯片技术分析P21在胰腺癌中的表达及与预后的关系
2016-07-05玉素甫买买提谢二娟
方 华, 玉素甫·买买提, 黄 韬, 谢二娟△
1湖北省医学会,武汉4300712华中科技大学同济医学院附属协和医院乳腺甲状腺外科,武汉 430022
采用组织芯片技术分析P21在胰腺癌中的表达及与预后的关系
方华1,玉素甫·买买提2,黄韬2,谢二娟1△
1湖北省医学会,武汉4300712华中科技大学同济医学院附属协和医院乳腺甲状腺外科,武汉430022
摘要:目的分析P21蛋白在胰腺癌和癌旁组织中的表达及与预后的关系。方法共90例胰腺癌患者纳入研究,每例均有完整的临床资料及对应的癌组织和癌旁组织标本,采用免疫组化技术进行芯片染色。分析免疫组化染色结果中P21的表达与胰腺癌临床病理特征的关系,并进行生存分析,探讨P21对预后的判断价值。结果90例胰腺癌组织中P21阳性表达率为48.9%。P21阳性表达与肿瘤大小、淋巴结转移、临床分期及细胞核增殖抗原(Ki-67)表达等相关(P<0.05)。P21阳性组患者的总生存期(Overall survival,OS)低于P21阴性组患者(P=0.022)。Cox多因素分析显示胰腺癌和癌旁组织中P21的阳性表达以及胰腺癌组织中Ki-67阳性表达为患者不良预后的独立影响因素。结论胰腺癌组织中P21阳性表达预示胰腺癌的不良预后,Ki-67与P21在胰腺癌组织中同时阳性表达或胰腺癌癌旁组织中P21阳性表达可增加不良预后风险。
关键词:胰腺癌;P21;预后;细胞核增殖抗原
胰腺癌恶性度极高[1],早期即可转移至肝脏,预后差。虽然早期根治性切除可以改善患者预后,但由于缺乏敏感的早期诊断指标,使其早期发现困难[1-2]。P21蛋白位于第6号染色体短臂上,可通过N末端和增殖细胞核抗原(PCNA)与Cyclin-CDK特异性结合,抑制CDK的活动,导致细胞周期停止,从而起到抑制细胞增殖的作用。文献报道[3],P21的过表达与乳腺癌、胃癌等多种肿瘤的复发转移及不良预后密切相关。体外实验发现,敲除P21基因后可降低胃癌细胞的侵袭转移能力。因此,研究P21在胰腺癌组织中的表达水平及预后的关系有一定的临床价值。
本研究采用组织芯片和免疫组织化学技术,研究P21的表达与胰腺癌临床病理特征及预后的关系,考察其能否作为乳腺癌临床预后的预测指标。
1材料与方法
1.1研究对象
本研究采用组织芯片进行免疫组化染色。组织芯片购自上海生物芯片工程中心,胰腺癌芯片具有完整的临床及病理资料,90例患者具有3~7年的随访资料。本组患者病理诊断均为胰腺导管腺癌,发病年龄36~85岁,平均发病年龄61.9岁,随访时间36~84个月,平均随访时间为(45.0±2.9)月。所有患者均采用美国癌症联合委员会(AJCC)2007年标准进行分期,入组患者手术前未接受放疗、化疗等抗肿瘤治疗。总生存期(OS)定义为患者手术治疗后死亡时间,排除车祸或其他非胰腺癌引起的死亡。
1.2研究方法
1.2.1免疫组织化学染色SABC免疫组化试剂盒购自福州迈新生物公司。芯片厚度4 μm,贴附于载玻片上,60℃充分烤片。二甲苯脱蜡,梯度乙醇水化,PBS洗5 min×3次。3%H2O2阻断内源性过氧化物酶10 min。水浴抗原修复20 min,5%正常山羊血清封闭10 min,滴加P21抗体(CST#2947),4℃冰箱过夜,PBS洗3次。滴加二抗,37℃恒温箱中孵育30 min,PBS洗3 min×3次。ABC复合物作用30 min,PBS洗3 min×3次,DAB显色。滴加DAB显色剂,苏木精复染,常规脱水,二甲苯透明,中性树脂封片。干片后送到上海芯超公司Aperio Scan Scope切片扫描仪进行扫描。
1.2.2免疫组化染色结果判定P21染色阳性部位以细胞核为主,染色呈棕黄色颗粒状(图1)。由2位病理科医生采用双盲法对所有标本染色情况进行评分。无阳性染色细胞计为阴性。染色阳性判断标准参照文献[4]:阳性细胞率≤10%为“+”,10%<阳性细胞率≤30%为“”,30%<阳性细胞率≤100%为“”。
1.3统计学方法
统计分析采用SPSS 22.0软件,根据临床数据特征采用χ2检验和Fisher精确概率法分析组间差异。应用Kaplan-Meier法绘制各组生存曲线,Log-rank检验差异性。应用Cox回归进行单因素及多
因素分析,并计算风险比(HR)及95%置信区间(CI)。以P<0.05为差异有统计学意义。
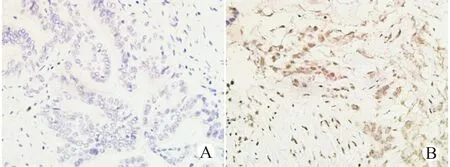
A:P21阴性表达;B:P21阳性表达图1 胰腺癌组织中P21表达的免疫组化染色(SP,×200)Fig.1 Immunohistochemical staining of P21 expression in pancreas cancer tissues(SP,×200)
2结果
2.1P21表达与临床病理特征
2.1.1胰腺癌组织中P21表达与患者临床特征的关系共90例胰腺导管腺癌患者纳入研究,根据P21的免疫组化染色检测结果将其分为P21阳性和阴性组。其中P21阳性44例(48.9%),P21阴性46例(51.1%)。P21阳性表达与阴性表达组间患者性别(P=1.000)、年龄(P=0.669)、病理分级(P=0.232)、肿瘤部位(P=0.163)、脉管侵犯(P=0.828)的差异无统计学意义。P21阳性组中淋巴结转移的患者较P21阴性组多(P<0.01),肿瘤大小普遍大于P21阴性组(P=0.009),临床分期明显高于阴性组(P<0.01),P21在癌组织中的高表达与癌组织中细胞核增殖抗原(Ki-67)的表达水平相关,见表1。
2.1.2胰腺癌癌旁组织中P21表达与患者临床特征的关系胰腺癌癌旁组织中P21的阳性表达与性别、年龄、病理分级、肿瘤部位、肿瘤大小、脉管侵犯、淋巴结转移、临床分期、Ki-67表达均无相关性,见表1。
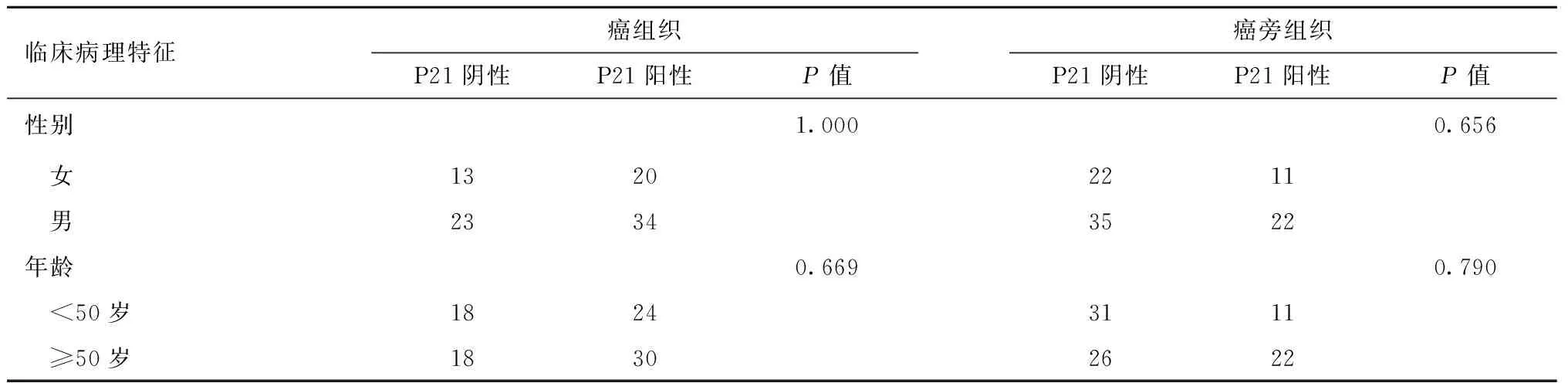
表1 P21表达与临床病理特征的关系(例)
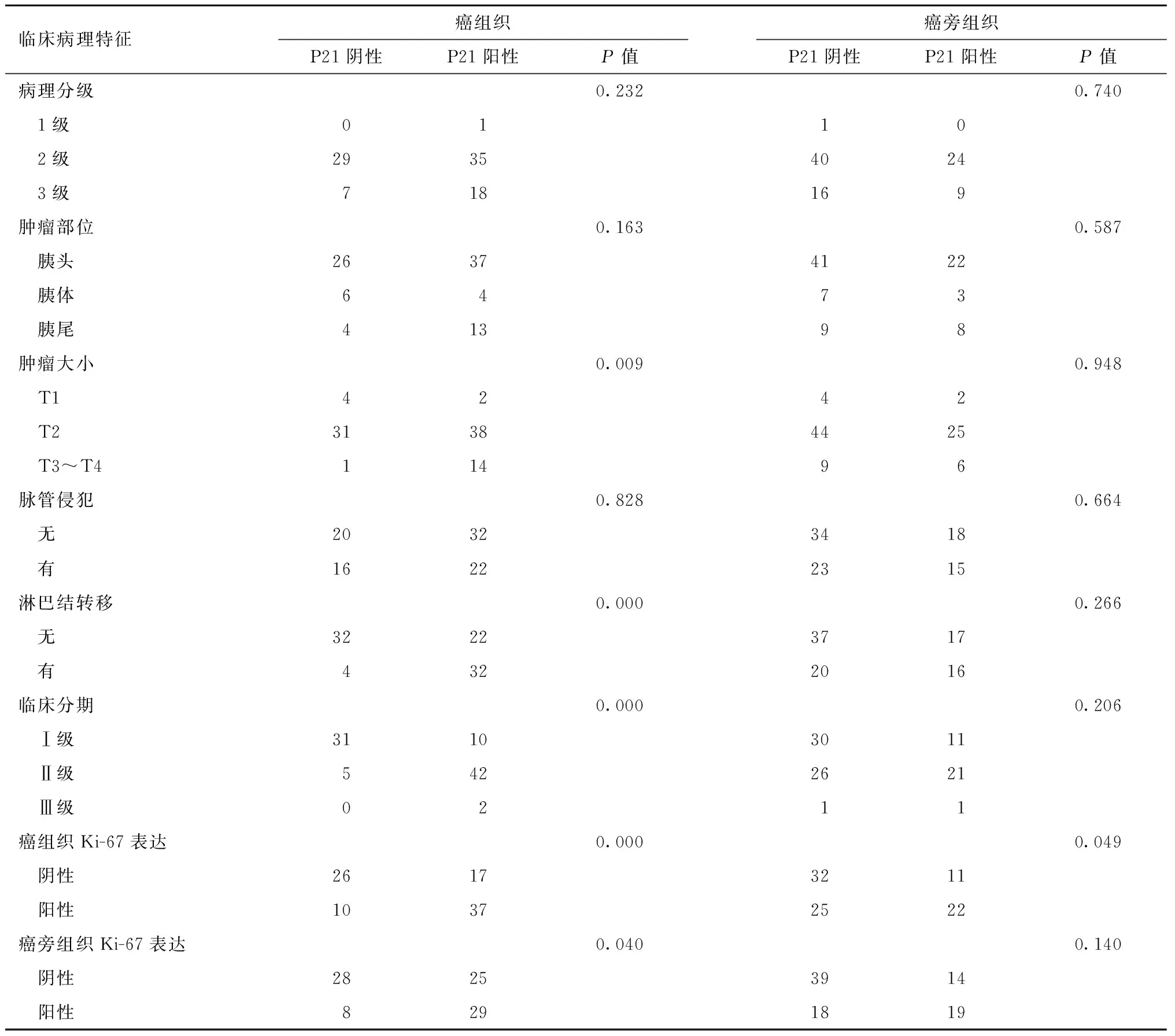
续表1
2.2P21与胰腺癌患者的生存分析
应用Kaplan-Meier法绘制生存曲线并用Log-rank检验差异性,结果显示(图2、3)P21阳性组患者较阴性组的总生存期(OS)显著缩短(P=0.022)。从Cox单因素分析结果看出P21在癌组织和癌旁组织的表达、病理分级、临床分期、淋巴结转移、Ki-67在癌和癌旁组织中的表达均与胰腺癌预后相关,而脉管侵犯、肿瘤大小、肿瘤部位等因素与预后无关。多因素Cox回归分析结果可见P21在癌组织和癌旁组织中的阳性表达、Ki-67在癌组织中的阳性表达是胰腺癌独立的预后因素,见表2。
3讨论
胰腺癌是一种高度异质性肿瘤,预后很差。同时,胰腺癌的发生发展是一个多阶段的复杂过程,多种基因共同参与其中,最终实现肿瘤细胞的增殖、侵袭及转移。研究发现,胰腺癌的发生发展与细胞周期的调节密切相关。
P21蛋白是与细胞周期调控有关的抑癌基因,P53又可在转录水平上调控P21蛋白表达[5],通过抑制CDK活性,导致细胞停滞在G1期,发挥抑制肿瘤生长的作用,P21在转移性胰腺癌中的表达水平远高于原发性胰腺癌。本组研究发现,P21在体积较大的肿瘤组织中阳性表达率明显高于体积较小的组织,此结果提示P21与胰腺癌细胞的增殖相关。淋巴结转移阳性组中P21阳性表达率明显高于淋巴结阴性组,这一结果提示P21是胰腺癌侵袭转移相关的指标,而在胰腺癌旁组织中P21的表达率与淋巴结转移率无关,这估计与癌旁组织中P21的分布不均匀,取材部位离肿瘤细胞的距离不同有关。Ki-67是目前研究较多的肿瘤相关指标之一,已被普遍认为与多种肿瘤的恶性生物学特性相关。文献报道[6-7],其与乳腺癌、胃癌、卵巢癌等多种肿瘤的预后相关。本研究发现,Ki-67在胰腺癌和癌旁组织中均高表达,而且与胰腺癌不良预后相关。同时,Ki-67的表达水平与P21具有同步性,两者同时高表达者预后更差。
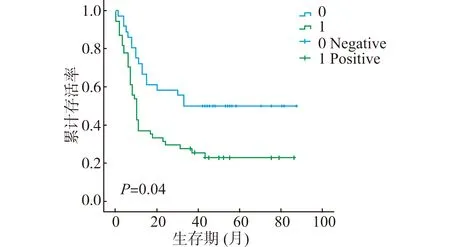
图2 P21在胰腺癌组织中的表达与预后的关系Fig.2 Correlation between the P21 expression in pancreas cancer tissues and prognosis
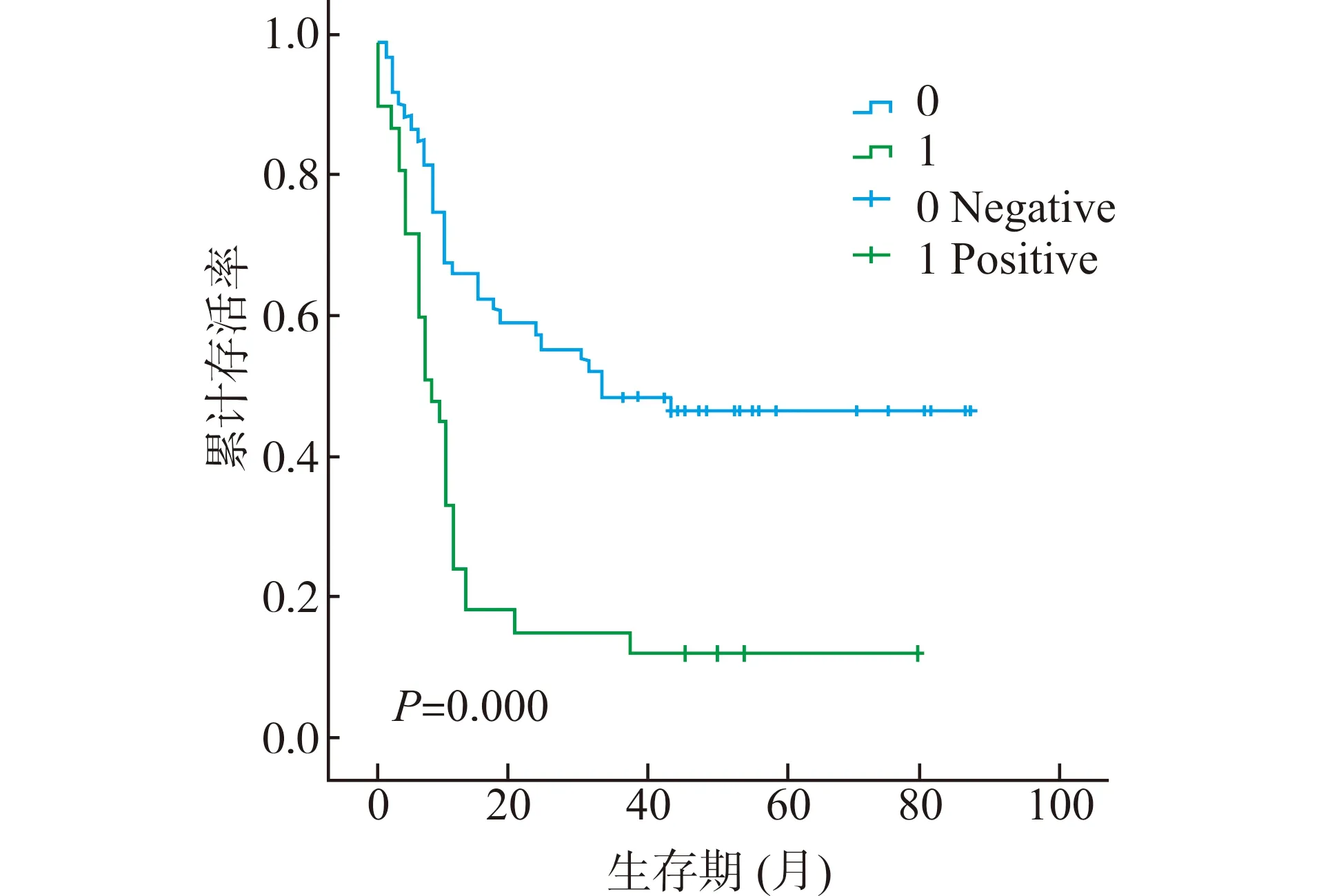
图3 P21在胰腺癌癌旁组织中的表达与预后的关系Fig.3 Correlation between the P21 expression in paracancerous tissues of pancreas cancer and prognosis
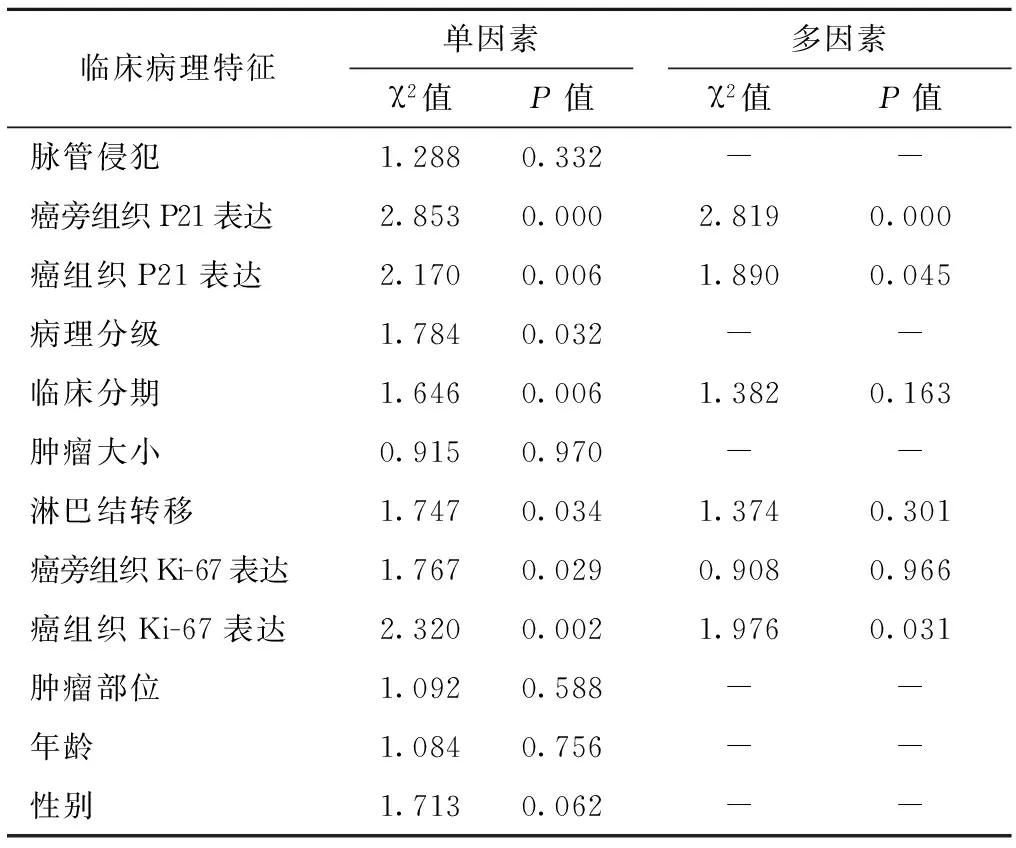
临床病理特征单因素χ2值P值多因素χ2值P值脉管侵犯1.2880.332--癌旁组织P21表达2.8530.0002.8190.000癌组织P21表达2.1700.0061.8900.045病理分级1.7840.032--临床分期1.6460.0061.3820.163肿瘤大小0.9150.970--淋巴结转移1.7470.0341.3740.301癌旁组织Ki-67表达1.7670.0290.9080.966癌组织Ki-67表达2.3200.0021.9760.031肿瘤部位1.0920.588--年龄1.0840.756--性别1.7130.062--
分析胰腺癌癌旁组织P21表达与预后的关系发现,P21在胰腺癌癌旁组织中阳性表达可引起不良预后,这可能与肿瘤局部扩散、具有较高的恶性生物学行为等相关[6]。通过多因素分析发现,胰腺癌和癌旁组织中P21阳性表达、胰腺癌组织中Ki-67的阳性表达可作为患者预后的独立因素。
胰腺癌组织中P21水平与患者的临床分期相关,而癌旁组织中的P21表达却无此相关性,但一旦癌旁组织中P21高表达就会增加患者的预后风险。脉管侵犯是公认的预后危险因素之一,但P21在胰腺癌和癌旁组织中的表达均与脉管侵犯无关,因此推测P21是胰腺癌血管侵犯不相关的分子标记物。
综上所述,从多因素分析结果看,P21在胰腺癌和癌旁组织中的表达,Ki-67在胰腺癌中的表达均可作为独立的预后因素。
参考文献
[1]Kloppel G,Lingenthal G,von Bulow M,et al.Histological and fine structural features of pancreatic ductal adenocarcinomas in relation to growth and prognosis:studies in xenografted tumours and clinico-histopathological correlation in a series of 75 cases[J].Histopathology,1985,9(8):841-856.
[2]Handra-Luca A,Hong S M,Walter K,et al.Tumour epithelial vimentin expression and outcome of pancreatic ductal adenocarcinomas[J].Br J Cancer,2011,104(8):1296-1302.
[3]Liu F,Li X,Wang C,et al.Downregulation of p21-activated kinase-1 inhibits the growth of gastric cancer cells involving cyclin B1[J].Int J Cancer,2009,125(11):2511-2519.
[4]Boschman C R,Stryker S,Reddy J K,et al.Expression of p53 protein in precursor and lesions and adenocarcinoma of human pancreas[J].Am J Pathol,1994,145(6):1291-1295.
[5]Cazzalini O,Scovassi A I,Savio M,et al.Multiple roles of the cell cycle inhibitor p21(CDKN1A) in the DNA damage response[J].Mutat Res,2010,704(1-3):12-20.
[6]Wei D,Le X,Zheng L,et al.Stat3 activation regulates the expression of vascular endothelial growth factor and human pancreatic cancer angiogenesis and metastasis[J].Oncogene,2003,22(3):319-329.
[7]Gaedcke J,Gunawan B,Grade M,et al.The mesopancreas is the primary site for R1 resection in pancreatic head cancer:relevance for clinical trials[J].Langenbecks Arch Surg,2010,395(4):451-458.
(2016-01-12收稿)
Prognostic Value of P21 Expression in Pancreas Cancer:A Tissue Microarray Analysis
Fang Hua1,Yusufu·Maimaiti2,Huang Tao2etal
1MedicalAssociationofHubeiProvince,Wuhan430071,China2DepartmentofBreastandThyroidSurgery,UnionHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430022,China
AbstractObjectiveTo explore the P21 expression in pancreas cancer and paracancerous tissues,and its correlation with the prognosis of pancreas cancer.MethodsImmunohistochemistry was used to detect the P21 expression in 90 cases of pancreas cancer and paracancerous tissues via tissue microarrays.The clinical data were analyzed retrospectively.Survival analysis and the COX proportional hazards model were used to explore the prognostic value of the P21 expression in pancreas cancer.ResultsThe positive rate of P21 expression in 90 cases of pancreas cancer tissues was 48.9%.The P21 expression was significantly associated with tumor size,lymph node metastasis,clinical stage,and Ki-67 expression (P<0.05 for all).The overall survival (OS) in patients positive for the P21 expression was significantly shorter than in those negative for the P21 expression (P=0.022).Multivariate analysis revealed that the P21 expression in pancreas cancer and paracancerous tissues,and the Ki-67 expression in pancreas cancer tissues were independent predictors of poor prognosis in patients with pancreas cancer.ConclusionThe P21 expression predicts a poor prognosis in patients with pancreas cancer.The simultaneous expression of P21 and Ki-67 in pancreas cancer tissues or P21 expression in paracancerous tissues may increase the risk of poor prognosis in pancreas carcinoma.
Key wordspancreas cancer;P21;prognosis;Ki-67
中图分类号:R735.9
DOI:10.3870/j.issn.1672-0741.2016.03.019
方华,女,1974年生,副主任技师,E-mail:3044402087@qq.com
△通讯作者,Corresponding author,E-mail:26057639@qq.com
