IL-32对HepG2 2.15细胞凋亡的影响*
2016-07-05潘兴飞孙媛丽尹旺春符明鹏沈关心朱慧芬
潘兴飞, 孙媛丽, 贺 琪, 尹旺春, 符明鹏, 沈关心, 朱慧芬△
1广州医科大学附属第三医院感染科,广州 510150 2 华中科技大学同济医学院基础医学院免疫学系,武汉 430030
IL-32对HepG2 2.15细胞凋亡的影响*
潘兴飞1,孙媛丽2,贺琪2,尹旺春2,符明鹏2,沈关心2,朱慧芬2△
1广州医科大学附属第三医院感染科,广州5101502华中科技大学同济医学院基础医学院免疫学系,武汉430030
摘要:目的研究白细胞介素-32(IL-32)对乙型肝炎病毒(HBV)感染的肝细胞(HepG2 2.15细胞,插入HBV全基因组,持续表达)凋亡的影响。方法将不同浓度的IL-32(0~0.4 μg/mL)蛋白质与HepG2细胞、HepG2 2.15细胞共培养,48 h后用MTT检测细胞增殖。收集与IL-32共培养48 h的HepG2细胞、HepG2 2.15细胞,加入Annexin Ⅴ和PI,室温避光孵育15 min,流式细胞仪检测细胞凋亡。将IL-32(0.2 μg/mL)与HepG2细胞、HepG2 2.15细胞共培养,分别于0、12、24 h后收集细胞,Human Active Caspase-3 Immunoassay检测试剂盒检测活化的Caspase-3表达水平,Caspase-3 Colorimetric检测试剂盒检测Caspase-3酶活性。结果IL-32抑制HepG2细胞、HepG2 2.15增殖,诱导HepG2细胞、HepG2 2.15细胞凋亡,且随着IL-32浓度的增高,细胞凋亡水平亦增高。IL-32诱导HepG2细胞、HepG2 2.15细胞活化的Caspase-3表达水平及Caspase-3酶活性均增加。结论IL-32可能通过活化Caspase-3通路诱导HBV感染的肝细胞凋亡而发挥抗病毒作用,同时亦参与慢性乙型病毒性肝炎肝损伤的发生。
关键词:白细胞介素-32;肝细胞;乙型肝炎病毒;细胞凋亡;Caspase-3
白细胞介素-32(interleukin-32,IL-32)是一种促炎症细胞因子,可以通过活化NF-κB、p38MAPK等信号通路诱导TNF-α、IL-8、IL-1β、等细胞因子表达[1],导致细胞因子网络活化,亦可影响细胞的生长、凋亡。研究发现IL-32可以诱导活化的T细胞凋亡,HeLa细胞中IL-32增高则HeLa细胞凋亡增加,降低HeLa细胞中的IL-32则HeLa细胞凋亡减少[2-3]。我们前期研究证实慢性乙型病毒性肝炎(chronic hepatitis B,CHB)肝组织中IL-32表达增高,且其表达水平与肝组织炎症、纤维化程度呈正相关[4]。因此,本研究在细胞水平检测IL-32对肝细胞凋亡的影响及机制。
1材料与方法
1.1细胞株及试剂
人肝癌细胞株HepG2、HepG2 2.15细胞(插入HBV全基因组,持续表达)为华中科技大学同济医学院免疫学实验室保存。重组人IL-32蛋白购自美国R&D公司。凋亡检测试剂盒(Alexa Fluor®488 Annexin Ⅴ/Dead Cell Apoptosis Kit)购自美国Invitrogen公司。Human Active Caspase-3 Immunoassay检测试剂盒购自美国R&D公司。Caspase-3 Colorimetric检测试剂盒购自美国BioVision公司。
1.2MTT法检测细胞增殖
MTT法参照文献[5]报道。简要步骤如下:将HepG2细胞、HepG2 2.15细胞接种至96孔板,将不同浓度的IL-32(0~0.4 μg/mL)分别与HepG2细胞、HepG2 2.15细胞共培养48 h,然后每孔加入MTT 10 μL,继续培养4 h,再加入细胞裂解液100 μL,将细胞置于微量振荡器上轻轻振荡15 min,在酶标仪上读取A值。抑制率(%)=(1-实验组A值/空白组A值)×100%。
1.3检测细胞凋亡
12孔板的每个孔铺入1.5×105细胞,培养24 h,加入不同浓度的IL-32(0~0.4 μg/mL)与之共培养,48 h后收集细胞,加入Annexin Ⅴ和PI孵育。首先用Alexa Fluor®488 Annexin Ⅴ/Dead Cell Apoptosis Kit与IL-32处理过的细胞共孵育,按Invitrogen公司说明书操作。具体步骤如下:用0.05%的胰酶将贴壁的细胞消化下来;用1 200 r/min离心机室温离心收集细胞;用预冷的PBS洗细胞2次;再用1×Annexin-binding缓冲液100 μL将细胞重悬;加入Alexa Fluor®488 Annexin Ⅴ 5 μL和100 μg/mL PI工作液1 μL,室温避光孵育15 min;再加入1×Annexin-binding缓冲液400 μL,轻轻混匀;最后用流式细胞仪检测凋亡。
1.4检测Caspase-3活化水平
用Human Active Caspase-3 Immunoassay检测试剂盒检测细胞Caspase-3活化水平。将IL-32(0.2 μg/mL)分别与HepG2细胞、HepG2 2.15细胞共培养,分别于0、12、24 h后收集细胞,检测活化Caspase-3表达水平,具体步骤参照试剂盒所提供的说明书操作。
1.5检测Caspase-3酶活性
用Caspase-3 Colorimetric检测试剂盒检测Caspase-3酶活性。将IL-32(0.2 μg/mL)分别与HepG2细胞、HepG2 2.15细胞共培养,分别于0、12、24 h后收集细胞,检测Caspase-3酶活性,具体步骤参照试剂盒所提供的说明书操作。
1.6统计学方法
2结果
2.1IL-32抑制HepG2细胞、HepG2 2.15细胞增殖
用MTT法检测IL-32对细胞增殖的影响,从表1可以看出,IL-32可以抑制HepG2细胞、HepG2 2.15细胞增殖,随IL-32浓度的增高,其对细胞增殖抑制作用增强。
表1IL-32对HepG2细胞、HepG2 2.15细胞增殖的影响
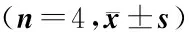
Table 1 Effect of IL-32 on the proliferation of HepG2 and
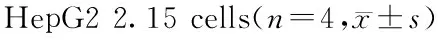

IL-32(μg/mL)HepG2细胞A值抑制率(%)HepG22.15细胞A值抑制率(%)00.62±0.0500.58±0.0300.10.50±0.04100.49±0.01120.20.35±0.06250.30±0.02290.40.28±0.02 50*0.23±0.01 55*
与对照组(0 μg/mL IL-32)比较,*P<0.05
2.2IL-32诱导HepG2、HepG2 2.15细胞凋亡
为了研究IL-32增高对细胞凋亡的影响,我们用商品化的IL-32蛋白(0~0.4 μg/mL)与细胞共培养,48 h后用流式细胞仪检测细胞凋亡水平。如图1所示,IL-32可诱导HepG2细胞凋亡,且随着IL-32浓度的增高,细胞凋亡水平增高。进一步检测IL-32对HepG2 2.15细胞凋亡的影响,以明确IL-32对HBV感染细胞凋亡的作用,如图1所示,IL-32可诱导HepG2 2.15细胞凋亡,且随着IL-32浓度的增高,细胞凋亡水平亦增高。
2.3IL-32诱导活化的Caspase-3表达增加
Caspase-3是内源性、外源性凋亡通路共有的重要效应酶,活化的Caspase-3发挥诱导凋亡的作用。凋亡检测发现0.2 μg/mL的IL-32蛋白质即显著诱导肝细胞凋亡,因此我们用浓度为0.2 μg/mL的IL-32蛋白与HepG2细胞、HepG2 2.15细胞共培养,分别共培养0、12、24 h后收集细胞,检测活化的Caspase-3表达水平。如图2所示,IL-32诱导活化的Caspase-3表达增加,且随着IL-32刺激时间的延长,活化的Caspase-3表达水平亦增高。
2.4IL-32诱导Caspase-3酶活性增强
将IL-32(0.2 μg/mL)与HepG2细胞、HepG2 2.15细胞共培养,分别于0、12、24 h后收集细胞,检测Caspase-3酶活性。如图3所示,IL-32诱导Caspase-3酶活性增强,且随着IL-32刺激时间的延长,Caspase-3酶活性亦增高。

图2 0.2 μg/mL IL-32诱导HepG2细胞(A)、HepG2 2.15细胞(B)活化的Caspase-3表达Fig.2 Expression of activated caspase-3 in HepG2(A)and HepG2 2.15 cells(B)induced by IL-32(0.2 μg/mL)
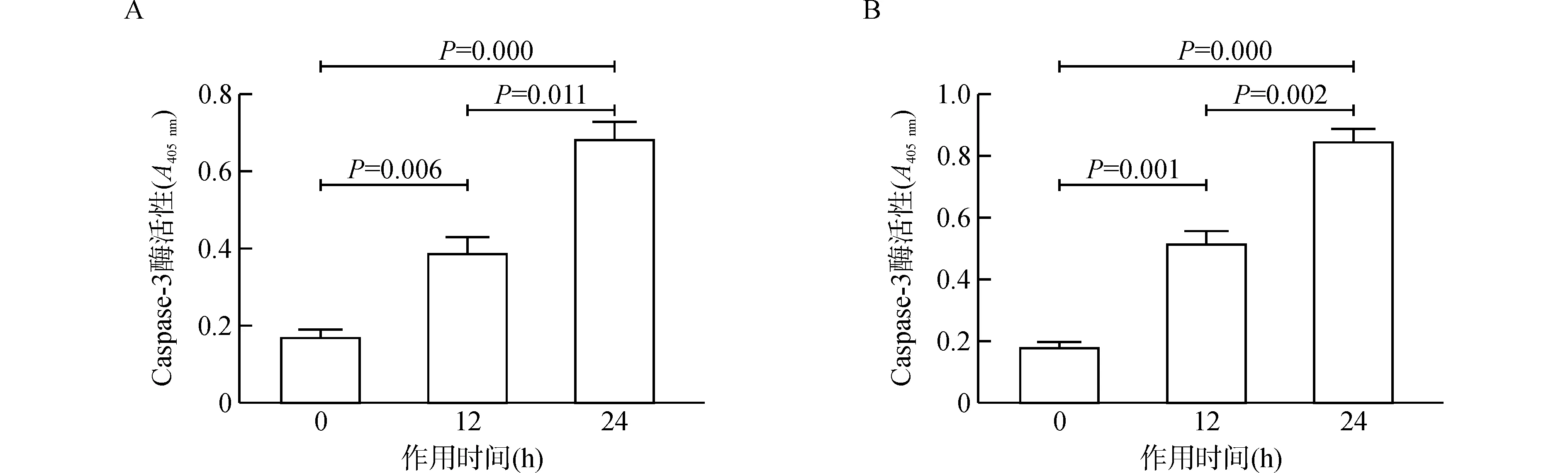
图3 0.2 μg/mL IL-32诱导HepG2细胞(A)、HepG2 2.15细胞(B)Caspase-3酶活性增强Fig.3 Increase of caspase-3 enzyme activities in HepG2(A)and HepG2 2.15 cells(B)induced by IL-32(0.2 μg/mL)
3讨论
本研究发现IL-32抑制HepG2细胞、HepG2 2.15细胞增殖,诱导HepG2细胞、HepG2 2.15细胞凋亡,且随着IL-32浓度的增高,细胞凋亡水平亦增高。促炎症细胞因子IL-32,既可呈分泌性表达,诱导活化局部细胞因子网络,参与丙型病毒性肝炎肝纤维化[6]、炎症性肠病[7]等炎症性疾病的发病,又可诱导HeLa细胞凋亡,在宫颈炎、宫颈癌的发病中起重要作用[2-3]。我们的前期研究发现CHB患者肝组织中IL-32表达增高,且其表达水平与肝组织炎症及纤维化程度呈正相关[4],但IL-32引起肝组织炎症是否与导致肝损伤有关尚未完全明确。
我们前期研究亦发现HBV及其编码的蛋白HBx可以诱导肝细胞表达IL-32[8],本研究发现IL-32随浓度增高而诱导HBV感染细胞凋亡增加。细胞凋亡是病毒性肝炎肝损伤的重要原因,反复的肝细胞损伤、修复是导致肝纤维化发生的重要原因。结合我们前期研究结果,我们推测IL-32可能通过诱导HBV感染细胞凋亡而导致肝损伤,参与CHB肝损伤的发生。
细胞凋亡是活体组织必须的生物过程,细胞凋亡过程被内源性、外源性两种通路介导,Caspase-3是内、外源凋亡通路共有的重要效应酶,Caspase-3活化导致维持细胞生存、死亡的蛋白降解,引起凋亡发生[9]。研究发现IL-32可诱导结核杆菌感染的THP-1细胞凋亡,IL-32表达增高的THP-1细胞活化的Caspase-3表达增加,Caspase-3抑制剂可降低IL-32诱导的THP-1细胞凋亡,由此认为IL-32可通过诱导THP-1细胞凋亡而抑制结核杆菌感染,并对机体具有保护作用[10]。本研究发现IL-32可诱导HepG2细胞及HepG2 2.15细胞凋亡,IL-32与HepG2细胞及HepG2 2.15细胞共培养后Caspase-3活化增加,而且Caspase-3酶活性亦增加,我们认为IL-32可能通过诱导Caspase-3活化、增加Caspase-3酶活性导致凋亡通路活化,从而诱导肝细胞凋亡。此外,我们发现HepG2 2.15细胞凋亡水平、HepG2 2.15细胞活化的Caspase-3表达水平、HepG2 2.15细胞Caspase-3酶活性均高于HepG2细胞,我们推测可能与HepG2 2.15细胞有HBV存在,机体因此而产生更强的保护机制,导致凋亡程度更强,以抑制HBV感染有关。
最新的研究发现CHB患者肝组织中Caspase-3表达增高,Caspase-3表达增高的肝细胞凋亡增加[11-12]。我们的前期研究发现CHB患者肝组织中IL-32表达增高,且其表达水平与肝组织炎症程度呈正相关。结合本研究结果,进一步证实IL-32可能通过活化Caspase-3而诱导HBV感染细胞凋亡,导致肝损伤发生。
综上所述,本研究发现IL-32可抑制HepG2细胞、HepG2 2.15细胞增殖,诱导HepG2细胞凋亡、HepG2 2.15细胞凋亡,其可能通过活化Caspase-3、增强Caspase-3酶活性而诱导凋亡通路活化。因此,我们认为IL-32可能通过诱导HBV感染细胞凋亡而发挥抗病毒作用,同时亦导致CHB肝损伤的发生。
参考文献
[1]Kim S H,Han S Y,Azam T,et al.Interleukin-32:a cytokine and inducer of TNFalpha[J].Immunity,2005,22(1):131-142.
[2]Goda C,Kanaji T,Kanaji S,et al.Involvement of IL-32 in activation-induced cell death in T cells[J].Int Immunol,2006,18(2):233-240.
[3]Lee S,Kim J H,Kim H,et al.Activation of the interleukin-32 pro-inflammatory pathway in response to human papillomavirus infection and over-expression of interleukin-32 controls the expression of the human papillomavirus oncogene[J].Immunology,2011,132(3):410-420.
[4]Xu Q,Pan X,Shu X,et al.Increased interleukin-32 expression in chronic hepatitis B virus-infected liver[J].J Infect,2012,65(4):336-342.
[5]冯刚,张丽娟,罗利琼.转染pCE-GFP的重组骨髓间充质干细胞对Walker-256细胞的体外抗肿瘤作用[J].华中科技大学学报:医学版,2011,40(2):204-208.
[6]Moschen A R,Fritz T,Clouston A D,et al.Interleukin-32:a new proinflammatory cytokine involved in hepatitis C virus-related liver inflammation and fibrosis[J].Hepatology,2011,53(6):1819-1829.
[7]Shioya M,Nishida A,Yagi Y,et al.Epithelial overexpression of interleukin-32 alpha in inflammatory bowel disease[J].Clin Exp Immunol,2007,149(3):480-486.
[8]Pan X,Cao H,Lu J,et al.Interleukin-32 expression induced by hepatitis B virus protein X is mediated through activation of NF-kappaB[J].Mol Immunol,2011,48(12/13):1573-1577.
[9]Riedl S J,Shi Y.Molecular mechanisms of caspase regulation during apoptosis[J].Nat Rev Mol Cell Biol,2004,5(11):897-907.
[10]Bai X,Kim S H,Azam T,et al.IL-32 is a host protective cytokine againstMycobacteriumtuberculosisin differentiated THP-1 human macrophages[J].J Immunol,2010,184(7):3830-3840.
[11]Yeganeh B,Rezaei M A,Alizadeh J,et al.Hepatitis B and C virus-induced hepatitis:Apoptosis,autophagy,and unfolded protein response[J].World J Gastroenterol,2015,21(47):13225-13239.
[12]高见,董凌月,安威.GFER抑制四氯化碳对HepG2细胞的损伤[J].中国组织化学与细胞化学杂志,2015,24(5):447-451.
(2015-12-22收稿)
Effect of Interleukin-32 on the Apoptosis of HepG2 2.15 Cells
Pan Xingfei1,Sun Yuanli2,He Qi2etal
1DepartmentofInfectiousDiseases,The3rdAffiliatedHospital,GuangzhouMedicalUniversity,Guangzhou510150,China2DepartmentofImmunology,SchoolofBasicMedicalSciences,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China
AbstractObjectiveTo investigate the effect of interleukin-32(IL-32)on the apoptosis of HepG2 2.15 cells in which the whole genome of HBV was inserted and persistently expressed.MethodsHepG2 cells or HepG2 2.15 cells were treated with different concentrations of IL-32(0-0.4 μg/mL).Forty-eight hours later,cell proliferation was assayed by MTT method.Cell apoptosis was assayed by flow cytometry(FCM)after treatment of both cells with IL-32 for 48 h,and then with annexin Ⅴ and PI at room temperature in the dark for 15 min.Subsequently,HepG2 cells or HepG2 2.15 cells were co-cultured with IL-32 at 0.2 μg/mL.They were collected at 0,12,24 h,respectively.Activated caspase-3 expression levels were assayed by using Human Active Caspase-3 Immunoassay Kit.Caspase-3 enzyme activities were detected by Caspase-3 Colorimetric Assay Kit.ResultsIL-32 could inhibit the proliferation of HepG2 cells and HepG2 2.15 cells,and induce their apoptosis in a dose-dependent manner.Activated caspase-3 expression levels and caspase-3 enzyme activities were increased in both HepG2 and HepG2 2.15 cells co-cultured with IL-32.ConclusionIL-32 play an anti-viral role by activating the caspase-3 pathway and inducing the apoptosis of HBV-infected hepatocytes,and it is involved in the liver damage of chronic hepatitis B at the same time.
Key wordsIL-32;hepatocytes;hepatitis B virus;cell apoptosis;caspase-3
中图分类号:R392.114
DOI:10.3870/j.issn.1672-0741.2016.03.003
*国家自然科学基金资助项目(No.81401306,No.81373152);广州医科大学附属第三医院博士启动基金(No.2014Y02)
潘兴飞,男,1980年生,主治医师,E-mail:panxing0125@163.com
△通讯作者,Corresponding author,E-mail:huifzhu12@hotmail.com
