产酸克雷伯氏菌赖氨酸脱羧酶的异源表达及粗酶性质
2016-07-04李乃强于丽珺徐岩
李乃强,于丽珺,徐岩
1 江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122 2 上海凯赛生物技术研发中心有限公司,上海 201203
产酸克雷伯氏菌赖氨酸脱羧酶的异源表达及粗酶性质
李乃强1,2,于丽珺2,徐岩1
1 江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡214122 2 上海凯赛生物技术研发中心有限公司,上海201203
李乃强, 于丽珺, 徐岩. 产酸克雷伯氏菌赖氨酸脱羧酶的异源表达及粗酶性质. 生物工程学报, 2016, 32(4): 537–531.
Li NQ, Yu LJ, Xu Y. Heterologous expression and characterization of Klebsiella oxytoca lysine decarboxylase. Chin J Biotech, 2016, 32(4): 527–531.
摘要:赖氨酸脱羧酶,可以催化赖氨酸脱羧生成戊二胺。戊二胺是重要的平台化合物,可以合成新型聚酰胺材料、脂肪族异氰酸酯等新材料。本研究对来自于产酸克雷伯氏菌的赖氨酸脱羧酶进行异源表达。以pUC18质粒为载体,将来源于产酸克雷伯氏菌的赖氨酸脱羧酶基因ldc克隆到大肠杆菌,得到菌株LN18。在添加0.5 mmol/L IPTG的LB培养基中,对LN18进行摇瓶培养,发酵液酶活可达到35 U/g发酵液,从发酵液制备的赖氨酸脱羧酶粗酶蛋白的酶活可以达到30 000 U/g粗蛋白。产酸克雷伯氏菌赖氨酸脱羧粗酶蛋白大小约80 kDa,粗酶的最适温度和pH值分别为55 ℃和5.5,与文献中报道的大肠杆菌的赖氨酸脱羧酶CadA在pH 8.0几乎没有酶活不同,产酸克雷伯氏菌的赖氨酸脱羧酶在pH 8.0的酶活达到最优pH下酶活的30%以上。金属离子对酶活有一定的影响,Mg2+对酶活有促进作用,Fe2+、Zn2+、Ca2+有一定的抑制作用。
关键词:赖氨酸脱羧酶,产酸克雷伯氏菌,戊二胺,异源表达,pH稳定性
Received: August 28, 2015; Accepted: October 25, 2015
Supported by: National High Technology Research and Development Program of China (863 Program) (No. 2011AA02A204-04).
Yan Xu. Tel: +86-531-88369463; Fax: +86-531-88567250; E-mail: yxu@jiangnan.edu.cn
一些学者如Gale和Epps等在20世纪40年代就研究了赖氨酸脱羧酶,其主要用途被用来定量分析赖氨酸的含量[1]。随着人们对赖氨酸脱羧酶的认识的提高,在越来越多的生物体内发现有赖氨酸脱羧酶的存在,如在大肠杆菌Escherichia coli、尸杆菌Bacterium cadaveris、蜂房哈夫尼菌Hafnia alvei、产酸克雷伯氏菌Klebsiella oxytoca等微生物中存在赖氨酸脱羧酶[2-4]。文献中研究比较广泛的是大肠杆菌的赖氨酸脱羧酶,大肠杆菌中存在两种类型的赖氨酸脱羧酶。一种是在低pH环境下诱导产生的赖氨酸脱羧酶,其编码基因为cadA[5],另外一种是组成型的,其编码基因为ldcC[6-7]。Krithika等[8]研究了来自大肠杆菌的两种赖氨酸脱羧酶CadA和Ldc的反应动力学以及它们的酶学性质。
赖氨酸脱羧酶催化赖氨酸脱羧得到的戊二胺是一种重要的平台化合物,可以合成新型聚酰胺、新型异氰酸酯和哌啶、吡啶等重要化合物。特别是用戊二胺合成的新型聚酰胺,由于其结晶度、结晶结构的不同以及内部官能团被氢键饱和的程度不同从而具备新的特性。如聚酰胺56具备阻燃性好、流动性好等特点,这些新的特点都为下游的材料提供了新的性能。
生物法合成戊二胺主要有两条途径,一种是以葡萄糖为原料,通过微生物发酵来直接合成戊二胺,其代谢途径复杂,得到产物的转化率低,生成的戊二胺对微生物有毒害作用。如在菌株谷氨酸棒杆菌Corynebacterium glutamicum ATCC 13032过量表达来源于E. coli的 cadA 基因得到菌株 TM45。TM45可以用50 g/L的葡萄糖生产2.6 g/L的戊二胺[9]。如Qian[10]等通过引入强启动子过表达赖氨酸脱羧酶、敲除代谢戊二胺的相关基因等构建的大肠杆菌XQ56能产9.6 g/L戊二胺。Kind等[11-13]通过代谢工程系统改造,包括目的基因的启动子、密码子优化、删除副产物乙酰戊二胺的相关酶系、提高重组菌分泌戊二胺的能力等。这些改进将葡萄糖到戊二胺的转化率提高到17%。另外一条途径是以赖氨酸为底物,用赖氨酸脱羧酶来催化生成戊二胺,该工艺路径短、产物单一,但是催化效率需要进一步提高,而且由于赖氨酸的价格不菲,限制了生物法戊二胺的产业化。生物法制备戊二胺随着戊二胺浓度的累积,反应液的pH不断上升使得酶活大大降低。Usheer K和 Irina Gutsche等[14]研究表明随着pH上升,大肠杆菌赖氨酸脱羧酶CadA由十聚体逐步解离成二聚体而丧失酶活。而为了维持酶活,就需要添加大量的pH缓冲试剂,这对后续的纯化和产品质量带来影响。因此寻求不同于大肠杆菌的赖氨酸脱羧酶,发掘新来源的赖氨酸脱羧酶的新功能,解决上述瓶颈问题,是生物法合成戊二胺的一个重要方向。
本文主要通过扩增来源于产酸克雷伯氏菌Klebsiella oxytoca的赖氨酸脱羧酶基因,将该基因在E. coli进行异源表达,将重组菌进行培养产酶,并对重组菌的赖氨酸脱羧酶进行纯化,研究其相关酶学性质。选择产酸克雷伯氏菌的主要原因是产酸克雷伯氏菌在食物中广泛存在,并且产酸克雷伯氏菌有较高的赖氨酸脱羧酶活力,能够累积一定量的戊二胺[15]。在后续的研究过程中,作者尝试了目的基因的密码子优化以及RBS优化 (核糖体结合位点优化),证明了密码子优化和RBS优化都是目的基因提高表达效率的有效手段。
1 材料与方法
1.1材料
1.1.1引物
本研究所用引物见表1。
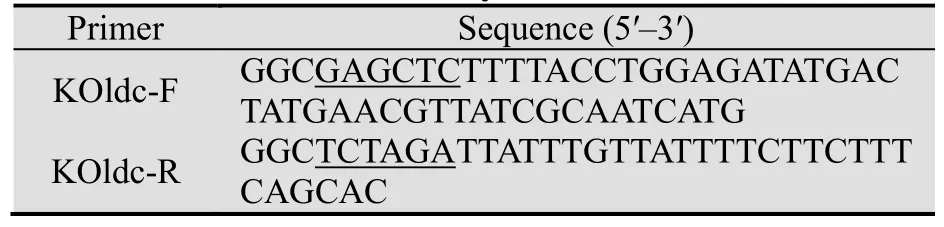
表1 本研究所用引物Table 1 Primers in this study
1.1.2主要试剂
琼脂粉、氯化钠、酵母粉和蛋白胨等购自国药集团化学试剂有限公司;PCR试剂盒、内切酶SacⅠ、内切酶XbaⅠ、内切酶EcoRⅠ、连接酶、质粒小量抽提试剂盒、琼脂糖、电转杯等购自上海生工生物工程有限公司。DNA回收试剂盒购自宝生物工程(大连) 有限公司,PCR引物由上海赛百盛基因技术有限公司合成。除非特殊说明,采用的试剂均为分析纯。
1.2方法
1.2.1ld c基因的克隆与测序
产酸克雷伯氏菌全基因组购买于DSMZ (DSMZ6673),以其为模板,根据GenBank Accession No. CP003683.1来设计ldc基因的扩增引物为KOldc-F和KOldc-R。设计PCR扩增条件为:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2.5 min ,30个循环;72 ℃延伸10 min。所得片段胶回收后与克隆载体pMD18-T连接,转化E. coli JM109,挑取阳性转化子。提取质粒酶切鉴定,并将重组质粒命名为pMD18-KOldc,并测序 (测序工作由上海生工完成)。
1.2.2重组表达载体的构建及鉴定
用SacⅠ和XbaⅠ分别酶切pMD18-KOldc和pUC18质粒,回收KOldc基因片段和pUC18线性片段后进行连接,所得质粒命名为pUC18-KOldc。用内切酶对pUC18-KOldc进行酶切,凝胶电泳验证酶切片段大小,将大小正确的pUC18-KOldc质粒电击转化E. coli MG1655 K12感受态细胞,得到含有pUC18-KOldc质粒的大肠杆菌细胞,命名为菌株LN18。
1.2.3重组菌培养
挑取在氨苄青霉素抗性LB平板培养基上的LN18单菌落转接到液体LB培养基中,加入氨苄青霉素钠至终浓度为100 mg/L,在37 ℃、200 r/min培养15 h后至OD560达到5时,按照1%的比例转接至装发酵培养基的摇瓶,发酵培养基同摇瓶培养基,IPTG的浓度为0.5 mmol/L,37 ℃、200 r/min的搅拌条件下培养过夜,发酵液的酶活可以达到35 U/g发酵液。
1.2.4赖氨酸脱羧酶粗酶制备和SDS-PAGE
所有的纯化步骤均在4 ℃下进行,缓冲液使用100 mmol/L 磷酸钾缓冲液 (pH 6.0)。将LN18发酵液进行离心收集,将收集的细胞悬浮于缓冲液中,使用超声波振荡器(HM2412, Honda Electronics Co. Ltd. Toyohashi, Japan)进行细胞破碎。细胞碎片通过离心去除。离心条件为4 ℃、15 000 r/min离心15 min,上清液为无细胞提取液。取40 mL无细胞提取液加入到40%饱和硫酸铵溶液中,在冰上搅拌4 h。然后于17 000 r/min离心20 min。将离心后的不溶物收集,将其溶解在100 mmol/L磷酸钠缓冲液中,冷冻干燥后存放于–20 ℃冰箱内,制备得到赖氨酸脱羧酶粗酶蛋白。对粗酶蛋白进行SDS-PAGE,分析蛋白的分子量,浓缩胶浓度为5%,分离胶浓度为12%,电泳结束后用考马斯亮蓝R-250染色。
1.2.5赖氨酸脱羧酶酶活测定方法
在500 mL三角瓶中加入pH值为5.5的5%的赖氨酸盐酸盐溶液100 g,加入5’-磷酸吡哆醛至终浓度为0.1 mmol/L,最后加入上述1.2.4制备的赖氨酸脱羧酶粗酶蛋白,37 ℃、170 r/min振荡反应10 min,沸水浴终止反应,反应液测定戊二胺含量,以每分钟1 g赖氨酸脱羧酶粗酶蛋白催化产生1 μmol的戊二胺定义为一个酶活单位,即1 U。
1.2.6戊二胺测定方法
利用核磁共振一维氢谱来定量分析酶反应液中的戊二胺。取定量的样品和含有定量内标和重水溶液混合。采用的仪器为Bruker 400 Ultrashield Plus NMR核磁共振仪,程序为FID 65536,扫描数为16,脉冲14.49 μs,功率17 W,样品温度27 ℃。为了提高测量的准确度,所有的样品都采用称重的方式。
1.2.7赖氨酸脱羧酶粗酶蛋白的最适pH和pH稳定性
分别配制pH值为4.0–10.0,浓度为5%的赖氨酸盐酸盐缓冲溶液,加入5’-磷酸吡哆醛至终浓度为0.1 mmol/L,加入纯化的赖氨酸脱羧酶粗酶蛋白,测定不同pH值下赖氨酸脱羧酶LDC的酶活。
分别将纯化的赖氨酸脱羧酶粗酶蛋白溶解于不同pH值缓冲液中,37 ℃静置保存36 h后测定酶活,确定此酶的pH稳定性。
1.2.8赖氨酸脱羧酶粗酶蛋白的最适温度及温度稳定性
配制pH值为5.5,终浓度为5%的赖氨酸盐酸盐缓冲液100 g,加入5’-磷酸吡哆醛至终浓度为0.1 mmol/L,加入纯化的赖氨酸脱羧酶粗酶蛋白,分别在20 ℃到80 ℃不同温度下测定酶活,研究酶的最适反应温度。
将纯化的赖氨酸脱羧酶蛋白溶解于pH值为5.5缓冲溶液中,静置于不同温度的水溶液中水浴保温36 h,测定酶活力,考察温度对酶稳定性的影响。
1.2.9不同金属离子对粗酶酶活的影响
在反应液中分别加入终浓度为10 mmol/L的各种离子,37 ℃测定赖氨酸脱羧酶LDC酶活,不加金属离子的作为对照。
2 结果与分析
2.1ldc基因在大肠杆菌中的表达
以克雷伯氏菌基因组DNA为模板,用KOldc-F、KOldc-R引物进行PCR扩增。所得到片段与目的基因ldc的2 148 bp大小一致 (约为2.1 kb),如图1所示。
胶回收此目的片段,连接pMD18-T载体构建得到pMD18-KOldc,转化大肠杆菌E. coli JM109中,提取质粒,经酶切鉴定后送出测序。测序结果通过Blast进行比对,表明PCR扩增获得的基因ldc核苷酸序列与K. oxytoca E718的赖氨酸脱羧酶的基因序列 (GenBank Accession No. CP003683.1) 同源性达99%,为一个完整的阅读框。pMD-KOldc用SacⅠ和XbaⅠ进行双酶切,胶回收KOldc片段,将其与经相同酶切线性化的pUC18载体连接,将得到的重组表达载体命名为pUC18-KOldc。并将其转化大肠杆菌JM109,通过菌落PCR筛选出阳性转化子,LB培养后提取质粒,用EcoRⅠ酶切验证确认。
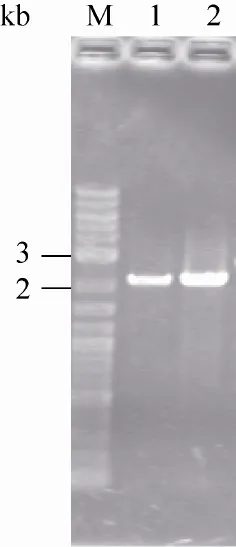
图1 产酸克雷伯氏菌ldc基因的扩增Fig. 1 PCR products of ldc gene. M: marker; 1-2: ldc PCR.
重组质粒pUC18-KOldc通过电击转化入E. coli MG1655 K12感受态细胞,首先通过菌落PCR筛选出阳性转化子。将阳性转化子液体培养后提取少量质粒酶切验证,酶切验证正确的阳性转化子命名为LN18。将LN18接种至含氨苄青霉素钠 (终浓度为100 μg/mL) 的LB培养基中,37 ℃振荡培养过夜,次日转接,35 ℃培养至OD560约4–5,加入IPTG过夜诱导表达,发酵液酶活可达到35 U。由于大肠杆菌本身的赖氨酸脱羧酶CadA的表达需要在低pH、有赖氨酸的诱导下才能表达,而且野生型的表达量很低[7]。因此认为表达的为产酸克雷伯氏菌的赖氨酸脱羧酶。将发酵液按照步骤1.2.4制备得到的粗酶的1×SDS-PAGE电泳结果表明,LDC蛋白大小约为80 kDa,结果见图2。
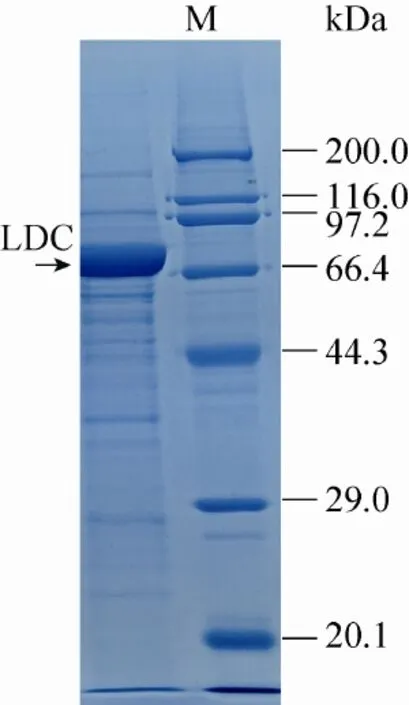
图2 赖氨酸脱羧酶粗酶蛋白SDS-PAGE电泳分析Fig. 2 SDS-PAGE analysis of proteins from strain LN18.
2.2产酸克雷伯氏菌赖氨酸脱羧酶的最适反应pH和pH稳定性
每种酶都有其最适pH,在最适pH下催化反应的速率是它的最高值。最适pH的偏离,使得酶活性部位的基团离子化发生变化从而降低酶的活力。本研究考察在pH 4.0–10.0的范围内产酸克雷伯氏菌赖氨酸脱羧酶粗酶的酶活变化,结果如图3所示。由图3可知,酶的最适反应pH为5.5左右,酶活达到30 000 U左右,随着pH值上升,酶活力逐渐降低,当pH值达到7.5左右时,酶活几乎降低一半,当pH值偏酸性如pH值为4.0时,酶活也大幅下降。通过比对前人的文献[8],发现产酸克雷伯氏菌赖氨酸脱羧酶的最适pH和大肠杆菌的赖氨酸脱羧酶CadA相近,最适pH都为5.5,但与大肠杆菌的赖氨酸脱羧酶CadA在pH 8.0几乎没有酶活不同,产酸克雷伯氏菌赖氨酸脱羧酶在pH 8.0的酶活能达到最适pH值酶活的30%以上。
将粗酶蛋白在不同pH缓冲液 (pH 4.0–10.0) 中于37 ℃处理36 h后,测定其相对酶活,相对酶活为处理前后的酶活百分比,结果如图3所示。产酸克雷伯氏菌赖氨酸脱羧酶在pH 5.0–6.0范围内比较稳定,能保持80%以上的酶活力;pH 7.0以上,酶稳定性迅速下降。
2.3产酸克雷伯氏菌赖氨酸脱羧酶的最适反应温度和温度稳定性
温度从两方面影响酶促反应的速率,升高温度增加底物分子的热能,提高反应的速率,但是较高温度会增加构成酶本身蛋白质结构的分子热能,增加了多重弱的非共价键相互作用破裂的机会,这些相互作用维系着酶的三维结构,最终将导致酶的变性。酶的三维构象会改变活性部位的结构,从而改变酶的催化活性。本研究将pH值为5.5的赖氨酸脱羧酶溶液放置于20 ℃–80 ℃的环境中测定酶活,结果见图4,由图4可知该粗酶的最适反应温度为55 ℃,在该温度下酶活达到37 000 U。

图3 产酸克雷伯氏菌赖氨酸脱羧酶的最适反应pH和pH稳定性Fig. 3 The optimal pH and pH stability for LDC.
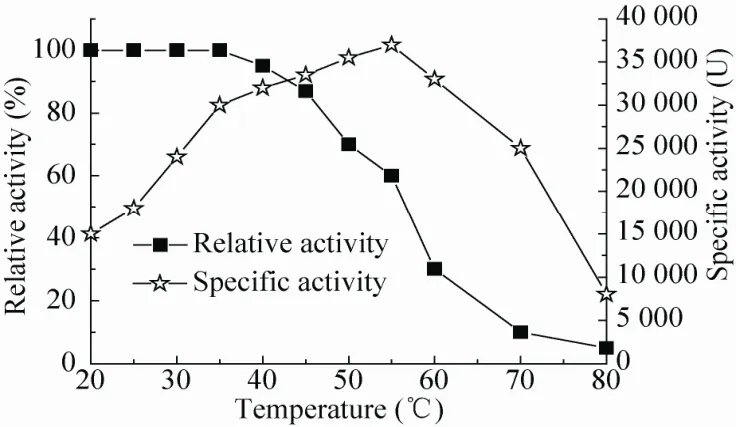
图4 产酸克雷伯氏菌赖氨酸脱羧酶的最适反应温度和温度稳定性Fig. 4 The optimal temperature and temperature stability for LDC.
温度稳定性试验结果如图4所示,产酸克雷伯氏菌赖氨酸脱羧酶粗酶蛋白在40 ℃以下较稳定,相对酶活没有变化,在40 ℃以上,酶稳定性逐渐下降,到达60 ℃时LDC相对活力下降接近80%。
2.4不同金属离子对产酸克雷伯氏菌赖氨酸脱羧酶活性的影响
金属离子经常可以作为酶促反应的辅因子,因此在酶促反应中经常添加某些金属离子来促进酶促反应的进行。赖氨酸脱羧酶反应需要5’-磷酸吡哆醛作为辅酶。反应体系中添加各种金属离子考察对酶活的影响,其中以不加离子时的酶作为对照,设其酶活为100%,结果表明K+、Na+、Co2+金属离子对酶促反应影响较小,Mg2+对酶活有促进作用,相对酶活为113,而Fe2+、Zn2+、Ca2+有一定的抑制作用。
3 讨论
产酸克雷伯氏菌赖氨酸脱羧酶基因可以在大肠杆菌中得到很好的表达。构建的重组菌LN18经过LB培养基培养过夜后用终浓度为0.5 mmol/L的IPTG诱导培养,发酵液酶活可以达到35 U/g发酵液,对发酵液的赖氨酸脱羧酶进行纯化,得到赖氨酸脱羧酶蛋白,酶活可以达到30 000 U。赖氨酸脱羧酶粗酶的最适反应pH值为5.5,最适反应温度为55 ℃。和大肠杆菌的赖氨酸脱羧酶CadA在pH 8.0几乎没有酶活不同,产酸克雷伯氏菌赖氨酸脱羧酶在pH 8.0左右仍然能保持在最优pH下酶活的30%以上。这可能使得在生物催化过程中可以减少pH缓冲盐的加入,有利于后续的产品纯化和提高产品的质量,对生物法合成戊二胺的产业化具备较好的应用价值。离子实验表明,K+、Na+、Co2+金属离子对酶促反应影响较小,Mg2+对酶有促进作用,Fe2+、Zn2+、Ca2+有一定的抑制作用。下一步研究将对该酶进行异源表达优化和分子定向进化,进一步提高酶的表达量和发掘酶在高pH下的表现性能,为生物法合成戊二胺的产业化奠定基础。
REFERENCES
[1] Gale EF, Epps HMR. The effect of the pH of the medium during growth on the enzymic activities of bacteria (Escherichia coli and Micrococcus lysodiekticus) and the biological significance of the changes produced. Biochem J, 1942, 36(7/9): 600–618.
[2] Sabo DL, Boeker EA, Byers B, et al. Purification and physical properties of inducible Escherichia coli lysine decarboxylase. Biochemistry, 1974, 13(4): 662–670.
[3] Meng SY, Bennett GN. Nucleotide sequence of the Escherichia coli cad operon: a system for neutralization of low extracellular pH. J Bacteriol, 1992, 174(8): 2659–2669.
[4] Fecker LF, Beier H, Berlin J. Cloning and characterization of a lysine decarboxylase gene from Hafnia alvei. Mol Gen Genet, 1986, 203(1): 177–184.
[5] Sabo DL, Boeker EA, Byers B, et al. Purification and physical properties of inducible Escherichia coli lysine decarboxylase. Biochemistry, 1974, 13(4): 662–670.
[6] Kikuchi Y, Kojima H, Tanaka T, et al. Characterization of a second lysine decarboxylase isolated from Escherichia coli. J Bacteriol, 1997, 179(14): 4486–4492.
[7] Lemonnier M, Lane D. Expression of the second lysine decarboxylase gene of Escherichia coli. Microbiology, 1998, 144(3): 751–760.
[8] Krithika G, Arunachalam J, Priyanka H, et al. The two forms of lysine decarboxylase; kinetics and effect of expression in relation to acid tolerance response in E. coli. J Exp Sci, 2010,1(12): 10–21.
[9] Mimitsuka T, Sawai H, Hatsu M, et al. Metabolic engineering of Corynebacterium glutamicum for cadaverine fermentation. Biosci Biotechnol Biochem, 2007, 71(9): 2130–2135.
[10] Qian Z G, Xia X X, Lee S Y. Metabolic engineering of Escherichia coli for the production of Cadaverine: a five carbon diamine. Biotechnol Bioeng, 2011, 108: 93–103.
[11] Kind S, Jeong WK, Schröder H, et al. Systems-wide metabolic pathway engineering in Corynebacterium glutamicum for bio-based production of diaminopentane. Metab Eng, 2010, 12: 341–351.
[12] Kind S, Jeong WK, Schröder H, et al. Identification and elimination of the competing N-acetyldiaminopentane pathway for improved production of diaminopentane by Corynebacterium glutamicum. Appl and Environ Microb, 2010, 76: 5175–5180.
[13] Kind S, Kreye S, Wittmann C. Metabolic engineering of cellular transport for overproduction of the platform chemical 1,5-diaminopentane in Corynebacterium glutamicum. Metab Eng, 2011, 13: 617–627.
[14] Kanjee U, Gutsche I, Alexopoulos E, et al. Linkage between the bacterial acid stress and stringent responses: the structure of the inducible lysine decarboxylase. EMBO J, 2011, 30(5): 931–944.
[15] Ozgul F, Ozgul Y. Formation of biogenic amines by gram-negative rods isolated from fresh, spoiled, VP-packed and MAP-packed herring (Clupea harengus). Eur Food Res Technol, 2005, 221(5): 575–581.
(本文责编郝丽芳)
Heterologous expression and characterization of Klebsiella oxytoca lysine decarboxylase
Naiqiang Li1,2, Lijun Yu2, and Yan Xu1
1 Key Laboratory of Industrial Biotechnology of Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China 2 Cathay Industrial Biotech Ltd., Shanghai 201203, China
Abstract:Cadaverine is a biogenic amine that has the potential to become an important platform chemical for the production of industrial polymers, such as polyamides and polyurethanes. We reported here a lysine decarboxylase from Klebsiella oxytoca. The lysine decarboxylase from Klebsiella oxytoca was cloned to Escherichia coli to get the strain LN18. The specific activity of the crude protein from LN18 reached 30 000 U. The molecular weight was about 80 kDa. The optimum temperature and pH of the crude protein were 55 ℃ and 5.5 respectively. The specific activity could keep over 30% at pH 8.0 compared the one at pH 5.5, much difference from Escherichia coli lysine decarboxylase CadA. Mg2+was positive to the specific activity, whereas Fe2+, Zn2+and Ca2+were negative.
Keywords:lysine decarboxylase, Klebsiella oxytoca, cadaverine, heterologous expression, pH stability
DOI:10.13345/j.cjb.150380
Corresponding authors: Naiqiang Li. Tel: +86-21-50801916; Fax: +86-21-50801386; E-mail: linaiqiang@cathaybiotech.com
