LC-MS对奥马珠单抗与其生物类似物CMAB007的分析与结构特征
2016-07-04徐珺张大鹏王皓郭怀祖
徐珺,张大鹏,王皓,郭怀祖
1 上海张江生物技术有限公司,上海 201203 2 抗体药物与靶向治疗国家重点实验室,上海 201203 3 复旦大学 生命科学学院,上海 200433
LC-MS对奥马珠单抗与其生物类似物CMAB007的分析与结构特征
徐珺1,3,张大鹏1,2,王皓1,2,郭怀祖1,2
1 上海张江生物技术有限公司,上海201203 2 抗体药物与靶向治疗国家重点实验室,上海201203 3 复旦大学 生命科学学院,上海200433
俆俆, 张大鹏, 王皓, 等. LC-MS对奥马珠单抗与其生物类似物CMAB007的分析与结构特征. 生物工程学报, 2016, 32(4): 497–506.
Xu J, Zhang DP, Wang H, et al. Structural characterization and analysis of Omalizumab and its biosimilar CMAB007 by LC-MS. Chin J Biotech, 2016, 32(4): 497–506.
摘要:哮喘是当今世界威胁公共健康的最主要的慢性肺部疾病,作为治疗中重度和难治性哮喘的特效药奥马珠单抗治疗费用相对昂贵,生物类似药CMAB007的研制可以降低治疗费用。本研究用质谱分析一种奥马珠单抗生物类似药CMAB007与原研药的一致性,分别从氨基酸分析、肽图、N/C端序列,还原质谱,寡糖含量,N 糖分析等层面对CMAB007和奥马珠单抗进行了系统的比对研究,为进一步临床研究打下基础。结果表明CMAB007和奥马珠单抗氨基酸序列一致,赖氨酸剪切也基本一致,带唾液酸修饰糖形和带核心岩藻糖形比例相近,高甘露糖形比例差异不大,CMAB007略低于奥马珠单抗。因此CMAB007满足生物类似药在结构比对上一致性的要求,有望成为国内首先上市的重组抗人IgE单克隆抗体药物。
关键词:单克隆抗体,奥马珠单抗,哮喘,液质联用,生物类似药
Received: July 24, 2015; Accepted: September 28, 2015
Supported b y: National Science and Technology Major Projects for "Major New Drugs Innovation and Development"(No. 20132X09401303), Shanghai Key Technologies R&D Program of Biological Medicine (No. 15431906100).
奥马珠单抗是由基因泰克、诺华和Tanox公司联合开发的一种人源化抗IgE单克隆抗体,可干扰IgE与肥大细胞和嗜酸粒细胞的FcεRI受体结合[1-2],从而抑制肥大细胞和嗜酸粒细胞的活化,减少组胺、蛋白水解酶、前列腺素、白细胞三烯、血小板激活因子、缓激肽等炎症介质的呈递[3],从而治疗特异性IgE水平增高引起的哮喘[4-5]。该药物2003年获美国FDA许可在上市,用于治疗中重度持续性哮喘。2014年增加了新适应症H1抗组胺剂治疗应答不充分的成人和青少年 (12岁及以上) 慢性自发性荨麻疹患者的辅助治疗[6]。奥马珠单抗2013年全球销量达到14.65亿美元。根据国外两项研究对其经济效益的评估来看,奥马珠单抗的主要缺点就是费用较高[7],其高昂的价格使这一药物在临床中的应用受到了一定的限制。为此,我们开发1种奥马珠单抗生物类似药CMAB007[8],以降低患者的经济负担[9]。
近年来,单克隆抗体药物凭借其高特异性、有效性和安全性,在临床和商业上取得了巨大的成功。2011年全球销售额前30的单克隆抗体药物总销售额达到1 100亿美元[10]。抗体药物通常具有5.6−150 kDa的分子量,不同的生产工艺在生产这些复杂的生物大分子时必然会产生不完全相同的产品[11];正是由于抗体药物的高分子质量和异质性,它的生产过程中的微小变化也会导致它的三维结构、酸性变异体比例和糖基化种类及比例等改变[12]。生物类似药,作为与原研药物在质量属性、安全性和有效性上具有相似性的药物,能加快药物的审批及在临床治疗中替代原研药,极大地促进了药物开发进程及降低患者的治疗费用[13-14]。因此,开发生物类似药,成为降低重组蛋白药物用药成本,提高药物可及性的必然选择,FDA、EMA、CFDA等各国药品监管部门都出台了生物类似药的指导原则。
欧盟认为生物仿制药是原研药物的一个拷贝,需要在物理化学性质、药物效果以及药物安全性上做充分的可比性研究,以证明他们的相似性[10]。CFDA发布了《生物类似药研发与评价技术指导原则 (试行)》 (以下简称《指导原则》),首次对明确了我国药品监管部门对生物类似药 (Biosimilar) 定义,注册分类,以及其药学、非临床,临床研究与评价中应遵循的基本原则。为我国的生物类似药开发指明了研究方向。
从欧盟批准的第一个生物类似药Remisima®(CT-P13)[15]的公众评估报告 (EPAR The Erasmus PhD Association Rotterdam) 以及我国的《指导原则》里对生物类似药对比的要求,生物类似药需要和原研药进行理化鉴定,包括采用适宜的分析方法确定一级结构和高级结构 (二级/三级/四级) 以及其他理化特性。还考虑翻译后的修饰可能存在差异,如氨基酸序列N端和C端的异质性、糖基化修饰 (包括糖链的结构和糖型等) 的异同。为此我们采用超高效液相色谱串联四级杆飞行时间质谱 (LC-ESI-Q-Tof) 技术,从不同水平对CMAB007及Omalizumab进行了生物类似性的研究。
1 材料与方法
1.1材料
乙酸 (HAc)、甲醇 (MeOH) 和乙腈(ACN):Fisher Scientific公司,MS级;碘化钠(NaI)、血纤肽(GFP):购自Sigma公司,纯度≥90%;甲酸(FA),Fluka公司,MS级;碳酸氢铵(NH4HCO3),国药化学试剂,分析纯;二硫苏糖醇 (DTT),购自Sigma公司;超纯水 (18.2 MΩ),取自Millipore公司Milli-Q系统;PVDF 0.45 um针头式滤器,购自Agela公司。重组N-糖苷酶(PNGaseF):上海张江生物技术有限公司;重组胰蛋白酶:上海张江生物技术有限公司;CMAB007:新型重组抗IgE人源化单克隆抗体,抗体药物与靶向治疗国家重点实验室研制;对照品:Omalizumab (Xolair®),诺华。
1.2仪器设备
AKTA Purifier纯化仪:GE公司;串联四级杆飞行时间质谱仪Xevo G2-S QTof:Waters 公司;数据分析软件,Biopharmalynx 1.3.3:Waters公司;超高效液相色谱层析系统,Acquity UPLC H-Class Bio 系统:Waters 公司;4 ℃冷藏冰箱及–20 ℃低温冰箱:SANYO公司;–80 ℃超低温冰箱:SANYO公司;超纯水,milli-Q系统:Millipore公司产品;冻干机:Christ公司;恒温金属浴:Thermo公司。
1.3方法
1.3.1单抗完整蛋白以及单抗经还原后的轻链、重链分析
用超纯水将两个样品稀释到1 mg/mL,离心后存于4 ℃冰箱待用。轻、重链样品使用1 mol/L DTT处理后待用。单抗完整蛋白及轻重链的反相分离在同一根MassPREP Desalting Column 2.1 mm×5 mm色谱柱上进行。流动相A 10%乙腈+1%甲酸水溶液,流动相B 50%甲醇+50%水溶液,流动相C乙腈,流动相D超纯水。流速为0.4 mL/min,柱温保持在80 ℃。质谱分析在电喷雾正离子模式下进行,脱溶剂气体温度和源温度分别设定为450 ℃和120 ℃。毛细管电压和锥孔电压分别设定为3 000 V和40 V。使用Biopharmalynx 1.3.3 (沃特世公司) 对完整蛋白及抗体轻重链的ESI质谱数据进行去卷积化处理。
1.3.2肽图分析
将两个蛋白样品分别用8 mol/L盐酸胍+5 mmol/L EDTA+0.5 mol/L Tris (pH 8.3) 的变性液混匀处理后用 1 mol/L DTT调节到浓度为60 mmol/L (37 ℃,孵育60 min)。然后加入2.9 mol/L碘乙酸钠,避光孵育45 min,加入1 mol/L 的DTT溶液终止反应。将上述样品脱盐到50 mmol/L NH4HCO3(使用G25脱盐柱),加入胰蛋白酶 (酶/底物的比例为:1∶50 (W/W)),振荡混匀后水浴 (37 ℃) 孵育4 h后使用甲酸终止反应,并调节样品pH 3。液质联用测定肽图。液相条件:0–60 min,流动相A 10%乙腈+1%甲酸水溶液,流动相B 50%甲醇+50%水溶液,流动相C乙腈,流动相D超纯水。流速为0.2 mL/min,柱温保持在45 ℃。质谱扫描范围(m/z):100–3 000,其余同“单抗轻、重链分析”。
1.3.3糖基化修饰分析
取两个蛋白样品0.5 mg,用30 kDa超滤管超滤浓缩,置换缓冲液,缓冲液为50 mmol/L 碳酸氢铵 (pH 8.0),浓缩后按蛋白:酶为50∶1加入PNGaseF,酶切体系为100 μL,37 ℃孵育24 h。使用HILIC固相萃取柱脱去溶液中的蛋白和盐,真空离心冻干。将冻干好的样品溶解在30%醋酸+70% DMSO反应体系中,并加入2-AB至终浓度50 mg/mL,氰基硼氢化钠至终浓度60 mg/mL,65 ℃避光干浴5 h。最后,再使用HILIC固相萃取柱除掉样品中多余的标记物,ACQUITY UPLC BEH300 GLycan 1.7 μm 2.1 mm×150 mm柱后质谱分析。液相条件:0–40 min,流动相B 30 mmol/L 甲酸铵,pH 4.5–5.0,流动相C乙腈。流速为0.4 mL/min,柱温保持在60 ℃。质谱扫描范围(m/z):100–3 000,其余同“单抗轻、重链分析”。
2 结果与分析
2.1单抗完整蛋白质谱分析

图1 奥马珠单抗 (上) 和CMAB007 (下) 完整蛋白去卷积处理图谱Fig. 1 Deconvoluted mass spectrum of intact Omalizumab (up) and CMAB007 (down).
抗体分子的结构是抗体药物重要属性,而氨基酸序列是抗体结构的基础,《指导原则》中也要求生物类似药和原研药进行头对头的对比分析[16]。我们选用本单位制备的重组抗IgE单克隆抗体 (CMAB007) 以及市面上购买的奥马珠单抗进行对比分析,进行去卷积处理后的质谱原图如下 (图1),奥马珠单抗和CMAB007单抗四个高丰度糖型异质体对比下来差别都在2−3 Da之间,两者基本没有差别,在质谱检测的误差范围内,说明我们的抗体和原研抗体具有相同的氨基酸序列理论分子量,糖型分布的丰度差别主要是由于糖的修饰比例有些许差别。
2.2单抗经DTT还原后的轻链、重链分析
单抗经过DTT还原后,打开二硫键,解链为轻链和重链片段,再经过质谱分析得到轻重链去卷积质谱图,图2是两个抗体轻链的质谱对比图,可以看出CMAB007与奥马珠单抗是完全一致的。
两个抗体重链的质谱图上可以看出两个主峰质量数分别为50 694 Da和50 856 Da,相差162 Da正好符合不同糖型间由于半乳糖残基的差异造成的质量数差异,也符合G0F和G1F糖型修饰的重链分子量。再加上51 018 Da这个峰的质量数也符合G2F的重链分子量,这里两个单抗的差异很小,差别也只是在糖型修饰所占比例上。
使用Biopharmalynx 1.3.3软件分析数据发现,两种单抗在转录后修饰的过程中都发生了比较完全的C端赖氨酸切除,根据文献报道,末端赖氨酸的截除并不影响抗原和抗体的结合、FC片段介导的功能、抗体的半衰期以及其他生物学作用[17],所以这个差异不会引起抗体功能的改变。
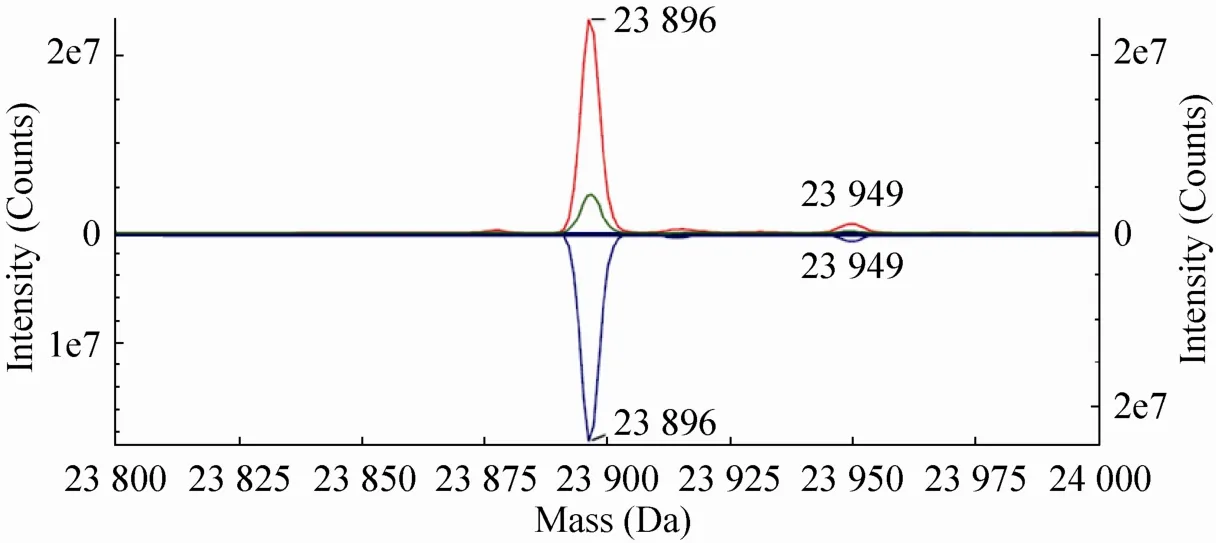
图2 奥马珠单抗 (上) 和CMAB007 (下) 轻链去卷积处理图谱Fig. 2 Deconvoluted mass spectrum of the light chain of Omalizumab (up) and CMAB007 (down).
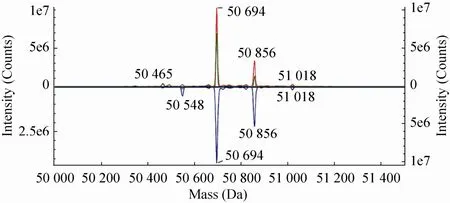
图3 奥马珠单抗 (上) 和CMAB007 (下) 重链去卷积处理图谱Fig. 3 Deconvoluted mass spectrum of the heavy chain of Omalizumab (up) and CMAB007 (down).
2.3肽图分析
这里我们用胰蛋白酶对两个单抗进行酶切,反相C18柱进行极性差异洗脱分离,液质联用技术同时检测一级和二级信息,再使用Biopharmalynx 1.3.3软件进行分析。CMAB单抗和奥马珠单抗的质量肽图谱总离子流图见图4和图5,两个单抗的肽图峰形及出峰时间相似。
1) 质量肽图覆盖率
我们把每个肽段和理论酶切肽段进行对比,得到能在质谱中找到理论分子量的肽段覆盖率,CMAB007的质谱肽图覆盖率轻、重链分别是100%和100%,奥马珠单抗轻、重链的覆盖率分别是100%和99%。两个单抗覆盖率差别不大,而且覆盖较全。
2) N-端氨基酸序列分析
轻链N-端第一个肽段理论序列是DIQLTQ SPSSLSASVGDR,共18个氨基酸,CMAB007单抗和奥马珠单抗轻链的N-端氨基酸序列的质量数分别是1 860.936 Da和1 860.932 Da与理论质量数1 860.930 Da一致。
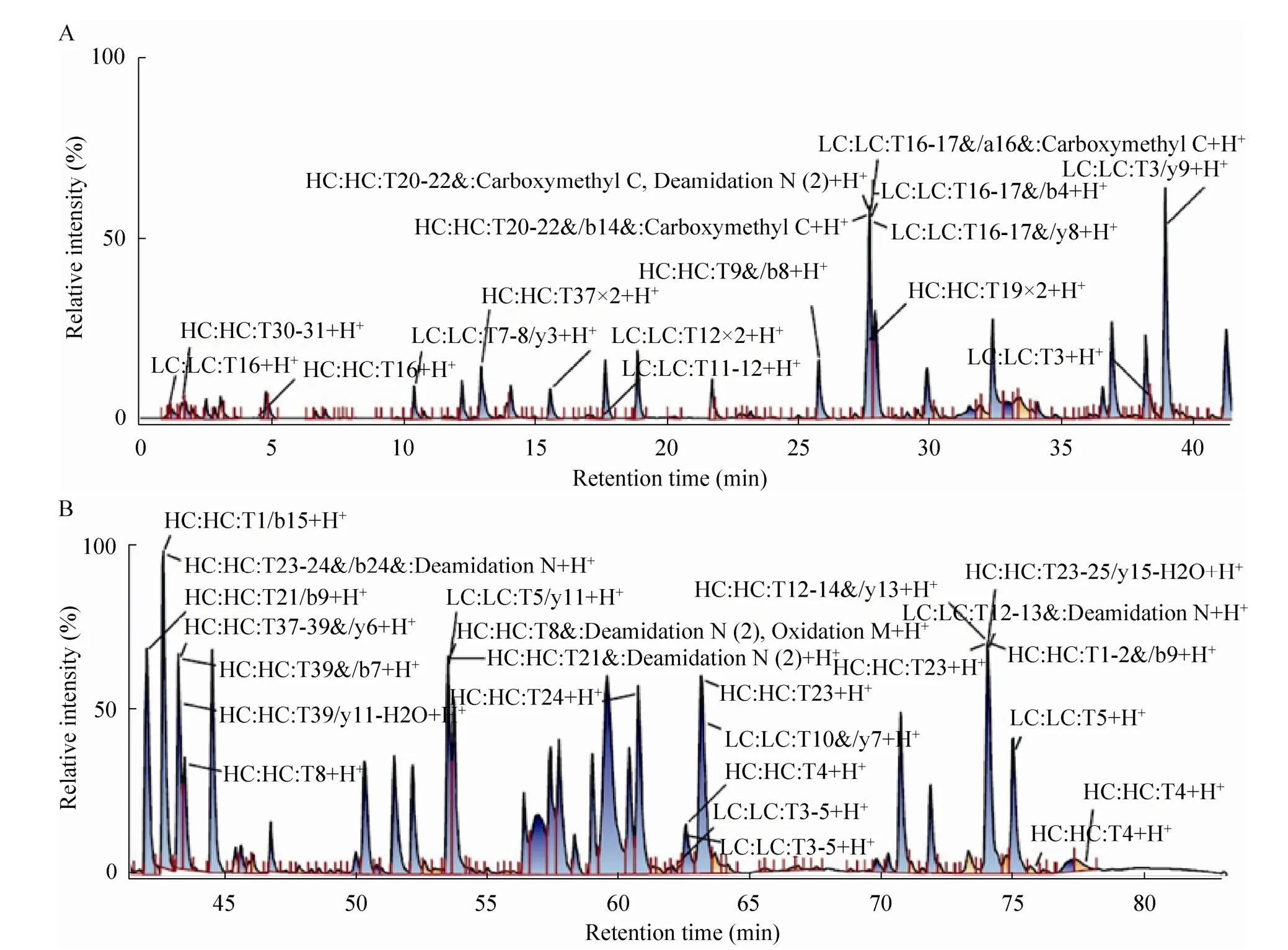
图4 CMAB007质量肽图谱TIC图Fig. 4 Total ion chromatogram of CMAB007 peptide mapping.

图5 奥马珠单抗质量肽图谱TIC图Fig. 5 Total ion chromatogram of Omalizumab peptide mapping.
重链N-端第一个肽段理论序列是EVQLVE SGGGLVQPGGSLR,共19个氨基酸,CMAB007单抗和奥马珠单抗重链的N-端氨基酸序列的质量数分别是1 882.006 Da和1 882.007 Da与理论质量数1 882.003 Da一致。
3) C-端赖氨酸修饰分析
重链C-端的赖氨酸在抗体表达的翻译后修饰阶段会被羧肽酶部分切除,这里我们根据质谱图谱对此翻译后修饰的比例进行了粗略估算,结果显示CMAB007单抗的赖氨酸剪切比例是93.3%,而奥马珠单抗的比例是93.5%。此结果说明两种单抗在翻译后修饰的过程中均发生了较为完全的赖氨酸剪切,而且两者的剪切比例也比较类似。
2.4游离寡糖分析
单克隆抗体是高度复杂的糖蛋白,由各种多肽结构域组成,其中一些存在糖基化。这些结构域组织在一起形成两种类型的功能区-Fab 和Fc,它们在治疗中发挥着各自不同的功能性作用,而其中的聚糖则可以调整或者协调这些活性的强度[18];单克隆抗体的各种作用模式包括对靶物质的中和作用,补体依赖的细胞毒作用 (CDC) 以及抗体依赖的细胞介导的细胞毒作用 (ADCC)。ADCC和CDC作用机制在治疗肿瘤的抗体药物研发过程中有着非常重要的意义[19],但由于正常细胞也表达靶标抗原,因此这两种效应对正常组织细胞也有一定伤害力,往往引起体内的不良反应。特别是CDC作用目前已被证实与某些不良反应相关。
目前对抗体糖型研究的结果发现通过增加半乳糖基化水平 (Galactosylation),可显著提高IgG1型单抗的CDC活性;通过降低岩藻糖基化水平 (Fucosylation),则可大大增加IgG1型单抗的ADCC活性。此外,含更多高甘露糖型(Man5、Man6、Man7) 的IgG1型抗体在体内的清除速度增加。因此采用抗体糖基化工程技术,在减少半乳糖基化水平的同时增加岩藻糖基化水平 (即提高G0F的总比例),将有助于降低ADCC和CDC效应,从而减少体内的不良反应;同时减少高甘露糖含量,从而减缓抗体的体内清除速率,延长抗体的半衰期[20]。
从图6和图7 CMAB007单抗和奥马珠单抗的主要糖形2-AB荧光色谱图中可以看出,两种单抗的糖形分布基本一致,均符合CHO细胞表达单克隆抗体的糖形分布特征:以G0F、G1F糖形为主,有部分去岩藻糖的糖形,以及少量末端唾液酸化的糖形和高甘露糖糖形。CMAB007单抗和奥马珠单抗带核心岩藻糖糖形的比例分别为约81.09%和约89.99%,带唾液酸修饰糖形的比例分别为约0.38%和约0.60%,这些比例都基本一致。CMAB007和奥马珠单抗的高甘露糖形比例分别为约2.92%和约4.23%(高甘露糖形的比例我们只统计积分含量在0.1%以上的Man5和Man6)。这里CMAB007更少的高甘露糖形比例有可能延长抗体的半衰期。

图6 CMAB007游离寡糖荧光检测FLR积分图 (积分含量在0.1%以上)Fig. 6 Fluorescence chromatogram of released free glycans from CMAB007 (content above 0.1%).

图7 奥马珠单抗游离寡糖荧光检测FLR积分图 (积分含量在0.1%以上)Fig. 7 Fluorescence chromatogram of released free glycans from Omalizumab (content above 0.1%).
3 结论
在本研究中,我们通过超高压液相色谱串联四级杆飞行时间质谱 (LC-ESI-Q-Tof) 技术从不同水平对重组抗IgE人源化单抗和奥马珠单抗的结构进行了详细的分析鉴定,在各个水平上对两个单抗进行了对比分析。在完整蛋白水平的质谱数据上看,CMAB007和原研单抗糖形分布基本一致。还原状态下,轻链部分没有N-端糖基化,重链部分不同的糖修饰也基本相同。不管是从两个抗体的质量肽图覆盖率还是C-端赖氨酸切除比例来看,两种单抗的差异都很小。在游离寡糖的质谱分析中,CMAB007高甘露糖形比例较低,其他糖形比例则差异不大。综合所有的表征分析指标来看,单抗CMAB007具有与Omalizumab一致的一级序列,糖基化方式与程度与奥马珠类似,体内实验与临床研究均证实了其高度类似性 (数据未列出),质量与活性也与原研药基本类似。有望成为国内最先上市的抗IgE生物类似药。
REFERENCES
[1] Buhl R. Omalizumab (Xolair®) improves quality of life in adult patients with allergic asthma: a review. Resp Med, 2003, 97(2): 123–129.
[2] Gould HJ, Sutton BJ. IgE in allergy and asthma today. Nat Rev Immunol, 2008, 8(3): 205–217.
[3] Chan AC, Carter PJ. Therapeutic antibodies for autoimmunity and inflammation. Nat Rev Immunol, 2010, 10(5): 301–316.
[4] Simons F. Anaphylaxis. J Allergy Clin Immunol, 2008, 121(2): S402–S407.
[5] Catley MC, Coote J, Bari M, et al. Monoclonal antibodies for the treatment of asthma. Pharmacol Therapeut, 2011, 132(3): 333–351.
[6] Maurer M, Rosén K, Hsieh H J, et al. Omalizumabfor the treatment of chronic idiopathic or spontaneous urticaria. N Engl J Med, 2013, 368(10): 924–935.
[7] Lai TW, Wang SB, Xu ZW, et al. Long-term efficacy and safety of omalizumab in patients with persistent uncontrolled allergic asthma: a systematic review and meta-analysis. Sci Rep, 2015, 5: 8191.
[8] Qian WZ, Zhang XM, Li BH, et al. Development and characterization of a novel anti-IgE monoclonal antibody. Biochem Biophys Res Commun, 2010, 395(4): 547–552.
[9] Reichert JM, Beck A, Iyer H. European Medicines Agency workshop on biosimilar monoclonal antibodies: July 2, 2009, London, UK. mAbs, 2009, 1(5): 394–416.
[10] Beck A, Diemer H, Ayoub D, et al. Analytical characterization of biosimilar antibodies and Fc-fusion proteins. TrAC-Trends Anal Chem, 2013, 48: 81–95.
[11] Fekete S, Gassner AL, Rudaz S, et al. Analytical strategies for the characterization of therapeutic monoclonal antibodies. TrAC-Trends Anal Chem , 2013, 42: 74–83.
[12] Xie XG, Wu J. Study on status and countermeasures about biosimilars in China. China Biotechnol, 2012, 32(3): 136–142 (in Chinese).解小刚, 吴晶. 我国生物仿制药发展现状与策略研究. 中国生物工程杂志, 2012, 32(3): 136–142.
[13] McCamish M, Woollett G. Worldwide experience with biosimilar development. mAbs, 2011, 3(2): 209–217.
[14] Hirsch BR, Lyman GH. Biosimilars: a cure to the U.S. health care cost conundrum? Blood Rev, 2014, 28(6): 263–268.
[15] Jung SK, Lee KH, Jeon JW, et al. Physicochemical characterization of Remsima®. mAbs, 2014, 6(5): 1163–1177.
[16] Wei W, Luo JH, Bai Y. General considerations of quality study for biosimilar products containing recombinant monoclonal antibodies. Chin Pharm J, 2014, 49(18): 1670–1674 (in Chinese).韦薇, 罗建辉, 白玉. 重组单克隆抗体生物类似药质量研究的一般考虑. 中国药学杂志, 2014, 49(18): 1670–1674.
[17] Antes B, Amon S, Rizzi A, et al. Analysis of lysine clipping of a humanized Lewis-Y specific IgG antibody and its relation to Fc-mediated effector function. J Chromatogr B Analyt Technol Biomed Life Sci, 2007, 852(1/2): 250–256.
[18] Wagner-Rousset E, Bednarczyk A, Bussat MC, et al. The way forward, enhanced characterization of therapeutic antibody glycosylation: comparison of three level mass spectrometry-based strategies. J Chromatogr B Analyt Technol Biomed Life Sci, 2008, 872(1/2): 23–37.
[19] Kuribayashi R, Hashii N, Harazono A, et al. Rapid evaluation for heterogeneities in monoclonal antibodies by liquid chromatography/mass spectrometry with a column-switching system. J Pharm Biomed Anal, 2012, 67–68: 1–9.
[20] Goetze AM, Liu YD, Zhang ZQ, et al. High-mannose glycans on the Fc region of therapeutic IgG antibodies increase serum clearance in humans. Glycobiology, 2011, 21(7): 949–959.
(本文责编 陈宏宇)
生物技术与方法
Structural characterization and analysis of Omalizumab and its biosimilar CMAB007 by LC-MS
Jun Xu1,3, Dapeng Zhang1,2, Hao Wang1,2, and Huaizu Guo1,2
1 Shanghai Zhangjiang Biotechnology Co., Ltd., Shanghai 201203, China 2 State Key Laboratory of Antibody Medicine and Targeted Therapy, Shanghai 201203, China 3 School of Life Sciences, Fudan University, Shanghai 200433, China
Abstract:We compared the similarity of Omalizumab (Xolair; a humanized anti-immunoglobulin E monoclonal antibody) and it’s biosimilar CMAB007. An in depth characterization of a candidate biosimilar was carried out using a systematic approach, the approach provides a set of routine tools that combine accurate intact mass measurement, peptide mapping, and released glycan profiling. CMAB007 and Omalizumab had the same primary structure and exhibited almost the same content of C-terminal lysine variants. The types of detected free oligosaccharides were very similar, such as sialylation, fucosylation and high mannose types. CMAB007 could be considered as a highly similar molecular to Omalizumab and expected to be the first humanized anti-immunoglobulin E monoclonal antibody drug in China.
Keywords:monoclonal antibody, Omalizumab, asthma, liquid chromatography mass spectrometry, biosimilar
DOI:10.13345/j.cjb.150339
Corresponding author:Huaizu Guo. Tel: +86-21-60129255; Fax: +86-21-60129270; E-mail: guohuaizu@163.com
