家蚕V型ATP酶B亚基的克隆及表达特征
2016-07-04陈慧芳王鑫谢康李懿赵萍
陈慧芳,王鑫,谢康,李懿,赵萍
西南大学 家蚕基因组生物学国家重点实验室,重庆 400716
家蚕V型ATP酶B亚基的克隆及表达特征
陈慧芳,王鑫,谢康,李懿,赵萍
西南大学 家蚕基因组生物学国家重点实验室,重庆400716
陈慧芳, 王鑫, 谢康, 等. 家蚕V型ATP酶B亚基的克隆及表达特征. 生物工程学报, 2016, 32(4): 487–496.
Chen HF, Wang X, Xie K, et al. Gene cloning and expression characteristics of vacuolar-type ATPase subunit B in Bombyx mori. Chin J Biotech, 2016, 32(4): 487–496.
摘要:V型ATP酶 (Vacuolar-type ATPase) 是一种定位于细胞膜和细胞器膜上的氢离子转运酶。它利用ATP水解的能量将氢离子转运到液泡、囊泡或者胞外,从而维持细胞内正常的酸碱环境。V型ATP酶B亚基(V-ATPase B) 作为ATP的催化位点,也有着非常重要的作用。为了探讨家蚕V-ATPase B (BmV-ATPase B) 的功能,首先从家蚕五龄幼虫的中肠cDNA中克隆了BmV-ATPase B基因并构建原核表达载体进行原核表达,获得了重组蛋白,经质谱鉴定正确后,通过镍柱亲和层析的方法纯化了该蛋白并制备了多克隆抗体;最后分析了该蛋白在家蚕丝腺中的表达特征并利用免疫荧光对其在丝腺中的表达位置进行了定位。结果显示BmV-ATPase B基因序列全长1 473 bp,预测蛋白分子量55 kDa,预测等电点5.3。通过Western blotting对家蚕5龄第3天和上蔟第1天幼虫丝腺的不同区段进行BmV-ATPase B蛋白的表达特征分析,发现在两个时期该蛋白均在前部丝腺高量表达,而在中部丝腺和后部丝腺表达量相对较低。进一步对两个时期丝腺的不同区段进行免疫荧光定位,发现该蛋白在两个时期的前部丝腺、中部丝腺和后部丝腺均定位于细胞层。利用激光共聚焦显微镜对该蛋白进行进一步的定位,发现该蛋白主要在丝腺的细胞膜表达。研究结果明确了该蛋白在丝腺中的表达模式,为深入研究该蛋白在蚕丝纤维形成中的作用奠定了基础。
关键词:家蚕,V型ATP酶B亚基,基因克隆,原核表达,Western blotting,免疫荧光定位
Received: August 11, 2015; Accepted: January 19, 2016
Supported by: National Natural Science Foundation of China (No. 31472154).
国家自然科学基金 (No. 31472154) 资助。
蚕丝是一种具有优良力学性能和稳定的生物包容性的生物材料,因此受到许多人的关注。蚕丝纤维由丝胶和丝素两部分组成,其中丝素是蚕丝纤维的重要组分,很大程度上决定了蚕丝纤维的性能。在丝纤维形成的过程中,丝素蛋白由溶胶状逐渐转变为凝胶状,这种转化过程与家蚕丝素蛋白pH值的变化密切相关[1-4]。丝腺是蚕丝纤维的形成场所,所以,丝腺腔内pH值的变化对蚕丝纤维的形成有重要影响。2014年王鑫等通过对家蚕丝腺进行溴酚蓝染色证明了从后部丝腺到前部丝腺是一个逐步酸化的过程[5],这个酸化的过程必然与丝腺细胞中氢离子转运蛋白相关。2013年,Yi等对家蚕前部丝腺进行了蛋白质组学分析,发现V型ATP酶在前部丝腺大量表达[6],之后Sylvie Breton等证明了V型ATP酶与细胞的酸化过程密切相关[7]。所以目前的观点认为,家蚕前部丝腺的酸性环境是由V型ATP酶创造并维持的。
V型ATP酶将氢离子转运到囊泡或者胞外,从而维持细胞内正常的酸碱环境[8],它利用ATP水解的能量转化为电化学势能进而介导氢离子的跨膜转运[9]。V型ATP酶由V0和V1两个亚单位组成,在真核生物中,V1亚单位包括8种不同的亚基 (A-H),V0亚单位包括a、c、c’、c’’、d、e亚基[9-11]。其中V0亚单位主要为氢离子提供通道[7],也有研究发现V0亚单位作为一个胞内pH传感器,控制胞吐和突触传递[10]。此外,V0亚单位中的a亚基具有增强果蝇神经元降解的能力[12]。V1亚单位主要负责分解ATP,其中B亚基是ATP的结合位点,为逆浓度梯度转运氢离子提供能量[7]。近来有研究报道在感染了BmNPV病毒的家蚕细胞中过表达V型ATP酶C亚基,可以显著抑制BmNPV病毒的增殖[8]。此外,家蚕V型ATP酶A亚基和B亚基(BmV-ATPase B) 可能参与BmNPV病毒与细胞膜的融合及核壳体的释放[13]。对新鲜桑叶和人工饲料饲养的家蚕进行蛋白质组学分析比较,发现在人工饲料饲养的家蚕幼虫脂肪体中有两种酶上调表达,其中一种被鉴定为BmV-ATPase B,其主要参与能量代谢[14]。由此可见V型ATP酶在家蚕抵御病毒感染及能量代谢的过程中有不可或缺的作用,然而V型ATP酶对丝纤维形成的影响尚不清楚。
基于此,为了便于进一步探究V型ATP酶对家蚕丝纤维形成的影响,本研究以BmV-ATPase B基因为靶标,对其进行克隆,构建原核表达载体以表达重组蛋白并制备多克隆抗体。通过Western blotting和免疫荧光定位对该蛋白在家蚕不同时期丝腺中表达特征进行分析,为研究该蛋白在蚕丝纤维合成中发挥的功能奠定了基础。
1 材料与方法
1.1主要材料与试剂
家蚕品种大造由西南大学家蚕基因资源库提供。待供试家蚕饲养至幼虫期5龄第3天和上蔟第1天,分别于冰冻条件下取前部丝腺、中部丝腺和后部丝腺,并迅速液氮冷冻,提取蛋白后置于–80 ℃冰箱保存。
DNA marker、限制性内切酶BamHⅠ、Hind Ⅲ、NdeⅠ、NotⅠ,pMD19-T-simple vector购自TaKaRa公司;pEASYTM-Blunt vector、低分子量蛋白质marker、预染蛋白质marker、HiFi Taq DNA聚合酶、宿主菌大肠杆菌Trans1-T1 和Trasetta (DE3) 购自北京全式金公司;T4 DNA连接酶购自NEB公司;异丙基硫代-β-D-半乳糖苷 (IPTG) 及抗生素购自Sigma公司;PCR产物及酶切产物回收试剂盒购自Promega公司;樱花冷冻切片包埋剂购自北京中杉金桥公司;p28表达载体 (pET28a改进) 由家蚕基因组生物学国家重点实验室保存;引物合成及测序由上海生工生物工程公司完成;α-tubulin是抗体购自碧云天公司的小鼠单克隆抗体,产品编号AT819;DAPI染色液购自碧云天公司,产品编号C1005;Cy3标记山羊抗兔抗体购自碧云天公司,产品编号ws/A0516。
1.2BmV-ATPase B基因的克隆
基于NCBI数据库CDS全长序列,通过Primer 5.0软件设计BmV-ATPase B (GenBank登录号:NM_0011098358.1) 的引物,上下游引物分别命名为BmV-ATPase B-F、BmV-ATPase B-R,引物序列如表1所示。以家蚕5龄第3天幼虫中肠的cDNA为模板,反应体系为50 Μl (10 × 缓冲液 5 μL,dNTPs 5 μL,Hifi Taq 1 μL,Bm-VATPase B-F 1 μL,BmV-ATPase B-R 1 μL,模板1 μL,ddH2O 36 μL),进行PCR扩增。反应条件为:95 ℃预变性5 min;95 ℃变性40 s,55 ℃退火40 s,72 ℃延伸30 s,30个循环;72 ℃再延伸10 min,12 ℃保存。PCR产物经1%琼脂糖凝胶电泳进行分离、切胶回收纯化后,与pEASYTM-Blunt载体连接,转化到大肠杆菌Trans1-T1菌株中,筛选阳性克隆。将测序正确的菌液扩大培养,提取质粒,命名为pEASYTM-Blunt-BmV-ATPase B。–20 ℃保存质粒备用。
1.3重组表达质粒的构建
通过Primer 5.0软件根据测序正确的全长CDS序列设计引物,并在引物两端分别添加酶切位点。上下游引物分别命名为BmV-ATPase B-Fy、BmV-ATPase B-Ry,序列如表1所示。以pEASYTM-Blunt-BmV-ATPase B质粒为模板进行PCR扩增,反应条件如上。PCR产物经1%琼脂糖凝胶电泳进行分离、切胶回收纯化,将p28载体质粒与BmV-ATPase B的PCR胶回收产物通过NdeⅠ、NotⅠ双酶切,进行切胶回收纯化,连接后转化,构建p28-BmV-ATPase B重组表达质粒,对重组质粒进行NdeⅠ、NotⅠ双酶切验证及测序验证。
1.4BmV-ATPase B的原核表达、鉴定与纯化
1.4.1BmV-ATPase B的原核表达
将测序验证正确的p28-BmV-ATPase B表达载体转化到大肠杆菌Transetta (DE3) 表达菌株中,筛选阳性克隆并接种到5 mL含卡那霉素、氯霉素的2×YT液体培养基中培养。当菌液OD600值到达0.6时,分别用24 mg/mL的IPTG 在16 ℃诱导20 h、37 ℃诱导4 h,以p28空载体转化的菌株作为阴性对照。收集菌体并用超声波破碎仪破碎。破碎后的菌液于4 ℃下10 000 r/min离心10 min,收集上清,再用适量的结合缓冲液 (50 mmol/L Tris-HCl,pH 7.5,150 mmol/L NaCl,0.2% TritonX-100) 悬浮沉淀。用SDS-PAGE分析目的蛋白质的表达情况。
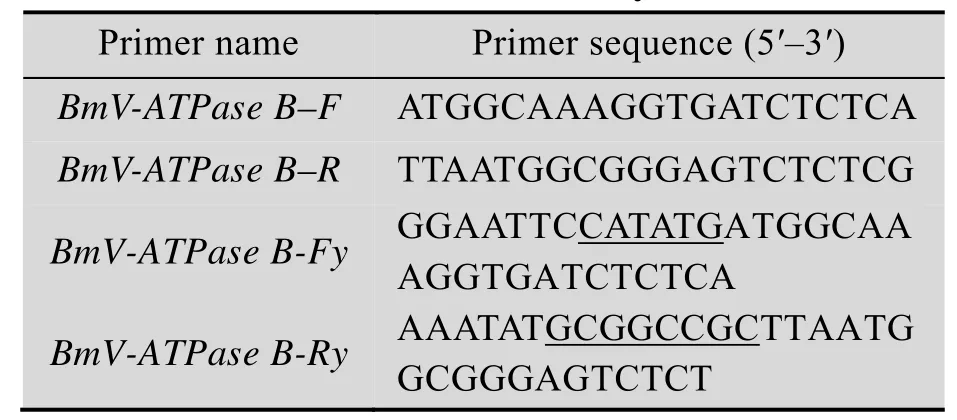
表1 本研究所用引物Table 1 Primers used in this study
1.4.2质谱鉴定
SDS-PAGE检测后的蛋白凝胶通过考马斯亮蓝染色后挖取目的蛋白点,将凝胶切碎后经过浸洗及冷冻干燥,提取蛋白上清液并保存;将收集保存的上清液通过真空冷冻干燥仪抽干,用ZipTipC18脱盐。分析前,将抽干的样品溶解在含有50%乙腈、0.1% TFA的溶液中,采用MALDI-TOF/TOF质谱鉴定方法对BmV-ATPaseB蛋白进行肽段图谱鉴定。
1.4.3BmV-ATPase B蛋白的纯化
以BmV-ATPase B蛋白表达量最高的培养条件即37 ℃诱导4 h条件下进行目的蛋白的大量诱导表达。收集菌液后用pH 8.0的结合缓冲液重悬沉淀、破碎,收集上清与沉淀,SDS-PAGE电泳检测目的蛋白的表达情况。确定蛋白在沉淀中以包涵体的形式表达。将提取的包涵体蛋白用8 mol/L尿素溶液溶解过夜。4 ℃、12 000 r/min离心15 min后取上清。采用镍柱亲和层析方法纯化目的蛋白质,分别用20 mmol/L、50 mmol/L、100 mmol/L、200 mmol/L、500 mmol/L、1 mol/L咪唑梯度洗脱,SDS-PAGE检测纯化后的效果。检测后发现1 mol/L咪唑的洗脱液中蛋白较纯,但蛋白总量不足,为了获得大量较纯蛋白,进一步采取切胶和电洗脱的方法进行纯化,将100 mmol/L、200 mmol/L、500 mmol/L和1 mol/L咪唑的洗脱液混合后超滤,蛋白质样品经SDS-PAGE电泳后,将含目的条带的凝胶切碎后置于透析袋中,用水平电泳槽正向洗脱8 h,再反向洗脱30 min。收集洗脱液,在pH 7.4的PBS (137 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/L Na2HPO4,2 mmol/L KH2PO4) 缓冲液中透析2 d,收集透析后溶液。分别用SDS-PAGE电泳和Bradford定量法检测蛋白质的纯度及浓度。
1.5多克隆抗体制备及Western blotting
将纯化后的目的蛋白质样品送南京钟鼎生物有限公司制备多克隆抗体。通过Western blotting对家蚕5龄第3天及上蔟第1天丝腺不同区段BmV-ATPase B蛋白的表达情况进行检测。Western blotting采用半干法转印,即SDS-PAGE结束后,在电流1.3 A,电压25 V条件下转膜15 min;用含有5%脱脂奶粉的TBST (150 mmol/L NaCl,20 mmol/L Tris-HCl,pH 8.0,0.05% Tween 20) 将膜封闭1 h;用BmV-ATPase B多克隆兔抗体按照1∶20 000比例的稀释液孵育2 h,以α-tubulin抗体作为内参;TBST清洗膜后以HRP标记的羊抗兔IgG按照1∶40 000稀释孵育2 h;再用TBST缓冲液清洗膜,最后用ECL显色液显色,置于CLINX化学曝光仪观察扫描显色结果。
1.6免疫荧光定位
取5龄第3天和上蔟第1天家蚕幼虫的丝腺分段包埋冷冻,冷冻切片后用PBST (137 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/L Na2HPO4,2 mmol/L KH2PO4,0.3% TritonX-100) 清洗10 min,再利用10%羊血清室温封闭2 h;接着使用1∶1 000比例稀释的一抗 (BmV-ATPase B抗体) 室温孵育2 h;然后用PBST清洗3次,每次10 min;之后使用1∶1 000比例稀释的二抗 (羊抗兔Cy3) 室温孵育2 h;同样使用PBST清洗3次,每次10 min;接着用10 mmol/L的PBS将DAPI染色液稀释3倍,染色20 min;随后使用PBST清洗10 min;滴抗荧光淬灭剂封片;最后利用荧光显微镜和激光共聚焦显微镜进行拍照与分析。
2 结果与分析
2.1基因的克隆及重组质粒的构建
从中肠的cDNA中扩增得到BmV-ATPase B的基因片段,其大小为1 473 bp (图1A),与理论分子量相符。将目的片段进行TA克隆,获得含有目的片段的重组质粒。以质粒为模板进行亚克隆。对阳性克隆质粒DNA 进行NdeⅠ、NotⅠ酶切鉴定,其产物包含载体和目的基因片段 (图1B),进一步测序验证表明成功构建了原核表达载体p28-BmV-ATPase B。
2.2蛋白的原核表达、质谱鉴定与纯化
将测序验证正确的p28-BmV-ATPase B表达载体转入Transetta (DE3) 表达菌株中。在不同条件下诱导该蛋白表达,SDS-PAGE检测发现蛋白在37 ℃诱导的条件下以包涵体的形式表达,(图2A泳道3),上清液中没有明显的目的条带,并且重组蛋白分子质量大小约55 kDa,也与理论分子量相一致。16 ℃诱导的条件下由于诱导时间和温度的差异未见明显目的条带 (图2A泳道7)。将原核表达获得的重组蛋白经过质谱鉴定,发现共有16段肽段与理论序列相匹配,其中有代表性的6段序列与所处的位置如表2所示。质谱鉴定结果与理论蛋白序列相符,表明原核表达得到的蛋白为BmV-ATPaseB蛋白。
然后,采用37 ℃大量诱导重组蛋白。将获得的包涵体蛋白用8 mol/L尿素溶液溶解,经镍柱亲和层析纯化,SDS-PAGE检测发现在1 mol/L咪唑洗脱时蛋白较纯,但纯化的目的蛋白质含量较低。为了获得大量高纯度重组蛋白以制备抗体,将100 mmol/L、200 mmol/L、500 mmol/L 和1 mol/L咪唑的洗脱液混合后进行超滤并切胶回收。电洗脱后,SDS-PAGE检测透析蛋白,发现得到了较纯蛋白 (图2B)。使用Bradford方法测定纯化的重组蛋白质量浓度为0.94 mg/mL,总量为20 mg,达到了抗体制备的要求。将获得的重组蛋白免疫兔子,得到了效价较高、特异性较好的多克隆抗体。2.3Western blotting检测

图1 BmV-ATPase B琼脂糖电泳检测Fig. 1 Agarose electrophoresis of BmV-ATPase B. (A) Electrophoresis of the fragment of BmV-ATPase B gene. M: DNA marker; 1: BmV-ATPase B. (B) Double digestion of recombinant plasmid p28-BmV-ATPase B. M: DNA marker; 1: recombinant plasmid p28-BmV-ATPase B.

图2 重组蛋白的诱导表达与纯化检测Fig. 2 SDS-PAGE analysis of the expression and the purification of recombinant proteins. (A) SDS-PAGE analysis of the expression of p28-BmV-ATPase B. M: protein molecular weight standard; 1–4: induced under 37 °C; 5–8: induced under16 °C; 1, 5: supernatant of p28-BmV-ATPase B; 2, 6: supernatant of p28; 3, 7: precipitation of p28-BmV-ATPase B; 4, 8: precipitation at of p28. (B) SDS-PAGE of the purified poteins. M: protein molecular weight standard; 1: recombinant-protein purified by gel recovery and electroelution.
利用制备的多克隆抗体,对5龄第3天及上蔟第1天前部、中部和后部丝腺进行Western blotting检测 (图3),图中只在目的蛋白相对分子量大小附近有条带,说明多克隆抗体特异性较高。结果显示无论是在5龄第3天还是上蔟第1天,该蛋白在前部丝腺的表达量最高,在中部丝腺及后部丝腺表达量相对较低。
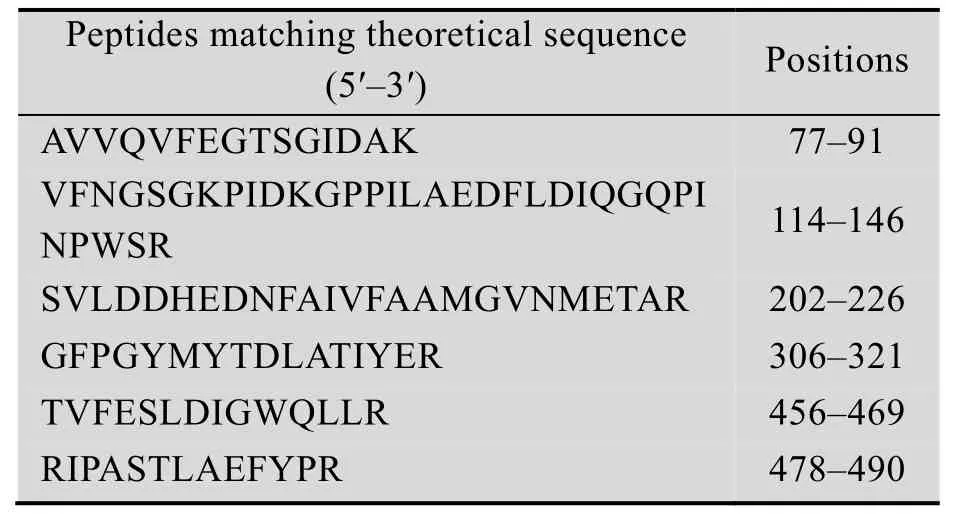
表2 与理论序列相匹配的肽段及位置Table 2 Positions and peptides matching theoretical sequence
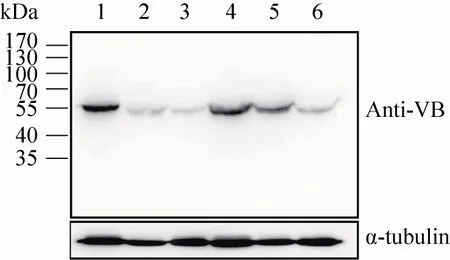
图3 BmV-ATPase B蛋白在家蚕丝腺的Western blotting检测Fig. 3 Western blotting analysis of BmV-ATPase B in the silk gland of Bombyx mori. 1–3: silk gland of silkworm on the 3rd day of 5th instar; 4–6: silk gland of the 1st day of wandering silkworm; 1, 4: anterior silk gland; 2, 5: middle silk gland; 3, 6: posterior silk gland; Anti-VB: antibody of BmV-ATPase B.
2.4免疫荧光定位
对5龄第3天及上蔟第1天家蚕的前部丝腺、中部丝腺及后部丝腺进行了免疫荧光定位,发现在这两个时期BmV-ATPase B蛋白均定位到了丝腺的细胞层 (图4红色信号)。进一步通过激光共聚焦显微镜对5龄第3天的前部丝腺、中部丝腺和后部丝腺进行了免疫荧光定位,发现BmV-ATPase B蛋白主要定位于丝腺的细胞膜,在细胞质中也有表达 (图5)。
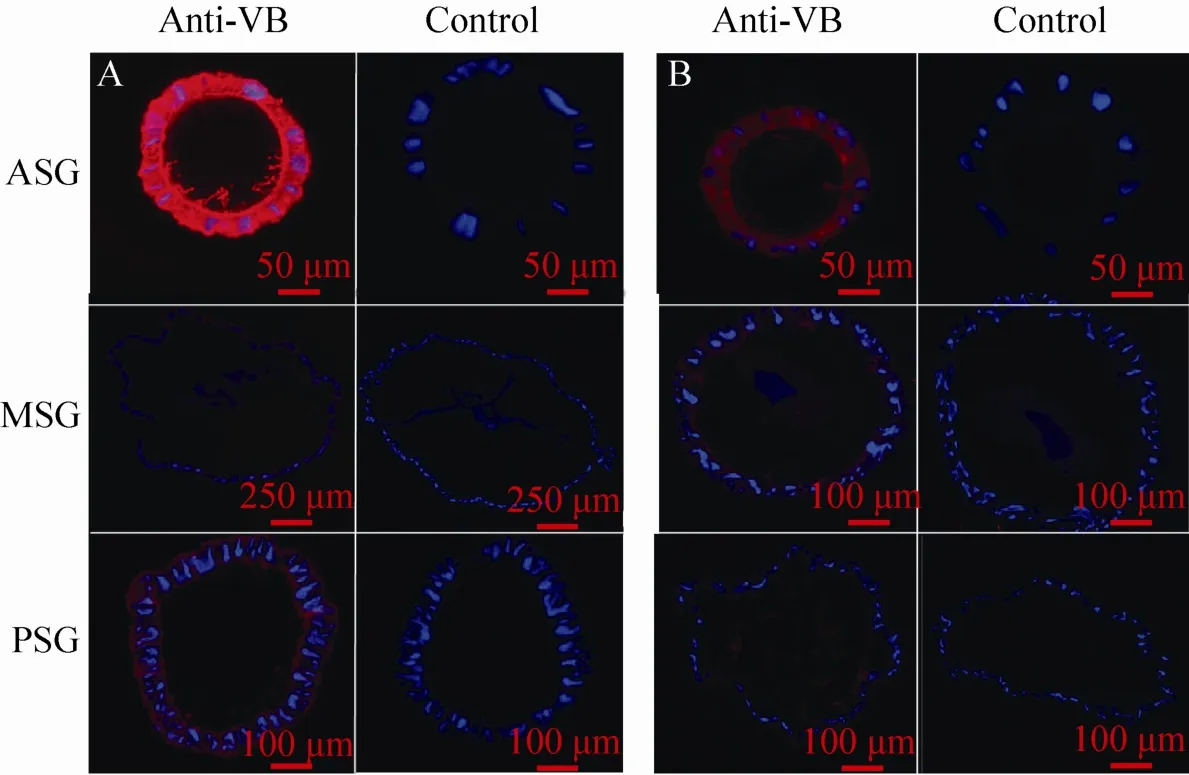
图4 BmV-ATPase B蛋白在家蚕丝腺的免疫荧光定位Fig. 4 Immunofluorescence localization of the protein BmV-ATPase B in the silk gland of Bombyx mori. (A) The silk gland of silkworm on the 3rd day of 5th instar. (B) The silk gland of 1st day of wandering silkworm. ASG: anterior silk gland; MSG: middle silk gland; PSG: posterior silk gland; Anti-VB: antibody of BmV-ATPase B.
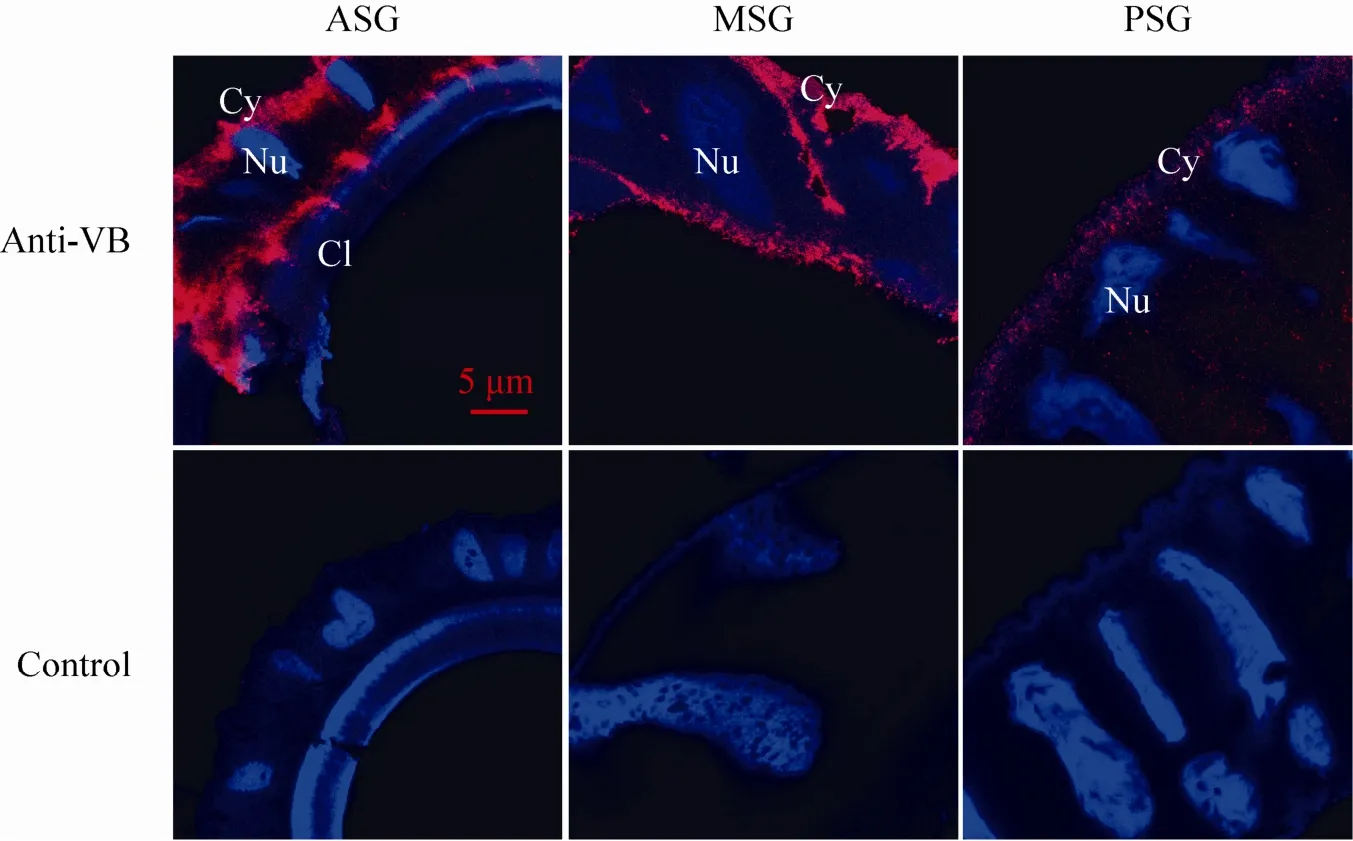
图5 BmV-ATPase B蛋白在丝腺细胞中的定位Fig. 5 Immunofluorescence localization of the protein BmV-ATPase B in the silk gland cell of Bombyx mori by Laser confocal scanning microscopy. ASG: anterior silk gland; MSG: middle silk gland; PSG: posterior silk gland; Anti-VB: antibody of BmV-ATPase B; Cy: cytomembrane; Nu: nucleus; Cl: cuticular layer.
3 讨论
V型ATP酶广泛存在于真核细胞中的内膜系统上,由多个亚基偶联起来利用ATP水解的能量介导氢离子的转运[9-11,15]。而V-ATPase B作为催化结构域的一部分,广泛存在于家蚕的各个组织中。有研究报道,BmV-ATPase B基因参与了家蚕对BmNPV病毒的抵抗[16]。但是目前,此基因在家蚕其他组织的功能仍然未见报道。因此,本研究首先对BmV-ATPase B基因进行了全长克隆,获得了此基因的全长CDS序列,在此基础上构建了原核表达载体p28-BmV-ATPase B。在Transetta (DE3) 表达菌株中诱导表达,发现该蛋白在37 ℃诱导的条件下以包涵体的形式成功表达。
有研究者将家蚕的前部丝腺在含有吖啶橙(细胞内部酸性指示剂) 的培养基中孵育,1 h后可以观察到在丝腺顶端细胞膜有橙色荧光,然后加入V型ATP酶的抑制剂巴弗洛霉素A1,孵育1 h后橙色荧光消失[17]。这说明了V型ATP酶调控着家蚕丝腺细胞的酸化过程。本研究进一步对家蚕5龄第3天和上蔟第1天丝腺不同区段进行Western blotting实验,结果表明BmV-ATPase B蛋白无论是在5龄第3天还是上蔟第1天在前部丝腺的表达量均高于中部丝腺和后部丝腺,这与王鑫等在转录水平的结果一致[5]。综合以上结果,我们认为前部丝腺细胞的酸化过程是由V型ATP酶产生的质子泵而引起的。由于前部丝腺是丝蛋白构象发生转变的场所[18],所以我们推测V型ATP酶在前部丝腺的高量表达主要为了转运大量的氢离子到丝腺腔内使丝蛋白的构象发生转变。
最后本研究通过激光共聚焦显微镜对BmV-ATPase B蛋白在丝腺的表达情况进行免疫荧光定位,发现该蛋白主要定位于丝腺的细胞膜,在丝腺的细胞质中也有表达。这是因为V型ATP酶是一种广泛存在于细胞内膜系统的膜蛋白[15,19],细胞质中存在大量的细胞器,如线粒体、溶酶体、高尔基体等,V型ATP酶作为质子泵铆定在细胞膜和细胞器膜上调控着管腔内的酸化过程[20],所以BmV-ATPase B定位到了丝腺的细胞膜和细胞质中。
有研究称在体外环境下伴随着pH值的降低,丝蛋白的二级结构中β折叠的含量逐渐升高[21-22]。在蜘蛛中研究发现,蜘蛛丝蛋白N端的二聚化作用与pH的变化有密切关系,蜘蛛丝蛋白在pH≤5.0的条件下会发生凝胶化反应[23-24]。当pH从7.0降到5.0时,蜘蛛丝蛋白的C端区域不稳定,会展开成为淀粉样β片层,而N端区域的二聚物很稳定,会锁定丝蛋白成为多聚体,从而引起纤维化的形成[25]。也有研究发现在pH 6.0左右家蚕丝蛋白N端区域的二级结构会从无规卷曲转变为β折叠[26]。以上研究都证明了pH值的变化影响了丝纤维的形成过程,所以我们推测BmV-ATPase B蛋白在前部丝腺的表达量的改变可能会影响到氢离子的转运,通过使丝蛋白构象变化进而影响丝纤维的性能。
因此,本研究将BmV-ATPase B基因作为丝纤维结构和性能改良的靶标,克隆了BmV-ATPase B基因,构建了原核表达载体表达蛋白并制备多克隆抗体。通过Western blotting和免疫荧光定位对该蛋白在家蚕不同时期丝腺中表达特征进行分析,对进一步探索和研究家蚕的成丝机理具有重要的理论和实践意义。
REFERENCES
[1] Zong XH, Zhou P, Shao ZZ, et al. Effect of pH and Copper(II) on the conformation transitions of silk fibroin based on EPR, NMR, and Raman spectroscopy. Biochemistry, 2004, 43(38): 11932−11941.
[2] Miyake S, Azuma M. Acidification of the silk gland lumen in Bombyx mori [Lepidoptera: Bombycidae] and Samia cynthia ricini [Lepidoptera: Bombycidae] and localization of H+-translocating vacuolar-type ATPase. J Insect Biotechnol Sericol, 2008, 77: 9−11.
[3] Matsumoto A, Chen JS, Collette A, et al. Mechanisms of silk fibroin sol-gel transitions. J Phys Chem B, 2006, 110(43): 21630−21638.
[4] Huang JT, Zhu LJ. Study on the mechanism of silk fiberization. Bull Sericult, 1998, 29(3): 5−7 (in Chinese).黄君霆, 朱良均. 蚕丝的纤维化机理研究. 蚕桑通报, 1998, 29(3): 5−7.
[5] Wang X, Li Y, Chen QM, et al. Bioinformational analysis and expression pattern of V-ATPase of in silkworm(Bombyx mori). Scientia Agric Sin, 2014, 47(8): 1611−1621 (in Chinese).王鑫, 李懿, 陈全梅, 等. 家蚕空泡型ATP酶(V-ATPase)基因的基本信息及表达特征. 中国农业科学, 2014, 47(8): 1611−1621.
[6] Yi QY, Zhao P, Wang X, et al. Shotgun proteomic analysis of the Bombyx mori anterior silk gland: An insight into the biosynthetic fiber spinning process. Proteomics, 2013, 13(17): 2657−2663.
[7] Breton S, Brown D. Regulation of luminal acidification by the V-ATPase. Physiology, 2013, 28(5): 318−329.
[8] Lü P, Xia HC, Gao L, et al. V-ATPase is involved in silkworm defense response against Bombyx mori nucleopolyhedrovirus. PLoS ONE, 2013, 8(6): e64962.
[9] Beyenbach KW, Wieczorek H. The V-type H+-ATPase: molecular structure and function, physiological roles and regulation. J Exp Biol, 2006, 209(4): 577−589.
[10] Poëa-Guyon S, Ammar MR, Erard M, et al. The V-ATPase membrane domain is a sensor of granular pH that controls the exocytotic machinery.J Cell Biol, 2013, 203(2): 283−298.
[11] Rane HS, Bernardo SM, Hayek SR, et al. The contribution of Candida albicans vacuolar ATPase subunit V1B, encoded by VMA2, to stress response, autophagy, and virulence is independent of environmental pH. Eukaryot Cell, 2014, 13(9): 1207−1221.
[12] Williamson WR, Wang D, Haberman AS, et al. A dual function of V0-ATPase a1 provides an endolysosomal degradation mechanism in Drosophila melanogaster photoreceptors. J Cell Boil, 2010, 189(5): 885−899.
[13] Cheng Y, Wang XY, Hu H, et al. A hypothetical model of crossing Bombyx mori nucleopolyhedrovirus through its host midgut physical barrier. PLoS ONE, 2014, 9(12): e115032.
[14] Zhou ZH, Yang HJ, Chen M, et al. Comparative proteomic analysis between the domesticated silkworm (Bombyx mori) reared on fresh mulberry leaves and on artificial diet. J Proteome Res, 2008, 7(12): 5103−5111.
[15] Zhao JH, Rubinstein JL. The study of vacuolar-type ATPases by single particle electron microscopy. Biochem Cell Biol, 2014, 92(6): 460−466.
[16] Yang H, Chen H, Chen K, et al. Characterization and localization of the vacuolar-type ATPase in the midgut cells of silkworm (Bombyx mori). Z Naturforsch C, 2009, 64(11/12): 899−905.
[17] Azuma M, Ohta Y. Changes in H+_translocating vacuolar-type ATPase in the anterior silk gland cell of Bombyx mori during metamorphosis. J Exp Biol, 1998, 201(4): 479−486.
[18] Xie F, Zhang HH, Shao HL, et al. Effect of shearing on formation of silk fibers from regenerated Bombyx mori silk fibroin aqueous solution. Int J Biol Macromol, 2006, 38(3/5): 284−288.
[19] Merkulova M, Păunescu TG, Azroyan A, et al. Mapping the H+(V)-ATPase interactome: identification of proteins involved in trafficking, folding, assembly and phosphorylation. Sci Rep, 2015, 5: 14827.
[20] Dechant R, Binda M, Lee SS, et al. Cytosolic pH is a second messenger for glucose and regulates the PKA pathway through V-ATPase. EMBO J, 2010, 29(15): 2515−2526.
[21] Yang YH, Shao ZZ, Chen X. Influence of pH value on the structure of regenerated Bombyx mori silk fibroin in aqueous solution by optical spectroscopy. Acta Chim Sin, 2006, 64(16): 1730−1736 (in Chinese).杨宇红, 邵正中, 陈新. 光谱法研究pH值对再生桑蚕丝素蛋白在水溶液中结构的影响. 化学学报, 2006, 64(16): 1730−1736.
[22] Zhou P, Xie X, Knight DP, et al. Effects of pH and calcium ions on the conformational transitions in silk fibroin using 2D raman correlation spectroscopy and 13C solid-state NMR. Biochemistry, 2004, 43 (35): 11302−11311.
[23] Jaudzems K, Askarieh G, Landreh M, et al. pH-dependent dimerization of spider silk N-terminal domain requires relocation of a wedged tryptophan side chain. J Mol Biol, 2012, 422(4): 477−787.
[24] Gauthier M, Leclerc J, Lefèvre T, et al. Effect of pH on the structure of the recombinant C-terminal domain of Nephila clavipes dragline silk protein. Biomacromolecules, 2014, 15(12): 4447−4454.
[25] Andersson M, Chen GF, Otikovs M, et al. Carbonic anhydrase generates CO2and H+that drive spider silk formation via opposite effects on the terminal domains. PLoS Biol, 2014, 12(8): e1001921.
[26] He YX, Zhang NN, Li WF, et al. N-terminal domain of Bombyx mori fibroin mediates the assembly of silk in response to pH decrease. J Mol Biol, 2012, 418(3/4): 197−207.
(本文责编郝丽芳)
医学与免疫生物技术
Gene cloning and expression characteristics of vacuolar-type ATPase subunit B in Bombyx mori
Huifang Chen, Xin Wang, Kang Xie, Yi Li, and Ping Zhao
State Key Laboratory of Silkworm Genome Biology, Southwest University, Chongqing 400716, China
Abstract:Vacuolar-type ATPase (V-ATPase), located in the membrane and organelle membrane, is one of important H+-transporting proteins. It keeps the proton balance by transporting H+into vacuole, vesicle, or extracellular using the energy from ATP hydrolysis. The subunit B of the vacuolar-type ATPase (BmV-ATPase B) contains the ATP catalytic site, and plays an important role in this process. To study the function of V-ATPase B in Bombyx mori (BmV-ATPase B), we cloned its coding gene from the midgut of the 5th instar silkworm larvae. Then we constructed prokaryotic expression vector and produced the recombinant protein in E. coli. The recombinant protein was identified as BmV-ATPase B by mass spectrometry and purified using Ni-NTA affinity chromatography. This purified protein was used to immunize rabbit to generate polyclonal antibodies of BmV-ATPase B. Finally, the expression patterns of BmV-ATPase B in the silk gland were analyzed by western blotting and immunofluorescence. The full length CDS sequence of BmV-ATPase B was 1 473 bp. BmV-ATPase B was 55 kDa with a PI of 5.3. We analyzed the expression patterns of BmV-ATPase B in different sections of silk gland from the silkworm on the 3rd day of 5th instar and 1st day of wander stage by western blotting. BmV-ATPase B was expressed in all sections of the silk gland and it was abundant in the anterior silk gland (ASG) both in these two developmental stages. Furthermore, immunofluorescence indicated that BmV-ATPase B was located in the silk gland cells. Laser confocal scanning microscopy analysis revealed that BmV-ATPase B was mainly expressed in the cytomembrane of silk gland cells. These data elucidated the expression patterns of BmV-ATPase B in the silk gland of silkworm, which provides a good basis for further studies on the function of V-ATPase B in silk fiber formation.
Keywords:silkworm (Bombyx mori), BmV-ATPase B, gene cloning, prokaryotic expression, Western blotting, immunofluorescence localization
DOI:10.13345/j.cjb.150364
Corresponding author:Ping Zhao. Tel: +86-23-68250885; E-mail: zhaop@swu.edu.cn
