磷钨酸铵-海藻酸钙复合吸附剂的制备及其铷吸附热力学及动力学
2016-07-04安莲英张春霞黄献奖成都理工大学材料与化学化工学院四川成都60059矿产资源化学四川省高校重点实验室四川成都60059
安莲英,张春霞,黄献奖(成都理工大学材料与化学化工学院,四川 成都 60059;“矿产资源化学”四川省高校重点实验室,四川 成都 60059)
磷钨酸铵-海藻酸钙复合吸附剂的制备及其铷吸附热力学及动力学
安莲英1,2,张春霞1,黄献奖1
(1成都理工大学材料与化学化工学院,四川 成都 610059;2“矿产资源化学”四川省高校重点实验室,四川 成都 610059)
摘要:杂多酸盐无机离子吸附剂对于碱金属离子具有良好吸附性能,可望用于铷的分离提取。以海藻酸钙(CaALG)为载体,对铷有良好选择性的磷钨酸铵(AWP)为活性成分,采用溶胶凝胶法制备球形复合吸附剂AWP-CaALG并优化了物料配比、CaCl2浓度、陈化时间及干燥温度等制备条件,通过SEM、XRD、IR分析对制备产物进行了表征。通过静态吸附实验,测得吸附剂对Rb+吸附容量达43 mg·g-1。实验考察了溶液中铷初始浓度、吸附温度对吸附过程的影响,分别采用Langmuir等温吸附模型、Freundlich等温吸附模型对实验数据进行线性回归分析,结果表明吸附过程更符合Freundlich等温吸附模型(R2>0.9962)。计算铷吸附过程焓变(ΔH)、熵变(ΔS)分别为−14.18 kJ·mol−1和−0.0367 kJ·mol−1·K−1,不同温度下ΔG均为负值,说明该吸附过程可自发进行,低温利于吸附,升温利于解吸。吸附动力学结果表明该吸附过程符合拟二级动力学模型,且受化学反应控制。
关键词:铷;磷钨酸铵;海藻酸钙;吸附;动力学;热力学
2015-04-21收到初稿,2015-10-12收到修改稿。
联系人及第一作者:安莲英(1956—),女,教授。
Received date: 2015-04-21.
Foundation item: supported by the National High Technology Research and Development Program of China (2012AA061704).
引 言
铷作为一种稀有、稀散碱金属元素,在有机催化剂、光电倍增管、特种玻璃以及抗癌药物等领域应用广泛,Rb2CO3可作为添加剂用于制备特种玻璃,提高其稳定性和耐用性;铷-铯-锑涂层可用于制备光电倍增管的光电阴极。生物医学领域[1],RbCl和其他铷盐可作为密度梯度介质用于病毒、核酸的超离心分离。铷还可作为助催化剂,用于提高反应的选择性和转化率[2-3]。铷没有独立的矿物,常和其他碱金属共存于锂云母、铯榴石、锂铯榴石、天然光卤石、盐湖卤水及地下卤水中。据报道92%以上的铷资源存在于盐湖卤水及地下卤水中,尤其是四川平落坝地下卤水铷含量高达3.75×10-2g·L-1[4]。因铷与物理化学性质极为相近的碱金属元素钠、钾共存,使铷的提取技术难度极大,致使大量卤水铷资源未得到合理利用。
由于铷和铯的物理化学性质非常接近,在很多应用领域二者常共同使用或相互替代,现今绝大部分的研究主要集中在高放射性废液中137Cs的分离,单独研究铷分离的文献少见报道。常见的铷、铯分离方法主要有分步结晶法、沉淀法以及溶剂萃取法和离子交换法。分步结晶法是较普遍且古老的方法,一般从含铷矿石中提取铷化合物,但要经过多次的重结晶,工序比较烦琐。在工业生产中,常采用沉淀法[5]分离提取铷、铯,主要适用于从高含量的溶液中分离提取铷、铯。溶剂萃取法因易实现连续化操作,应用潜力较大。技术较为成熟且对Cs+和Rb+有较高选择性的萃取剂主要有酚类试剂4-仲丁基-2-(α-甲苄基)苯酚(BAMBP)及4-叔丁基-2-(α-甲苄基)苯酚(t-BAMBP)[6-7]。
近年来离子交换法在铷、铯分离中的应用研究较为活跃,合成了一些高选择性的吸附剂。其中酚醛树脂型[8-9]吸附剂对铯具有较高的选择性,贾莉英等[10]以聚苯乙烯型大孔树脂作为骨架,接枝邻苯二酚合成了一种新型的有机离子交换树脂。有机吸附剂耐热性和抗辐射性差,对高价金属离子的交换势大等缺点,在实际生产中应用价值并不大。随着杯芳烃等选择性萃取剂研究的发展,也有研究尝试将杯芳烃与其他载体制成复合吸附剂[11]。沸石以其性质稳定,资源丰富,价格低廉受青睐,但对铷、铯的选择性并不高[12]。磷钼酸盐、磷钨酸盐、硅钼酸盐等杂多酸盐对铷、铯有较高的选择性,然而由于其粉末过细,不适合交换柱的连续操作,难以用于实际生产过程,因此常将杂多酸盐负载于其他载体上制备成复合吸附剂[13-14]。Mimura等[15-16]将海藻酸钠与磷钨酸铵、磷钼酸铵悬浊液滴入Ca(NO3)2溶液中,制成海藻酸钙包裹的磷钨酸铵复合吸附剂,处理高放射性废液,能吸附其中99%的Cs+。目前,针对Rb+的吸附研究并不多,Ye等[17]采用类似方法制备得到磷钼酸铵-海藻酸钙复合吸附剂,进行了铷铯吸附研究,在平衡pH为3.5~4.5时,对铷的吸附容量可达0.58 mmol·g-1。本文以海藻酸钙为载体,磷钨酸铵为活性成分,考察了磷钨酸铵-海藻酸钙复合吸附剂(AWP-CaALG)的制备工艺条件对Rb+吸附性能的影响,并对Rb+吸附过程的热力学及动力学特性进行较详细的研究,拟为铷的提取分离技术提供新的方法。
1 实验部分
1.1实验材料和仪器
试剂:氯化铷(RbCl)、浓盐酸(HCl)、氯化钙(CaCl2)、磷钨酸铵(AWP)、海藻酸钠(NaALG),以上试剂均为分析纯,购于成都科龙试剂厂。
仪器和检测方法:扫描电镜(SEM,Hitachi,s530)观察AWP-CaALG的表面形貌;通过电感耦合等离子发射光谱仪(ICP-OES,PE,Optima 5300V)测定溶液中Rb+浓度。X射线衍射仪(XRD,丹东方圆仪器有限公司,DX-2700)和红外光谱仪(FT-IR,瑞士布鲁克公司,TENSOR-27)检测AWP-CaALG成分结构;电子天平(梅特勒-托利多仪器上海有限公司,AL104)进行药品称量。
1.2AWP-CaALG的制备
称取0.3 g海藻酸钠,溶于20 ml蒸馏水中,充分搅拌得质量分数为1.5%的海藻酸钠溶胶。向溶胶中加入一定量的磷钨酸铵,搅拌均匀;用医用针筒吸取该悬浊液逐滴加入到一定浓度的CaCl2溶液中(具体条件见2.1.1节),滴毕于室温下搅拌陈化。陈化结束后,将复合吸附剂抽滤分离,用蒸馏水浸洗多次除去残余CaCl2,于烘箱内烘干至恒重,贮藏于干燥器中,待用。
1.3静态吸附实验
取50 mg吸附剂,加入5 ml C(Rb+)=1.0 g·L-1的溶液(pH=7),室温下静态吸附24 h(课题组前期实验表明,24 h已经达吸附平衡,pH在2~9之间吸附率较为稳定,后续热力学及动力学研究参照此条件)[18],利用ICP-OES测定吸附后溶液中Rb+浓度。以吸附容量作为评价指标,分别考察物料配比、CaCl2浓度、陈化时间、干燥温度等合成条件对铷的吸附性能的影响。
吸附容量公式定义为

式中,qe为吸附剂的吸附容量,mg·g-1;C0和Ce分别为Rb+初始浓度和吸附后的浓度,mg·L-1;V为溶液体积,ml;m为吸附剂的用量,mg。
2 结果与讨论
2.1AWP-CaALG的制备条件优化
2.1.1物料配比及CaCl2浓度对吸附性能的影响物料配比及CaCl2浓度对AWP-CaALG吸附性能的影响如图1、图2所示。
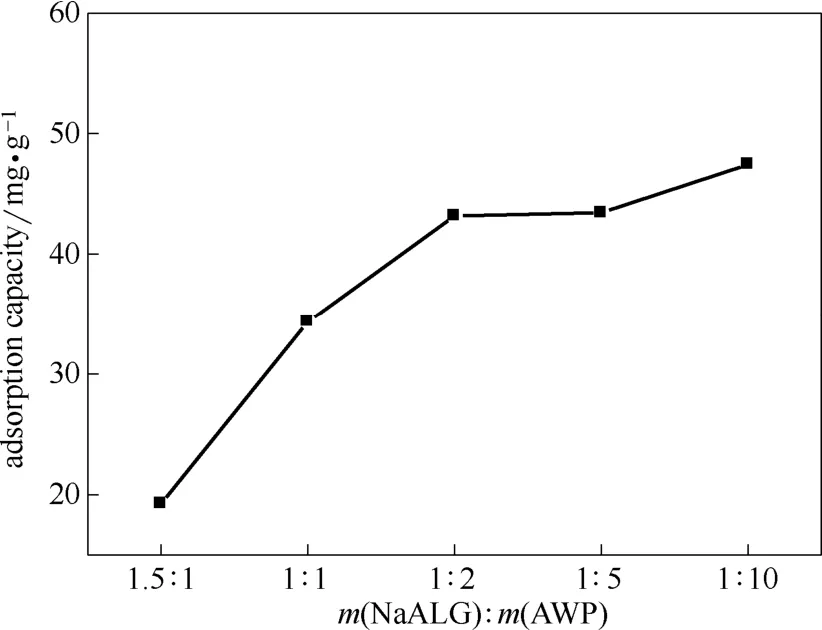
图1 物料配比的影响Fig.1 Effect of material ratio (AWP-CaALG: 50 mg,C(Rb+)=1.0 g·L-1,adsorption for 24 h)

图2 CaCl2浓度的影响Fig.2 Effect of concentration of CaCl2(AWP-CaALG: 50mg,C(Rb+)=1.0 g·L-1,adsorption for 24 h)

图3 AWP-CaALG复合吸附剂SEM照片Fig.3 SEM images of adsorbent
图1表明随着AWP含量的增加,铷吸附容量增大。但在m(NaALG):m(AWP)=1:2之后,吸附剂的吸附容量增加缓慢。由图2可知,CaCl2浓度对吸附剂的吸附容量的影响较大。当CaCl2的浓度为0.5 mol·L-1时,吸附容量达到最大值。在低浓度CaCl2溶液中,由于溶胶液滴凝胶化速度过慢,导致部分磷钨酸铵流失,吸附容量降低。过高浓度CaCl2溶液将使溶胶液滴表面迅速凝胶化,阻碍溶胶液滴内层海藻酸钠的进一步陈化,导致磷钨酸铵无法充分分散,比表面积降低,吸附容量降低。因此,选定的物料配比为1:2,CaCl2浓度为0.5 mol·L-1。
图3为不同配料比制得的吸附剂SEM照片。图3(a)为m(NaALG):m(AWP)=1:2的复合吸附剂,其粒径约为1 mm。球形颗粒表面布满褶皱,说明吸附剂具有较大的比表面积;随着AWP用量的增加,吸附剂的粒径增大;图3(b)为m(NaALG):m(AWP)=1:5的复合吸附剂,图中可见明显的裂纹,吸附剂变得易碎,不适合上柱操作。
2.1.2陈化时间及干燥温度对吸附性能的影响图4与图5分别为陈化时间与干燥温度对吸附剂的吸附效果的影响。当陈化时间在24~36 h范围内时,吸附效果较好。陈化36 h时,吸附容量达到最大值。由图5可知,干燥温度对吸附剂影响并不明显。当烘干温度为105℃时,吸附剂的吸附容量高达43 mg·g-1。故选择陈化时间为24 h,烘干温度为105℃。

图4 陈化时间的影响Fig.4 Effect of aging time (AWP-CaALG: 50mg,C(Rb+)=1.0 g·L-1,adsorption for 24 h)

图5 干燥温度的影响Fig.5 Effect of drying temperature (AWP-CaALG:50 mg,C(Rb+)=1.0 g·L-1,adsorption for 24 h)
2.2复合吸附剂性能表征
图6为制得的复合吸附剂与原料磷钨酸铵的XRD标准谱图。经比较发现,复合吸附剂的XRD谱图中存在完整的磷钨酸铵的特征衍射峰,且强度较强。图7为复合吸附剂的红外光谱图,图中可观测到NH4+和(PW12O40)3-特征吸收峰1404.13、1037.09、1083.00、818.31、891.79和520.60 cm-1。结合图6、图7,可知磷钨酸铵在复合吸附剂中仍以晶体形式存在,并未与载体海藻酸钙发生化学反应[18]。

图6 磷钨酸铵XRD标准谱图与AWP-CaALG复合吸附剂XRD谱图Fig.6 XRD pattern of AWP and AWP-CaALG a—AWP; b—AWP-CaALG

图7 AWP-CaALG复合吸附剂红外光谱图Fig.7 FT-IR spectrum of AWP-CaALG
2.3吸附等温模型和热力学参数
2.3.1吸附等温模型等温吸附模型最常用的模型是Langmuir等温吸附模型和Freundlich等温吸附模型。Langmuir等温吸附模型[19][式(2)],是假设吸附过程是均一表面上的单分子层吸附,且被吸附的吸附质间不存在相互作用。
将Langmuir方程转换成线性形式

式中,Ce为平衡时溶液中吸附质的浓度,mg·L-1;qe为吸附平衡时单位质量吸附剂上吸附质的质量,mg·g-1;qm为最大单分子层吸附容量,mg·g-1;KL为Langmuir吸附常数,与吸附容量和能量有关,L·mg-1。通过Ce拟合Ce/qe得到斜率和截距,即可求出KL和qm。
Freundlich模型[18]是在Langmuir等温吸附模型的基础上假设吸附表面为非均一表面,方程可整理成如下线性形式

式中,Kf(mg·g-1)和1/n为Freundlich常数,分别与吸附容量和吸附强度有关。均可通过lgCe拟合lgqe求得。
实验考察了Rb+不同初始浓度(200、400、600、800、1000 mg·L-1)的溶液在3个温度下的平衡吸附量(吸附剂用量0.5 g,吸附时间24 h,pH=7),结果见表1。分别用线性Langmuir模型和Freundlich模型对实验结果进行回归分析,分别以Ce/qe对Ce、lgqe对lgCe作图,拟合直线方程,求得模型各参数,结果见表2。

表1 吸附热力学研究基础数据Table 1 Basic data of adsorption thermodynamics

表2 等温吸附模型拟合结果Table 2 Regression results for Langmuir and Freundlich isotherm
经比较,Freundlich等温吸附曲线的相关系数均大于相同温度下Langmuir等温吸附曲线的相关系数,即Freundlich等温吸附曲线更能准确地反映该吸附过程。
2.3.2吸附过程热力学计算自由能变(ΔG)、熵变
(ΔS)、焓变(ΔH)等热力学参数可由式(4)~式(7)进行计算

式中,K为平衡常数;Ce为溶液的平衡浓度,mg·L−1;CAe为平衡时吸附剂上离子的浓度,mg·L−1;R为摩尔气体常数,R=8.314 J·mol−1·K−1;T为温度,K。
将实验数据以lgK对1/T作图,由拟合直线方程y=−1.91757+740.33915x[式(7)]的斜率和截距即可分别求出ΔH和ΔS,再结合式(6)求得ΔG,不同温度下的ΔG见表3,结果(ΔH=−14.18 kJ·mol−1,ΔS= −0.0367 kJ·mol−1,ΔG<0)表明AWP-CaALG吸附Rb+的过程是放热反应且为熵减过程,低温利于吸附,升温利于解吸。

图8 温度与分配比的关系Fig. 8 Relationship between T and distribution ratio
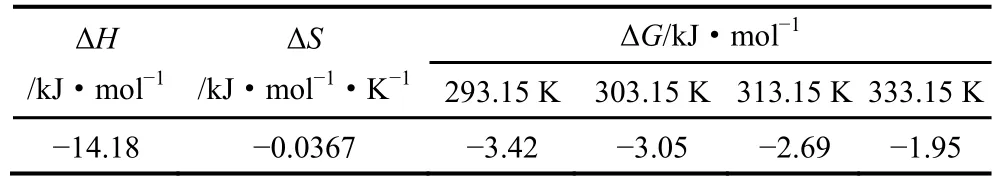
表3 AWP-CaALG吸附Rb+热力学参数Table 3 Thermodynamic parameters of AWP-CaALG adsorption to Rb+
2.4吸附动力学模型
为研究AWP-CaALG复合吸附剂吸附铷离子的机制,在常温下通过研究吸附量随时间(2~24 h)的变化关系,得到复合吸附剂对浓度为200 mg·L−1与600 mg·L−1的氯化铷溶液吸附动力学数据(表4)。采用拟一级反应动力学模型和拟二级反应动力学模型对动力学数据进行拟合。拟一级反应动力学模型和拟二级反应动力学模型分别整理为

式中,F=qt/qe,qe和qt分别为平衡时和t时的吸附容量,mg·g−1;k1(h−1) 和k2(g·mg−1·h−1)均为动力学常数。

表4 吸附动力学研究基础数据Table 4 Basic data of adsorption kinetic
将以上实验数据分别以−ln(1−F)对t和t/qt对t作图,若得到一条直线,则证明模型的适用性,拟合结果见表5。
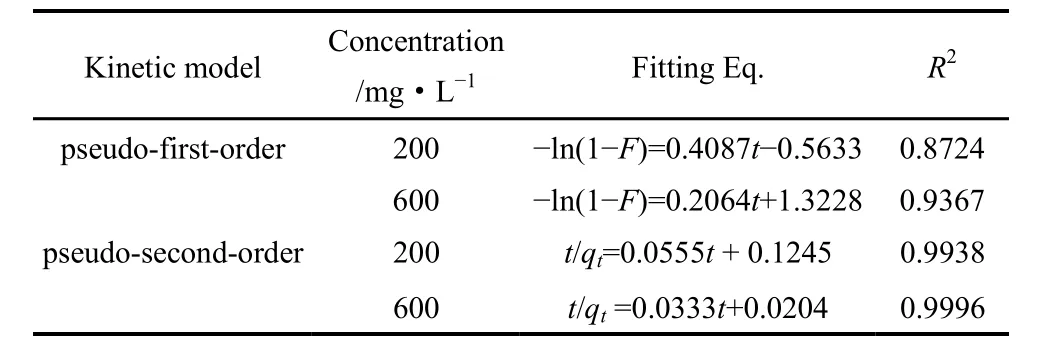
表5 吸附动力学模型拟合结果Table 5 Adsorption kinetic model of AWP-CaALG to Rb+
结果表明拟二级反应动力学模型的相关系数R2均在0.99以上,因此复合吸附剂对Rb+的吸附过程更符合拟二级动力学过程。通常拟二级动力学模型是基于吸附过程为化学反应控制步骤的假设推导出来[20],这提示复合吸附剂对Rb+的吸附过程可能受化学反应控制。
2.5控制机理模型
动边界模型广泛用于吸附或离子交换过程的研究,该模型假设反应从颗粒表面的活性位点开始并逐步向颗粒内移动,即离子交换的过程为交换离子通过反应壳层后在未反应核表面逐渐进行的,如图9所示。

图9 动边界模型示意图Fig.9 Schematic diagram of moving boundary model
动边界模型中,吸附时间与交换率间的关系如下所示[21]:
液膜扩散控制(FDC)

颗粒扩散控制(PDC)
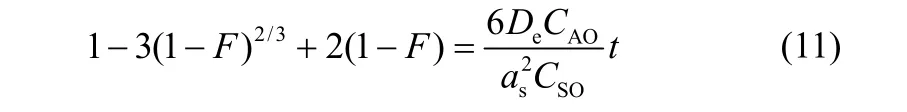
化学反应控制(CRD)
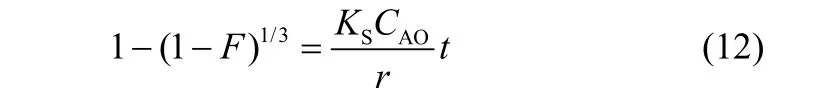
式中,CAO为溶液中吸附质浓度,mg·L−1;CSO为吸附剂上可交换离子浓度,mg·L−1;KmA为液膜扩散系数,m·h−1;as为化学计量系数;De为颗粒内扩散系数,m2·h−1;Ks为化学反应速率常数,m··h−1;r为平均粒径,m;t为吸附时间,h;k为扩散系数;F= qt/qe为交换率。
分别以式(10)~式(12)对实验数据进行拟合。不同Rb+浓度拟合方程及化学反应速率常数见表6。结果表明,以化学反应控制模型拟合得到的相关系数最大,当浓度为200和600 mg·L−1时,分别为0.9485和0.9904。因此,复合吸附剂对Rb+的吸附过程受化学反应控制,这和吸附过程符合拟二级动力学过程一致。

表6 控制机理拟合曲线Table 6 Fitting curves of control mechanism
3 结 论
(1)AWP-CaALG复合吸附剂的较优制备条件为:海藻酸钠与磷钨酸铵质量比为1:2,氯化钙浓度为0.5 mol·L−1,室温陈化24 h,干燥温度为105℃。该吸附剂在Rb+浓度为1.0 g·L−1的溶液中,吸附容量可达43 mg·g−1。
(2)AWP-CaALG吸附Rb+的过程可用Freundlich等温吸附模型描述。在293~313 K条件下吸附过程ΔG<0、ΔS=−0.0367 kJ·mol−1、ΔH=−14.18 kJ·mol−1,表明该吸附是个自发的放热过程。吸附过程符合拟二级动力学模型,且受化学反应控制。
符号说明
as——化学计量系数
CAo,Cso——分别为溶液中和吸附剂上可交换吸附质浓
度,mg·L−1
C0,Ce,CAe——分别为溶液中吸附质初始浓度和吸附平衡后的浓度与吸附剂上吸附质的浓度,mg·L−1
De——颗粒内扩散系数,m2·h−1
Kf,K ——分别为Freundlich常数和平衡常数
KL——Langmuir吸附常数,L·mg−1
Ks,KmA——分别为化学反应速率常数与液膜扩散系数,
m·h−1
k ——扩散系数
k1,k2——动力学常数,单位分别为h−1,g·mg−1·h−1
m ——吸附剂的用量,mg
qe,qt,qm——分别为吸附平衡时与t时吸附剂的吸附容量
和最大单分子层吸附容量,mg·g−1
R ——摩尔气体常数,R=8.314 J·mol−1·K−1
r ——平均粒径,m
T ——温度,K
t ——吸附时间,h
V ——溶液体积,ml
References
[1] BUTTERMAN W C,REESE R G. Mineral commodity profiles-rubidium [R]. US: USGS,2003.
[2] 盛丁杰,张明森. 碱金属铷对邻二甲苯制苯酐催化剂性能的影响[J]. 石油学报(石油加工),2001,17(5): 36-41. SHENG D J,ZHANG M S. Influence of adding alkali metal Rb on performance of catalysts for phthalic anhydride from o-xylene[J]. Acta Petrolei Sinica (Petroleum Processing Section),2001,17(5): 36-41.
[3] 陈振兴,方忠和,黄彩娟,等. 铯-铷-钒系低温硫酸催化剂的研制[J]. 催化学报,2000,21(4): 384-386. DOI: 10.3321/j.issn.0253-9837. 2000.04.025. CHEN Z X,FANG Z H,HUANG C J,et al. Preparation of Cs-Rb-V catalyst for H2SO4production at low temperature [J]. Chinese Journal of Catalysis,2000,21(4): 384-386. DOI: 10.3321/j.issn.0253-9837. 2000.04.025.
[4] 林耀庭,唐庆. 四川盆地卤水分布及开发前景展望[J]. 化工矿产地质,1999,21(4): 209-214. LIN Y T,TANG Q. Distribution of brine in Sichuan basin and its prospects for tapping [J]. Geology of Chemical Minerals,1999,21(4): 209-214.
[5] 杨志红,杨磊,丁有钱,等. 沉淀法分离Cs和Rb的研究[J]. 核化学与放射化学,2004,26(2): 95-98. YANG Z H,YANG L,DING Y Q,et al. Study of separation of Cs and Rb with precipitation process [J]. Journal of Nuclear and Radiochemistry,2004,26(2): 95-98.
[6] 杨玲,王林生,赖华生,等. 不同稀释剂中t-BAMBP萃取铷铯的研究[J]. 稀有金属,2011,35(4): 627-632. DOI: 10.3969/j.issn. 0258-7076.2011.04.026. YANG L,WANG L S,LAI H S,et al. Extraction of rubidium and cesium with t-BAMBP in various diluents [J]. Chinese Journal of Rare Metals,2011,35(4): 627-632. DOI: 10.3969/j.issn.0258-7076. 2011.04.026.
[7] 安莲英,宋晋,卢智,等. t-BAMBP 萃取分离高钾卤水中的铷[J].化工矿物与加工,2010,39(10): 14-17. AN L Y,SONG J,LU Z,et al. Separation of Rb+from brine with high concentration of potassium by using t-BAMBP as extractant [J]. Industrial Minerals & Processing,2010,39(10): 14-17.
[8] DUMONT N,FAVRE-RÉGUILLON A,LEMAIRE B D M. Extraction of cesium from an alkaline leaching solution of spent catalysts using an ion-exchange column [J]. Separation Science and Technology,2006,31(7): 1001-1010. DOI: 10.1080/ 01496399608002501.
[9] FAVRE-REGUILLON A,DUNJIC B,LEMAIRE M,et al. Synthesis and evaluation of resorcinol-based ion-exchange resins for the selective removal of cesium [J]. Solvent Extraction and Ion Exchange,2007,19(1): 181-191. DOI:10.1081/SEI-100001382.
[10] 贾莉英,陈晓青,危俊婷,等. 新型离子交换树脂的合成及其对Rb+交换性能[J]. 中南工业大学学报,2001,32(1): 54-57. DOI: 10.3969/j.issn.1672-7207.2001.01.014. JIA L Y ,CHEN X Q ,WEI J T,et al. Synthesis of graft-p-tert-butylphenol resin and its adsorption capability of rubidium [J]. J. Cent. South Univ. Technol.,2001,32(1): 54-57. DOI: 10.3969/j.issn.1672-7207.2001.01.014.
[11] ZHANG A Y,XIAO C L,XUE W J,et al. Chromatographic separation of cesium by a macroporous silica-based supramolecular recognition agent impregnated material [J]. Separation and Purification Technology,2009,66(3): 541-548. DOI: 10.1016/j. seppur.2009.02.002.
[12] 王雪静,高世扬,周建国,等. 用天然斜发沸石从西藏地热水中分离提取K+,Rb+,Cs+的研究[J]. 盐湖研究,2002,10(3): 31-37. WANG X J,GAO S Y,ZHOU J G,et al. Study on the extraction and separation of K+,Rb+,Cs+with naturnal clinoptilolite from geothermal water in Tibet[J]. Journal of Salt Lake Research,2002,10(3): 31-37.
[13] 秦玉楠. 新型AMoP/SiO2离子交换剂的制备及应用——从制盐母液中直接提取铯和铷的新方法[J]. 中国钼业,2001,25(5): 19-20. QIN Y N. The preparation and application of new typal AMoP/SiO2ion exchanger [J]. China Molybdenum Industry,2001,25(5): 19-20.
[14] CHAKRAVARTY R,RAM R,PILLAI K T,et al. Ammonium molybdophosphate impregnated alumina microspheres as a new generation sorbent for chromatographic137Cs/137mBa generator [J]. Journal of Chromatography A,2012,1220(13): 82-91. DOI: 10.1016/j.chroma.2011.11.059.
[15] MIMURA H,WU Y,WANG Y F,et al. Selective separation and recovery of cesium by ammonium tungstophosphate-alginate microcapsules [J]. Nuclear Engineering and Design,2011,241(12): 4750-4757. DOI: 10.1016/j.nucengdes.2011.03.031.
[16] MIMURA H,SAITO M,ONODERA K A Y. Selective uptake of cesium by ammonium molybdophosphate (AMP)-calcium alginate composites [J]. Journal of Nuclear Science and Technology,2012,38(10): 872-878. DOI: 10.1080/18811248.2001.9715108.
[17] YE X,WU Z,Li W,et al. Rubidium and cesium ion adsorption by an ammonium molybdophosphate-calcium alginate composite adsorbent [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects,2009,342(1/2/3): 76-83. DOI: 10.1016/j.colsurfa. 2009.04.011.
[18] AN L Y,HUANG X J,ZHAO X Y,et al. Preparation of ammonium tungstophosphate-calcium alginate composite adsorbent and its adsorption properties of rubidium [J]. Advanced Materials Research,2013,652: 2524-2528. DOI: 10.4028/www.scientific. net/AMR. 652-654.2524.
[19] EASTOE J,DALTON J S. Dynamic surface tension and adsorption mechanisms of surfactants at the air-water interface [J]. Advances in Colloid and Interface Science,2000,85(2/3): 103-144. DOI: 10.1016/S0001-8686(99)00017-2.
[20] HO Y S. MCKAY G. Pseudo-second order model for sorption processes [J]. Process Biochemistry,1999,34(5): 451-465. DOI: 10.1016/S0032-9592(98)00112-5.
[21] 姜志新. 离子交换动力学及其应用(上)[J]. 离子交换与吸附,1989,5(1): 54-73.
JIANG Z X. Ion exchange kinetics and its application (first volume) [J]. Ion Exchange and Adsorption,1989,5(1): 54-73.
Preparation of ammonium tungstophosphate-calcium alginate composite adsorbent and adsorption thermodynamic and kinetic characteristics to rubidium
AN Lianying1,2,ZHANG Chunxia1,HUANG Xianjiang1
(1College of Materials and Chemistry & Chemical Engineering,Chengdu University of Technology,Chengdu 610059,Sichuan,China;2Mineral Resources Chemistry Key Laboratory of Sichuan Higher Education Institutions,Chengdu 610059,Sichuan,China)
Abstract:Heteropoly acid salt inorganic ion adsorbent which has good adsorption performance for alkali metal ions could be used for the separation or extraction of rubidium. A spherical composite adsorbent AWP-CaALG was prepared by sol-gel method with calcium alginate (CaALG) and ammonium tungstophosphate (AWP) which were as carrier and active component,respectively,and characterized by SEM,XRD,IR analysis. The adsorption capacity of the adsorbent toward rubidium was determined to be 43 mg·g−1under the optimum preparation conditions of m(NaALG):m(AWP)=1:2 and concentration of CaCl2of 0.5 mol·L−1with aging for 24 h and being dried at 105℃. The research of thermodynamic was carried out using Langmuir isotherm model and Freundlich isotherm model for description of experimental data. The free energy (ΔG),enthalpy (ΔH) and entropy (ΔS) changes of adsorption were evaluated. The result showed that the process of adsorption of Rb+by AWP-CaALG could be described by Freundlich equation. The adsorption of Rb+was spontaneous and exothermic process,andtherefore,low temperature was advantageous to the adsorption. The study of kinetic was conducted using pseudo-first-order kinetic model,pseudo-second-order kinetic model and shell progressive model for description of kinetic data. The result showed that the adsorption of Rb+could be described by the pseudo-second order kinetic model and was controlled by the chemical reaction.
Key words:rubidium; ammonium tungstophosphate; calcium alginate; adsorption; kinetic; thermodynamics
DOI:10.11949/j.issn.0438-1157.20150505
中图分类号:O 643.12;O 642.2
文献标志码:A
文章编号:0438—1157(2016)04—1378—08
基金项目:国家高技术研究发展计划项目(2012AA061704)。
Corresponding author:Prof. AN Lianying,anliany@cdut.edu.cn
