纳米腐殖酸动态吸附废水中镉离子及其洗脱特性
2016-07-04程亮侯翠红徐丽雒廷亮张保林刘国际郑州大学化工与能源学院河南郑州450001
程亮,侯翠红,徐丽,雒廷亮,张保林,刘国际(郑州大学化工与能源学院,河南 郑州 450001)
纳米腐殖酸动态吸附废水中镉离子及其洗脱特性
程亮,侯翠红,徐丽,雒廷亮,张保林,刘国际
(郑州大学化工与能源学院,河南 郑州 450001)
摘要:在静态法研究纳米腐殖酸吸附模拟含镉废水基础上搭建考察模拟含镉废水中镉离子在吸附剂上动态吸附及洗脱特性的吸附柱实验装置,考察镉离子溶液浓度、吸附(脱附)温度、共存离子和进料流速对穿透吸附量和饱和吸附量的影响,运用Thomas模型研究了纳米腐殖酸柱吸附过程动力学机理,测定了再生后纳米腐殖酸的穿透吸附量和饱和吸附量,结果表明:初始镉离子浓度150 mg·L-1和流速10 ml·min-1下,其饱和吸附量分别为426.3 mg·g-1和405.5 mg·g-1;Thomas模型所得饱和吸附量qem分别为364.1、436.1和441.9 mg·g-1;洗脱峰镉离子浓度分别为3.3、12.0和22.0 g·L-1;共存离子SO42-浓度增加,纳米腐殖酸对镉离子的穿透吸附量和饱和吸附量降低;吸附和脱附均可常温工况进行。经30次吸附和再生后,穿透吸附量和饱和吸附量无明显降低。用红外光谱仪(FT-IR)、扫描电镜(SEM)及X射线能谱仪(EDS)对纳米腐殖酸吸附再生前、后性能进行表征,结果表明:纳米腐殖酸物化性能稳定,形貌基本无变化,尺度发生一定程度减小,表面及内部的氨基、羟基等对吸附镉离子均发挥有效作用,该材料可满足重复使用。
关键词:纳米腐殖酸;动力学机理;穿透吸附量;饱和吸附量;动态吸附;脱附;吸附剂;废水
2015-07-08收到初稿,2015-12-03收到修改稿。
联系人:刘国际。第一作者:程亮(1986—),男,博士研究生。
Received date: 2015-07-08.
Foundation item: supported by the Science and Technology Hall of Henan Province Foundation and Frontier Project (2011A530008) and the Outstanding Doctoral Dissertation Cultivation Fund of Zhengzhou University (201311).
引 言
镉是一种有毒且有害的重金属离子[1-2],主要来源于金属矿山采选冶炼、镍镉电池、农药、工业排放污泥、陶瓷与无机颜料制造等领域排放废水[3-4]。鉴于镉离子对生物具有强致癌性、致畸形、突变和氧化性,进入人体后能引起骨痛病、生理代谢紊乱等疾病[5],同时2012年国家环保总局统计的全国排放废水中总镉量为188.7 t,故需对含镉废水排放前严格处理。目前,田犀卓等[6]和Duan等[7]用钢渣-蒙脱土复合材料作吸附剂对水中Cd2+进行静态吸附,其最大饱和吸附量分别为12.45 mg·g-1和15.78 mg·g-1,但其强度差,使用时间短;Cho等[8]和Xue等[9]通过粉煤灰对废水中Cd2+进行去除,对Cd2+的最大吸附量为14.69 mg·g-1,但其存在于水中,固液分离较困难;伍禅翠等[10-11]以生物质改性竹炭作吸附剂去除水溶液中Cu2+、Cd2+,但其对高浓度废水处理效果不佳;张福凯等[12]利用脱灰煤基活性炭吸附处理工业含镉废水,其最大吸附量为40 mg·g-1,但制备费用高,再生性能较差;李光林等[13]采用离子选择电极法研究了腐殖酸静态吸附镉离子的动力学。迄今为止未见采用纳米腐殖酸作吸附剂动态柱吸附废水中镉离子及其洗脱工艺报道。纳米腐殖酸含有羧基、醌基、羟基等活性化学官能团,其平均粒径为60~70 nm,因纳米尺寸效应[14-17],具有传质和吸附速率均较快、去除率高等特性。
前期采用静态法考察纳米腐殖酸吸附含镉废水中镉离子,其对镉离子吸附量最高可达425.1 mg·g-1,该法适用于实验室前期理论研究及性能初步评价。而实际情况下废水处理过程常采用柱式连续操作,以提高治理效率和降低成本。为使研究更加系统,本研究在静态吸附实验结果基础上采用柱装置考察纳米腐殖酸动态吸附模拟含镉废水和洗脱性能,深入考察镉离子溶液浓度、共存离子、流速等对该纳米腐殖酸柱吸附性能的影响,并运用Thomas模型研究纳米腐殖酸柱吸附过程动力学机理,另外分析洗脱液浓度对纳米腐殖酸洗脱性能的影响、洗脱过程中镉离子浓度与pH变化的关系,以期为纳米腐殖酸后续在含镉废水资源化处理中的实际应用提供系统的理论依据和工艺参数。
1 材料及实验方法
1.1实验试剂及仪器
纳米腐殖酸,平均粒径为60 nm,以河南巩义风化煤为原料,通过碱溶酸析配加高剪切技术自制;氢氧化钠、国药集团化学试剂有限公司提供,分析纯;盐酸,分析纯,洛阳昊华化学试剂有限公司提供;DZF-O型真空干燥箱,上海跃进医疗器械厂生产;BS224S型电子分析天平,北京赛多利斯仪器系统有限公司提供;pH211型酸度计,意大利HANNA公司提供;f50 mm×500 mm型色谱柱,上海精科实业公司特制;BT100-1L型蠕动泵,保定兰格恒流泵有限公司提供;DBS-160F型自动收集器,上海精科实业公司特制。
1.2吸附剂纳米腐殖酸制备方法
根据文献[16]制备。
1.3柱吸附实验装置及工艺
吸附装置分吸附和洗脱两部分,该装置主要由含镉废水储存槽、蠕动泵、吸附柱、收集器4部分组成,吸附剂纳米腐殖酸采用湿法装填,吸附柱中流体采用下行方式。吸附部分:一定浓度的模拟含镉废水经蠕动泵后进入纳米腐殖酸吸附柱,柱底部流出液用紫外-可见分光光度计测定镉离子浓度。
1.4柱吸附实验及洗脱实验
(1)吸附实验称取一定量纳米腐殖酸装柱(f50 mm×500 mm),在一定流速下吸附模拟含镉废水(pH=2.0)。定时收集流出液,用紫外-可见分光光度计测定镉离子浓度。吸附饱和后(ct/c0>95%),用一定浓度的氢氧化钠溶液洗脱吸附平衡后纳米腐殖酸上的镉离子。
分别按式(1)、式(2)计算纳米腐殖酸对镉的穿透吸附量qb和饱和吸附量qe

式中,qb为柱吸附穿透吸附量,mg·g-1;qe为柱吸附饱和吸附量,mg·g-1;Vb为吸附过程中流出液浓度低于0.5 mg·L-1的总体积,L;Ve为吸附平衡时流出液总体积,L;c0为进口镉浓度,mg·L-1;cb,a为Vb段平均浓度,mg·L-1;ce,a为Ve段平均浓度,mg·L-1;m为纳米腐殖酸质量,g。
(2)洗脱实验配制一定浓度氢氧化钠储备液,导入至上述吸附饱和的吸附柱进行洗脱。流出液分为中性液及碱性液两部分。中性洗脱液含有镉离子及微量OH-,基本失去继续洗脱能力;碱性洗脱液含有大量OH-,具有继续洗脱能力,可用于下一轮循环洗脱。
1.5柱吸附模型
采用Thomas模型分析纳米腐殖酸对镉的柱吸附机理,并对其柱吸附行为进行预测。Thomas模型[18]假设无轴向扩散,并且吸附过程符合Freundlich等温吸附线和准二级反应动力学。
线性模型表达式如式(3)所示
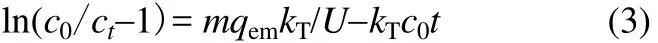
式中,kT为Thomas速率常数,L·(mg·min)-1;qem为预测的单位质量纳米腐殖酸饱和吸附容量,mg·g-1;U为体积流量,L·min-1;ct为某时间t时流出液镉浓度,mg·L-1。
1.6纳米腐殖酸交换容量测定
采用酸碱滴定法测定含氨基纳米腐殖酸的全交换容量,操作如下:称取0.1 g 纳米腐殖酸于50 ml具塞锥形瓶中,加入25.00 ml 0.1 mol·L-1盐酸,常温浸泡24 h。随后从中分别移取3份5.00 ml溶液至25 ml锥形瓶中,加入1~2滴酚酞溶液,用0.1 mol·L-1氢氧化钠标准溶液分别滴定,平均消耗氢氧化钠标准溶液体积记V1。移取5 ml 0.1 mol·L-1空白盐酸溶液,用0.1 mol·L-1氢氧化钠标准溶液滴定,消耗氢氧化钠标准溶液体积记V2。
纳米腐殖酸交换容量EC按式(4)计算
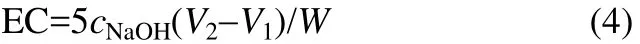
式中,EC为纳米腐殖酸交换容量,mmol·g-1;V1为浸泡纳米腐殖酸后剩余盐酸消耗氢氧化钠标准溶液体积量,ml;V2为空白溶液消耗氢氧化钠标准溶液体积量,ml;W为纳米腐殖酸质量,g;cNaOH为氢氧化钠标准溶液浓度,mol·L-1。
1.7洗脱液浓度的影响
称取3份一定质量的吸附剂纳米腐殖酸装柱(f50 mm×500 mm),以10 ml·min-1的速率吸附镉(c0=100 mg·L-1,pH=2.0)至饱和后(ct/c0>95%),分别用一定浓度的氢氧化钠溶液洗脱纳米腐殖酸(10 ml·min-1),每隔一段时间取流出液测定镉离子浓度及pH变化。
1.8表征仪器
TU-1810型紫外可见分光光度计,北京普析通用仪器公司;NEXUS-470型傅里叶变换红外光谱仪(FT-IR),美国Thermo Nicolet公司;JSM-6700型电子扫描电镜(SEM),日本电子公司生产;QUANTA 200型X射线能谱分析仪(EDS),美国Thermo Electron SPA公司提供。
2 结果与讨论
2.1镉离子浓度的影响
柱吸附操作过程中,镉离子浓度会明显影响吸附剂纳米腐殖酸的处理性能。图1为纳米腐殖酸在不同初始镉离子浓度下的柱吸附曲线,图2给出了相应条件下的穿透吸附量qb及饱和吸附量qe。
如图1所示,在考察的浓度范围内(c0=48.0~149.9 mg·L-1),随着初始镉离子浓度提高,吸附曲线明显变陡,液体处理量相应降低。由图2可看出,随着初始镉离子浓度增大,穿透吸附量及饱和吸附量逐渐提高。这主要因为高浓度的镉离子具有更高的浓度梯度,有利于提高吸附剂纳米腐殖酸与镉离子的传质推动力,更多的吸附位点被取代。当镉离子初始浓度为150 mg·L-1时,qb、qe分别为291.2 mg·g-1和426.3 mg·g-1。根据式(4)计算,纳米腐殖酸氨基交换容量约8.5 mmol·g-1,其对镉的理论最高吸附量为441.9 mg·g-1。由此可看出吸附剂纳米腐殖酸上氨基活性位点基本参与镉离子的吸附过程,而且柱吸附量明显高于传统树脂[19-21],后者对镉离子的柱吸附量为60~160 mg·g-1。
柱吸附模型可为后续的吸附工艺规模化应用提供可靠的设计参数。其中,Thomas模型常用于分析化学吸附过程的动力学模型,该模型假设无轴向扩散且吸附过程符合Freundlich等温吸附线和可逆二级反应动力学。因此,根据式(3)采用Thomas简化模型考察吸附剂纳米腐殖酸对镉的柱吸附机理,相应线性拟合曲线及数据见图3、表1。表1相关性系数表明:Thomas 模型能够较好地拟合本吸附体系的实验数据(R2>0.9000)。在48.0、98.5、149.9 mg·L-1的初始镉离子浓度下,通过Thomas模型推测的饱和吸附量qem分别为364.1、436.1、441.9 mg·g-1,基本符合图3所得的实验值qe。

图1 不同镉离子浓度对柱吸附的影响Fig. 1 Effect of different initial Cd(Ⅱ) concentration on column adsorption of Cd(Ⅱ)(m=2.0 g,U=10 ml·min-1,D=50 mm,H=50 mm,pH=2.0)

图2 不同镉离子浓度下穿透吸附量及饱和吸附量Fig. 2 Amounts of breakthrough and saturated adsorption at different Cd(Ⅱ) concentrations

图3 Thomas模型柱吸附拟合曲线Fig. 3 Column adsorption fitting curves of linearized Thomas equation
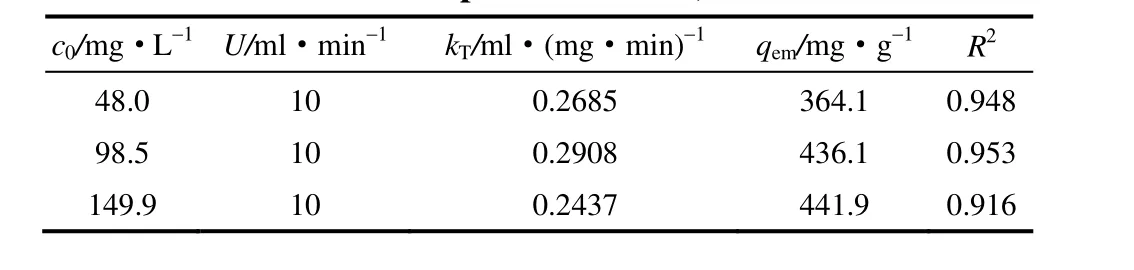
表1 Thomas模型柱吸附拟合参数Table 1 Predicted parameters of Thomas model for adsorption of Cd(Ⅱ)
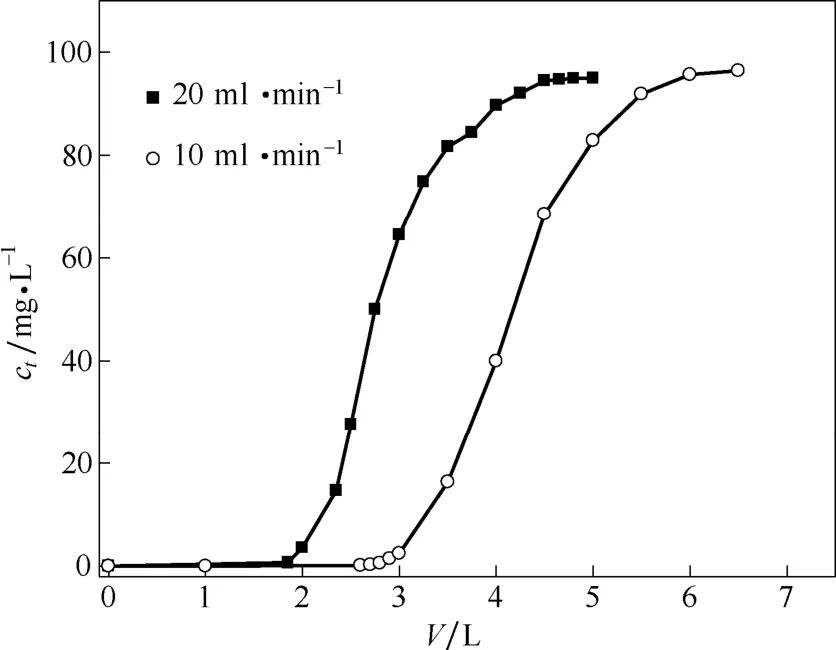
图4 不同流速对柱吸附镉离子的影响Fig. 4 Effect of different flow rate on column adsorption of Cd(Ⅱ)(m=2.0g,c0=98.5 mg·L-1,D=50 mm,H=50 mm,pH=2)
2.2流速的影响
柱吸附过程中溶液流速的高低会直接影响纳米腐殖酸吸附镉离子能力。图4为吸附剂纳米腐殖酸在不同流速下对镉离子的柱吸附曲线,表2给出了相应条件下穿透吸附量及饱和吸附量。
由图4可知,在考察的流速范围内(10~20 ml·min-1),流速增大,相应的穿透吸附量及饱和吸附量降低明显,穿透吸附量及饱和吸附量分别由276.0、405.5 mg·g-1降至182.1、274.0 mg·g-1,降幅分别为34.0%和32.3%。流速过快,纳米腐殖酸来不及接触镉离子,容易造成出水超标,除镉效果不佳;流速太低,溶液中的镉离子在纳米腐殖酸上停留时间长,使穿透点及饱和点提前而导致处理能力降低,同时直接增加处理成本,不利于大规模工业化应用。故选用10 ml·min-1的适宜流速考察纳米腐殖酸吸附镉离子性能。
2.3温度的影响
温度对吸附速率和活化能会产生一定影响。图5为10、30及50℃下纳米腐殖酸对废水中镉离子吸附动力学曲线。

表2 不同流速下穿透吸附量及饱和吸附量Table 2 Amounts of breakthrough and saturated adsorption at different flow rates

图5 温度对吸附的影响Fig 5 Effect of different temperature on adsorption of Cd(Ⅱ)(m=2.0 g,V=200 ml,c0=300 mg·L-1,pH=2)
从图5可看出,在所考察的温度范围下(10~50℃),温度升高,明显提高了纳米腐殖酸对镉离子的饱和吸附量。吸附温度升至50℃,其对镉离子的饱和吸附量达到433.9 mg·g-1,与纳米腐殖酸理论吸附量基本接近。同时,吸附温度为10℃,纳米腐殖酸对镉离子于60 min达到吸附平衡;温度分别为30、50℃,吸附平衡时间缩减到30 min。由此可知,升高温度对纳米腐殖酸吸附镉离子的速率也有一定改善,也表明其对镉离子的吸附为吸热过程。从实际应用、经济成本和能源节约考虑,纳米腐殖酸对镉离子的吸附和脱附均可常温工况运行。
2.4共存离子的影响
实际含镉废水中通常有多种离子共存(NO-3、 SO42-等),其对纳米腐殖酸吸附镉离子也会产生影响,故考察了不同硫酸根离子浓度对纳米腐殖酸吸附镉离子的影响。图6为吸附剂纳米腐殖酸在不同硫酸根离子浓度下对镉的柱吸附曲线,表3为相应条件下对镉离子的穿透吸附量及饱和吸附量。
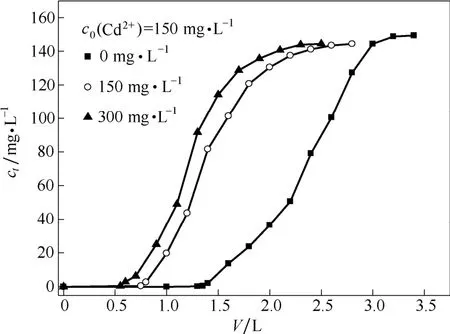
图6 硫酸根离子对纳米腐殖酸吸附镉离子的影响Fig. 6 Effect of coexisting SO24-ion on adsorption of Cd(Ⅱ)(m=2.0g,U=10 ml·min-1,D=50 mm,H=50 mm,pH=2)

表3 不同SO24-浓度下穿透吸附量及饱和吸附量Table 3 Amounts of breakthrough and saturated adsorption at different SO24-concentrations
从图6看出,在考察的硫酸根离子浓度范围内(0~300 mg·L-1),随着硫酸根离子初始浓度越高,纳米腐殖酸对镉离子的穿透吸附量及饱和吸附量降低。由表3中q(c1):q(c2):q(c3)可看出,当硫酸根离子浓度为150 mg·L-1时,纳米腐殖酸对镉离子的穿透吸附量qb(c2)为qb(c1)的0.55倍;随着吸附时间延长,纳米腐殖酸吸附至饱和后,其对镉离子的饱和吸附量qe(c2)为qe(c1)的0.60倍。当硫酸根离子浓度为300 mg·L-1时,qb(c2)为qb(c1)的0.39倍;随着吸附时间延长,纳米腐殖酸吸附至饱和后,qe(c2)为qe(c1)的0.47倍。由此可知,吸附剂纳米腐殖酸吸附的饱和率高于其穿透率。这是因为弱碱性的纳米腐殖酸吸附材料对镉离子的吸附选择性高于硫酸根离子,而且随着吸附时间延长,纳米腐殖酸上部分硫酸根离子被溶液中的镉离子取代,最终达到吸附平衡。
2.5洗脱液浓度的影响
吸附剂材料的洗脱性能直接关系到其是否能够有效重复利用。弱碱性纳米腐殖酸与OH-具有很好的结合能力,故选用的洗脱剂为不同浓度氢氧化钠溶液,对吸附饱和后的吸附剂纳米腐殖酸进行再生。不同浓度氢氧化钠溶液对镉离子洗脱曲线如图7所示,相应条件下洗脱过程流出液的pH变化如图8所示。

图7 氢氧化钠浓度对洗脱的影响Fig. 7 Effect of concentration of NaOH solution on desorption of Cd(Ⅱ)(m=2.0 g,U=10 ml·min-1,D=50 mm,H=50 mm)

图8 流出液pH与时间t的关系Fig. 8 Relationship of effluent between pH and t
由图7可知,随着氢氧化钠浓度提高,洗脱曲线变陡,镉离子洗脱速度相应提高。在0.1、0.5、1.0 mol·L-1氢氧化钠浓度下,洗脱峰的镉离子浓度依次为3.3、12.0、22.0 g·L-1,在10~30 min内基本能完成洗脱过程。考虑到循环利用和低廉成本性,选取最佳洗脱液浓度为1.0 mol·L-1。结合图8可知,镉离子洗脱峰前半段流出液基本呈中性,OH-得到充分利用。洗脱峰后半段流出液呈碱性,含有大量的OH-,这些OH-未被有效利用,在后续工业化工艺流程中可考虑碱性流出液的循环利用问题。
2.6红外光谱分析(FT-IR)
为评估吸附剂纳米腐殖酸经30次吸附再生后的化学稳定性能,采用红外光谱分析其吸附前后的结构变化。结果如图9所示。

图9 纳米腐殖酸30次吸附再生红外光谱图Fig. 9 FT-IR spectrum of nanoscale humic acid during 30 cyclesa—fresh nanoscale humic acid; b—regenerated nanoscale humic acid after 30 cycles
由图9可看出,原纳米腐殖酸及再生30次后的吸附剂纳米腐殖酸在3424.21、3420.78 cm-1的吸收峰分别为—NH—、—NH2的N—H伸缩振动峰,2927.26、2922.62 cm-1分别为羧基氢键缔合—OH伸展振动及羰基共轭双键伸缩振动峰,2241.91、2240.75 cm-1分别为烷氧基、氨基的羰基伸缩振动峰,由此可见吸附剂纳米腐殖酸吸附前后结构基本无明显变化[22-23],而且保持良好的化学稳定性。
2.7扫描电镜分析(SEM)
图10为吸附剂纳米腐殖酸吸附前,30次吸附再生前、后形貌图。比较图10(b)和图10(c)可看出,经30次吸附再生后,吸附剂纳米腐殖酸的形貌基本无变化,依然呈准球状,表明吸附剂纳米腐殖酸具有良好的使用稳定性。从尺度大小上看,纳米腐殖酸发生一定程度的减小,粒度由吸附再生前的约90 nm变为再生后的约60 nm,说明吸附剂纳米腐殖酸经1 mol·L-1氧氧化钠溶液洗脱后其表面吸附质被除去而恢复到原有尺寸。
2.8X射线能谱分析(EDS)
为了解纳米腐殖酸吸附镉离子是以表面吸附为主还是颗粒内外均发挥良好的吸附作用,通过EDS线扫描进一步测定其断面特征元素分布情况。图11为原纳米腐殖酸(a)、吸附镉纳米腐殖酸(b)及洗脱纳米腐殖酸(c)断面EDS线扫描元素分析结果。由图11(a)可看出,原纳米腐殖酸中C、N、O及Cl含量沿纳米腐殖酸断面直径方向分布较均匀;如图11(b)所示,纳米腐殖酸吸附镉后,镉含量同样沿纳米腐殖酸断面直径方向均匀分布,而且氯离子含量明显下降;如图11(c)所示,纳米腐殖酸经氢氧化钠溶液洗脱再生后,纳米腐殖酸断面的镉离子基本得到有效去除。从分析可知,纳米腐殖酸表面及内部的氨基、羟基等对吸附镉离子均发挥有效作用,而且镉离子分布较为均匀。

图10 纳米腐殖酸吸附前及30次吸附再生前、后SEM图Fig. 10 SEM photos of raw nanoscale humic acid,regenerated nanoscale humic acid before and after 30 cycles

图11 纳米腐殖酸断面EDS线扫描图Fig. 11 EDS curves of line scanning cross section of nanoscale humic acid

图12 纳米腐殖酸循环30次饱和吸附曲线Fig.12 Saturated adsorption curves of Cd(Ⅱ) from rinse wastewater during 30 cycles for nanoscale humic acid(m=2.0 g,U=10 ml·min-1,D=50 mm,H=50 mm)
2.9吸附再生性能
图12、表4分别为2.0 g 吸附剂纳米腐殖酸再生吸附含镉废水的饱和曲线及吸附量。从图12和表4可得,相应工况条件下第1次穿透吸附量及饱和吸附量分别为206.5、339.9 mg·g-1。纳米腐殖酸经30次吸附再生后,饱和吸附量降低约9.5%,基本保持良好的循环使用性能,表明该吸附剂可满足重复使用处理含镉模拟废水。同时从图13的洗脱曲线可看出,采用1.0 mol·L-1氢氧化钠洗脱液,纳米腐殖酸约10 min完成洗脱过程,大大减少洗脱时间和成本,而且洗脱曲线峰的浓度最高为21.0 g·L-1。

表4 30次饱和吸附穿透及饱和吸附量Table 4 Amounts of breakthrough and saturated adsorption during 30 cycles

图13 纳米腐殖酸30次洗脱曲线Fig. 13 Elution curves of Cd(Ⅱ) during 30 cycles for nanoscale humic acid(U=10 ml·min-1,D=50 mm,H=50 mm)
3 结 论
(1)在不同镉离子初始浓度范围内(48.0~149.9 mg·L-1),吸附剂纳米腐殖酸在初始镉离子浓度为150 mg·L-1下,其饱和吸附量最高可达426.3 mg·g-1,其表面上氨基活性位点基本参与镉离子的吸附过程;柱吸附过程符合Thomas模型(R2>0.9000),通过Thomas模型在48.0、98.5及149.9 mg·L-1初始镉离子浓度下推测的饱和吸附量分别为364.1、436.1及441.9 mg·g-1。
(2)在流速范围内(10~20 ml·min-1),穿透吸附量及饱和吸附量分别由276.0、405.5 mg·g-1降至182.1、274.0 mg·g-1,其降幅分别为34.0%和32.3%;吸附和脱附均可常温工况下进行;硫酸根离子初始浓度由150 mg·L-1到300 mg·L-1,纳米腐殖酸对镉的穿透吸附量及饱和吸附量降低。洗脱实验表明,洗脱液氢氧化钠溶液浓度为0.1、0.5、1.0 mol·L-1时,洗脱峰的镉离子浓度分别为3.3、 12.0、22.0 g·L-1。镉离子洗脱峰前半段流出液基本呈中性,OH-得到充分利用;后半段流出液呈碱性,含有较多未被利用的OH-,可循环利用。
(3)FT-IR、SEM及EDS分析表明纳米腐殖酸维持良好的物理化学稳定性能,其形貌基本无变化,尺度发生一定程度减小,纳米腐殖酸表面及内部的氨基、羟基等对吸附镉离子均发挥有效作用,而且镉离子分布较为均匀。吸附剂纳米腐殖酸经30次再生柱吸附模拟含镉废水,其穿透吸附量(206.5~176.0 mg·g-1)及饱和吸附量(339.9~307.4 mg·g-1)无明显降低,可见该材料可满足重复使用治理含镉废水。
符号说明
cb,a——Vb段平均浓度,mg·L-1
ce,a——Ve段平均浓度,mg·L-1
ct——t时刻流出液浓度,mg·L-1
c0——流入液初始浓度,mg·L-1
D——柱内径,mm
EC——纳米腐殖酸交换容量,mmol·g-1
H——装填高度,mm
kT——Thomas速率常数,L·(mg·min)-1
m——纳米腐殖酸质量,g
qb——柱操作穿透吸附量,mg·g-1
qe——柱操作饱和吸附量,mg·g-1t——吸附时间,min
U——体积流量,ml·min-1
Vb——流出液浓度低于0.5 mg·L-1总体积,L
Ve——流出液总体积,L
References
[1] KISHORE G R,SREE R P,KRISHNA D. Industrial wastes as adsorbents for the removal of cadmium from waste water: a review [J]. International Journal of Chemical Sciences,2013,11(3): 1371-1384.
[2] HUANG Y X,ARTURO A K. EDTA functionalized magnetic nanoparticle sorbents for cadmium and lead contamined water treatment [J]. Water Research,2015,80(9): 159-168.
[3] CHEN T,ZHOU Z Y,HAN R,et al. Adsorption of cadmium by biochar derived from municipal sewage sludge: impact factors and adsorption mechansm [J]. Chemosphere,2015,134(9): 286-293.
[4] OLU-OWOLABI B I,POPOOLA D B,UNUABONAH E I. Removal of Cu2+and Cd2+from aqueous solution by bentonite clay modified with binary mixture of goethite and humic acid [J]. Water,Air& Soil Pollution,2010,211(36): 459-474
[5] MIRETZKY P,CIRELLI A F. Cd(Ⅱ) removal from aqueous solution by raw and modified lignocellulosic materials: a review [J]. Journal of Hazardous Materials,2010,180(1/2/3): 1-19.
[6] 田犀卓,金兰淑,应博,等. 钢渣-蒙脱石复合吸附剂对水中Cd2+的吸附去除 [J]. 环境科学学报,2015,35(1): 207-214. TIAN X Z,JIN L S,YING B,et al. Adsorption of Cd2+from aqueous solution by steel slag-montmorillonite composite adsorbent [J]. Acta Scientiae Circumstantiae,2015,35(1): 207-214.
[7] DUAN J M,SU B. Removal characteristic of Cd2+from acidic aqueous solution by modified steel-making slag [J]. Chemical Engineering Journal,2014,246(4): 160-167.
[8] CHO H,OH D,KIM K. A study on removal characteristics of heavy metals from aqueous solution by fly ash [J]. Journal of Hazardous Materials,2005,127(1/3): 187-195.
[9] XUE Y J,HOU H B,Zhu S J. Competitive adsorption of copper(Ⅱ),cadmium(Ⅱ),lead(Ⅱ) and zinc(Ⅱ) onto basic oxygen furnace slag [J]. Journal of Hazardous Materials,2009,162(1): 391-401.
[10] 伍禅翠,梁英,李京鸿,等. 改性竹炭对水溶液中Cu2+、Cd2+的吸附性能 [J]. 材料科学与工程学报,2015,33(3): 377-382. WU C C,LIANG Y,LI J H,et al. Adsorption behavior of the modified bamboo-charcoal for copper(Ⅱ) and cadmium(Ⅱ) in aqueous solution [J]. Journal of Materials Science and Engineering,2015,33(3): 377-382.
[11] UCHIMIYA M,WARTELLE L H,KLASSON K T,et al. Influence of pyrolysis temperature on bio-char property and function as a heavy metal sorbent in soil [J]. Journal Agriculture Food Chemical,2011,59(8): 2501-2510.
[12] 张福凯,徐龙君,张丁月. 脱灰煤基活性炭吸附处理含镉废水 [J].环境工程学报,2014,8(2): 559-562. ZHANG F K,XU L J,ZHANG D Y. Cd2+removal in wastewater with demineralized coal-based activated carbon [J]. Chinese Journal of Environmental Engineering,2014,8(2): 559-562.
[13] 李光林,魏世强,青长乐,等. 镉在腐殖酸上的吸附与解吸特性研究 [J]. 农业环境科学学报,2003,22(1): 34-37. LI G L,WEI S Q,QING C L,et al. Characteristics of adsorption and desorption of cadmium on humic acids [J]. Journal of Agro-Environment Science,2003,22(1): 34-37.
[14] 程亮,侯翠红,刘国际,等. 纳米腐殖酸对镉离子的吸附热力学及动力学 [J]. 高校化学工程学报,2015,29(1): 72-77. CHENG L,HOU C H,LIU G J,et al. Thermodynamics and kinetics of cadmium ions adsorption by nanoscale humic acid [J]. Journal of Chemical Engineering of Chinese Universities,2015,29(1): 72-77.
[15] 程亮,张保林,徐丽,等. 腐殖酸热分解动力学 [J]. 化工学报,2014,65(9): 3470-3478. CHENG L,ZHANG B L,XU L,et al. Thermal decomposition kinetics of humic acid [J]. CIESC Journal,2014,65(9): 3470-3478.
[16] 程亮,张保林,侯翠红,等. 高剪切条件下纳米腐殖酸的制备与表征 [J]. 化工学报,2012,63(8): 2648-2654. CHENG L,ZHANG B L,HOU C H,et al. Preparation and characterization of nanoscale humic acid under high shearing condition [J]. CIESC Journal,2012,63(8): 2648-2654.
[17] 程亮,徐丽,侯翠红,等. 低温条件下纳米腐殖酸-尿素配合物的制备及表征 [J]. 化工学报,2015,66(7): 2725-2736. CHENG L,XU L,HOU C H,et al. Preparation and characterization of nanoscale humic acid-urea complex under low temperature conditions [J]. CIESC Journal,2015,66(7): 2725-2736.
[18] CHU K H. Fixed bed sorption: setting the record straight on the Bohart-Adams and Thomas models [J]. Journal of Hazardous Materials,2010,177(1-3): 1006-1012.
[19] PEHLIVAN E,CETIN S. Sorption of Cd(Ⅱ) ions on two Lewatit-anion exchange resins and their quantitative determination using UV-visible spectrophotometer [J]. Journal of Hazardous Materials,2009,163(1): 448-453.
[20] EDEBALI S,PEHLIVAN E. Evaluation of Amberlite IRA96 and Dowex 1 × 8 ion-exchange resins for the removal of Cd(Ⅱ) from aqueous solution [J]. Chemical Engineering Journal,2010,161(1/2): 161-166.
[21] JACHULA J,HUBICKI Z. Removal of Cd(Ⅱ) and As(Ⅴ) ions from aqueous solutions by polyacrylate and polystyrene anion exchange resins [J]. Applied Water Science,2013,3(3): 653-664.
[22] 胡皆汗,郑学仿. 实用红外光谱学[M]. 北京: 科学出版社,2011: 29-38. HU J H,ZHENG X F. Practical Infrared Spectroscopy[M]. Beijing: Science Press,2011: 29-38.
[23] 程亮,徐丽,刘伟,等. 超声作用联合纳米腐殖酸处理苯酚废水[J]. 化学工程,2014,42(9): 6-12. CHENG L,XU L,LIU W,et al. Efficient removal of phenol wastewater using nanoscale humic acid adsorbent in ultrasound aided [J]. Chemical Engineering(China),2014,42(9): 6-12.
Dynamic adsorption and de-sorption characteristics of wastewater containing cadmium ion on nanoscale humic acid
CHENG Liang,HOU Cuihong,XU Li,LUO Tingliang,ZHANG Baolin,LIU Guoji
(School of Chemical Engineering and Energy,Zhengzhou University,Zhengzhou 450001,Henan,China)
Abstract:Based on the study of the absorption of simulated wastewater containing cadmium ion on nanoscale humic acid using static method,the adsorption column experimental device was set up to study the dynamic adsorption and elution characteristics of simulated wastewater containing cadmium ion,and the influence factors such as cadmium ion concentration,adsorption (de-sorption) temperatures,coexisting ions,feed rate on the breakthrough adsorption capacity and saturated adsorption capacity were investigated. The kinetic mechanism of column adsorption process on nanoscale humic acid was studied by using Thomas model,and the breakthrough adsorption capacity and saturated adsorption capacity of nanoscale humic acid after regeneration were determined. The results showed that the initial cadmium ion concentration was 150 mg·L-1and the feed rate was 10 ml·min-1,the saturated adsorption capacity was 426.3 mg·g-1and 405.5 mg·g-1,respectively. The saturated adsorption capacity in Thomas model was 364.1 mg·g-1,436.1 mg·g-1and 441.9 mg·g-1,respectively. The cadmium ionconcentration at eluting peak was 3.3 g·L-1,12.0 g·L-1and 22.0 g·L-1,respectively. The concentration of co-existing ions SO42-was increased,and the breakthrough and saturated adsorption amount of nanoscale humic acids for cadmium ion was reduced. Adsorption and de-sorption temperature were conducted with normal temperature condition. After adsorption and regeneration for 30 times,the breakthrough adsorption capacity and saturated adsorption capacity did not significantly decrease. The performance of nanoscale humic acid before and after adsorption and regeneration was characterized by FT-IR,SEM and EDS,respectively. The results showed that nanoscale humic acid had good stability of physical and chemical performances,the morphology had no obvious change,the scale decreased slightly,both the amide and hydroxyl on the surface and in the internal played an effective role,and thus this material can be used repeatedly.
Key words:nanoscale humic acid; dynamics mechanism; breakthrough adsorption capacity; saturated adsorption capacity; dynamics adsorption; de-sorption; adsorbents; wastewater
DOI:10.11949/j.issn.0438-1157.20151099
中图分类号:O 631.1;TQ 028.15
文献标志码:A
文章编号:0438—1157(2016)04—1348—09
基金项目:河南省科技厅基础与前沿项目(2011A530008);郑州大学优秀博士论文培育基金项目(201311)。
Corresponding author:Prof. LIU Guoji,guojiliu@zzu.edu.cn
